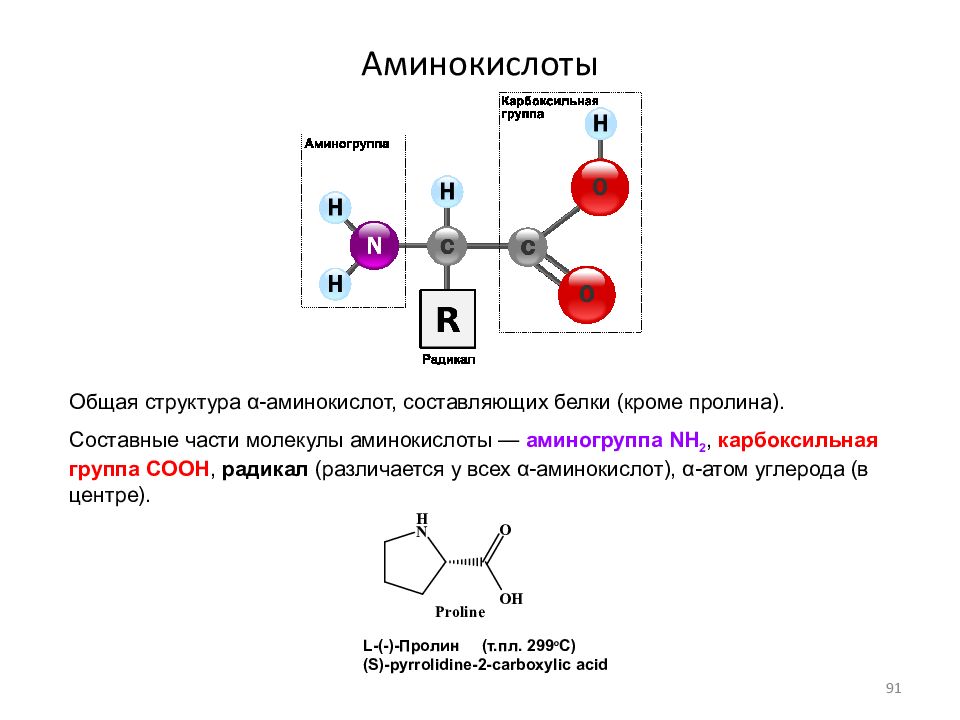
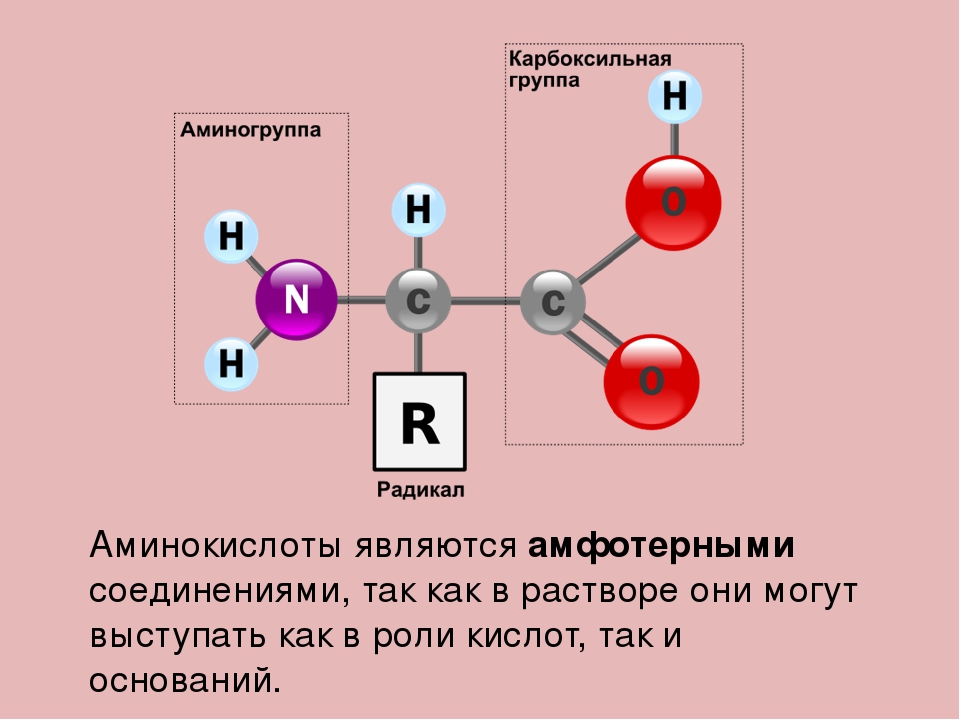
Состоит из аминокислот: Аминокислоты — основные понятия
Урок 19. молекулярная структура живого — Естествознание — 10 класс
Естествознание, 10 класс
Урок 19. «Молекулярная структура живого»
Перечень вопросов, рассматриваемых в теме:
- Какие химические элементы входят в состав живой клетки;
- Какую роль играют углеводы и липиды;
- Как устроены белки, и как их молекулы приобретают определённую пространственную форму;
- Что такое ферменты, и как они распознают свои субстраты;
- Какое строение имеют молекулы РНК и ДНК;
- Какие особенности молекулы ДНК позволяют ей играть роль носителя генетической информации.
Глоссарий по теме:
Органические соединения – химические соединения, основой строения которых являются атомы углерода; составляют отличительный признак живого.
Полимер – (от греч поли – много, мерос – часть) – многозвеньевая цепь, образующаяся при соединении друг с другом относительно простых молекул – мономеров.
Мономеры – низкомолекулярные соединения, способные к образованию макромолекул. Мономерами белков являются аминокислоты; полисахаридов – моносахариды; нуклеиновых кислот – нуклеотиды.
Денатурация – нарушение природной структуры белка (изменение пространственной формы молекулы).
Принцип комплементарности – возможность возникновения водородной связи между определёнными (соответствующими) азотистыми основаниями. Комплементарные основания: А – Т, Г – Ц. Также компилементарными являются пары А – У.
Репликация – свойство молекулы ДНК заключающееся в самодублировании молекулы на основе принципа комплементарности. Этот процесс лежит в основе наследственности.
Основная и дополнительная литература по теме урока (точные библиографические данные с указанием страниц):
- Естествознание. 10 класс [Текст]: учебник для общеобразоват.
 организаций: базовый уровень / И.Ю. Алексашина, К.В. Галактионов, И.С. Дмитриев, А.В. Ляпцев и др. / под ред. И.Ю. Алексашиной. – 3-е изд., испр. – М.: Просвещение, 2017.: с 88-93.
организаций: базовый уровень / И.Ю. Алексашина, К.В. Галактионов, И.С. Дмитриев, А.В. Ляпцев и др. / под ред. И.Ю. Алексашиной. – 3-е изд., испр. – М.: Просвещение, 2017.: с 88-93.
Электронные ресурсы:
Основы биохимии. Портал открытая биология // Электронный доступ: https://biology.ru/textbook/chapter8/section1/paragraph2/
Химические вещества клетки .Проект «вся биология» // Электронный доступ: http://www.sbio.info/materials/obbiology/obbkletka/
Теоретический материал для самостоятельного изучения
Чтобы познакомиться с сущностью процессов, протекающих в живых организмах, следует, в первую очередь, познакомиться с их химическим составом. Представление о мельчайших структурах даёт понимание – как способствовать сохранению своего здоровья и биологических систем более высокого ранга.
Вы уже знаете, что из 104 элементов системы Д. И. Менделеева около 70 были обнаружены в живых организмах. Т.е., химический состав живой и неживой природы один и тот же, что свидетельствует об их единстве.
Атомы в клетках не существуют самостоятельно, они образуют различные соединения, которые выполняют определённую функцию.
Одним из важнейших неорганических соединений является вода, которая в клетках вода составляет 70-80%. Из школьного курса химии, вы знаете, что вода является хорошим растворителем. Из физики, что она обладает высокой теплоёмкостью и низкой теплопроводностью. Биологическая роль воды в организме состоит в том, что вода способствует движению веществ и нормальному ходу биохимических реакций, в ней хранится тепло. При недостатке воды, температура тела спортсмена может увеличиваться на 10°, а при движении – и более, так как метаболизм проходит непрерывно и интенсивно.
Основные вещества клетки представляют собой молекулы, состоящие из взаимосвязанных атомов углерода. Такие соединения углерода получили название органические соединения. Органические соединения клетки образуют макромолекулы, представляющие собой многозвеньевые цепи – полимеры. В их числе базовыми являются белки, жиры (липиды), углеводы и нуклеиновые кислоты. Липиды и углеводы играют важную роль в построении структур организмов, выполняют энергетическую и другие важные функции.
Липиды и углеводы играют важную роль в построении структур организмов, выполняют энергетическую и другие важные функции.
Однако, вторую по величине группу в вашем организме составляют белки, на их долю приходится около 50% соединений. Белки выполняют самые разнообразные задачи в организме: участвуют в построении мышечных волокон или соединительной ткани; порождают движение нашего тела; выполняют другие важные функции в организме. Например, – транспортную (гемоглобин), рецепторную, сигнальную, или регуляторную (белки-гормоны), каталитическую (белки-ферменты), защитную (антитела, интерфероны), энергетическую (при расщеплении 1г. белка выделяется 17,6 кДж энергии). Можно сказать, что практически нет таких процессов в биологической системе, которые бы шли без участия белков.
Структура белков
 Вторичная структура (пространственное расположение молекулярной цепи) является результатом возникновения водородных связей между близко расположенных аминокислот в молекулярной цепи. В результате молекула приобретает форму спирали. Дальнейшая упаковка молекулы в компактные структуры приводит к образованию клубочков (глобул) – так называемой
Вторичная структура (пространственное расположение молекулярной цепи) является результатом возникновения водородных связей между близко расположенных аминокислот в молекулярной цепи. В результате молекула приобретает форму спирали. Дальнейшая упаковка молекулы в компактные структуры приводит к образованию клубочков (глобул) – так называемой Белок может терять, присущую ей, трёхмерную структуру (денатаруция). Это изменение может носить временный или постоянный характер, но и в том и в другом случае последовательность аминокислот белка остаётся неизменной.
Такая способность к самоорганизации – уникальное свойство белков, определяющее выполнение ими функций. Свернувшись определённым образом, молекула-фермент может связаться только со своим специфичным веществом (субстратом), присоединив его к активному центру. При помощи белка-фермента происходят химические преобразования субстрата в конечный продукт. Например, фермент пищеварительного тракта липаза расщепляет только жиры. Биологическое значение ферментов – ускорение протекания биохимических реакций, т.е. являются биологическими катализаторами.
Собранные из 20-ти аминокислот белки можно представить как буквы в словах – их разные комбинации создают многообразие слов (белков). Набор белков для каждого организма уникален! Именно сочетание уникальных белков определяет различия и сходства организмов.
Набор белков для каждого организма уникален! Именно сочетание уникальных белков определяет различия и сходства организмов.
Каждому организму ежедневно требуется производить огромное количество белков. Как при этом не допускаются ошибки? В этом механизме безошибочной сборки белков участвуют нуклеиновые кислоты.
Нуклеиновые кислоты представляют собой многозвеньевые цепи, звеньями которых являются нуклеотиды. Нуклеотиды состоят из остатка фосфорной кислоты, углевода и азотистого основания. Различаются нуклеотиды по последнему компоненту: аденин, тимин, цитозин, гуанин и урацил (А, Т, Г, Ц, У – сокращённые буквенные обозначения).
Соединение нуклеотидов в цепочку происходит благодаря связи между углеводом одного нуклеотида и остатком фосфорной кислоты другого, что определяет направленность молекулы (начало-конец).
В зависимости от того, какой углевод входит в состав нуклеотида (рибоза или дезоксирибоза), различают рибонуклеиновые кислоты (РНК) и дезоксирибонуклеиновые кислоты (ДНК).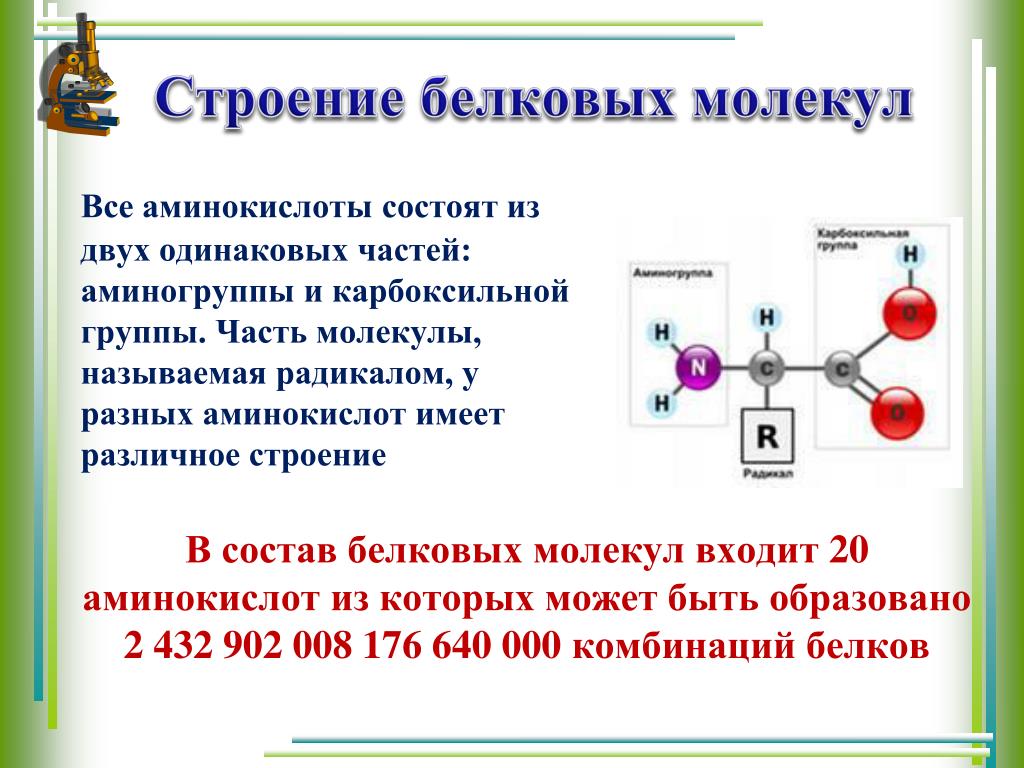
Модель строения молекулы ДНК предложили ДЖ.Уотсон и Ф.Крик в 1953 году. На основе экспериментальных данных было установлено, что количество А=Т, Г=Ц. Молекула ДНК состоит из двух цепочек закрученных спирально вправо. Цепочки удерживаются друг возле друга за счёт водородных связей, которые возникают между комплементарными азотистыми основаниями: А — Т и Г – Ц. Пара полинуклеотидных цепей расположенных комплементарно друг другу называют комплементарными цепями.
Принцип комплементарности позволяет не только молекуле безошибочно само восстанавливаться, но и само удваиваться. Процесс самодублирования молекулы ДНК – репликации, происходит при участии сложного набора ферментов, которые разъединяют комплементарные цепи. На каждой одиночной (материнской) полинуклеотидной цепи начинается сборка новых цепей ДНК. Под действием группы ферментов, так называемой ДНК-полимеразы, нуклеотиды соединяются в цепи и в результате воссоздаются две идентичные двойные спирали ДНК. Репликация молекулы ДНК может происходить безошибочно многократно.
Порядок расположения нуклеотидов в молекулах ДНК определяет порядок аминокислот в молекулах белков. ДНК организма хранит информацию о всём наборе белков, определяющим свойства клеток и организма в целом. Благодаря наличию механизма репликации, эта информация может быть передана поколениям потомков. Поэтому молекулы ДНК являются носителями наследственной информации.
В отличие от ДНК молекула РНК состоит из одной полинуклеотидной цепи. Существует несколько типов РНК, которые выполняют в клетке разные функции:
— информационная или матричная РНК (мРНК) – играет роль посредника при передаче генетической информации от ДНК к структурам клетки, синтезирующим белок, — рибосомам;
— рибосомные РНК (р-РНК) – вместе с белками формируют рибосомы,
— транспортные РНК (тРНК), доставляют аминокислоты к месту синтеза белка,
и некоторые другие.
Вывод
Клетки всех живых существ обладают схожестью элементного химического состава, а также обнаруживает общность живого и неживого. Молекулярную структуру живого составляют белки, липиды, углеводы и нуклеиновые кислоты. Органические соединения клетки образуют макромолекулы, представляющие собой многозвеньевые цепи – полимеры. Такое сходство химического состава является подтверждением единства происхождения всего живого.
Молекулярную структуру живого составляют белки, липиды, углеводы и нуклеиновые кислоты. Органические соединения клетки образуют макромолекулы, представляющие собой многозвеньевые цепи – полимеры. Такое сходство химического состава является подтверждением единства происхождения всего живого.
Белки принимают участие практически во всех биохимических реакциях клетки и организма. Цепочки молекул белка построены из 20 аминокислот в разных комбинациях и последовательностях. Для каждого организма состав белков уникален. Последовательность аминокислот белков организма зашифрована в молекула ДНК. Способность ДНК к самокопированию (репликации) обеспечивает возможность передачи генетической информации в живой природе.
Примеры и разбор решения заданий тренировочного модуля:
Задание 1. Выберите один ответ:
Пространственную структуру в виде глобулы характерно для структуры белка называемой:
- Первичной;
- Вторичной;
- Третичной;
Ответ: Третичной
Пояснение: первичная структура линейная последовательность аминокислот белка, вторичная – молекула образует спираль.
Задание 2. Найдите ошибку (ошибки) и вычеркните их.
«Молекулы белков состоят из остатков аминокислот и азотистых оснований. Замена одного аминокислотного звена другим в белковой молекуле не изменяет её свойств. Нарушение природной структуры белка называется денатурацией. При этом белки не утрачивают биологическую активность. Денатурация может происходить под действием радиации, низкой температуры, ряда органических растворителей (спирт, ацетон), воды.»
Ответ: «Молекулы белков состоят из остатков аминокислот и азотистых оснований. Замена одного аминокислотного звена другим в белковой молекуле не изменяет её свойств. Нарушение природной структуры белка называется денатурацией. При этом белки не утрачивают биологическую активность. Денатурация может происходить под действием радиации, низкой температуры, ряда органических растворителей (спирт, ацетон), воды.»
Пояснение: азотистые основания не входят в состав белков, это составная часть нуклеотидов (мономеров нуклеиновых кислот).
Основа основ, или Как выбрать правильный коллаген? » Медвестник
Кости, мышцы, сухожилия и кожа содержат соединительную ткань, которая в основном состоит из коллагена — самого распространенного типа белка в организме человека. Точные измерения показывают, что коллаген составляет до 35% всего белка в организме, т.е. человек состоит на 1/3 из него. Основная функция коллагена — это прочность и эластичность кожи, костей и гибкость суставов. С возрастом синтез коллагена в коже снижается, что приводит к потере эластичности кожи и развитию морщин. На уменьшение синтеза коллагена также влияют стресс, курение, неправильное питание, недосыпание, окислительное повреждение, солнечное излучение и ряд других факторов.
Сегодня ученым известно более 25 типов коллагена, однако 90% коллагена в организме человека относятся к 4-м основным типам: 1, 2, 3 и 5.
- Коллаген типа 1 — составляет почти 90% коллагена, входит в состав сухожилий, органов и костей.
- Коллаген типа 2 — входит в состав хрящей коленей, плеч и других суставов.

- Коллаген типа 3 — это основной тип хряща ретикулярных волокон. Он обычно встречается там же, где и коллаген типа 1.
- Коллаген типа 5 — формирует волосы и является компонентом кожи.
Самым грозным врагом коллагена является время: где-то после 35—40 лет его выработка начинает уменьшаться и процессы восстановления в коже, суставах и костях начинают страдать. Также ускоряют потерю коллагена излучение, курение и различные диетические ограничения, например питание с высоким содержанием углеводов (фаст-фуд) или низким содержанием антиоксидантов.
Коллаген — сложный белок, и для его синтеза и правильного функционирования необходимы адекватное поступление с пищей строительных материалов (аминокислот, ряда микроэлементов) и защитные факторы, нейтрализующие вредные факторы.
Рекомендуемые продукты, способствующие выработке коллагена в организме:
- Костный бульон и различные студни, в составе которых много аминокислот, являющихся строительными компонентами коллагена.

- Миндаль, грецкие орехи, бобовые культуры и семена, которые содержат много аминокислот.
- Богатые витамином А продукты: морковь, абрикосы и яйца.
- Продукты, содержащие витамин С, который участвует в синтезе коллагена: цитрусовые, сладкий перец, многие фрукты.
- Зеленые листовые овощи: капуста (особенно брокколи), шпинат.
- Лук и чеснок, богатые серой, которая играет важную роль при формировании хряща.
- Яркие ягоды, например черника и голубика, обеспечивающие антиоксидантную защиту.
Правильное питание и физическая активность также имеют решающее значение для здоровья суставов. Научные исследования показали, что дополнительный прием коллагена может быть полезен для оптимального здоровья суставов и помогает укреплять кости, поддерживать здоровье кожи, волос, ногтей. Это белок показан для профилактики артрита, остепороза, возрастных нарушений и заболеваний суставов и мышц, старения кожи, морщин, целлюлита и даже — сердечно-сосудистых заболеваний и преждевременного старения. Необходим коллаген и при высоких нагрузках на скелет, кости и мышцы — при занятиях спортом и фитнесом, в подростковом периоде, после травм и операций.
Необходим коллаген и при высоких нагрузках на скелет, кости и мышцы — при занятиях спортом и фитнесом, в подростковом периоде, после травм и операций.
Добавки с коллагеном, как правило, состоят из следующих аминокислот, которые ученые разделяют на три категории:
- Незаменимые аминокислоты. Этот тип аминокислот нужно получать с пищей, поскольку они не вырабатываются организмом. К числу таких аминокислот относятся лизин, серин, треонин, лейцин, валин, фенилаланин, метионин, изолейцин, гистидин и гидроксилизин.
- Условно-незаменимые аминокислоты. Этот тип аминокислот организм обычно может вырабатывать самостоятельно, но в состоянии стресса, воздействии вредных факторов среды он не способен выработать достаточный объем данных кислот. Поэтому в данной ситуации может быть полезен прием пищевых добавок. К их числу относятся глицин, пролин, глютамин (глютаминовая кислота), аланин и тирозин.
- Заменимые аминокислоты. Этот тип аминокислот также важен для организма, однако организм способен самостоятельно вырабатывать их.
 Потребление этих аминокислот в рационе питания не является обязательным, но такое потребление безвредно и помогает обеспечить организм компонентами, необходимыми для синтеза коллагена. К этим аминокислотам относятся гидроксипролин, аргинин, а также аспарагиновая кислота.
Потребление этих аминокислот в рационе питания не является обязательным, но такое потребление безвредно и помогает обеспечить организм компонентами, необходимыми для синтеза коллагена. К этим аминокислотам относятся гидроксипролин, аргинин, а также аспарагиновая кислота.
Производители коллагена используют разные источники для изготовления своего продукта. Одни компании извлекают сырье из животноводства (коровы), другие получают коллаген из рыб. California Gold Nutrition использует высококачественный коллаген из морских источников, идеально подходящий пескетарианцам, то есть тем людям, которые не употребляют мясо, но едят рыбу.
Коллагеновые добавки содержат широкий перечень аминокислот, необходимых для роста волос, поддержания здоровья кожи и сухожилий, а также здоровья костей. Коллаген отлично подойдет тем людям, которые хотят получать должный объем аминокислот только в составе добавок, без глютена и молочных продуктов.
Ситуации, при которых рекомендовано употребление добавок с коллагеном
Артрит и остеоартритОстеоартрит возникает в результате разрушения хряща в суставах.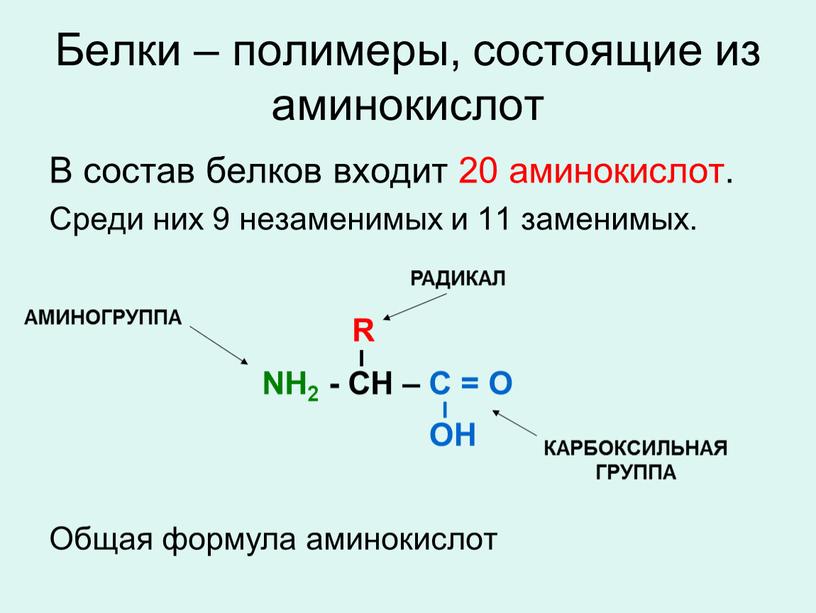 Исследование 2017 года с использованием животной модели показало, что добавки с коллагеном не только уменьшают воспаление суставов, но и предотвращают потерю хряща в них, а также способствуют восстановлению подвижности и объема движений.
Исследование 2017 года с использованием животной модели показало, что добавки с коллагеном не только уменьшают воспаление суставов, но и предотвращают потерю хряща в них, а также способствуют восстановлению подвижности и объема движений.
Остеопороз
По мере старения человека его кости становятся тоньше. Люди с остеопорозом подвержены повышенному риску переломов костей, чаще всего — риску перелома бедра при случайном падении. К числу факторов риска возникновения остеопороза относятся курение и нехватка витамина D. Данному заболеванию также больше подвержены женщины в возрасте от 65 лет. Согласно результатам исследований, коллаген может помочь увеличить прочность костей, их устойчивость к переломам. Исследование 2005 года свидетельствует об увеличении прочности костей при приеме коллагена в виде добавок.
Повреждения и старение сухожилий
Сухожилия — это толстые волокнистые шнуры из коллагена. Сухожилия связывают мышцы с костями и отвечают за движение. Обеспечение прочности сухожилий играет важную роль в предотвращении травм. Травмы сухожилий распространены среди спортсменов и любителей спорта. Согласно данным исследования 2005 года, добавки с коллагеном повышают прочность сухожилий, а исследование 2016 года показало, что они также могут помочь увеличить толщину ахиллова сухожилия.
Травмы сухожилий распространены среди спортсменов и любителей спорта. Согласно данным исследования 2005 года, добавки с коллагеном повышают прочность сухожилий, а исследование 2016 года показало, что они также могут помочь увеличить толщину ахиллова сухожилия.
Здоровье кожи
Прием добавок с коллагеном призван улучшить состояние кожу изнутри, снабдив ее строительными компонентами. Исследования показывают, что коллагеновые добавки имеют многочисленные достоинства для кожи. По данным исследований, пищевые коллагеновые добавки могут быть полезными людям с целлюлитом и морщинами. Они также могут улучшить рост волос и ногтей.
Профилактика целлюлита?
Целлюлит — это патологическое состояние, которое люди пытались устранить на протяжении десятилетий. В двойном слепом плацебо-контролируемом исследовании 2015 года был сделан вывод, что «… долгосрочная терапия с пероральным приемом БПК (биоактивные пептиды коллагена) приводит к улучшению симптомов целлюлита и оказывает положительное влияние на здоровье кожи». В этом исследовании женщины принимали коллаген в течение минимум 6 месяцев. Улучшения были отмечены уже через 3 месяца.
В этом исследовании женщины принимали коллаген в течение минимум 6 месяцев. Улучшения были отмечены уже через 3 месяца.
Уменьшение количества лицевых морщин
По данным исследования 2014 года, прием добавок с коллагеном помогает уменьшить число морщин на коже. Кроме того, двойное слепое плацебо-контролируемое исследование, проведенное в 2014 году, показало улучшение эластичности кожи испытуемых, которые принимали 2500 мг коллагена в день в течение восьми недель, по сравнению с теми испытуемыми, которые принимали плацебо. Исследование 2012 года показало улучшение состояния морщин и снижение сухости кожи при приеме 1000 мг коллагена в течение 12 недель.
В результатах исследования 2016 года, опубликованных в Journal of Science of Food and Agriculture, содержится вывод о том, что пероральный прием коллагена «привел к значительному улучшению состояния при лицевых кожных заболеваниях, в том числе недостаточной влажности и эластичности кожи лица, наличия морщин и шероховатостей». В исследовании 2008 года сделан вывод о том, что «добавки, содержащие коллаген, полезны при индуцированном солнечным светом повреждении кожи и фотостарении». В итогах исследования 2015 года, опубликованных в Journal of Cosmetic Dermatology («Журнал косметической дерматологии»), сообщается, что «пероральные добавки с коллагеновыми пептидами эффективно уменьшают повреждения кожи, связанные со старением».
В исследовании 2008 года сделан вывод о том, что «добавки, содержащие коллаген, полезны при индуцированном солнечным светом повреждении кожи и фотостарении». В итогах исследования 2015 года, опубликованных в Journal of Cosmetic Dermatology («Журнал косметической дерматологии»), сообщается, что «пероральные добавки с коллагеновыми пептидами эффективно уменьшают повреждения кожи, связанные со старением».
Рост ногтей и волос
Исследование 2017 года, опубликованное в Journal of Cosmetic Dermatology, показало, что прием добавки с 2500 мг коллагена привел к увеличению скорости роста ногтей на 12% и к снижению числа случаев сломанных ногтей на 42%. Кроме того, четверо из пяти испытуемых согласились с тем, что их общий внешний вид ногтей улучшился.
Как принимать добавки с коллагеном?
Чаще всего рекомендуется принимать 2500—5000 мг коллагена в день при дополнительном приеме витамина С, чтобы оптимизировать формирование коллагена и обеспечить антиоксидантную защиту.
На iHerb есть разнообразные формы и виды коллагена для любых жизненных ситуаций — любые дозировки, большое количество таблеток в упаковке, в жидкой форме/мягкие капсулы, порошке и т.п.
Fision KeraVeg18 от компании Tri-k – коктейль из аминокислот важных для здоровья и красоты ваших волос.
Человеческий волос состоит из трех основных частей (слоев): кутикулы (чешуйки), кортекса (содержит натуральный пигмент) и сердцевины. Основным компонентом волоса, является кератин, который отвечает за его структурные свойства, в том числе прочность и эластичность. Этот специализированный волокнистый белок состоит из 18 аминокислот. Производные кератина являются важными активными ингредиентами, используемыми в составах для ухода за волосами, для улучшения их общего качества. Обычно эти ингредиенты получаются из животных источников (свиньи, овцы или быки).
Fision KeraVeg18 (Wheat Amino Acids, Soy Amino Acids, Arginine HCl, Serine, Threonine) — это растительная альтернатива кератину животного происхождения. Обладает сопоставимой эффективностью, а в некоторых случаях даже повышенной, в сравнении с гидролизованным животным кератином. Он может быть использован в любых составах по уходу за волосами в качестве более экологичного аналога продуктам животного происхождения. Fision KeraVeg18 представляет собой когезивный раствор, содержащий аминокислоты пшеницы и сои, с дополнительным обогащением незаменимыми растительными аминокислотами — аргинин, серин и треонин. Данные аминокислоты входят в состав кератина человеческих волос, а соответственно проявляют сродство к поверхности волоса.
Обладает сопоставимой эффективностью, а в некоторых случаях даже повышенной, в сравнении с гидролизованным животным кератином. Он может быть использован в любых составах по уходу за волосами в качестве более экологичного аналога продуктам животного происхождения. Fision KeraVeg18 представляет собой когезивный раствор, содержащий аминокислоты пшеницы и сои, с дополнительным обогащением незаменимыми растительными аминокислотами — аргинин, серин и треонин. Данные аминокислоты входят в состав кератина человеческих волос, а соответственно проявляют сродство к поверхности волоса.
Известно, что аргинин помогает усиливать и укреплять структуру волос, обеспечивает кондиционирование и увлажнение. Серин действует как прекурсор выработки церамидов и также обеспечивает кондиционирование волос. Треонин является незаменимой аминокислотой, способствующей поддержанию баланса белка в организме.
Преимущества Fision KeraVeg18 по сравнению с аналогичными продуктами.
• Функциональные соотношение аминокислот в продукте аналогично их соотношению в человеческом волосе
• Антиоксидантная активность, защита волос и кожи головы от воздействия свободных радикалов
• Придает силу волосам
• Повышает эластичность волос
• Помогает защитить волосы от травмирующих салонных процедур и внешних стрессов
• Придает здоровый блеск волосам
• Улучшает расчесывание волос
• Уменьшает статический заряд и пушение волос
Подходит для различных рецептур для ухода за волосами и кожей головы: шампуни, кондиционеры, несмываемые продукты по уходу за волосами, продукты для стайлинга.
Проведенные исследования эффективности Fision KeraVeg18:
Исследования силы и эластичности необработанных волос африканского типа:
Цель испытания: продемонстрировать преимущества Fision KeraVeg18 по сравнению с гидролизованным кератином животного, измеряя эластичное удлинение и удельную работу, необходимую для разрыва отдельных прядей волос.
Процедура: пряди по 90 волосков необработанных африканских волос (исходные кудри VII типа) были разделены на 3 группы (прядь по 30 волос на каждую обрабатываемую группу).
- Группа 1 была обработана 2% Fision KeraVeg18 в составе коммерческого шампуня и кондиционера,
- Группа 2 была обработана 2% гидролизованным кератином в составе коммерческого шампуня и кондиционера,
- Группа 3 была обработана коммерческий шампунем и кондиционером (плацебо).
Вначале волосы обрабатывали с использованием набора Soft Sheen Carson Healthy Gloss 5, согласно инструкции производителя. После этого волосы обрабатывали в течение 5 циклов шампунем (1 минута) и кондиционером (2 минуты). Волосы сушили 24 часа в условиях окружающей среды. Измерения проводили по методике Dia-Stron.
После этого волосы обрабатывали в течение 5 циклов шампунем (1 минута) и кондиционером (2 минуты). Волосы сушили 24 часа в условиях окружающей среды. Измерения проводили по методике Dia-Stron.
Результаты: было показано, что Fision KeraVeg18 помогает противостоять ухудшению качества необработанных волос и снижению ломкости, улучшая их эластичность и прочность. Волосы, обработанные Fision KeraVeg18, продемонстрировали повышенное эластичное удлинение и прочность по сравнению с плацебо и гидролизованным кератином.
Исследования силы и эластичности обесцвеченных волос белых европейцев:
Цель испытания: продемонстрировать преимущества Fision KeraVeg18 по сравнению с гидролизованным животным кератином и плацебо, измеряя эластичное удлинение и удельную работу, необходимую для разрыва отдельных волос из пряди.
Процедура: прядь волос — 90 штук трижды обесцвеченных волосков белых европейцев, взятых с одной головы. Трехкратная обработка лечебным растворами в течение 30 минут
3 группы:
- группа 1 была обработана лечебным раствором 2% Fision KeraVeg18
- группа 2 была обработана лечебным раствором 2% гидролизованный кератин,
- группа 3 необработанная группа для сравнения.

После первой и второй обработки волосы оставляли сохнуть в течение 24 часов в условиях окружающей среды. После последней обработки волосы калибровали перед тестированием. Измерения проводили по методике Dia-Stron.
Результаты: было показано, что Fision KeraVeg18 эффективен для ухода за обесцвеченными волосами белого европейца, улучшая их эластичность и прочность на разрыв на уровне аналогичном или превышающим гидролизованный кератин. Fision KeraVeg18 помогает восстановить повреждения, вызванные химической обработкой волос.
Исследование облегчения расчёсывания влажных и сухих волос:
Цель испытания: продемонстрировать облегчение влажного и сухого расчесывания при использовании Fision KeraVeg18 по сравнению с плацебо и гидролизованным кератином.
Процедура: пряди по 9 штук русых волос белого европейца длиной около 15 см, обесцвеченных один раз, (3 пряди на каждую обрабатываемую группу).
- Группа 1 была обработана 2% Fision KeraVeg18 в составе шампуня и кондиционера,
- группа 2 была обработана 2% гидролизованном кератином в составе шампуня и кондиционера,
- группа 3 была обработана шампунем и кондиционером (плацебо).

Сила, необходимая для расчесывания волос, измерялась с помощью мини тестера на растяжение Dia-Stron MTT175. Для очистки образцов волос была проведена предварительная обработка 10% раствором SLES. После предварительной обработки образцы сушили в условиях окружающей среды 24 часа. Затем волосы были обработаны соответствующими шампунями и кондиционерами в течение 5 циклов. После обработок измеряли силу при влажном расчесывании. Далее волосам давали высохнуть в течение 24 часов в условиях окружающей среды перед измерением силы при сухом расчесывании. В обоих тестах измеряли силу при расчесывании после 1 и 5 обработок. Все процедуры были протестированы троекратно.
Результаты: Полученные данные демонстрируют, что Fision KeraVeg18 эффективно облегчает расчесывание волос – сухих эффективнее, а влажных на том же уровне, что и гидролизованный кератин. В дополнение к улучшению общего качества волос Fision KeraVeg18 помогает облегчить расчесывание влажных и сухих волос. Облегчение расчесывания при использовании продуктов с Fision KeraVeg18 являются признаком более гладкой и здоровой кутикулы.
Облегчение расчесывания при использовании продуктов с Fision KeraVeg18 являются признаком более гладкой и здоровой кутикулы.
Сенсорное исследование
Цель испытания: Продемонстрировать положительную динамику при удаление спутанности, легкость укладки, эластичность/ гибкость, блеск / сияние, пушение / статический заряд после 4 применений продуктов с Fision KeraVeg18.
Процедура: 5 женщин различного происхождения оценивали головы манекенов с волосами белых европейцев.
- 1 обработка волос была проведена 2% Fision KeraVeg18 в составе коммерческого шампуня и кондиционера,
- 2 обработка волос была проведена 2% гидролизованным кератином в составе коммерческого шампуня и кондиционера.
Для очистки волос была проведена их предварительная обработка 10% раствором SLES.
Испытуемые оценили состояние влажных и сухих волос на основе параметров, перечисленных в целях испытания. Обработку проводили на половине головы шампунями и кондиционерами в общей сложности 4 раза. Вначале оценка проводилась на влажных волосах. Далее волосам давали высохнуть в условиях окружающей среды в течение 24 часов для проведения последующей оценки сухих волос. Оценку проводили по 11-балльной шкале от 0 (наихудший) до 10 (лучший).
Вначале оценка проводилась на влажных волосах. Далее волосам давали высохнуть в условиях окружающей среды в течение 24 часов для проведения последующей оценки сухих волос. Оценку проводили по 11-балльной шкале от 0 (наихудший) до 10 (лучший).
Результаты: при оценке влажных волос участники комиссии отдали предпочтение Fision KeraVeg18 за его способность улучшать гибкость волос и обеспечивать легкое удаление спутанности. В исследовании сухих волос участники оценили Fision KeraVeg18 равнозначно с гидролизованным кератином. Fision KeraVeg18 также улучшал внешний вид волос за счет увеличения блеска и уменьшения вьющихся волос, обеспечивал волосам наиболее здоровый вид. Эти результаты демонстрируют дополнительные преимущества Fision KeraVeg18 для восстановления и омоложения волос.
Антиоксидантная активность:
Цель испытания: Для измерения антиоксидантной защиты волос Fision KeraVeg18 и гидролизованный кератин были исследованы на эффективность нейтрализации перекисных радикалов по сравнению с тролоксом (водорастворимый аналог витамина Е).
Процедура: Значение Oxygen Radical Absorbancy Capacity (ORAC, дословно «объем поглощения кислородных радикалов»), которое оценивает способность вещества ограничивать окислительное разложение флуоресцеина. 1 тестируемый раствор 1% Fision KeraVeg18, 2 тестируемый раствор 1% гидролизованный кератин.
Результаты: Основываясь на исследовании ORAC, можно утверждать, что Fision KeraVeg18 обладает антиоксидантной защитой аналогичной гидролизованному кератину и помогает ограничить окислительное повреждение волос и кожи головы.
Введение 2-5% Fision KeraVeg18 в продукты по уходу за волосами повысит эластичность и силу волос, поможет защитить волосы от травмирующих салонных процедур и внешних стрессов, в том числе вызванной свободными радикалами, сделает волосы более блестящими и здоровыми, улучшит расчесывание волос, уменьшит статические токи и пушение волос. Fision KeraVeg18 – удовлетворяет современным требованиям этичности, создан без использования животного сырья.
Белки | Tervisliku toitumise informatsioon
Белки составляют примерно 15–20% массы тела человека, что при весе в 70 кг дает около 12 кг. Основные задачи белков – обеспечение роста, построения и развития организма. Белковый состав имеют почти все энзимы и часть гормонов. Белки активно участвуют в производстве антител и обеспечивают крепость и активность иммунной системы, а также участвуют в транспортировке многих соединений.
Белки состоят из аминокислот, подразделяемых на незаменимые, которые нужно получать с пищей, и заменимые, которые организм способен синтезировать самостоятельно. Незаменимыми для человека аминокислотами являются изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан, валин и гистидин. Заменимыми для человека аминокислотами являются аланин, аспарагин, аспарагиновая кислота, цистеин, глютамин, глютаминовая кислота, глицин, пролин, серин и тирозин. Разные продукты содержат разные сочетания и количества аминокислот.
Белки животного происхождения (белки яиц, молока, рыбы и мяса) содержат больше незаменимых аминокислот по сравнению с белками растительного происхождения.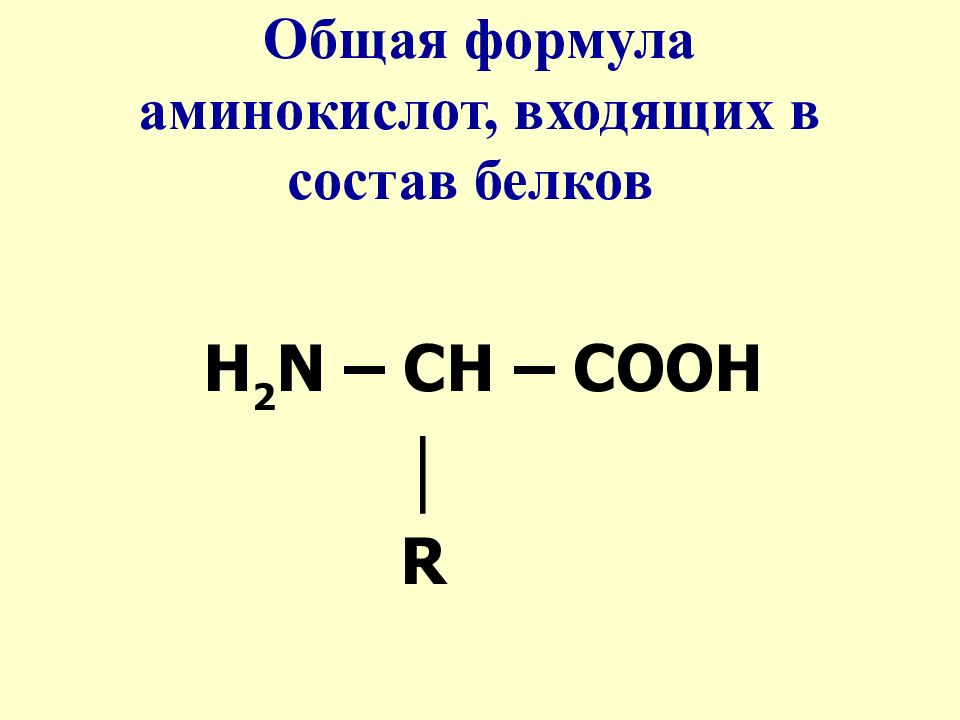 К сожалению, источники многих незаменимых животных белков слишком насыщены жиром. Довольно хороший аминокислотный состав имеют также белки, содержащиеся в сое, рисе, орехах и семенах.
К сожалению, источники многих незаменимых животных белков слишком насыщены жиром. Довольно хороший аминокислотный состав имеют также белки, содержащиеся в сое, рисе, орехах и семенах.
В части белков (например, белках зерновых растений) недостает некоторых незаменимых аминокислот. Их дефицит можно компенсировать небольшим количеством белков животного происхождения, например, приготовить манную кашу на молоке, добавить в макароны сыр и т.д.
Белки выполняют в организме множество функций:
- они необходимы для роста и строительства клеток организма,
- почти все энзимы и часть гормонов имеют белковый состав,
- активно участвуют в производстве антител и обеспечивают крепость и активность иммунной системы,
- участвуют в транспортировке многих соединений,
- дают пищевую энергию: 1 г = 4 ккал.
Рекомендуется покрывать белками 10–20 % суточной потребности в энергии. Человеку с потребностью в энергии 2000 ккал в сутки следует употреблять: от 0,1 x 2000 ккал / 4 ккал = 50 г до 0,20 x 2000 ккал/ 4 ккал = 100 г белков.
Лучшими источниками белков животного происхождения являются яйца, молочные продукты (например, творог, сыр, зернистый творог), рыба, птица, мясо. Лучшими источниками белков растительного происхождения являются бобовые, орехи, семена и зерновые продукты. Серьезный недостаток белка приводит к отекам и мышечной слабости, изменениям волос и кожи. Белковый дефицит часто возникает вместе с дефицитом энергии, обусловленным недостатком белков и других питательных веществ в результате общего дефицита питательных веществ.
Длительное питание продуктами с чрезмерным содержанием белка вредно, поскольку нагружает почки и печень, может вызвать подагру и повышает риск возникновения аллергии. Энергия, получаемая с белками, в долгосрочной перспективе не должна превышать 20 % суточной пищевой энергии.
что могут рассказать аминокислоты о жизни на других планетах — РТ на русском
Исследователи из Университета Вальпараисо (США) приблизились к ответу на вопрос, есть ли жизнь на других планетах.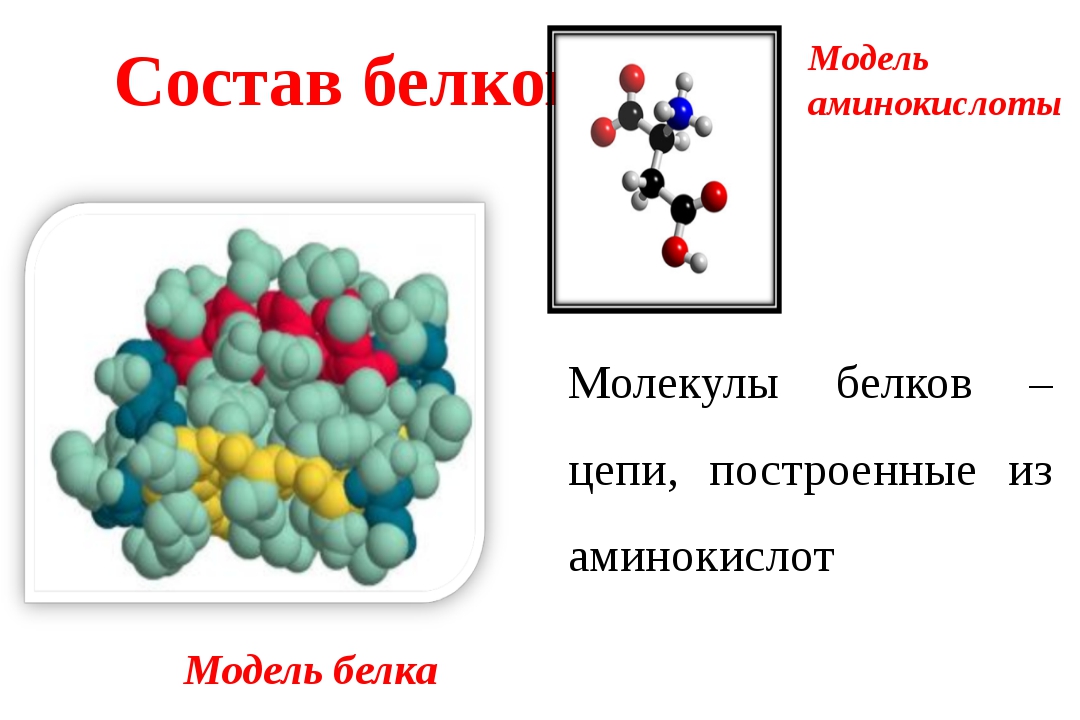 Они воссоздали в лаборатории внеземные условия и поместили в эту искусственную среду аминокислоты — строительный материал для белков. Разработанная ими методика призвана выяснить, как ведут себя в экстремальных условиях эти химические соединения.
Они воссоздали в лаборатории внеземные условия и поместили в эту искусственную среду аминокислоты — строительный материал для белков. Разработанная ими методика призвана выяснить, как ведут себя в экстремальных условиях эти химические соединения.
Учёные продолжают искать жизнь за пределами Земли. Но при отсутствии данных с других планет им приходится довольствоваться догадками и теориями.
Также по теме
Тайна второй планеты: чего ожидать от исследований ВенерыВ последнее время на международном уровне возрождается интерес к исследованию Венеры. Планета очень схожа с Землёй по размерам и…
Исследователи полагают, что инопланетные живые существа в чём-то похожи на землян.
«Химический состав жизни на Земле — по преимуществу производная всего нескольких избранных ингредиентов. Как и человеческое тело, вся известная жизнь на 95% состоит из водорода, кислорода и углерода. Атомы углерода охотно образуют связи как с другими атомами углерода, так и со многими другими элементами — поэтому мы и получились углеродной формой жизни. И именно поэтому изучение молекул, которые содержат углерод, — это так называемая органическая химия», — пишет в своей статье американский астрофизик Нил Деграсс Тайсон.
Атомы углерода охотно образуют связи как с другими атомами углерода, так и со многими другими элементами — поэтому мы и получились углеродной формой жизни. И именно поэтому изучение молекул, которые содержат углерод, — это так называемая органическая химия», — пишет в своей статье американский астрофизик Нил Деграсс Тайсон.
Однако оснований полагать, что жизнь на другой планете развивалась бы точно так же, как и на Земле, нет. Чтобы выяснить, какие варианты реальны, исследователи Университета Вальпараисо разработали новый подход к проблеме. Они решили испытать, как поведут себя земные аминокислоты в искусственно созданных «инопланетных» условиях.
«Наша главная цель — выяснить, есть ли у аминокислот структурные характеристики, которые приводят к большей устойчивости аминокислот во внеземных условиях, и что это могут быть за характеристики», — пояснила задачи исследовательской группы её руководитель Клэр Маммосер.
Суть метода состоит в следующем. Аминокислоты помещают в разную по свойствам среду.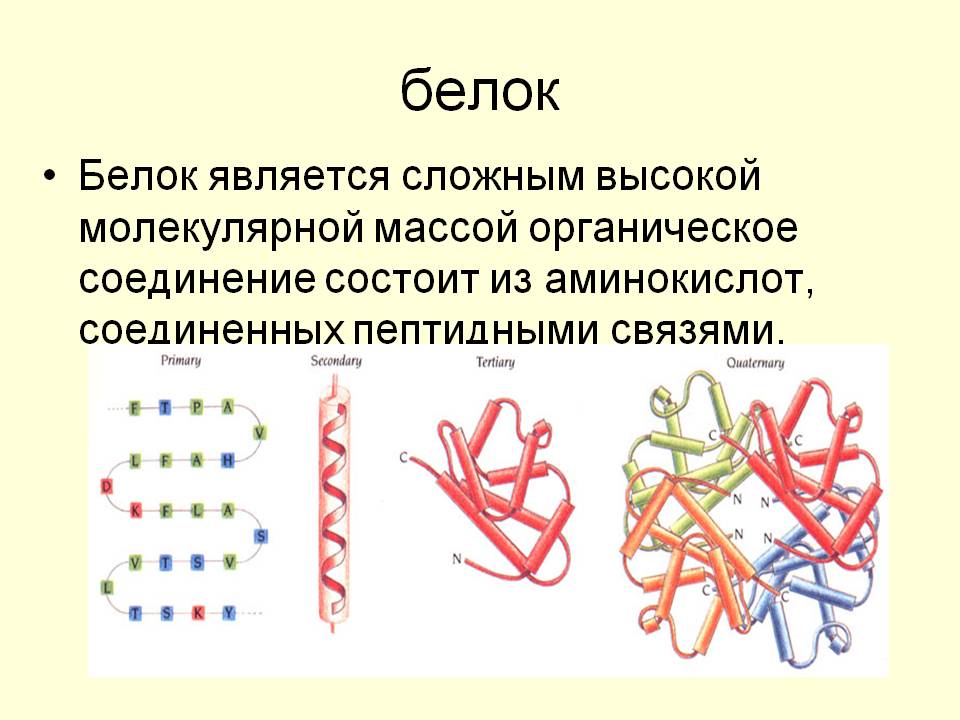 В лаборатории их подвергают воздействию ультрафиолета, очень высокой и очень низкой температуры, а также других не самых благоприятных с точки зрения земной жизни условий. Таким образом можно выяснить, как вели бы себя вещества на Марсе, Энцеладе (спутнике Сатурна) и Европе (луне Юпитера).
В лаборатории их подвергают воздействию ультрафиолета, очень высокой и очень низкой температуры, а также других не самых благоприятных с точки зрения земной жизни условий. Таким образом можно выяснить, как вели бы себя вещества на Марсе, Энцеладе (спутнике Сатурна) и Европе (луне Юпитера).
В ходе предварительных опытов исследователи подвергли различным испытаниям пять аминокислот, которые участвуют в образовании белков (а значит, способствуют развитию жизни), и десять аминокислот, которые этого не делают.
Также по теме
Как в «Звёздных войнах»: возможна ли жизнь на планете с двумя солнцамиУчёные построили компьютерную модель и выяснили, что на планете земного типа, которая обращается вокруг системы из двух звёзд, вполне…
Во время конференции по экспериментальной биологии, проводимой Американским обществом биохимии и молекулярной биологии в Чикаго, исследовательская группа заявила о первых успехах. Оказалось, что разработанный учёными метод позволяет не только отслеживать, в каких условиях и как будет вести себя аминокислота, но и определять, какие именно характеристики (например, размер) определяют её поведение. Однако конечная цель учёных не в том, чтобы проверить на прочность земные аминокислоты.
Оказалось, что разработанный учёными метод позволяет не только отслеживать, в каких условиях и как будет вести себя аминокислота, но и определять, какие именно характеристики (например, размер) определяют её поведение. Однако конечная цель учёных не в том, чтобы проверить на прочность земные аминокислоты.
«При разных обстоятельствах вне Земли белки живых организмов не обязательно будут такими же, как у организмов на нашей планете. Это значит, что для их образования могут требоваться известные нам аминокислоты, которые, как пока считается, не участвуют в создании жизни», — поясняет Клэр Маммосер.
Следующий этап экспериментов будет включать в себя исследование аминокислот, найденных на Земле в местах падения метеоритов. И это ещё не всё. Для исследований учёные привлекут и аминокислоты, которые получались в ходе экспериментов по поиску «истоков жизни».
Один из первых таких экспериментов был проведён в 1953 году. Поместив смесь газов, предположительно соответствующую земной атмосфере в древности, Стэнли Миллер и Гарольд Юри подвергли её воздействию электрических разрядов. Они надеялись получить из неорганических молекул органические. Их эксперимент привёл к образованию нескольких аминокислот. Правда, на вопрос о том, как появилась жизнь на Земле, они так и не ответили.
Они надеялись получить из неорганических молекул органические. Их эксперимент привёл к образованию нескольких аминокислот. Правда, на вопрос о том, как появилась жизнь на Земле, они так и не ответили.
Единственное небесное тело, на которое ступал человек, за исключением Земли, — это Луна. Поэтому в поиске жизни в космосе исследователям приходится довольствоваться косвенными признаками: анализом атмосферы и попытками изучить, какие условия могут быть на той или иной планете в зависимости от её удалённости от ближайшей звезды и свойств этого местного солнца.
Чтобы сделать промежуточный вывод о том, возможно ли существование жизни на другой планете, исследователи сопоставляют данные о ней с тем, в каких условиях способны обитать хоть какие-нибудь живые организмы. Стоит отметить, что тут учёным иногда даёт подсказки Земля. Время от времени следы той или иной формы жизни находят в самых неожиданных местах. Так, в апреле 2017 года следы органики были обнаружены в минерале серпентине недалеко от Марианской впадины.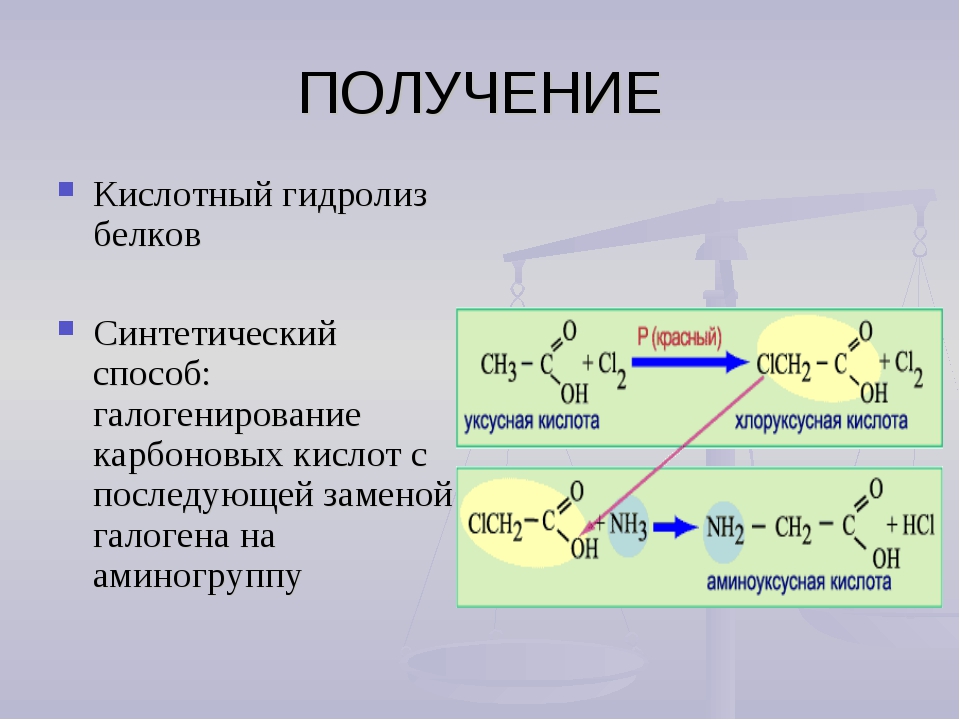
Найденные вещества производят микробы, которые обычно обитают в более доступных местах. Их обнаружение близ грязевого вулкана у самого глубокого места Тихого океана говорит о том, что живые организмы могут обитать на гораздо большей глубине, чем считалось ранее. Другими словами, сейчас известно далеко не всё об условиях, в которых может существовать жизнь. Вероятно, эксперимент американских учёных из Университета Вальпараисо расскажет и о том, из каких «кирпичиков» она может строиться на других планетах.
В чем разница между животным и растительным белком?
Белок — это неотъемлемая часть рациона питания. Он принимает участие в построении, восстановлении и поддержании структуры тела. Прекрасным источником протеина может стать как растительная, так и животная пища. Однако некоторые различия между ними все же есть.
Белок присутствует во всем теле — от мышц и внутренних органов до костей, кожи и волос. Тело не хранит белок, как и другие макроэлементы, поэтому он должен поступать в организм с пищей.
Протеины состоят из аминокислот. Для правильной работы тело человека нуждается в балансе всех 22 видов аминокислот. Оно не может продуцировать 9 из них, называемых незаменимыми. Полноценным источником белка является пища, содержащая все 9.
Правильный баланс аминокислот способствует построению мышц и может помочь организму быстро восстанавливаться.
Растительный белок против животного
Понимание различий между растительными и животными белками важно для всех, кто хочет обеспечить сбалансированность своего рациона. Одно из основных различий между ними заключается в содержании аминокислот.
Аминокислоты являются строительными элементами белка. Когда организм переваривает белки из пищи, он расщепляет их до аминокислот.
Телу могут потребоваться разные аминокислоты в разное время. Принято считать, что диета должна включать полноценные источники белка, которые содержат все 9 незаменимых аминокислот.
Некоторые продукты животного происхождения являются полноценными источниками белка. Среди них следующие:
Среди них следующие:
- рыба;
- яйца;
- молочные продукты;
- красное мясо;
- мясо птицы.
Большинство растительных белков являются неполноценными, а это означает, что у них отсутствует хотя бы 1 из незаменимых аминокислот.
Однако некоторые растительные продукты, такие как киноа и гречка, являются полноценными источниками белка.
Важно, чтобы вегетарианцы и веганы сочетали разные источники получения протеина. Это станет гарантией того, что они получат полный набор незаменимых аминокислот. Кроме того, следует иметь в виду, что для переваривания некоторых видов растительного белка организму требуется больше времени.
Следующие растительные продукты питания содержат наибольшее количество белка:
- цельные злаки;
- чечевица;
- орехи;
- фасоль;
- бобовые;
- определенные фрукты, такие как авокадо;
- соя;
- семена конопли;
- рис;
- горох.
Что лучше для здоровья?
При выборе между растительными и животными источниками белка важно учитывать другие питательные вещества, которые обеспечивают продукты.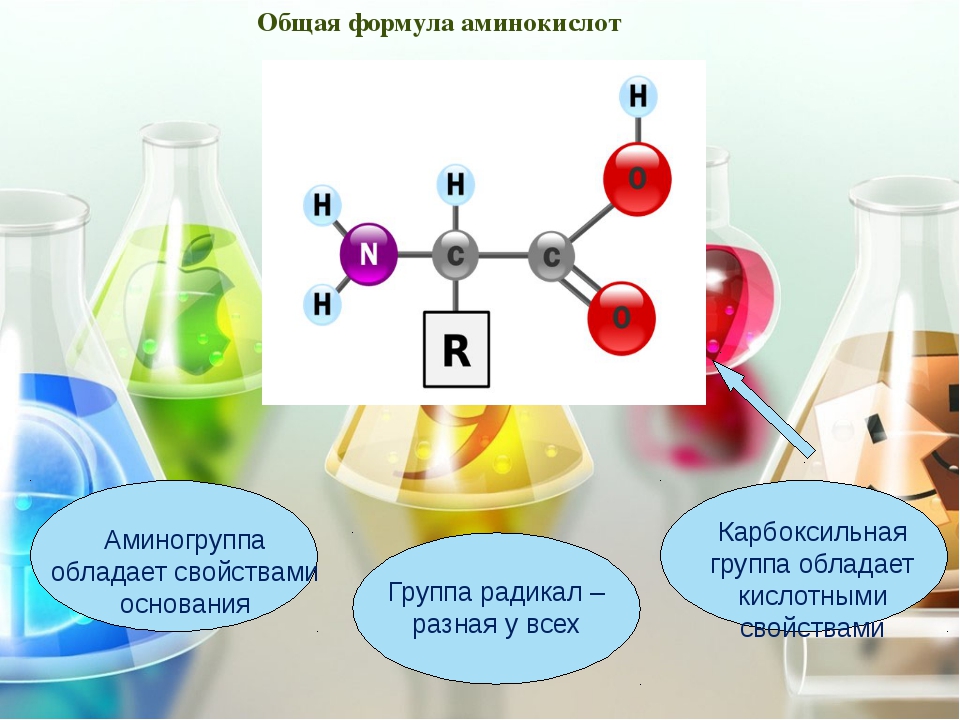 Продукты, богатые белком, могут иметь широкие питательные профили.
Продукты, богатые белком, могут иметь широкие питательные профили.
Некоторые источники животного протеина могут содержать высокие уровни гема железа и витамина B12, в то время как многие растительные продукты не содержат этих питательных веществ.
С другой стороны, растения содержат специфические питательные вещества, называемые фитонутриентами, и некоторые антиоксиданты, которые отсутствуют в пище животного происхождения.
Продукты животного происхождения содержат насыщенный жир и высокий уровень холестерина. По этим причинам человеку желательно избегать употребления этих продуктов в большом количестве.
У многих людей холестерин из продуктов питания ассоциируется с заболеваниями сердечно-сосудистой системы. Однако данные некоторых недавних исследований не доказывают наличия причинно-следственной связи.
Пищевые волокна — еще один важный фактор. Только растительные продукты содержат клетчатку, которая помогает сбалансировать работу пищеварительной системы. Употребление большего количества растительного белка также может улучшить общее состояние здоровья человека.
Употребление большего количества растительного белка также может улучшить общее состояние здоровья человека.
Согласно результатам метаанализа, проведенного в 2016 г. в Гарвардском университете (Harvard University), США, ученые предположили, что употребление большого количества животного белка, особенно полученного из обработанного красного мяса, может повысить риск смерти от сердечно-сосудистых заболеваний.
Тем не менее исследователи отметили, что они выявили связь между употреблением животного белка и сердечно-сосудистыми заболеваниями у людей с по меньшей мере 1 фактором риска, связанным с образом жизни. Среди них курение, употребление алкоголя или избыточная масса тела и ожирение. Результаты также свидетельствуют, что употребление большего количества растительного белка может помочь снизить эти и другие риски.
В целом лучший способ покрыть диетические потребности человека — это использовать широкий ассортимент продуктов.
Что лучше для наращивания мышц?
Спортсмены и другие люди, стремящиеся увеличить мышечную массу и уменьшить количество времени, которое требуется на восстановление, часто обращают пристальное внимание на потребление белка.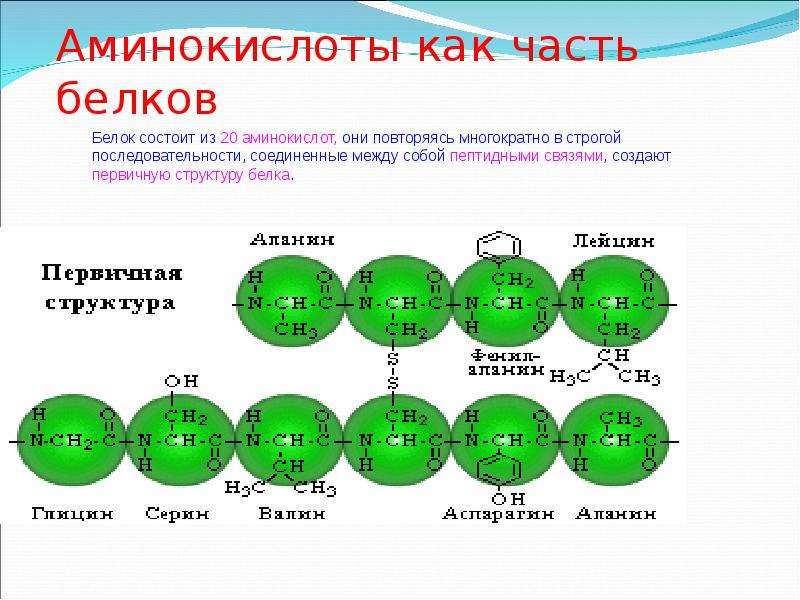 Он помогает восстанавливать и наращивать мышцы после усердной тренировки.
Он помогает восстанавливать и наращивать мышцы после усердной тренировки.
Многие спортсмены для построения мышц обращаются к применению сывороточного протеина. Он легче расщепляется и поглощается организмом. Именно эти свойства дают сывороточному белку ряд преимуществ над другими типами, такими как мясной, яичный и овощной.
Что касается растительных источников, то результаты некоторых исследований свидетельствуют, что изолят рисового протеина может иметь такие же преимущества, что и сывороточный протеин. Часто рекомендуют использовать комбинацию растительных белков после тренировки. Это может обеспечить организму источник целого ряда аминокислот.
Наилучшие источники растительных и животных белков
Просто получение достаточного количества белка может быть более важно, чем сосредоточение внимания на его виде. Результаты исследования, опубликованные в журнале «The American Journal of Clinical Nutrition», свидетельствуют, что включение достаточного количества белка в диету существенно улучшает показатели мышечного здоровья, такие как недостаточная мышечная масса и сила в четырехглавой мышце бедра.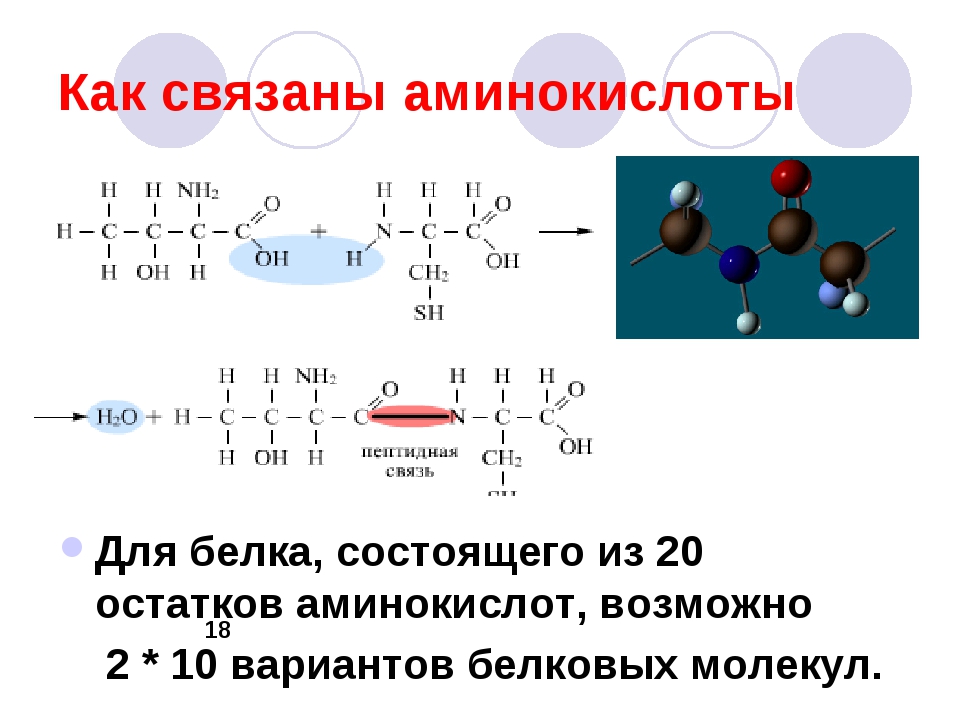
Исследователи отметили, что количество белка более важно, чем его тип. Однако некоторые источники протеина могут быть более полезны для организма. Например, рыба и белое мясо, как правило, содержат меньше жира, чем красное мясо. Для многих людей выбор между белками животного и растительного происхождения включает ряд этических соображений. Вместо того, чтобы сосредоточиться на одном типе белка, лучше потреблять широкий ассортимент продуктов. Это может помочь гарантировать то, что человек получает здоровый баланс аминокислот и других жизненно важных питательных веществ. Однако вопрос формирования рациональной диеты в отношении определения потребности и источников белка следует обсуждать с диетологом.
По материалам www.medicalnewstoday.com
Обмен белков в организме — анализы на белки, симптомы, лечение
directions
Белки являются одними из сложнейших веществ организма и служат основой протоплазмы клеток. В их состав помимо углерода, кислорода, водорода и азота входят и аминокислоты. Последние дают основу для построения молекул белков. Они играют огромную роль в человеческом организме и отвечают за важнейшие функции: дыхание, выделения, пищеварение, движение, защитную, обеспечивают организм необходимой энергией и восполняют компоненты клетки. Нарушение обмена белка развивается в том случае, если в организм поступает его большее либо меньшее количество. На этой почве могут возникать различные опасные заболевания, поэтому при малейшем подозрении необходимо своевременно сделать все тесты.
В их состав помимо углерода, кислорода, водорода и азота входят и аминокислоты. Последние дают основу для построения молекул белков. Они играют огромную роль в человеческом организме и отвечают за важнейшие функции: дыхание, выделения, пищеварение, движение, защитную, обеспечивают организм необходимой энергией и восполняют компоненты клетки. Нарушение обмена белка развивается в том случае, если в организм поступает его большее либо меньшее количество. На этой почве могут возникать различные опасные заболевания, поэтому при малейшем подозрении необходимо своевременно сделать все тесты.
Врачи-специалисты
Старшая медицинская сестра
Медицинская сестра
Медицинская сестра эндоскопического кабинета
Врач-терапевт
Анализ на коронавирус методом ПЦР.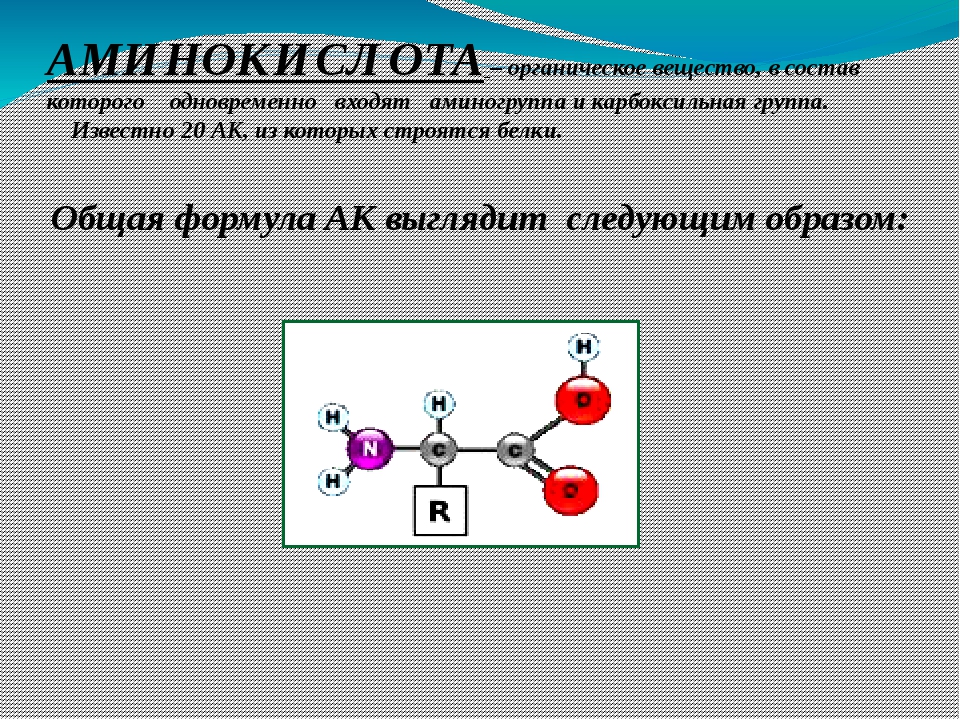 Результат в течение суток
Результат в течение суток
Наши клиники в Санкт-Петербурге
Медицентр Юго-ЗападПр.Маршала Жукова 28к2
Кировский район
- Автово
- Проспект Ветеранов
- Ленинский проспект
Получить подробную информацию и записаться на прием Вы можете по телефону +7 (812) 640-55-25
Анализы на белки
Альбумин является основным белком плазмы крови. Его синтез происходит в печени. Главная задача, которую выполняет альбумин, заключается в поддержании давления плазмы относительно объёма крови. Вместе с этим он осуществляет доставку различных веществ и их депонирование. Его сниженный уровень говорит о протекании в организме патологических процессов.
Его синтез происходит в печени. Главная задача, которую выполняет альбумин, заключается в поддержании давления плазмы относительно объёма крови. Вместе с этим он осуществляет доставку различных веществ и их депонирование. Его сниженный уровень говорит о протекании в организме патологических процессов.
Белковые фракции – комплексный анализ, позволяющий оценить наличие в плазме крови альбумина и глобулинов. Исследование назначается при патологии почек и печени, онкологических и системных заболеваниях, нарушениях питания, а так же хронических и острых воспалительных заболеваниях.
Креатинин представляет собой конечный продукт обмена белков. Принимает участие в энергетическом обмене тканей. Из организма выводится вместе с мочой, поэтому по анализу можно судить о состоянии почек. Высокий уровень указывает на наличие почечной недостаточности, обезвоживании организма, мясной диете.
Мочевая кислота занимается выведение азота из организма. Нарушение её обмена напрямую связано со сбоем в работе почек.
Нарушение её обмена напрямую связано со сбоем в работе почек.
Мочевина вырабатывается в печени. Во время её синтеза обезвреживается аммиак. Анализ мочевины в крови может выявить наличие множество опасных заболеваний, требующих срочного лечения, таких как: злокачественные опухоли, заболевания почек, ожоги, лейкоз, почечная недостаточность, цирроз, гепатит, печёночная недостаточность.
Общий белок – органический полимер, который состоит из аминокислот. Его определение в плазме крови позволяет судить о заболеваниях почек, печени, нарушении питания и онкологических заболеваниях.
Тимоловая проба позволяет дать характеристику работе печени. Повышение результатов исследования возникает в случаях, когда у человека: гепатит А, малярия, токсический гепатит, вирусные инфекции, цирроз печени.
Во время беременности очень часто встречается отличное от нормы значение анализов на белки в организме.
Какие симптомы нарушения обмена белков?
Различают несколько видов нарушения содержания белков в плазме крови: гиперпротеинемия означает увеличение его количества, а гипопротеинемия – уменьшение. Повышенное содержание белка может быть как наследственным, так и приобретённым заболеванием. При нарушении в обмене нуклеиновых кислот возникает подагра.
Повышенное содержание белка может быть как наследственным, так и приобретённым заболеванием. При нарушении в обмене нуклеиновых кислот возникает подагра.
Симптомы нарушений обмена белка:
- Избыточное потребление белка может проявляться в виде:
- запора либо поноса;
- отвращения к еде;
- повышенного содержания белков в плазме крови;
- дисбактериоза кишечника;
- Низкое потребление белка может проявляться в виде двух различных заболеваний:
- Квашиоркор – это несбалансированный алиментарный недостаток белка в человеческом организме. К симптомам заболевания можно отнести: отёки, вялость, апатию, низкую массу тела, асцит, задержку развития, иммунодефицит, пониженное содержание белков в крови. Прогноз при возникновении этого заболевания неблагоприятный и очень часто больные умирают. Чаще всего развивается у детей от 1го до 4-х лет.
 Болезнь возникает из-за дефицита одного либо нескольких питательных веществ. Ещё больше может усугубить положение контакт с инфекцией (например, ВИЧ) или отравление токсинами.
Болезнь возникает из-за дефицита одного либо нескольких питательных веществ. Ещё больше может усугубить положение контакт с инфекцией (например, ВИЧ) или отравление токсинами. - Алиментарная дистрофия – сбалансированная недостаточность. Симптомы возникновения заболевания: отёки, содержание белка в крови на нижней границе, низкая масса тела, иммунодефицит, повышенное содержание кетоновых тел. Для алиментарной дистрофии нехарактерна задержка физического и умственного развития. В отличие от квашиоркора при дистрофии прогноз для заболевших наиболее благоприятный, однако так же встречаются случаи со смертельным исходом. Наблюдается у детей в возрасте до одного года.
- Для несбалансированного питания, при котором происходит дефицит незаменимых аминокислот, характерна: низкая масса тела, нарушение развития и роста, плохой аппетит. В случае недостаточного содержания в организме какой-либо аминокислоты симптомы могут носить специфический характер, влияющий на различные органы и провоцирующий появление заболеваний.

- Избыточное содержание аминокислот так же плохо влияет на организм. Оно проявляется в виде снижения аппетита и массы тела, нарушения вкусовых рецепторов, а так же питания тканей и органов.
Как лечится нарушение обмена белков?
После точной постановки диагноза лечение назначается специалистом для каждого пациента индивидуально. В случае алиментарной дистрофии в первые дни необходимо соблюдать абсолютный покой. Не должно возникать психических и физических нагрузок. Питание при этом должно быть полноценным, богатым витаминами и белками. Вместе с тем расширение рациона происходит постепенно, чтобы организм смог адаптироваться к новому режиму приёма пищи. Вводятся белковые препараты и назначаются анаболические стероидные гормоны. При подагрическом артрите применяются противовоспалительные препараты.
756,860,1176,1300,1285,1017
Антон Иванов 21. 12.2020
17:50
12.2020
17:50 medi-center.ru
Огромная благодарность неврологу Соловьёву Даниилу Петровичу! Настоящий доктор, побольше бы таких докторов!
Кириличев Кирилл Александрович 03.12.2020 10:44medi-center.ru
Хочу поблагодарить терапевта Дерешовского Александра Сергеевича, за профессионализм и внимательность к пациенту. Именно этими качествами должен обладать настоящий Врач. Доктор всегда был на связи, проявлял интерес к самочувствию и готов был ответить на любой поставленный мной вопрос. Побольше бы таких специалистов в такое непростое для всех время.
Гришин Сергей Андреевич 19. 10.2020
18:16
10.2020
18:16 medi-center.ru
Наблюдались с Covid всей семьей в Меди-центре на Охтинской. От всех нас огромный привет и благодарность Дерешовскому Александру Сергеевичу и Алетдинову Жану Вячеславовичу. Эти бесстрашные сталкеры ежедневно ходят в запретные зоны брать мазки, обследовать и назначать лечение, успокаивать и консультировать больных, оказывать им психологическую помощь. Приятно было увидеть Александра Сергеевича в должности врача, поздравляем с окончанием академии!
Царёва Светлана 30.09.2020 14:31medi-center.ru
Обратилась в отделение на Жукова к травматологу Байжанову с сильнейшими болями в пятке, не могла наступать, оказалась пяточная шпора и плоскостопие.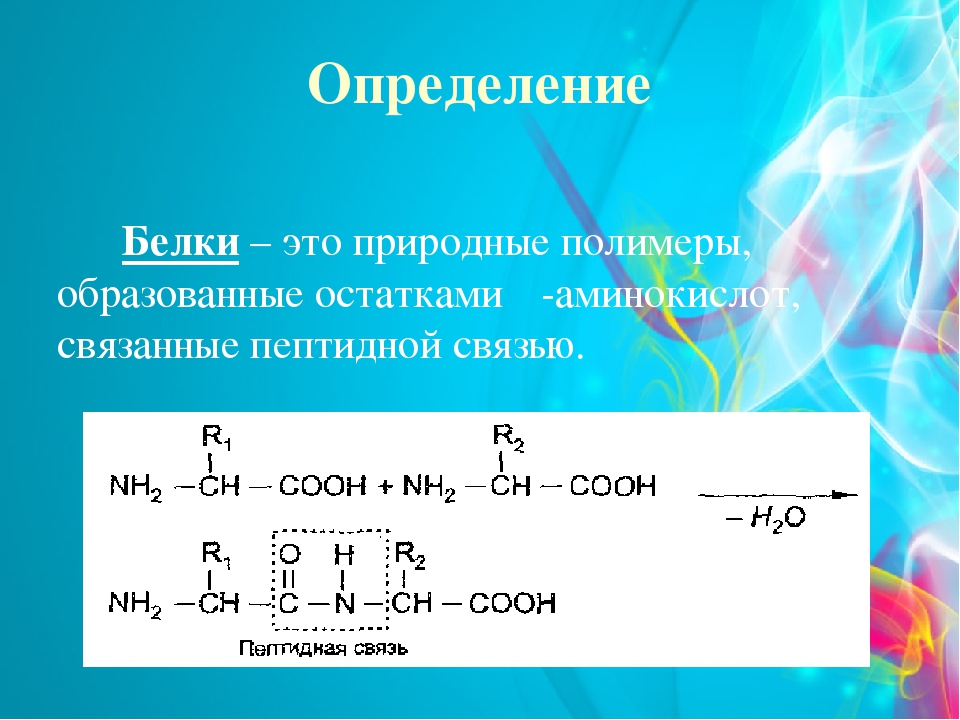 Очень благодарна Абыл Хаиру за проведенное лечение, боль полностью не прошла, но по сравнению с тем, что было, день и ночь, не могла наступать на ногу. Еще хочу отметить важный момент, доктор подробно и на доступном мне языке объяснил мне причину и суть заболевания, дал рекомендации по дальнейшему лечению. Большое спасибо, лучшие рекомендации молодому специалисту 🙂
Очень благодарна Абыл Хаиру за проведенное лечение, боль полностью не прошла, но по сравнению с тем, что было, день и ночь, не могла наступать на ногу. Еще хочу отметить важный момент, доктор подробно и на доступном мне языке объяснил мне причину и суть заболевания, дал рекомендации по дальнейшему лечению. Большое спасибо, лучшие рекомендации молодому специалисту 🙂
Была 21.06.20 у Гареевой Регины Гумеровны.Хочу поблагодарить ее за проффесионализм,хорошее отношение к пациентам и за здравое рассуждение!Она все подробно объяснила,не пугала и не делала поспешных выводов,как некоторые,а ,наоборот,подбадривала.На вид добрая и спокойная.Всем советую????????
Выражаю благодарность Сидоркину Владимиру Александровичу (ЛОР). Благодаря профессионализму и опыту, врач смог диагностировать воспаление тройничного нерва, хотя изначально предполагал фарингит, т.к. боль была в районе лобных пазух. Верный диагноз доктор поставил после просмотра диска с рентгеновским снимком. Невролог подтвердил диагноз.
Убедительная просьба, обеспечить ЛОР-врача возможностью просматривать рентгеновские снимки на цифровых носителях (диски), чтобы врач не бегал по клинике в поисках ПК с дисководом.
Невролог подтвердил диагноз.
Убедительная просьба, обеспечить ЛОР-врача возможностью просматривать рентгеновские снимки на цифровых носителях (диски), чтобы врач не бегал по клинике в поисках ПК с дисководом.
Структура белка | Изучайте науку в Scitable
Строительными блоками белков являются аминокислоты, которые представляют собой небольшие органические молекулы, которые состоят из альфа (центрального) атома углерода, связанного с аминогруппой, карбоксильной группы, атома водорода и вариабельного компонента, называемого боковой цепью (см. Ниже ). Внутри белка несколько аминокислот связаны между собой пептидными связями , тем самым образуя длинную цепь. Пептидные связи образуются в результате биохимической реакции, которая извлекает молекулу воды, поскольку она соединяет аминогруппу одной аминокислоты с карбоксильной группой соседней аминокислоты.Линейная последовательность аминокислот в белке считается первичной структурой белка.
Белки состоят из набора всего из двадцати аминокислот, каждая из которых имеет уникальную боковую цепь. Боковые цепи аминокислот имеют разный химический состав. Самая большая группа аминокислот имеет неполярные боковые цепи. Некоторые другие аминокислоты имеют боковые цепи с положительными или отрицательными зарядами, в то время как другие имеют полярные, но незаряженные боковые цепи. Химический состав боковых цепей аминокислот имеет решающее значение для структуры белка, потому что эти боковые цепи могут связываться друг с другом, чтобы удерживать длину белка в определенной форме или конформации.Боковые цепи заряженных аминокислот могут образовывать ионные связи, а полярные аминокислоты способны образовывать водородные связи. Гидрофобные боковые цепи взаимодействуют друг с другом посредством слабых ван-дер-ваальсовых взаимодействий. Подавляющее большинство связей, образованных этими боковыми цепями, нековалентны. Фактически, цистеины — единственные аминокислоты, способные образовывать ковалентные связи, что они и делают со своими конкретными боковыми цепями. Из-за взаимодействий боковых цепей последовательность и расположение аминокислот в конкретном белке определяют, где в этом белке происходят изгибы и складки (рис. 1).
Из-за взаимодействий боковых цепей последовательность и расположение аминокислот в конкретном белке определяют, где в этом белке происходят изгибы и складки (рис. 1).
Рис. 1: Взаимосвязь между боковыми цепями аминокислот и конформацией белка
Определяющим признаком аминокислоты является ее боковая цепь (вверху, синий кружок; внизу, все цветные кружки). Когда аминокислоты соединяются серией пептидных связей, они образуют полипептид, другое слово для обозначения белка. Затем полипептид сворачивается в определенную конформацию в зависимости от взаимодействий (пунктирные линии) между его боковыми аминокислотными цепями.
Рисунок 2: Структура белка бактериородопсина
Бактериородопсин — это мембранный белок бактерий, который действует как протонный насос. Его форма важна для его функции. Общая структура белка включает как альфа-спирали (зеленый), так и бета-листы (красный).
Первичная структура белка — его аминокислотная последовательность — управляет складыванием и внутримолекулярным связыванием линейной аминокислотной цепи, что в конечном итоге определяет уникальную трехмерную форму белка. Водородная связь между аминогруппами и карбоксильными группами в соседних областях белковой цепи иногда вызывает определенные паттерны сворачивания. Эти стабильные паттерны сворачивания, известные как альфа-спирали и бета-листов , составляют вторичную структуру белка.Большинство белков содержат несколько спиралей и листов в дополнение к другим, менее распространенным паттернам (рис. 2). Совокупность образований и складок в единой линейной цепи аминокислот — иногда называемой полипептидом — составляет третичную структуру белка. Наконец, четвертичная структура белка относится к тем макромолекулам с множеством полипептидных цепей или субъединиц.
Водородная связь между аминогруппами и карбоксильными группами в соседних областях белковой цепи иногда вызывает определенные паттерны сворачивания. Эти стабильные паттерны сворачивания, известные как альфа-спирали и бета-листов , составляют вторичную структуру белка.Большинство белков содержат несколько спиралей и листов в дополнение к другим, менее распространенным паттернам (рис. 2). Совокупность образований и складок в единой линейной цепи аминокислот — иногда называемой полипептидом — составляет третичную структуру белка. Наконец, четвертичная структура белка относится к тем макромолекулам с множеством полипептидных цепей или субъединиц. Окончательная форма, принятая вновь синтезированным белком, обычно является наиболее энергетически выгодной.Когда белки сворачиваются, они тестируют множество конформаций, прежде чем достичь своей окончательной формы, которая является уникальной и компактной. Сложенные белки стабилизируются тысячами нековалентных связей между аминокислотами. Кроме того, химические силы между белком и его непосредственным окружением способствуют формированию и стабильности белка. Например, белки, которые растворены в цитоплазме клетки, имеют на своей поверхности гидрофильные (водолюбивые) химические группы, тогда как их гидрофобные (водоотталкивающие) элементы имеют тенденцию скрываться внутри.Напротив, белки, которые вставлены в клеточные мембраны, имеют на своей поверхности некоторые гидрофобные химические группы, особенно в тех областях, где поверхность белка подвергается воздействию липидов мембран. Однако важно отметить, что полностью свернутые белки не принимают форму. Скорее, атомы в этих белках остаются способными совершать небольшие движения.
Кроме того, химические силы между белком и его непосредственным окружением способствуют формированию и стабильности белка. Например, белки, которые растворены в цитоплазме клетки, имеют на своей поверхности гидрофильные (водолюбивые) химические группы, тогда как их гидрофобные (водоотталкивающие) элементы имеют тенденцию скрываться внутри.Напротив, белки, которые вставлены в клеточные мембраны, имеют на своей поверхности некоторые гидрофобные химические группы, особенно в тех областях, где поверхность белка подвергается воздействию липидов мембран. Однако важно отметить, что полностью свернутые белки не принимают форму. Скорее, атомы в этих белках остаются способными совершать небольшие движения.
Несмотря на то, что белки считаются макромолекулами, они слишком малы, чтобы их можно было визуализировать даже в микроскоп.Итак, ученые должны использовать косвенные методы, чтобы выяснить, как они выглядят и как сложены. Наиболее распространенным методом исследования структуры белков является рентгеновская кристаллография . С помощью этого метода твердые кристаллы очищенного белка помещают в пучок рентгеновских лучей, а диаграмма отклоненных рентгеновских лучей используется для прогнозирования положений тысяч атомов в кристалле белка.
С помощью этого метода твердые кристаллы очищенного белка помещают в пучок рентгеновских лучей, а диаграмма отклоненных рентгеновских лучей используется для прогнозирования положений тысяч атомов в кристалле белка.
аминокислот | Введение в химию
Цель обучения
- Опишите структуру аминокислоты и особенности, которые придают ее специфическим свойствам
Ключевые моменты
- Каждая аминокислота содержит центральный атом C, аминогруппу (Nh3), карбоксильную группу (COOH) и определенную группу R.
- Группа R определяет характеристики (размер, полярность и pH) для каждого типа аминокислоты.
- Пептидные связи образуются между карбоксильной группой одной аминокислоты и аминогруппой другой путем дегидратационного синтеза.
- Цепочка аминокислот представляет собой полипептид.
Условия
- полипептид Любой полимер (одинаковых или разных) аминокислот, соединенных пептидными связями.

- Группа R Группа R представляет собой боковую цепь, специфичную для каждой аминокислоты, которая придает определенные химические свойства этой аминокислоте.
- аминокислот Любая из 20 встречающихся в природе α-аминокислот (имеющих амино- и карбоксильные группы на одном атоме углерода) и различные боковые цепи, которые объединяются через пептидные связи с образованием белков.
Структура аминокислоты
Аминокислоты — это мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую фундаментальную структуру, которая состоит из центрального атома углерода, также известного как альфа (α) углерод, связанного с аминогруппой (NH 2 ), карбоксильной группой (COOH) и водородом. атом.В водной среде клетки как аминогруппа, так и карбоксильная группа ионизируются в физиологических условиях, и поэтому имеют структуры -NH 3 + и -COO —, соответственно. Каждая аминокислота также имеет другой атом или группу атомов, связанных с центральным атомом, известную как группа R. Эта группа R или боковая цепь придает каждой аминокислоте специфические характеристики белков, включая размер, полярность и pH.
Эта группа R или боковая цепь придает каждой аминокислоте специфические характеристики белков, включая размер, полярность и pH.
Типы аминокислот
Название «аминокислота» происходит от аминогруппы и карбоксикислотной группы в их основной структуре. В белках присутствует 21 аминокислота, каждая из которых имеет определенную R-группу или боковую цепь. Десять из них считаются незаменимыми аминокислотами у человека, потому что человеческий организм не может их производить, и они должны быть получены с пищей.Все организмы имеют разные незаменимые аминокислоты в зависимости от их физиологии.
Характеристики аминокислот
Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка, а какие — внутри? Какое распределение аминокислот вы ожидаете найти в белке, встроенном в липидный бислой?
Химический состав боковой цепи определяет характеристики аминокислоты.Аминокислоты, такие как валин, метионин и аланин, неполярны (гидрофобны), тогда как аминокислоты, такие как серин, треонин и цистеин, полярны (гидрофильны). Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные (с высоким pH) аминокислоты. Пролин является исключением из стандартной структуры анимокислоты, поскольку его группа R связана с аминогруппой, образуя кольцеобразную структуру.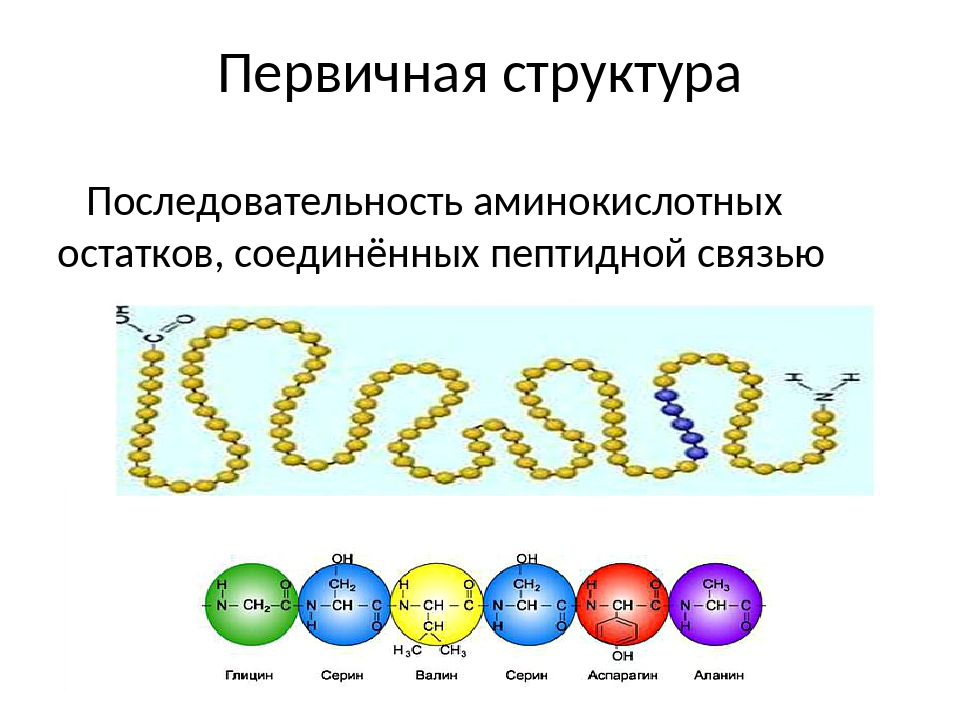
Аминокислоты обозначаются одной заглавной буквой или трехбуквенным сокращением.Например, валин обозначается буквой V или трехбуквенным символом val.
Пептидные облигации
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка. Каждая аминокислота связана с другой аминокислотой ковалентной связью, известной как пептидная связь. Когда две аминокислоты ковалентно связаны пептидной связью, карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты объединяются и высвобождают молекулу воды.Любая реакция, которая объединяет два мономера в реакцию, в которой образуется H 2 O в качестве одного из продуктов, известна как реакция дегидратации, поэтому образование пептидной связи является примером реакции дегидратации.
Образование пептидной связи Образование пептидной связи — это реакция синтеза дегидратации. Карбоксильная группа одной аминокислоты связана с аминогруппой входящей аминокислоты.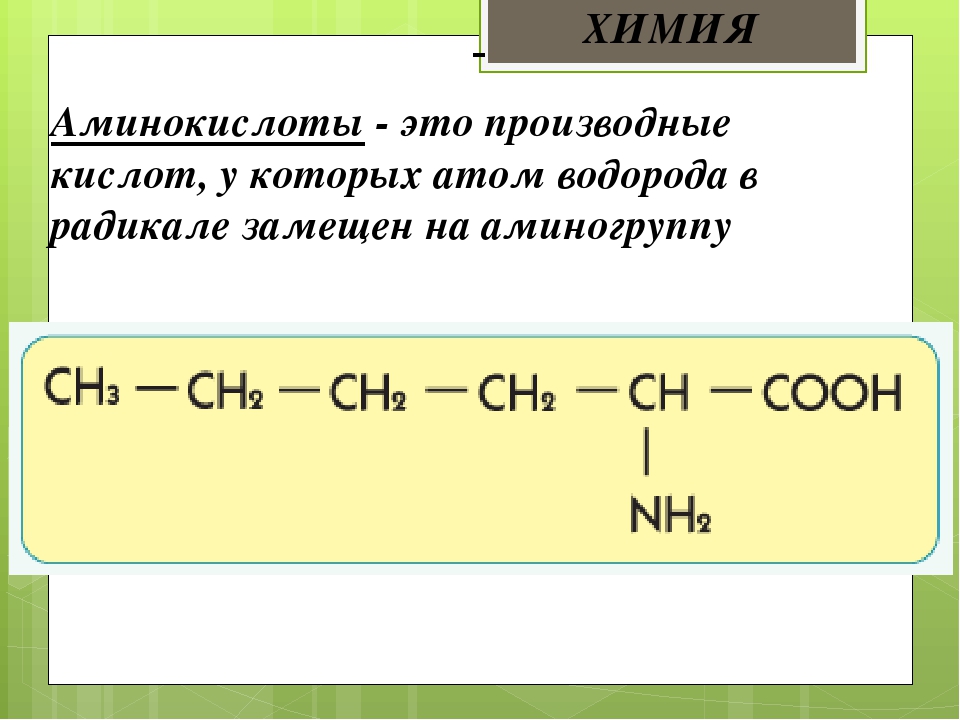 При этом выделяется молекула воды.
При этом выделяется молекула воды.Полипептидные цепи
Образовавшаяся цепочка аминокислот называется полипептидной цепью.Каждый полипептид имеет свободную аминогруппу на одном конце. Этот конец называется N-концом или амино-концом, а другой конец имеет свободную карбоксильную группу, также известную как C или карбоксильный конец. При считывании или сообщении аминокислотной последовательности белка или полипептида принято использовать направление от N к C. То есть предполагается, что первая аминокислота в последовательности находится на N-конце, а последняя аминокислота — на C-конце.
Хотя термины полипептид и белок иногда используются взаимозаменяемо, полипептид технически представляет собой любой полимер аминокислот, тогда как термин белок используется для полипептида или полипептидов, которые сложены должным образом, в сочетании с любыми дополнительными компонентами, необходимыми для правильного функционирования, и являются теперь работоспособен.
Показать источники Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Этот конкретный ресурс использовал следующие источники:
аминокислот | Биология для майоров I
Результаты обучения
- Продемонстрировать знакомство с мономерными единицами белков: аминокислоты
Белки представляют собой одну из наиболее распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул.Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить для транспортировки, хранения или перепонки; или они могут быть токсинами или ферментами. Каждая клетка живой системы может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Их структуры, как и их функции, сильно различаются. Однако все они представляют собой полимеры из аминокислот , расположенных в линейной последовательности.
Рис. 1. Аминокислоты имеют центральный асимметричный углерод, к которому присоединены аминогруппа, карбоксильная группа, атом водорода и боковая цепь (R-группа).
Аминокислоты — это мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую фундаментальную структуру, которая состоит из центрального атома углерода, также известного как альфа ( α ) углерода, связанного с аминогруппой (Nh3), карбоксильной группой (COOH) и атомом водорода. . Каждая аминокислота также имеет другой атом или группу атомов, связанных с центральным атомом, известную как группа R (рис. 1).
Название «аминокислота» происходит от того факта, что они содержат как аминогруппу, так и карбоксильно-кислотную группу в своей основной структуре.Как уже упоминалось, в белках присутствует 20 аминокислот. Девять из них считаются незаменимыми аминокислотами у человека, потому что человеческий организм не может их производить, и они получают с пищей.
Для каждой аминокислоты группа R (или боковая цепь) отличается (рис. 2).
Практический вопрос
Рис. 2. В белках обычно встречаются 20 общих аминокислот, каждая из которых имеет свою R-группу (вариантная группа), которая определяет его химическую природу.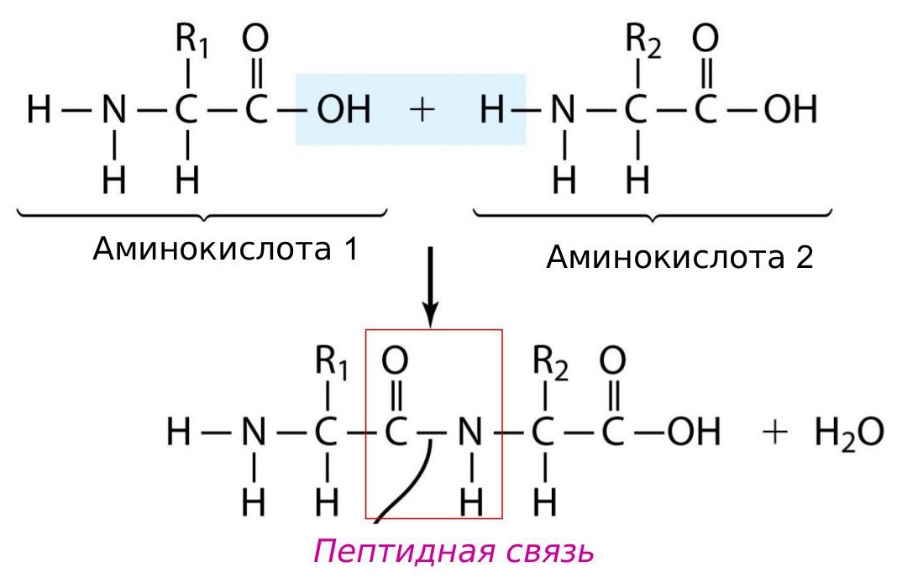
Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка, а какие — внутри? Какое распределение аминокислот вы ожидаете найти в белке, встроенном в липидный бислой?
Показать ответ Полярные и заряженные аминокислотные остатки (остаток после образования пептидной связи) с большей вероятностью будут обнаружены на поверхности растворимых белков, где они могут взаимодействовать с водой, и неполярные (например.g., боковые цепи аминокислот) с большей вероятностью будут обнаружены внутри, где они изолированы от воды. В мембранных белках неполярные и гидрофобные боковые цепи аминокислот связаны с гидрофобными хвостами фосфолипидов, в то время как полярные и заряженные боковые цепи аминокислот взаимодействуют с полярными головными группами или с водным раствором. Однако бывают исключения. Иногда положительно и отрицательно заряженные боковые цепи аминокислот взаимодействуют друг с другом внутри белка, а полярные или заряженные боковые цепи аминокислот, которые взаимодействуют с лигандом, могут быть обнаружены в кармане связывания лиганда.
Химическая природа боковой цепи определяет природу аминокислоты (то есть, является ли она кислотной, основной, полярной или неполярной). Например, аминокислота глицин имеет атом водорода в качестве группы R. Аминокислоты, такие как валин, метионин и аланин, неполярны или гидрофобны по природе, тогда как аминокислоты, такие как серин, треонин и цистеин, полярны и имеют гидрофильные боковые цепи. Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные аминокислоты.Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры аминокислоты, поскольку его аминогруппа не отделена от боковой цепи (рис. 2).
Аминокислоты обозначаются одной заглавной буквой или трехбуквенным сокращением. Например, валин обозначается буквой V или трехбуквенным символом val. Так же, как некоторые жирные кислоты необходимы для диеты, некоторые аминокислоты также необходимы.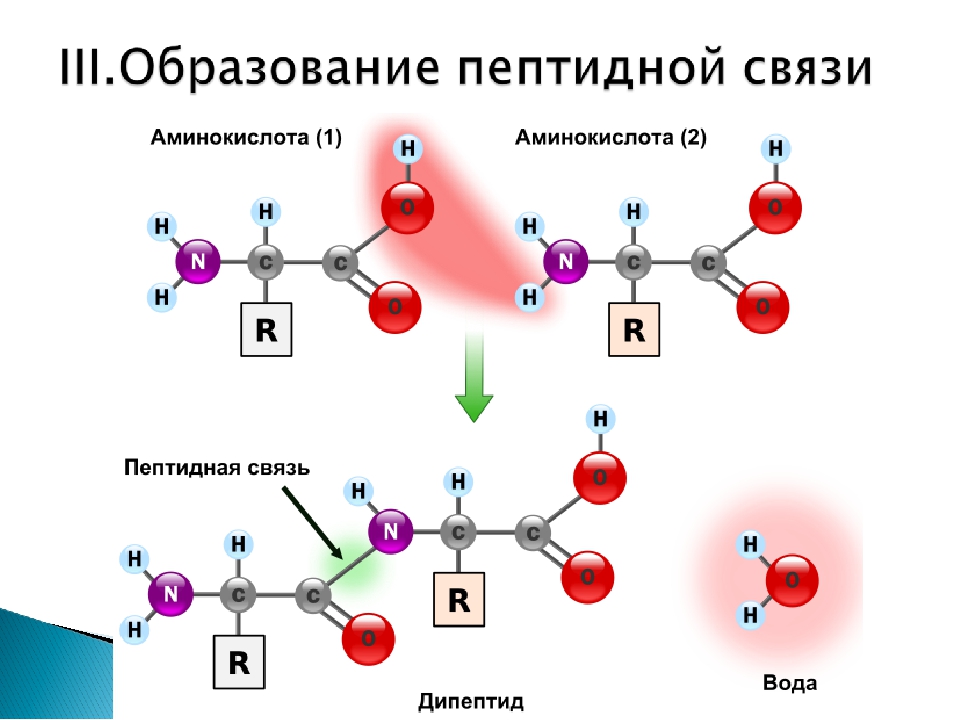 Они известны как незаменимые аминокислоты, а у людей они включают изолейцин, лейцин и цистеин.Незаменимые аминокислоты относятся к тем, которые необходимы для построения белков в организме, но не производятся организмом; Какие аминокислоты являются незаменимыми, варьируется от организма к организму.
Они известны как незаменимые аминокислоты, а у людей они включают изолейцин, лейцин и цистеин.Незаменимые аминокислоты относятся к тем, которые необходимы для построения белков в организме, но не производятся организмом; Какие аминокислоты являются незаменимыми, варьируется от организма к организму.
Рис. 3. Образование пептидной связи — это реакция синтеза дегидратации. Карбоксильная группа одной аминокислоты связана с аминогруппой входящей аминокислоты. При этом выделяется молекула воды.
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка.Каждая аминокислота присоединена к другой аминокислоте ковалентной связью, известной как пептидная связь, которая образуется в результате реакции дегидратации. Карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты объединяются, высвобождая молекулу воды. Полученная связь представляет собой пептидную связь (рис. 3).
Продукты, образованные такими связями, называются пептидами. По мере того, как к этой растущей цепи присоединяется больше аминокислот, полученная цепь называется полипептидом. Каждый полипептид имеет свободную аминогруппу на одном конце.Этот конец называется N-концом или амино-концом, а другой конец имеет свободную карбоксильную группу, также известную как C или карбоксильный конец. Хотя термины полипептид и белок иногда используются взаимозаменяемо, полипептид технически представляет собой полимер аминокислот, тогда как термин белок используется для полипептида или полипептидов, которые объединились вместе, часто имеют связанные непептидные простетические группы, имеют различную форму. , и имеют уникальную функцию. После синтеза (трансляции) белков большинство белков модифицируются.Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению, фосфорилированию или могут потребовать добавления других химических групп. Только после этих модификаций белок становится полностью функциональным.
По мере того, как к этой растущей цепи присоединяется больше аминокислот, полученная цепь называется полипептидом. Каждый полипептид имеет свободную аминогруппу на одном конце.Этот конец называется N-концом или амино-концом, а другой конец имеет свободную карбоксильную группу, также известную как C или карбоксильный конец. Хотя термины полипептид и белок иногда используются взаимозаменяемо, полипептид технически представляет собой полимер аминокислот, тогда как термин белок используется для полипептида или полипептидов, которые объединились вместе, часто имеют связанные непептидные простетические группы, имеют различную форму. , и имеют уникальную функцию. После синтеза (трансляции) белков большинство белков модифицируются.Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению, фосфорилированию или могут потребовать добавления других химических групп. Только после этих модификаций белок становится полностью функциональным.
Эволюционное значение цитохрома c
Цитохром c является важным компонентом цепи переноса электронов, частью клеточного дыхания, и обычно он находится в клеточной органелле, митохондрии. Этот белок имеет простетическую группу гема, и центральный ион гема попеременно восстанавливается и окисляется во время переноса электрона.Поскольку роль этого важного белка в производстве клеточной энергии имеет решающее значение, за миллионы лет он очень мало изменился. Секвенирование белков показало, что существует значительная гомология аминокислотной последовательности цитохрома с среди различных видов; другими словами, эволюционное родство можно оценить путем измерения сходства или различий между последовательностями ДНК или белков различных видов.
Этот белок имеет простетическую группу гема, и центральный ион гема попеременно восстанавливается и окисляется во время переноса электрона.Поскольку роль этого важного белка в производстве клеточной энергии имеет решающее значение, за миллионы лет он очень мало изменился. Секвенирование белков показало, что существует значительная гомология аминокислотной последовательности цитохрома с среди различных видов; другими словами, эволюционное родство можно оценить путем измерения сходства или различий между последовательностями ДНК или белков различных видов.
Ученые определили, что цитохром с человека содержит 104 аминокислоты.Для каждой молекулы цитохрома с от разных организмов, которая была секвенирована на сегодняшний день, 37 из этих аминокислот появляются в одном и том же положении во всех образцах цитохрома с. Это указывает на то, что, возможно, был общий предок. При сравнении последовательностей белков человека и шимпанзе различий в последовательностях не обнаружено. Когда сравнивали последовательности человека и макаки-резуса, единственное обнаруженное различие заключалось в одной аминокислоте. В другом сравнении секвенирование человека и дрожжей показывает разницу в 44-м положении.
В другом сравнении секвенирование человека и дрожжей показывает разницу в 44-м положении.
Внесите свой вклад!
У вас была идея улучшить этот контент? Нам очень понравится ваш вклад.
Улучшить эту страницуПодробнее
Аминокислоты — обзор
Электролитные и кислотно-основные свойства
Аминокислоты — это амфолиты; т.е. они содержат как кислотные, так и основные группы. Свободные аминокислоты никогда не могут встречаться в виде неионных молекул. Вместо этого они существуют как нейтральные цвиттер-ионы , которые содержат как положительно, так и отрицательно заряженные группы.Цвиттерионы электрически нейтральны и поэтому не мигрируют в электрическом поле. В кислом растворе (ниже pH 2,0) преобладающая разновидность аминокислоты заряжена положительно и мигрирует к катоду. В щелочном растворе (pH выше 9,7) преобладающая разновидность аминокислоты заряжена отрицательно и мигрирует к аноду.
Изоэлектрическая точка (pI) аминокислоты — это pH, при котором молекула имеет нулевой средний суммарный заряд и, следовательно, не перемещается в электрическом поле.PI рассчитывается путем усреднения значений pK ‘для двух функциональных групп, которые вступают в реакцию, когда цвиттерион попеременно становится одновалентным катионом или одновалентным анионом.
При физиологическом pH моноаминомонокарбоновые аминокислоты, например, глицин и аланин, существуют в виде цвиттерионов. То есть при pH 6,9–7,4 α-карбоксильная группа (pK ‘= 2,4) диссоциирует с образованием отрицательно заряженного карбоксилатного иона (COO —), в то время как α-аминогруппа (pK ′ = 0,7 ) протонируется с образованием аммониевой группы (NH 3 + ).Значение pK ‘α-карбоксильной группы значительно ниже, чем у сопоставимой алифатической кислоты, например, уксусной кислоты (pK’ = 4,6). Эта более сильная кислотность обусловлена захватом электронов положительно заряженным ионом аммония и, как следствие, повышенной склонностью карбоксильного водорода к диссоциации как H + . Группа α-аммония, соответственно, является более слабой кислотой, чем алифатический ион аммония, например этиламин (pK ‘= 9,0), поскольку индуктивный эффект отрицательно заряженного карбоксилат-аниона имеет тенденцию предотвращать диссоциацию H + .Профиль титрования глицина (рис. 3.6) почти идентичен профилям всех других моноаминомонокарбоновых аминокислот с неионизируемыми R-группами (Ala, Val, Leu, Ile, Phe, Ser, Thr, Gln, Asn, Met и Pro). .
Рисунок 3.6. Профиль титрования глицина, моноаминомонокарбоновой кислоты.
Титрование глицина имеет следующие основные особенности. Титрование инициируют гидрохлоридом глицина, Cl — (H 3 + NCH 2 COOH), который является полностью протонированной формой аминокислоты.В этой форме молекула содержит две кислотные функциональные группы; следовательно, для полного титрования 1 моля гидрохлорида глицина требуется два эквивалента основания. Имеются два значения pK ‘: pK’1 из-за реакции карбоксильной группы и pK’2 из-за реакции аммониевой группы. Добавление 0,5 экв. Основания к 1 моль гидрохлорида глицина повышает pH 2,34 (pK’1), тогда как добавление 1,5 экв. Дополнительно увеличивает pH до 9,66 (pK’2). При низких значениях pH (например, 0,4) молекулы представляют собой преимущественно катионы с одним положительным зарядом; при значениях pH 5–7 у большинства молекул чистый заряд равен нулю; при высоких значениях pH (например,ж., 11.7), все молекулы по существу являются анионами с одним отрицательным зарядом. Середина между двумя значениями pK ‘[т.е. при pH = (2,34 + 9,66) / 2= 6,0] — это pI. Таким образом, pI — это среднее арифметическое значений pK′1 и pK′2 и точка перегиба между двумя сегментами профиля титрования.
Буферная способность слабых кислот и слабых оснований максимальна при их значениях pK ‘. Таким образом, моноаминомонокарбоновые кислоты проявляют свою наибольшую буферную способность в двух диапазонах pH, близких к их двум значениям pK ‘, а именно, pH 2.3 и pH 9,7 (рис. 3.6). Ни эти аминокислоты, ни α-амино- или α-карбоксильные группы других аминокислот (которые имеют аналогичные значения pK ‘) не обладают значительной буферной способностью в нейтральном (физиологическом) диапазоне pH. Единственными аминокислотами с R-группами, которые обладают буферной способностью в физиологическом диапазоне pH, являются гистидин (имидазол; pK ‘= 6,0) и цистеин (сульфгидрил; pK’ = 8,3). Значения pK и pI для выбранных аминокислот перечислены в таблице 3.2. Значения pK ‘для R-групп меняются в зависимости от ионного окружения.
Таблица 3.2. Значения pK ‘и pI выбранных свободных аминокислот при 25 ° C *
| Аминокислота | pK’1 (α-COOH) | pK’2 | pK’3 | pI |
|---|
| Аланин | 2,34 | 9,69 (β-Nh4 +) | 6,00 | |||||
| Аспарагиновая кислота | 2,09 | 3,86 (γ-COOH) | 9,82 (α-Nh4) | pK’22)|||||
| Глутаминовая кислота | 2.19 | 4,25 (γ-COOH) | 9,67 (α-Nh4 +) | 3,22 (pK′1 + pK′22) | ||||
| Аргинин | 2,17 | 9,04 (α-Nh4 +) 12,48 (Гуанид) | 902 )10,76 (pK’2 + pK’32) | |||||
| Гистидин | 1,82 | 6,00 (имидазолий) | 9,17 (Nh4 +) | 7,59 (pK’2 + pK’326 Lysine | 2,18 | 8,95 (α-Nh4 +) | 10,53 (ε-Nh4 +) | 9,74 (pK’2 + pK’32) |
| Цистеин | 1.71 | 8,33 (SH) | 10,78 (α-Nh4 +) | 5,02 (pK′1 + pK′22) | ||||
| Тирозин | 2,20 | 9,11 (α-Nh4 +) | OH (фенол 10) | 5,66 (pK’1 + pK’22) | ||||
| Серин | 2,21 | 9,15 (α-Nh4 +) | 13,6 (спирт ОН) | 5,68 (pK’1 + pK’22) | 9034 |
Значения pK ‘для функциональных групп в белках могут значительно отличаться от значений для свободных аминокислот.R-группы ионизируются при физиологическом pH и имеют анионные и катионные группы соответственно.
Первичная структура: аминокислоты связаны пептидными связями с образованием полипептидных цепей — биохимия
Белки представляют собой линейных полимера , образованных путем связывания α-карбоксильной группы одной аминокислоты с α-аминогруппой другой аминокислоты с пептидная связь (также называемая амидной связью ). Образование дипептида из двух аминокислот сопровождается потерей молекулы воды ().Равновесие этой реакции находится на стороне гидролиза, а не синтеза. Следовательно, биосинтез пептидных связей требует ввода свободной энергии. Тем не менее, пептидные связи довольно стабильны кинетически; время жизни пептидной связи в водном растворе в отсутствие катализатора приближается к 1000 годам.
Рис. 3.18
Образование пептидной связи. Связывание двух аминокислот сопровождается потерей молекулы воды.
Ряд аминокислот, соединенных пептидными связями, образуют полипептидную цепь , , и каждая аминокислотная единица в полипептиде называется остатком .Полипептидная цепь имеет полярность , потому что ее концы разные, с α-аминогруппой на одном конце и α-карбоксильной группой на другом. По соглашению, за амино-конец принимается за начало полипептидной цепи, , и поэтому последовательность аминокислот в полипептидной цепи записывается, начиная с аминотерминального остатка. Таким образом, в пентапептиде Tyr-Gly-Gly-Phe-Leu (YGGFL) фенилаланин является амино-концевым (N-концевым) остатком, а лейцин — концевым карбоксильным (C-концевым) остатком ().Leu-Phe-Gly-Gly-Tyr (LFGGY) — это другой пентапептид с разными химическими свойствами.
Рисунок 3.19
Аминокислотные последовательности имеют направление. Эта иллюстрация пентапептида Tyr-Gly-Gly-Phe-Leu (YGGFL) показывает последовательность от аминоконца до карбоксильного конца. Этот пентапептид, лей-энкефалин, представляет собой опиоидный пептид, который модулирует восприятие (подробнее …)
Полипептидная цепь состоит из регулярно повторяющейся части, называемой основной цепью , или основной цепью, и вариабельной частью, включающей отличительные боковые цепи ().Основа полипептида богата потенциалом водородных связей. Каждый остаток содержит карбонильную группу, которая является хорошим акцептором водородных связей, и, за исключением пролина, группу NH, которая является хорошим донором водородных связей. Эти группы взаимодействуют друг с другом и с функциональными группами из боковых цепей для стабилизации конкретных структур, как будет подробно описано.
Рисунок 3.20
Компоненты полипептидной цепи. Полипептидная цепь состоит из постоянной основной цепи (показана черным) и вариабельных боковых цепей (показана зеленым).
Большинство природных полипептидных цепей содержат от 50 до 2000 аминокислотных остатков и обычно называются белками . Пептиды, состоящие из небольшого количества аминокислот, называются олигопептидами или просто пептидами . Средняя молекулярная масса аминокислотного остатка составляет около 110, поэтому молекулярная масса большинства белков составляет от 5500 до 220 000. Мы также можем относиться к массе белка, которая выражается в дальтонах; один дальтон равен одной атомной единице массы.Белок с молекулярной массой 50 000 имеет массу 50 000 дальтон или 50 кД (килодальтон).
Дальтон—
Единица массы, почти равная единице массы атома водорода. Назван в честь Джона Далтона (1766-1844), который разработал атомную теорию материи.
В некоторых белках линейная полипептидная цепь сшита. Наиболее распространенными поперечными связями являются дисульфидные связи, образующиеся в результате окисления пары остатков цистеина (). Полученная единица связанных цистеинов называется цистином .Внеклеточные белки часто имеют несколько дисульфидных связей, тогда как внутриклеточные белки их обычно не имеют. В некоторых белках редко присутствуют недисульфидные поперечные связи, происходящие из других боковых цепей. Например, таким образом укрепляются коллагеновые волокна в соединительной ткани и фибриновые сгустки крови.
Килодальтон (кД) —
Единица массы, равная 1000 дальтон.
Рисунок 3.21
Перекрестные ссылки. Образование дисульфидной связи из двух остатков цистеина является реакцией окисления.
3.2.1. Белки имеют уникальные аминокислотные последовательности, которые определяются генами
В 1953 году Фредерик Сэнджер определил аминокислотную последовательность инсулина, белкового гормона (). Эта работа является вехой в биохимии, поскольку она впервые показала, что белок имеет точно определенную аминокислотную последовательность . Более того, он продемонстрировал, что инсулин состоит только из 1 аминокислот, связанных пептидными связями между α-амино и α-карбоксильными группами. Это достижение побудило других ученых провести исследования последовательностей широкого спектра белков.Действительно, теперь известны полные аминокислотные последовательности более чем 100 000 белков. Поразительным фактом является то, что каждый белок имеет уникальную, точно определенную аминокислотную последовательность . Аминокислотная последовательность белка часто упоминается как его первичная структура .
Серия точных исследований, проведенных в конце 1950-х и начале 1960-х годов, показала, что аминокислотные последовательности белков детерминированы генетически. Последовательность нуклеотидов в ДНК, молекула наследственности, определяет комплементарную последовательность нуклеотидов в РНК, которая, в свою очередь, определяет аминокислотную последовательность белка.В частности, каждая из 20 аминокислот репертуара кодируется одной или несколькими конкретными последовательностями из трех нуклеотидов (раздел 5.5).
Знание аминокислотных последовательностей важно по нескольким причинам. Во-первых, знание последовательности белка обычно необходимо для выяснения механизма его действия (например, каталитического механизма фермента). Более того, белки с новыми свойствами могут быть получены путем изменения последовательности известных белков. Во-вторых, аминокислотные последовательности определяют трехмерную структуру белков.Аминокислотная последовательность — это связь между генетическим посланием в ДНК и трехмерной структурой, которая выполняет биологическую функцию белка. Анализ отношений между аминокислотными последовательностями и трехмерными структурами белков раскрывает правила, которые управляют складыванием полипептидных цепей. В-третьих, определение последовательности — это компонент молекулярной патологии, быстро развивающейся области медицины. Изменения в аминокислотной последовательности могут вызвать нарушение функции и заболевание.Тяжелые, а иногда и смертельные заболевания, такие как серповидно-клеточная анемия и кистозный фиброз, могут быть результатом изменения одной аминокислоты в белке. В-четвертых, последовательность белка многое говорит о его эволюционной истории (см. Главу 7). Белки похожи друг на друга по аминокислотной последовательности только в том случае, если у них есть общий предок. Следовательно, молекулярные события в эволюции можно проследить по аминокислотным последовательностям; молекулярная палеонтология — это процветающая область исследований.
3.2.2. Полипептидные цепи гибкие, но с ограничениями по конформации
Изучение геометрии белкового остова выявляет несколько важных особенностей.Во-первых, пептидная связь по существу плоская (). Таким образом, для пары аминокислот, связанных пептидной связью, шесть атомов лежат в одной плоскости: α-атом углерода и группа CO от первой аминокислоты и группа NH и α-атом углерода от второй аминокислоты. Природа химической связи внутри пептида объясняет это геометрическое предпочтение. Пептидная связь имеет значительный характер двойной связи , который предотвращает вращение вокруг этой связи.
Рис. 3.23
Пептидные связи плоские.В паре связанных аминокислот шесть атомов (C α , C, O, N, H и C α ) лежат в одной плоскости. Боковые цепи показаны зелеными шарами.
Неспособность связи вращаться ограничивает конформацию пептидного остова и объясняет планарность связи. Этот характер двойной связи также выражается в длине связи между группами CO и NH. Расстояние C-N в пептидной связи обычно составляет 1,32 Å, что находится между значениями, ожидаемыми для одинарной связи C-N (1.49 Å) и двойной связи C = N (1,27 Å), как показано на. Наконец, пептидная связь не заряжается, что позволяет полимерам аминокислот, связанных пептидными связями, образовывать плотно упакованные глобулярные структуры.
Рис. 3.24
Типичная длина связи внутри пептидной единицы. Пептидная единица показана в транс-конфигурации.
Для плоской пептидной связи возможны две конфигурации. В транс-конфигурации два α-углеродных атома находятся на противоположных сторонах пептидной связи. В цис-конфигурации эти группы находятся на одной стороне пептидной связи. Почти все пептидные связи в белках являются транс-. Такое предпочтение транс-цис-формы можно объяснить тем, что стерические столкновения между группами, присоединенными к α-атомам углерода, препятствуют образованию цис-формы, но не происходят в транс-конфигурации (). Безусловно, наиболее распространенными цис-пептидными связями являются связи X-Pro. Такие связи менее предпочтительны для транс-конфигурации, поскольку азот пролина связан с двумя тетраэдрическими атомами углерода, ограничивая стерические различия между транс- и цис-формами ().
Рис. 3.25
Транс- и цис-пептидные связи. Трансформация пользуется большой популярностью из-за стерических конфликтов, которые происходят в цис-форме.
Рис. 3.26
Облигации Trans- и Cis X-Pro. Энергии этих форм относительно сбалансированы, поскольку стерические столкновения происходят в обеих формах.
В отличие от пептидной связи, связи между аминогруппой и α-атомом углерода и между α-атомом углерода и карбонильной группой являются чистыми одинарными связями. Две соседние жесткие пептидные единицы могут вращаться вокруг этих связей, принимая различную ориентацию. Эта свобода вращения вокруг двух связей каждой аминокислоты позволяет белкам складываться по-разному . Повороты вокруг этих связей могут быть заданы двугранными углами (). Угол поворота вокруг связи между атомами азота и α-углерода называется phi (φ). Угол поворота вокруг связи между α-углеродом и карбонильными атомами углерода называется psi (ψ). Поворот по часовой стрелке вокруг любой связи, если смотреть спереди на заднюю группу, соответствует положительному значению.Углы φ и ψ определяют путь полипептидной цепи.
Двугранный угол —
Мера поворота вокруг связи, обычно принимаемая в пределах от -180 ° до + 180 °. Двугранные углы иногда называют торсионными углами.
Рис. 3.27
Вращение связей в полипептиде. Структуру каждой аминокислоты в полипептиде можно регулировать вращением вокруг двух одинарных связей. (A) Phi (φ) — угол поворота вокруг связи между атомами азота и α-углерода, (подробнее…)
Возможны ли все комбинации φ и ψ? Г. Н. Рамачандран признал, что многие комбинации запрещены из-за стерических столкновений между атомами. Допустимые значения могут быть визуализированы на двумерном графике, который называется диаграммой Рамачандрана (). Три четверти возможных комбинаций (φ, ψ) исключаются просто из-за локальных стерических столкновений. Стерическое исключение, тот факт, что два атома не могут находиться в одном и том же месте в одно и то же время, может быть мощным организующим принципом .
Рисунок 3.28
Диаграмма Рамачандрана, показывающая значения φ и ψ. Не все значения φ и ψ возможны без столкновений между атомами. Наиболее благоприятные регионы показаны темно-зеленым; пограничные области показаны светло-зеленым. (подробнее …)
Способность биологических полимеров, таких как белки, складываться в четко определенные структуры, является замечательной термодинамически. Рассмотрим равновесие между развернутым полимером, который существует как случайный клубок, то есть как смесь многих возможных конформаций, и свернутой формой, которая принимает уникальную конформацию.Благоприятная энтропия, связанная с большим количеством конформаций в развернутой форме, противодействует сворачиванию и должна преодолеваться взаимодействиями, благоприятствующими свернутой форме. Таким образом, очень гибкие полимеры с большим количеством возможных конформаций не складываются в уникальные структуры. Жесткость пептидной единицы и ограниченный набор допустимых углов φ и ψ ограничивает количество структур, доступных для развернутой формы, в достаточной степени, чтобы позволить сворачиванию белка происходить .
Аминокислоты | Энциклопедия.com
CONCEPT
Аминокислоты — это органические соединения, состоящие из углерода, водорода, кислорода, азота и (в некоторых случаях) серы, связанных в характерные образования. Нити аминокислот составляют белки, которых существует бесчисленное множество разновидностей. Из 20 аминокислот, необходимых для производства белков, необходимых человеческому организму, сам организм производит только 12, а это означает, что мы должны удовлетворять наши потребности в остальных восьми за счет питания. Это всего лишь один пример важности аминокислот для жизнедеятельности.Другой предостерегающей иллюстрацией силы аминокислот является спектр заболеваний (в первую очередь серповидно-клеточная анемия), которые ухудшают или уносят жизни тех, чьи аминокислоты находятся вне последовательности или работают со сбоями. Когда-то использовавшиеся для датировки объектов из далекого прошлого, аминокислоты существовали на Земле как минимум три миллиарда лет — задолго до появления первых настоящих организмов.
КАК ЭТО РАБОТАЕТ
«Карта» аминокислот
Аминокислоты — это органические соединения, то есть они содержат углерод и водород, связанные друг с другом.Помимо этих двух элементов, они включают азот, кислород и, в некоторых случаях, серу. Основная структура молекулы аминокислоты состоит из атома углерода, связанного с аминогруппой (-NH 2 ), карбоксильной группы (-COOH), атома водорода и четвертой группы, которая отличается от одной аминокислоты до другой, который часто называют группой — R или боковой цепью. Группа- R , которая может варьироваться в широких пределах, отвечает за различия в химических свойствах.
Это объяснение звучит немного технически и требует знания химии, которое выходит за рамки этого эссе, но позвольте нам его несколько упростить. Представьте, что молекула аминокислоты похожа на циферблат компаса с атомом углерода в центре. От центра в четырех направлениях компаса расходятся линии, представляющие химические связи с другими атомами или группами атомов. Эти направления основаны на моделях, которые обычно используются для представления молекул аминокислот, хотя север, юг, восток и запад, используемые на следующей иллюстрации, являются простыми терминами, упрощающими визуализацию молекулы.
К югу от атома углерода (C) находится атом водорода (H), который, как и все другие атомы или группы, соединен с углеродным центром химической связью. К северу от углеродного центра находится так называемая аминогруппа (-NH 2 ). Дефис в начале указывает, что такая группа обычно не стоит отдельно, но обычно присоединена к какому-либо другому атому или группе. На востоке находится карбоксильная группа, представленная как -COOH. В аминогруппе два атома водорода связаны друг с другом, а затем с азотом, тогда как карбоксильная группа имеет два отдельных атома кислорода, натянутых между атомом углерода и атомом водорода.Следовательно, они не представлены как O 2 .
Наконец, на западе находится группа R , которая может сильно варьироваться. Это как если бы другие части аминокислоты вместе образовали стандартный суффикс в английском языке, такой как -tion. В начале этого суффикса могут быть прикреплены всевозможные термины, взятые из корневых слов, например, , воспитывать, или , удовлетворять, или , восстание, — отсюда, образование, удовлетворение, и революция. Различия в терминах, прикрепленных к передней части, чрезвычайно широки, но хвостовая часть, -tion, представляет собой единую формацию. Аналогично, углерод, водород, аминогруппа и карбоксильная группа в аминокислоте более или менее постоянны.
НЕСКОЛЬКО ДОПОЛНИТЕЛЬНЫХ ЗАМЕЧАНИЙ.
Название аминокислота фактически происходит от аминогруппы и кислотной группы, которые являются наиболее химически реактивными частями молекулы. Каждая из распространенных аминокислот, помимо химического названия, имеет более знакомое название и трехбуквенное сокращение, которое часто используется для ее идентификации.В данном контексте эти сокращения нас не интересуют. Молекулы аминокислот, которые содержат аминогруппу и карбоксильную группу, не ведут себя как обычные молекулы. Вместо того, чтобы плавиться при температуре выше 392 ° F (200 ° C), они просто разлагаются. Они вполне растворимы или способны растворяться в воде, но нерастворимы в неполярных растворителях (масла и все продукты на масляной основе), таких как бензол или эфир.
ПРАВАЯ И ЛЕВАЯ ВЕРСИИ.
Все аминокислоты в организме человека, за исключением глицина, являются правосторонними или левосторонними версиями одной и той же молекулы, что означает, что в некоторых аминокислотах положения карбоксильной группы и R -группы совпадают. переключился.Интересно, что почти все аминокислоты, встречающиеся в природе, являются левыми версиями молекул или L-формами. (Следовательно, модель, которую мы описали, на самом деле является левой, хотя различия между «правым» и «левым» — в том числе с направлением поляризации света — слишком сложны, чтобы обсуждать их здесь.)
Правые версии (D-формы) не встречаются в белках высших организмов, но они присутствуют в некоторых низших формах жизни, например, в клеточных стенках бактерий.Они также содержатся в некоторых антибиотиках, среди которых стрептомицин, актиномицин, бацитрацин и тетрациклин. Эти антибиотики, некоторые из которых широко известны широкой публике, могут убивать бактериальные клетки, препятствуя образованию белков, необходимых для поддержания жизни и воспроизводства.
Аминокислоты и белки
Химическая реакция, характерная для аминокислот, включает образование связи, называемой пептидной связью, между карбоксильной группой одной аминокислоты и аминогруппой второй аминокислоты.Таким образом, очень длинные цепи аминокислот могут соединяться вместе, образуя белки, которые являются основными строительными блоками всего живого. Конкретные свойства каждого вида белка во многом зависят от вида и последовательности аминокислот в нем. Другие аспекты химического поведения белковых молекул обусловлены взаимодействиями между амино и карбоксильными группами или между различными R -группами вдоль длинных цепочек аминокислот в молекуле.
НОМЕРА И СОЧЕТАНИЯ.
Аминокислоты действуют как мономеры или отдельные звенья, которые объединяются в большие цепочечные молекулы, называемые полимерами, которые могут содержать от двух до 3000 аминокислотных единиц. Группы, состоящие только из двух аминокислот, называются дипептидами, а три аминокислоты, связанные вместе, называются трипептидами. Если в цепи более 10, они называются полипептидами, а если их 50 или более, они называются белками.
Все миллионы различных белков в живых организмах образуются путем связывания всего 20 аминокислот, образующих длинные полимерные цепи.Подобно 26 буквам алфавита, которые соединяются в разные слова, в зависимости от того, какие буквы используются и в какой последовательности, 20 аминокислот могут соединяться вместе в различных комбинациях и сериях для образования белков. Но в то время как в словах обычно всего около 10 или меньше букв, белки обычно состоят из от 50 до 3000 аминокислот. Поскольку каждую аминокислоту можно использовать много раз в цепи и нет ограничений на длину цепи, количество возможных комбинаций для образования белков действительно огромно.Существует около двух квадриллионов различных белков, которые могут существовать, если каждая из 20 аминокислот, присутствующих в организме человека, используется только один раз. Однако так же, как не все последовательности букв имеют смысл, не все последовательности аминокислот производят функционирующие белки. Как мы увидим, некоторые другие последовательности могут функционировать и, тем не менее, вызывать нежелательные эффекты.
ПРИМЕНЕНИЕ В РЕАЛЬНОЙ ЖИЗНИ
ДНК (дезоксирибонуклеиновая кислота), молекула во всех клетках, которая содержит генетические коды для наследования, создает закодированные инструкции для синтеза аминокислот.В 1986 году американский ученый-медик Таддеус Р. Драйя (1940-) использовал аминокислотные последовательности для идентификации и выделения гена типа рака, известного как ретинобластома, факт, который иллюстрирует важность аминокислот в организме.
Аминокислоты также присутствуют в гормонах, химических веществах, которые необходимы для жизни. Среди этих гормонов есть инсулин, который регулирует уровень сахара в крови и без которого человек умер бы. Другой — адреналин, который контролирует кровяное давление и дает животным внезапный прилив энергии, необходимый в ситуации сильного стресса — убегая от хищника на лугах или (используя пример человека) лицом к лицу с грабителем в переулке или с хулиганом на детская площадка.Биохимические исследования аминокислотных последовательностей в гормонах сделали это возможность для ученых изолировать и искусственно производить эти и другие гормоны, в том числе гормон роста человека.
Аминокислоты и питание
Так же, как белки образуются, когда аминокислоты соединяются в длинные цепи, они могут расщепляться с помощью реакции, называемой гидролизом , — обратным образованию пептидной связи. Именно это происходит в процессе пищеварения, когда специальные пищеварительные ферменты в желудке позволяют разрушить пептидную связь.(Ферменты — это тип белка — см. Ферменты.) Аминокислоты, снова разделенные, попадают в тонкий кишечник, откуда они попадают в кровоток и разносятся по всему организму. Каждая отдельная клетка организма может затем использовать эти аминокислоты для сборки новых и различных белков, необходимых для ее конкретных функций. Таким образом, жизнь представляет собой непрерывный цикл, в котором белки расщепляются на отдельные аминокислотные единицы, и из этих аминокислот создаются новые белки.
ОСНОВНЫЕ АМИНОКИСЛОТЫ.
Из многих тысяч возможных аминокислот человеку требуется только 20 различных видов. Два других появляются в телах некоторых видов животных, и около 100 других можно найти в растения. Учитывая огромное количество аминокислот и возможных комбинаций, существующих в природе, количество незаменимых для жизни аминокислот чрезвычайно мало. Однако из 20 аминокислот, необходимых человеку для производства белка, только 12 могут вырабатываться в организме, тогда как остальные восемь — изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин — должны быть получены с пищей. .(Кроме того, взрослые способны синтезировать аргинин и гистидин, но считается, что эти аминокислоты необходимы растущим детям, а это означает, что дети не могут производить их самостоятельно.)
Полноценный белок — это белок, содержащий все необходимые вещества. аминокислоты в количествах, достаточных для роста и восстановления тканей тела. Большинство белков животного происхождения, за исключением желатина, содержат все незаменимые аминокислоты и поэтому считаются полноценными белками.С другой стороны, многие растительные белки не содержат всех незаменимых аминокислот. Например, в кукурузе, рисе и пшенице отсутствует лизин, в кукурузе также отсутствует триптофан, а в рисе — треонин. В соевых бобах отсутствует метионин. Веганы или вегетарианцы, которые не потребляют в своем рационе животные белки (то есть яйца, молочные продукты и т.п.), подвержены риску недоедания, поскольку они могут не усвоить одну или несколько незаменимых аминокислот.
Аминокислоты, здоровье и болезни
Аминокислоты можно использовать для лечения всех видов заболеваний.Например, тирозин можно использовать при лечении болезни Альцгеймера, состояния, характеризующегося началом деменции или умственного ухудшения, а также симптомов алкогольной абстиненции. Таурин применяется для контроля эпилептических припадков, лечения высокого кровяного давления и диабета, а также для поддержки работы печени. Многие другие аминокислоты используются при лечении множества других заболеваний. Иногда само заболевание связано с проблемами с производством или функционированием аминокислот.В эссе «Витамины» обсуждается пеллагра — заболевание, возникающее в результате дефицита витамина группы B, известного как ниацин. Пеллагра является результатом диеты, богатой кукурузой, в которой, как мы уже отмечали, не хватает лизина и триптофана. Его симптомы часто описываются как «три Ds»: диарея, дерматит (или воспаление кожи) и деменция. Благодаря большему пониманию питания и здоровья пеллагра в значительной степени искоренена, но все еще существует состояние с почти идентичными симптомами: болезнь Хартнупа, генетическое заболевание, названное в честь британской семьи в конце 1950-х годов, которая страдала от нее.
Болезнь Хартнупа характеризуется неспособностью транспортировать аминокислоты от почек к остальным частям тела. Симптомы сначала, казалось, подсказывали врачам, что болезнь, которая присутствует у одного из примерно 26 000 живорожденных, — это пеллагра. Тесты показали, что у больных не было недостаточного уровня триптофана, как в случае с пеллагрой. С другой стороны, около 14 аминокислот было обнаружено в избытке в моче больных болезнью Хартнупа, что указывает на то, что вместо того, чтобы правильно транспортировать аминокислоты, их тела просто выделяют их.Это потенциально очень серьезное заболевание, но его можно лечить с помощью никотинамида витамина B, который также используется для лечения пеллагры. Добавление триптофана в рацион также показало положительные результаты у некоторых пациентов.
СЕРПНО-КЛЕТОЧНАЯ АНЕМИЯ.
Также возможны небольшие ошибки в аминокислотной последовательности в организме. В то время как эти ошибки иногда допускаются в природе без серьезных проблем, в других случаях единственная неправильно расположенная аминокислота в полимерной цепи может вызвать чрезвычайно серьезное состояние нарушения функции белка.Примером этого является серповидно-клеточная анемия, смертельное заболевание, в конечном итоге вызванное единственной ошибкой в аминокислотной последовательности. В организме людей, страдающих серповидноклеточной анемией, которые обычно являются выходцами из Африки к югу от Сахары или их потомками в Соединенных Штатах или где-либо еще, глутаминовая кислота заменяется валином в шестой позиции от конца белковой цепи в молекуле гемоглобина. (Гемоглобин — это железосодержащий пигмент красных кровяных телец, который отвечает за транспортировку кислорода к тканям и удаление из них углекислого газа.Эта небольшая разница делает молекулы серповидно-клеточного гемоглобина чрезвычайно чувствительными к недостатку кислорода. В результате, когда красные кровяные тельца выделяют свой кислород тканям, как это делают все красные кровяные тельца, они не могут повторно насыщаться кислородом в нормальном режиме и вместо этого скручиваются в форму. это дало название серповидно-клеточной анемии. Это вызывает закупорку кровеносных сосудов. До разработки лечения препаратом гидроксимочевина в середине 1990-х годов средняя продолжительность жизни человека с серповидно-клеточной анемией составляла около 45 лет.
Аминокислоты и далекое прошлое
В эссе «Эволюция» обсуждается несколько типов датирования — термин, относящийся к научным усилиям, направленным на определение возраста конкретного предмета или явления. Методы датировки могут быть относительными (т. Е. Сравнительными и обычно основанными на пластах или слоях горных пород) или абсолютными. В то время как относительное датирование не включает фактических оценок возраста в годах, абсолютное датирование включает. Одним из первых разработанных методов абсолютного датирования была аминокислотная расимизация, представленная в 1960-х годах.Как отмечалось ранее, существуют «левые» l-формы и «правые» d-формы всех аминокислот. Практически все живые организмы (за исключением некоторых микробов) включают только l-формы, но после смерти организма l-аминокислоты постепенно превращаются в зеркальные d-аминокислоты.
На скорость конверсии влияет множество факторов, и, хотя аминокислотный рацимизация была популярна как форма свидания в 1970-х годах, с этим есть проблемы. Например, процесс протекает с разной скоростью для разных аминокислот, и на скорость дополнительно влияют такие факторы, как влажность и температура.Из-за неопределенностей с аминокислотным расимизацией он был в значительной степени заменен другими методами абсолютного датирования, такими как использование радиоактивных изотопов.
Конечно, сами аминокислоты дали важные ключи к пониманию далекого прошлого планеты. Открытие в 1967 и 1968 годах осадочных пород, содержащих следы аминокислот возрастом более трех миллиардов лет, оказало огромное влияние на изучение биологической истории Земли. Здесь впервые было конкретное свидетельство жизни — по крайней мере, в очень простой химической форме — существовавшей за миллиарды лет до появления первого настоящего организма.Открытие этих образцов аминокислот сильно повлияло на размышления ученых об эволюции, особенно на самых ранних стадиях, на которых были заложены химические основы жизни.
ГДЕ ПОДРОБНЕЕ
«Аминокислоты». Институт химии, факультет биологии, химии и фармации, Свободный университет, Берлин (веб-сайт).
Гудселл, Дэвид С. Наша молекулярная природа: двигатели, машины и сообщения тела. Нью-Йорк: Коперник, 1996.
«Введение в аминокислоты». Отделение кристаллографии Бирбекского колледжа (веб-сайт).
Михал, Герхард. Биохимические пути: атлас биохимии и молекулярной биологии. Нью-Йорк: Джон Вили и сыновья, 1999.
Ньюстром, Харви. Каталог питательных веществ: витамины, минералы, аминокислоты, макроэлементы — полезное использование, помощники, ингибиторы, источники пищи, рекомендации по потреблению и симптомы чрезмерного или недостаточного употребления. Джефферсон, Северная Каролина: Макфарланд и компания, 1993.
Орнштейн, Роберт Э. и Чарльз Свенсионис. Исцеляющий мозг: научный читатель. New York: Guilford Press, 1990.
Справочное руководство по аминокислотам (веб-сайт).
Сильверстайн, Элвин, Вирджиния Б. Сильверстайн и Роберт А. Сильверстайн. Белки. Рис. Энн Каневари Грин. Брукфилд, Коннектикут: Millbrook Press, 1992.
Springer Link: Amino Acids (веб-сайт).
КЛЮЧЕВЫЕ ТЕРМИНЫ
АМИНОКИСЛОТ:
Органические соединения, состоящие из углерода, водорода, кислорода, азота и (в некоторых случаях) серы, связанных в характерные образования. Нити аминокислот составляют белки.
AMINO GROUP:
Химическое образование NH 2 , входящее в состав всех аминокислот.
БИОХИМИЯ:
Область биологических наук, связанная с химическими веществами и процессами в организмах.
КАРБОКСИЛЬНАЯ ГРУППА:
Образование COOH, общее для всех аминокислот.
СОЕДИНЕНИЕ:
Вещество, в котором атомы более чем одного элемента химически связаны друг с другом.
ДИПЕПТИД:
Группа, состоящая всего из двух аминокислот.
ДНК:
Дезоксирибонуклеиновая кислота, молекула всех клеток и многих вирусов, содержащая генетические коды наследования.
ФЕРМЕНТ:
Белковый материал, ускоряющий химические реакции в организме растений и животных.
ОСНОВНЫЕ АМИНОКИСЛОТЫ:
Аминокислоты, которые не могут вырабатываться организмом и поэтому должны быть получены с пищей. Белки, содержащие незаменимые аминокислоты, известны как полных белка.
ГЕН:
Единица информации о конкретном наследуемом (способном к наследовании) признаке, которая передается от родителей к потомству, хранится в молекулах ДНК, называемых хромосомами .
ГОРМОН:
Молекулы, продуцируемые живыми клетками, которые посылают сигналы в точки, удаленные от точки их происхождения, и вызывают специфические эффекты на деятельность других клеток.
МОЛЕКУЛА:
Группа атомов, обычно, но не всегда представляющая более одного элемента, объединенная в структуру. Соединения обычно состоят из молекул.
ОРГАНИЧЕСКИЙ:
Одно время химики использовали термин органический только в отношении живых существ. Теперь это слово применяется к соединениям, содержащим углерод и водород.
ПЕПТИДНАЯ СВЯЗЬ:
Связь между карбоксильной группой одной аминокислоты и аминогруппой второй аминокислоты.
ПОЛИМЕРЫ:
Большие цепочечные молекулы, состоящие из множества субъединиц, известных как мономеры .
ПОЛИПЕПТИД:
Группа от 10 до 50 аминокислот.
БЕЛКИ:
Большие молекулы, состоящие из длинных цепочек из 50 или более аминокислот. Белки выполняют функции стимулирования нормального роста, восстановления поврежденных тканей, поддержки иммунной системы организма и выработки ферментов.
РНК:
Рибонуклеиновая кислота, молекула, транслируемая с ДНК в ядре клетки, контрольный центр клетки, который направляет синтез белка в цитоплазме или пространстве между клетками.
СИНТЕЗ:
Для химического производства, как в теле.
ТРИПЕПТИД:
Группа из трех аминокислот.
Аминокислота — CMBIwiki
Белок состоит из небольших строительных блоков, называемых аминокислотами.
Аминокислоты лежат в основе биоинформатики. Эволюция в основном управляется случайными изменениями в ДНК, ведущими к изменениям отдельных аминокислот, которые медленно накапливаются в течение эонов (это, конечно, не вся история, но, безусловно, большая ее часть).Если мы хотим выровнять две последовательности, мы выравниваем их аминокислоты. Белки состоят в основном из аминокислот, и если мы хотим модифицировать белок с помощью методов белковой инженерии, мы обмениваем аминокислоты.
Обзор всех аминокислот, разделенных на группы.Обзор
20 аминокислот
Мы знаем 20 незаменимых аминокислот, это означает, что ваш организм не может сам производить эти молекулы. Нормальная и здоровая диета содержит достаточно этих незаменимых аминокислот, чтобы выжить.
Каждая аминокислота имеет свои свойства. Они могут быть представлены полным именем, трехбуквенным или однобуквенным кодом:
Общая структура
Общая структура всех аминокислотКаждая аминокислота состоит из нескольких атомов, одинаковых для всех аминокислот, эти атомы образуют основу аминокислоты. Каждая аминокислота имеет центральный атом углерода, известный как С-альфа. К этому атому углерода всегда присоединены атом водорода, аминогруппа и группа карбоновой кислоты.Четвертая группа, которая присоединяется к центральному C-альфа, — это вариабельная боковая цепь. Эта боковая цепь различается для каждой аминокислоты, поэтому конкретные свойства аминокислоты являются результатом различия в боковых цепях. За исключением глицина, каждая аминокислота хиральна.
Образование пептидной связиПептидная связь
Две аминокислоты соединены пептидной связью. Эта связь всегда соединяет карбоксильную группу первой аминокислоты с аминогруппой второй аминокислоты.Во время этой реакции теряется молекула воды.
Эта связь имеет немного двойной характер и поэтому не может вращаться.

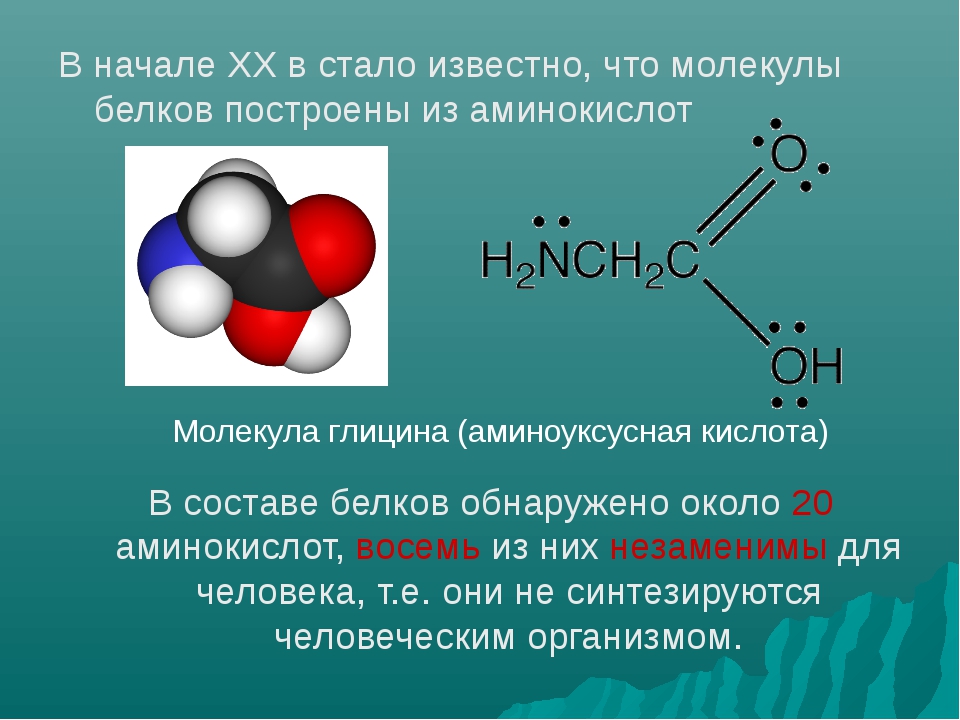 организаций: базовый уровень / И.Ю. Алексашина, К.В. Галактионов, И.С. Дмитриев, А.В. Ляпцев и др. / под ред. И.Ю. Алексашиной. – 3-е изд., испр. – М.: Просвещение, 2017.: с 88-93.
организаций: базовый уровень / И.Ю. Алексашина, К.В. Галактионов, И.С. Дмитриев, А.В. Ляпцев и др. / под ред. И.Ю. Алексашиной. – 3-е изд., испр. – М.: Просвещение, 2017.: с 88-93.

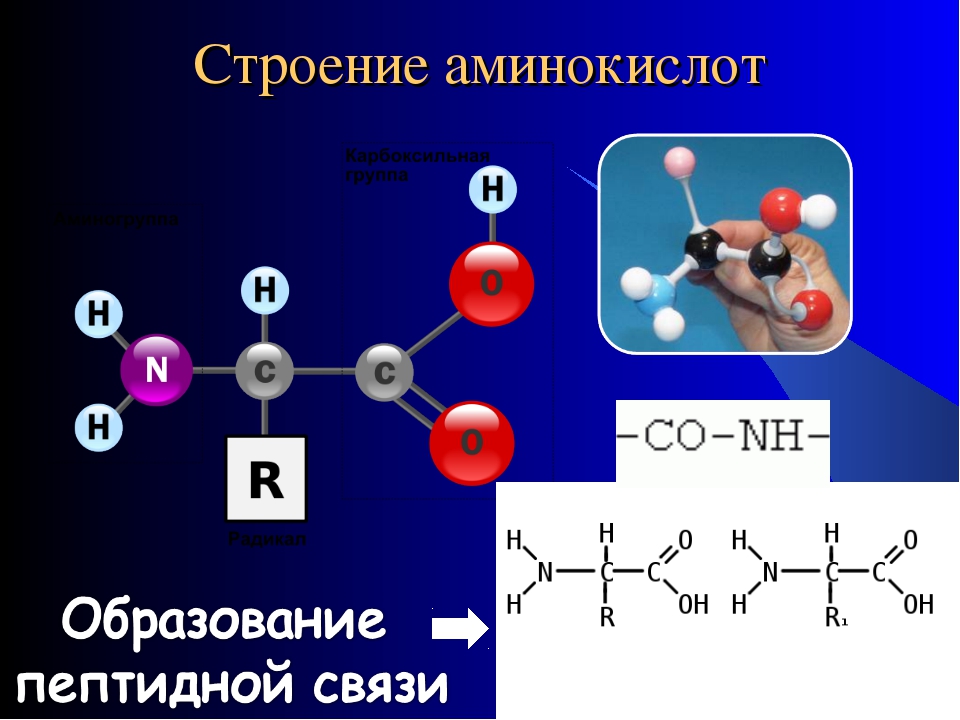 Потребление этих аминокислот в рационе питания не является обязательным, но такое потребление безвредно и помогает обеспечить организм компонентами, необходимыми для синтеза коллагена. К этим аминокислотам относятся гидроксипролин, аргинин, а также аспарагиновая кислота.
Потребление этих аминокислот в рационе питания не является обязательным, но такое потребление безвредно и помогает обеспечить организм компонентами, необходимыми для синтеза коллагена. К этим аминокислотам относятся гидроксипролин, аргинин, а также аспарагиновая кислота.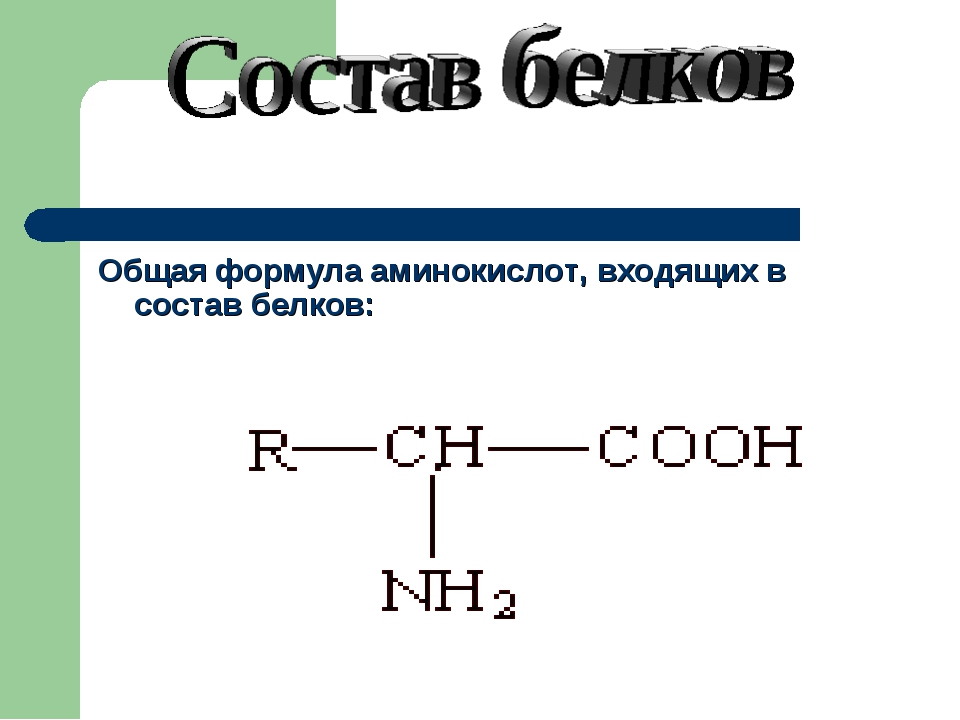


 Болезнь возникает из-за дефицита одного либо нескольких питательных веществ. Ещё больше может усугубить положение контакт с инфекцией (например, ВИЧ) или отравление токсинами.
Болезнь возникает из-за дефицита одного либо нескольких питательных веществ. Ещё больше может усугубить положение контакт с инфекцией (например, ВИЧ) или отравление токсинами.