Часть аминокислоты придающая ей основные свойства: главные составные части белков — Студопедия
главные составные части белков — Студопедия
Физико-химические и биологические свойства белков определяются их аминокислотным составом. Аминокислоты — это аминопроизводные класса карбоновых кислот. Аминокислоты входят не только в состав белков. Многие из них выполняют специальные функции. Поэтому в живых организмах различают аминокислоты протеиногенные (кодируются генетически) и непротеиногенные (не кодируются генетически). Протеиногенных аминокислот 20. 19 из них являются a-аминокислотами. Это означает, что аминогруппа у них присоединена к a-углеродному атому той карбоновой кислоты, производным которой они являются. Общая формула этих аминокислот выглядит следующим образом:
Только одна аминокислота — пролин не соответствует этой общей формуле. Ее относят к иминокислотам.
a-углеродный атом аминокислот является ассимметричным (исключение составляет аминопроизводное уксусной килоты — глицин). Это означает, что у каждой аминокислоты имеются, как минимум, 2 оптически активных антипода.
Во всех случаях, когда в молекуле органического соединения атом углерода связан с 4 разными атомами или функциональными группами, этот атом ассиметричен, поскольку он может существовать в двух изомерных формах, называемых энантиомерами или оптическими (стерео-) изомерами. Соединения с ассимметричными атомами «С» встречаются в виде двух форм (хиральных соединений) — левой и правой, в зависимости от направления вращения плоскости поляризации плоскополяризованного света. Все стандартные аминокислоты кроме одной (глицин) содержат в a-положении ассимметричный атом углерода, с которым связаны 4 замещающих группы. Поэтому они обладают оптической активностью, то есть способны вращать плоскость
поляризации света в том или ином направлении.
Однако в основе системы обозначения стереоизомеров лежит не вращение плоскости поляризации света, а абсолютная конфигурация молекулы стереоизомера. Для выяснения конфигурации оптически активных аминокислот их сравнивают с глицериновым альдегидом — простейшим трехуглеродным углеводом, который содержит ассимметричный атом углерода. Стереоизомеры всех хиральных соединений, независимо от направления вращения плоскости поляризации плоскополяризованного света, соответствующие по конфигурации L-глицериновому альдегиду, обозначаются буквой L, а соответствующие D-глицериновому альдегиду — буквой D. Таким образом, буквы L и D относятся к абсолютной конфигурации 4 замещающих групп при хиральном атоме «С», а не к направлению вращения плоскости поляризации.
Для выяснения конфигурации оптически активных аминокислот их сравнивают с глицериновым альдегидом — простейшим трехуглеродным углеводом, который содержит ассимметричный атом углерода. Стереоизомеры всех хиральных соединений, независимо от направления вращения плоскости поляризации плоскополяризованного света, соответствующие по конфигурации L-глицериновому альдегиду, обозначаются буквой L, а соответствующие D-глицериновому альдегиду — буквой D. Таким образом, буквы L и D относятся к абсолютной конфигурации 4 замещающих групп при хиральном атоме «С», а не к направлению вращения плоскости поляризации.
Классификация аминокислот проводится по строению их радикала. Существуют разные подходы к классификации. Большая часть аминокислот — это алифатические соединения. 2 аминокислоты являются представителями ароматического ряда и 2 — гетероциклического.
Аминокислоты можно разделить, по их свойствам, на основные, нейтральные и кислые. Они отличаются числом амино- и карбоксильных групп в молекуле.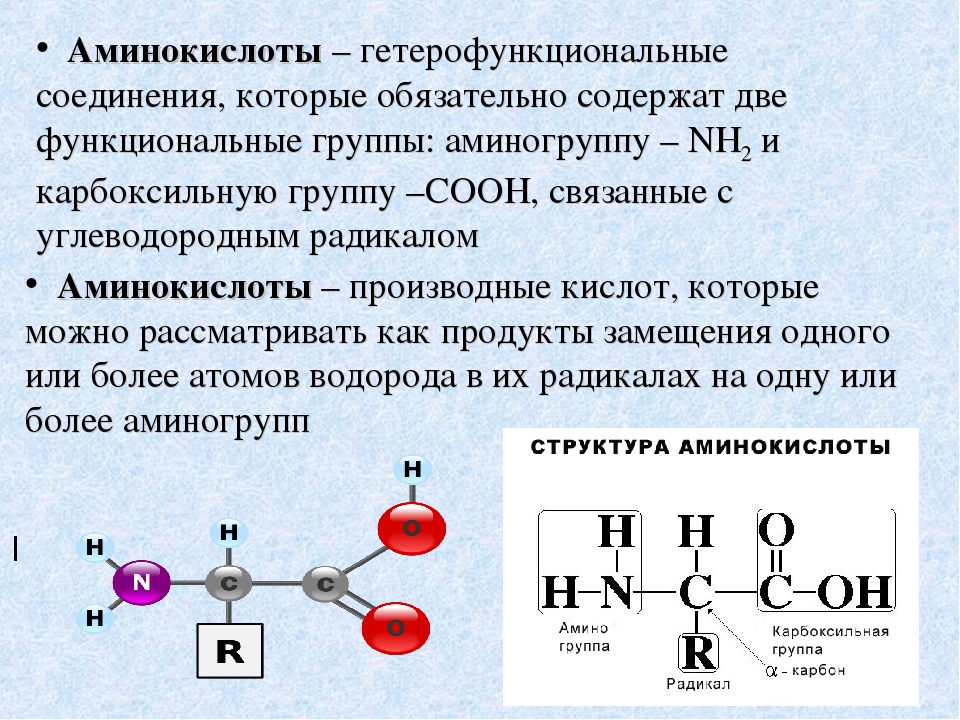 Нейтральные — содержат по одной амино- и одной карбоксильной группе (моноаминомонокарбоновые). Кислые имеют 2 карбоксильные и одну аминогруппу (моноаминодикарбоновые), основные -2 аминогруппы и одну карбоксильную (диаминомонокарбоновые).
Нейтральные — содержат по одной амино- и одной карбоксильной группе (моноаминомонокарбоновые). Кислые имеют 2 карбоксильные и одну аминогруппу (моноаминодикарбоновые), основные -2 аминогруппы и одну карбоксильную (диаминомонокарбоновые).
1. Собственно алифатическими можно назвать 5 аминокислот. Глицин или гликокол (Гли),
при работе с компьютером — (G), — a-аминоуксусная кислота. Является единственной оптически неактивной аминокислотой. Глицин используется не только для синтеза белков. Его атомы входят в состав нуклеотидов, гема, он входит в состав важного трипептида — глутатиона.
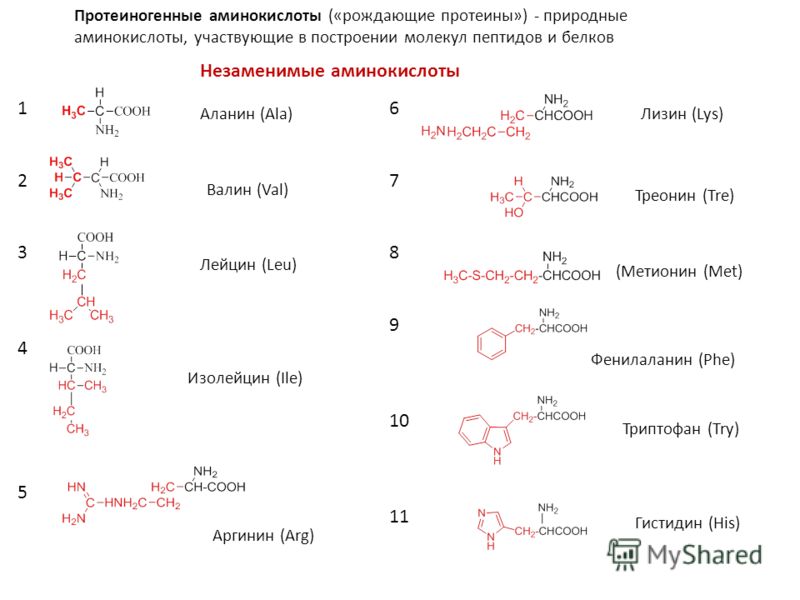
Аланин (Ала), при работе с компьютером — (А) — a-аминопропионовая кислота. Аланин нередко используется в организме для синтеза глюкозы.
По структуре все аминокислоты, за исключением глицина, можно рассматривать как производные аланина, у которого один или несколько атомов водорода в составе радикала замещены различными функциональными группами.
Валин (Вал), при работе с компьютером (V) — аминоизовалериановая кислота. Лейцин (Лей, L) — аминоизокапроновая кислота. Изолейцин (Иле, I) — a-амино-b-этил-b-метилпропионовая кислота. Эти три аминокислоты, обладая выраженными гидрофобными свойствами, играют важную роль в формировании пространственной структуры белковой молекулы.
Лейцин (Лей, L) — аминоизокапроновая кислота. Изолейцин (Иле, I) — a-амино-b-этил-b-метилпропионовая кислота. Эти три аминокислоты, обладая выраженными гидрофобными свойствами, играют важную роль в формировании пространственной структуры белковой молекулы.
2. Гидроксиаминокислоты. Серин (Сер, S) — a-амино-b-гидроксипропионовая кислота и треонин (Тре, T) — a-амино-b-гидроксимасляная кислота играют важную роль в процессах ковалентной модификации структуры белков. Их гидроксильная группа легко взаимодействует с фосфорной кислотой, что бывает необходимым для изменения функциональной активности белков.
3. Серусодержащие аминокислоты. Цистеин (Цис, C) — a-амино-b-тиопропионовая кислота. Специальным свойством цистеина является способность к окислению (в присутствии кислорода) и взаимодействию с другой молекулой цистеина с образованием дисульфидной связи и нового соединения — цистина. Эта аминокислота благодаря активной -SH группе легко вступает в окислительно-восстановительные реакции, защищая клетку от действия окислителей, участвует в образовании дисульфидных мостиков, стабилизирующих структуру белков, входит в состав активного центра ферментов.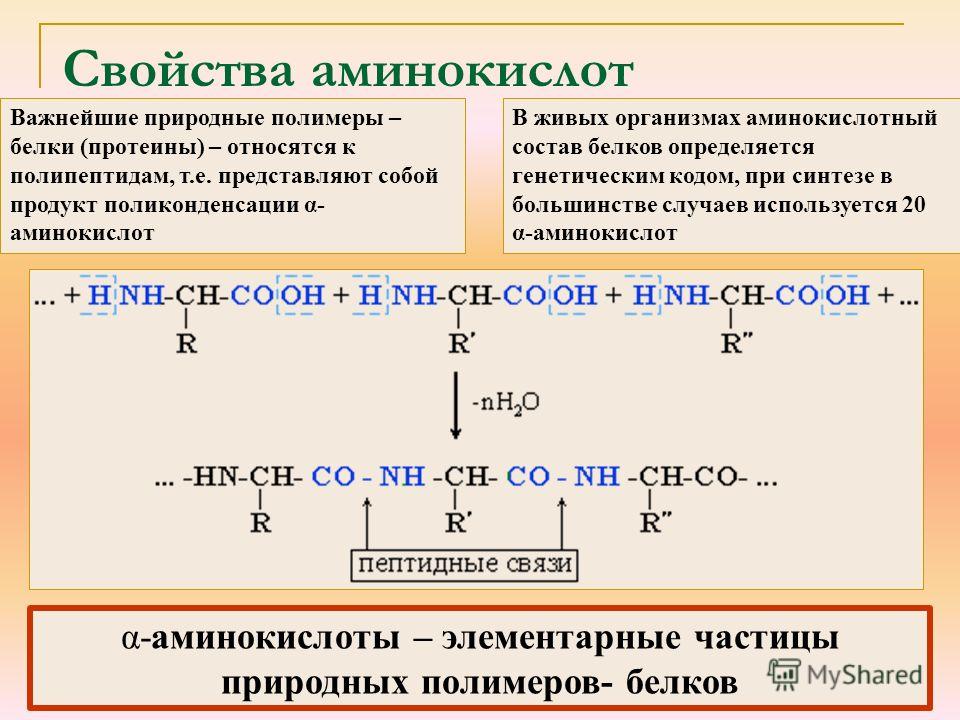
Метионин (Мет, M) -a-амино-b-тиометилмасляная кислота. Выполняет функцию донора подвижной метильной группы, необходимой для синтеза биологически активных соединений: холина, нуклеотидов и т.д. Это гидрофобная аминокислота.
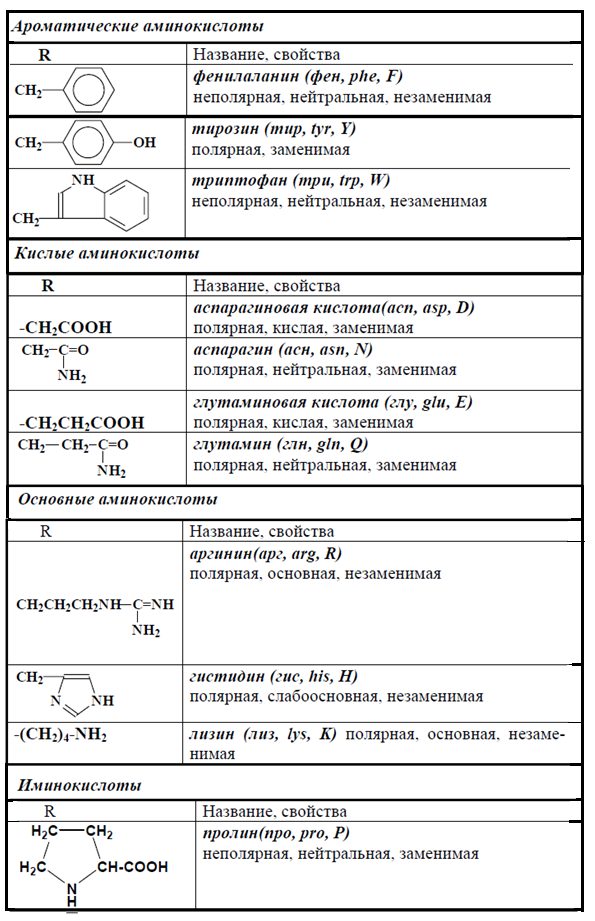
4. Дикарбоновые аминокислоты. Глутаминовая (Глу, E) — a-аминоглутаровая кислота и аспарагиновая кислота (Асп, D) -a-аминоянтарная кислота. Это наиболее распространенные аминокислоты белков животных организмов. Обладая дополнительной карбоксильной группой в радикале, эти аминокислоты способствуют ионному взаимодействию, придают заряд белковой молекуле. Эти аминокислоты могут образовывать амиды.
5. Амиды дикарбоновых аминокислот. Глутамин (Глн, Q) и аспарагин (Асн, N). Эти аминокислоты выполняют важную функцию в обезвреживании и транспорте аммиака в организме. Амидная связь в их составе частично имеет характер двойной. За счет этого амидная группа обладает частичным положительным зарядом и не будет диссоциировать.
6. Циклические аминокислоты имеют в своем радикале ароматическое или гетероциклическое ядро. Фенилаланин (Фен, F) — a-амино-b-фенилпропионовая кислота. Тирозин (Тир, Y) — a-амино-b-параоксифе-нилпропионовая кислота. Эти 2 аминокислоты образуют взаимосвязанную пару, выполняющую важные функции в организме, среди которых следует отметить использование их клетками для синтеза ряда биологически активных веществ (адреналина, тироксина).
Триптофан (Три, W) a-амино-b-индолилпропионовая кислота. Используется для синтеза витамина PP, серотонина, гормонов эпифиза.
Гистидин (Гис, H) — a-амино-b-имидазолилпропионовая кислота. Может использоваться при образовании гистамина, регулирующего проницаемость тканей и проявляющего свое действие при аллергии.
7. Диаминомонокарбоновые аминокислоты. Лизин (Лиз, K) — диаминокапроновая кислота. Аргинин (Арг, R)- a-амино-b-гуанидин-валериановая кислота. Эти аминокислоты имеют дополнительную аминогруппу, которая придает основные свойства белкам, содержащим много таких аминокислот. Образование аргинина является частью метаболического пути обезвреживания аммиака (синтез мочевины).
Образование аргинина является частью метаболического пути обезвреживания аммиака (синтез мочевины).
8. Иминокислота — пролин (Про, P). Отличается от других аминокислот по строению. Её радикал образует с a-аминогруппой единую циклическую структуру. Благодаря этой особенности вокруг связи между a-аминогруппой и a-углеродным атомом невозможно никакое вращение. У всех других аминокислот возможность вращения вокруг этой связи имеется. Вдобавок в состав пролина входит вторичная аминогруппа (с азотом азота связан только один атом водорода), которая отличается, по своим химическим характеристикам от первичной аминогруппы (-NH2) в составе других аминокислот. Особое место отводится этой аминокислоте в структуре коллагена, где пролин, в процессе синтеза коллагена, может превращаться в гидроксипролин.
В скобках указаны сокращенные обозначения аминокислот, которые образуются из первых трех букв их тривиального названия. В последнее время для записи первичной структуры используются и однобуквенные символы, что важно при использовании ЭВМ в работе с белками.
главные составные части белков — Студопедия
Физико-химические и биологические свойства белков определяются их аминокислотным составом. Аминокислоты — это аминопроизводные класса карбоновых кислот. Аминокислоты входят не только в состав белков. Многие из них выполняют специальные функции. Поэтому в живых организмах различают аминокислоты протеиногенные (кодируются генетически) и непротеиногенные (не кодируются генетически). Протеиногенных аминокислот 20. 19 из них являются a-аминокислотами. Это означает, что аминогруппа у них присоединена к a-углеродному атому той карбоновой кислоты, производным которой они являются. Общая формула этих аминокислот выглядит следующим образом:
Только одна аминокислота — пролин не соответствует этой общей формуле. Ее относят к иминокислотам.
a-углеродный атом аминокислот является ассимметричным (исключение составляет аминопроизводное уксусной килоты — глицин). Это означает, что у каждой аминокислоты имеются, как минимум, 2 оптически активных антипода. Природа выбрала для создания белков L-форму. Поэтому природные белки построены из L-a- аминокислот.
Это означает, что у каждой аминокислоты имеются, как минимум, 2 оптически активных антипода. Природа выбрала для создания белков L-форму. Поэтому природные белки построены из L-a- аминокислот.
Во всех случаях, когда в молекуле органического соединения атом углерода связан с 4 разными атомами или функциональными группами, этот атом ассиметричен, поскольку он может существовать в двух изомерных формах, называемых энантиомерами или оптическими (стерео-) изомерами. Соединения с ассимметричными атомами «С» встречаются в виде двух форм (хиральных соединений) — левой и правой, в зависимости от направления вращения плоскости поляризации плоскополяризованного света. Все стандартные аминокислоты кроме одной (глицин) содержат в a-положении ассимметричный атом углерода, с которым связаны 4 замещающих группы. Поэтому они обладают оптической активностью, то есть способны вращать плоскость
поляризации света в том или ином направлении.
Однако в основе системы обозначения стереоизомеров лежит не вращение плоскости поляризации света, а абсолютная конфигурация молекулы стереоизомера. Для выяснения конфигурации оптически активных аминокислот их сравнивают с глицериновым альдегидом — простейшим трехуглеродным углеводом, который содержит ассимметричный атом углерода. Стереоизомеры всех хиральных соединений, независимо от направления вращения плоскости поляризации плоскополяризованного света, соответствующие по конфигурации L-глицериновому альдегиду, обозначаются буквой L, а соответствующие D-глицериновому альдегиду — буквой D. Таким образом, буквы L и D относятся к абсолютной конфигурации 4 замещающих групп при хиральном атоме «С», а не к направлению вращения плоскости поляризации.
Для выяснения конфигурации оптически активных аминокислот их сравнивают с глицериновым альдегидом — простейшим трехуглеродным углеводом, который содержит ассимметричный атом углерода. Стереоизомеры всех хиральных соединений, независимо от направления вращения плоскости поляризации плоскополяризованного света, соответствующие по конфигурации L-глицериновому альдегиду, обозначаются буквой L, а соответствующие D-глицериновому альдегиду — буквой D. Таким образом, буквы L и D относятся к абсолютной конфигурации 4 замещающих групп при хиральном атоме «С», а не к направлению вращения плоскости поляризации.
Классификация аминокислот проводится по строению их радикала. Существуют разные подходы к классификации. Большая часть аминокислот — это алифатические соединения. 2 аминокислоты являются представителями ароматического ряда и 2 — гетероциклического.
Аминокислоты можно разделить, по их свойствам, на основные, нейтральные и кислые. Они отличаются числом амино- и карбоксильных групп в молекуле. Нейтральные — содержат по одной амино- и одной карбоксильной группе (моноаминомонокарбоновые). Кислые имеют 2 карбоксильные и одну аминогруппу (моноаминодикарбоновые), основные -2 аминогруппы и одну карбоксильную (диаминомонокарбоновые).
Нейтральные — содержат по одной амино- и одной карбоксильной группе (моноаминомонокарбоновые). Кислые имеют 2 карбоксильные и одну аминогруппу (моноаминодикарбоновые), основные -2 аминогруппы и одну карбоксильную (диаминомонокарбоновые).
1. Собственно алифатическими можно назвать 5 аминокислот. Глицин или гликокол (Гли),
при работе с компьютером — (G), — a-аминоуксусная кислота. Является единственной оптически неактивной аминокислотой. Глицин используется не только для синтеза белков. Его атомы входят в состав нуклеотидов, гема, он входит в состав важного трипептида — глутатиона.
Аланин (Ала), при работе с компьютером — (А) — a-аминопропионовая кислота. Аланин нередко используется в организме для синтеза глюкозы.
По структуре все аминокислоты, за исключением глицина, можно рассматривать как производные аланина, у которого один или несколько атомов водорода в составе радикала замещены различными функциональными группами.
Валин (Вал), при работе с компьютером (V) — аминоизовалериановая кислота. Лейцин (Лей, L) — аминоизокапроновая кислота. Изолейцин (Иле, I) — a-амино-b-этил-b-метилпропионовая кислота. Эти три аминокислоты, обладая выраженными гидрофобными свойствами, играют важную роль в формировании пространственной структуры белковой молекулы.
2. Гидроксиаминокислоты. Серин (Сер, S) — a-амино-b-гидроксипропионовая кислота и треонин (Тре, T) — a-амино-b-гидроксимасляная кислота играют важную роль в процессах ковалентной модификации структуры белков. Их гидроксильная группа легко взаимодействует с фосфорной кислотой, что бывает необходимым для изменения функциональной активности белков.
3. Серусодержащие аминокислоты. Цистеин (Цис, C) — a-амино- b-тиопропионовая кислота. Специальным свойством цистеина является способность к окислению (в присутствии кислорода) и взаимодействию с другой молекулой цистеина с образованием дисульфидной связи и нового соединения — цистина. Эта аминокислота благодаря активной -SH группе легко вступает в окислительно-восстановительные реакции, защищая клетку от действия окислителей, участвует в образовании дисульфидных мостиков, стабилизирующих структуру белков, входит в состав активного центра ферментов.
Эта аминокислота благодаря активной -SH группе легко вступает в окислительно-восстановительные реакции, защищая клетку от действия окислителей, участвует в образовании дисульфидных мостиков, стабилизирующих структуру белков, входит в состав активного центра ферментов.
Метионин (Мет, M) — a-амино-b-тиометилмасляная кислота. Выполняет функцию донора подвижной метильной группы, необходимой для синтеза биологически активных соединений: холина, нуклеотидов и т.д. Это гидрофобная аминокислота.
4. Дикарбоновые аминокислоты. Глутаминовая (Глу, E) — a-аминоглутаровая кислота и аспарагиновая кислота (Асп, D) — a-аминоянтарная кислота. Это наиболее распространенные аминокислоты белков животных организмов. Обладая дополнительной карбоксильной группой в радикале, эти аминокислоты способствуют ионному взаимодействию, придают заряд белковой молекуле. Эти аминокислоты могут образовывать амиды.
5. Амиды дикарбоновых аминокислот. Глутамин (Глн, Q) и аспарагин (Асн, N). Эти аминокислоты выполняют важную функцию в обезвреживании и транспорте аммиака в организме. Амидная связь в их составе частично имеет характер двойной. За счет этого амидная группа обладает частичным положительным зарядом и не будет диссоциировать.
Амиды дикарбоновых аминокислот. Глутамин (Глн, Q) и аспарагин (Асн, N). Эти аминокислоты выполняют важную функцию в обезвреживании и транспорте аммиака в организме. Амидная связь в их составе частично имеет характер двойной. За счет этого амидная группа обладает частичным положительным зарядом и не будет диссоциировать.
6. Циклические аминокислоты имеют в своем радикале ароматическое или гетероциклическое ядро. Фенилаланин (Фен, F) — a-амино-b-фенилпропионовая кислота. Тирозин (Тир, Y) — a-амино-b-параоксифе-нилпропионовая кислота. Эти 2 аминокислоты образуют взаимосвязанную пару, выполняющую важные функции в организме, среди которых следует отметить использование их клетками для синтеза ряда биологически активных веществ (адреналина, тироксина).
Триптофан (Три, W) — a-амино-b-индолилпропионовая кислота. Используется для синтеза витамина PP, серотонина, гормонов эпифиза.
Гистидин (Гис, H) — a-амино-b-имидазолилпропионовая кислота. Может использоваться при образовании гистамина, регулирующего проницаемость тканей и проявляющего свое действие при аллергии.
Может использоваться при образовании гистамина, регулирующего проницаемость тканей и проявляющего свое действие при аллергии.
7. Диаминомонокарбоновые аминокислоты. Лизин (Лиз, K) — диаминокапроновая кислота. Аргинин (Арг, R) — a-амино-b-гуанидин-валериановая кислота. Эти аминокислоты имеют дополнительную аминогруппу, которая придает основные свойства белкам, содержащим много таких аминокислот. Образование аргинина является частью метаболического пути обезвреживания аммиака (синтез мочевины).
8. Иминокислота — пролин (Про, P). Отличается от других аминокислот по строению. Её радикал образует с a-аминогруппой единую циклическую структуру. Благодаря этой особенности вокруг связи между a-аминогруппой и a-углеродным атомом невозможно никакое вращение. У всех других аминокислот возможность вращения вокруг этой связи имеется. Вдобавок в состав пролина входит вторичная аминогруппа (с азотом азота связан только один атом водорода), которая отличается, по своим химическим характеристикам от первичной аминогруппы (-NH2) в составе других аминокислот. Особое место отводится этой аминокислоте в структуре коллагена, где пролин, в процессе синтеза коллагена, может превращаться в гидроксипролин.
Особое место отводится этой аминокислоте в структуре коллагена, где пролин, в процессе синтеза коллагена, может превращаться в гидроксипролин.
В скобках указаны сокращенные обозначения аминокислот, которые образуются из первых трех букв их тривиального названия. В последнее время для записи первичной структуры используются и однобуквенные символы, что важно при использовании ЭВМ в работе с белками.
Химические свойства аминокислот | Химия онлайн
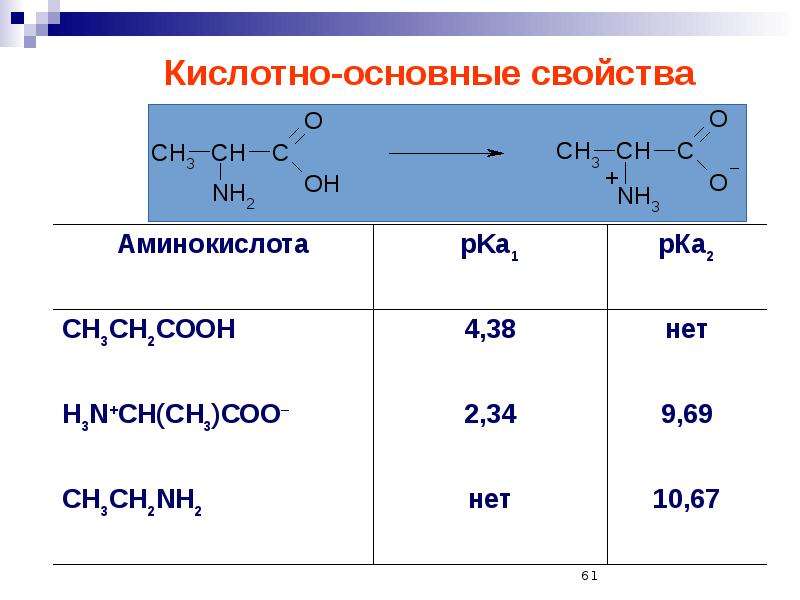
Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
Кислотно-основное равновесие в водных растворах
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
В кислой среде молекулы аминокислот представляю собой катион. В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
Аминокислоты в твердом состоянии всегда существуют в виде биполярного, двухзарядного иона — цвиттер-иона.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Карбоксильная группа аминокислоты отщепляет ион водорода, который затем присоединяется к аминогруппе той же молекулы по месту неподеленной электронной пары азота. В результате действие функциональных групп нейтрализуется, образуется так называемая внутренняя соль.
Водные растворы аминокислот в зависимости от количества функциональных групп имеют нейтральную, кислую или щелочную среду.
Аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Видеоопыт «Свойства аминоуксусной кислоты»
а) моноаминомонокарбоновые кислоты (нейтральные кислоты)
Внутримолекулярная нейтрализация — образуется биполярный цвиттер-ион.
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН≈7).
б) моноаминодикарбоновые кислоты (кислые аминокислоты)
Водные растворы моноаминодикарбоновых кислот имеют рН<7 (кислая среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток ионов водорода Н+.
в) диаминомонокарбоновые кислоты (основные аминокислоты)
Водные растворы диаминомонокарбоновых кислот имеют рН>7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН— .
2. Взаимодействие с основаниями и кислотами
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН).
Как кислота (участвует карбоксильная группа)
Как карбоновые кислоты α-аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
а) взаимодействие с основаниями
Образуются соли:
б) взаимодействие со спиртами (р. этерификации)
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
в) взаимодействие с аммиаком
Образуются амиды:
Как основание (участвует аминогруппа)
а) взаимодействие с сильными кислотами
Подобно аминам, аминокислоты реагируют с сильными кислотами с образованием солей аммония:
б) взаимодействие с азотистой кислотой (р. дезаминирования)
дезаминирования)
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.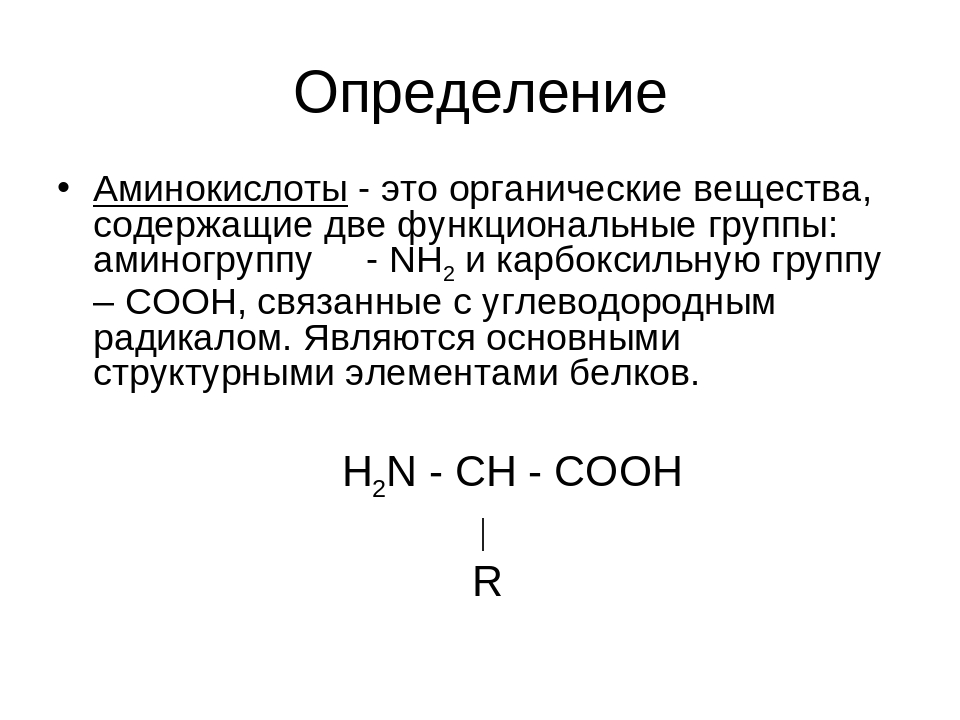 е представляют собой продукт поликонденсации a-аминокислот.
е представляют собой продукт поликонденсации a-аминокислот.
5. Качественные реакции!
а) нингидриновая реакция
Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета:
Иминокислота пролин дает с нингидрином желтое окрашивание.
б) с ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Видеоопыт «Образование медной соли аминоуксусной кислоты»
Аминокислоты
Биологическая роль аминокислот | Химия онлайн
Известно около 200 природных аминокислот, но только 20 из них играют важнейшую роль в жизни человека. Эти аминокислоты называют протеиногенными — строящими белки.
Первые аминокислоты были открыты в начале XIX века.
В пищевых продуктах наиболее распространены 22 аминокислоты.
В составе белков найдено 20 различных α-аминокислот (одна из них – пролин, является не амино- , а иминокислотой), поэтому их называют белковыми аминокислотами.
Все другие аминокислоты существуют в свободном состоянии или в составе коротких пептидов, или комплексов с другими органическими веществами.
Многие из них найдены только в определенных организмах, а некоторые – только в одном каком-либо организме.
Большинство микроорганизмов и растения синтезируют необходимые им аминокислоты, животные и человек не способны к образованию так называемых незаменимых аминокислот, получаемых с пищей.
К заменимым относятся аминокислоты, присутствие которых в пище не обязательно для нормального развития организма. В случае их недостаточности они могут синтезироваться из других аминокислот или из небелковых компонентов. Аминокислоты валин, лейцин, изолейцин, лизин, метионин, треонин, триптофан и фенилаланин являются незаменимыми почти для всех видов животных.
Аминокислоты валин, лейцин, изолейцин, лизин, метионин, треонин, триптофан и фенилаланин являются незаменимыми почти для всех видов животных.
Аминокислоты являются наиболее важной составной частью организма. Аминокислоты – строительные блоки, из которых строятся белковые структуры, мышечные волокна. Организм использует их для собственного роста, восстановления, укрепления и выработки различных гормонов, антител и ферментов.
Они содержатся в ядре, протоплазме и стенках клеток, где выполняют разнообразные функции жизнедеятельности.
Аминокислоты участвуют в обмене белков и углеводов, в образовании важных для организмов соединений (например, пуриновых и пиримидиновых оснований, являющихся неотъемлемой частью нуклеиновых кислот), входят в состав гормонов, витаминов, алкалоидов, пигментов, токсинов, антибиотиков и т. д.
Некоторые аминокислоты служат посредниками при передаче нервных импульсов.
С нарушением обмена аминокислот связан ряд наследственных и приобретенных заболеваний, сопровождающихся серьезными проблемами в развитии организма.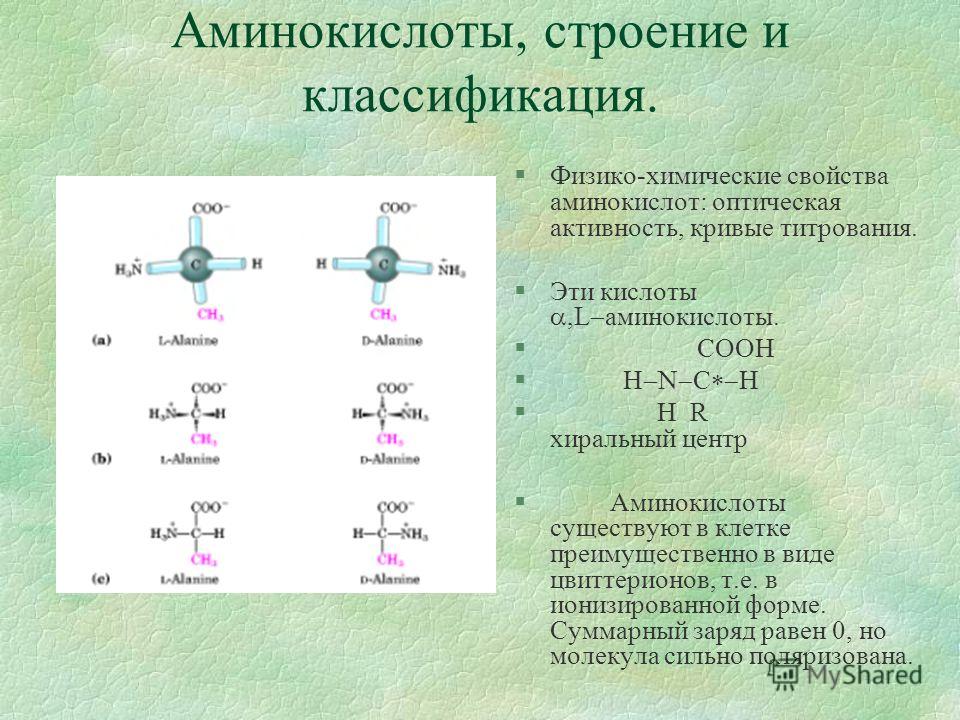
Главными продуктами разложения аминокислот являются аммиак, мочевина и мочевая кислота. Восполнение потерь аминокислот происходит в основном в результате расщепления белков.
Аминокислоты обеспечивают:
— основные метаболические процессы: синтез и утилизация витаминов, липотропное (жиромобилизующее) действие, гликолиз и гликонеогенез;
— процессы детоксикации организма, в том числе при токсикозе беременных; — формирование иммунной системы организма;
— энергетические потребности клеток и, прежде всего, мозга, участвуют в образовании нейромедиаторов, обладают антидепрессантной активностью, улучшают память;
— метаболизм углеводов, участвуют в образовании и накоплении гликогена в мышцах и печени, обеспечивают наращивание мышечной массы, cнижают утомляемость, улучшают работоспособность;
— стимулируют работу гипофиза, увеличивают выработку гормона роста, гормонов щитовидной железы, надпочечников;
— участвуют в образовании коллагена и эластина, способствуют восстановлению кожи и костной ткани, а также заживлению ран;
— принимают участие в кроветворении, и, прежде всего, в выработке гемоглобина.
Интересно знать
Во время беременности повышается потребность женского организма в триптофане и лизине, у грудных детей – в триптофане и изолейцине.
Особенно увеличивается потребность организма в незаменимых аминокислотах после больших потерь крови, ожогов, а также вовремя других процессов, сопровождаемых регенерацией тканей.
Для птиц незаменимой аминокислотой является глицин.
У жвачных животных биосинтез всех незаменимых аминокислот производится микроорганизмами кишечного тракта.
Для человека высокую «биологическую ценность» имеют лишь немногие животные белки, такие, как белок куриного яйца или белок материнского молока. Они содержат незаменимые аминокислоты не только в достаточном количестве, но и в необходимом для человека соотношении.
Низкая ценность многочисленных растительных белков связана с небольшим содержанием в них отдельных незаменимых аминокислот (главным образом лизина и метионина). В белке соевой муки мало метионина, в кукурузе – лизина и триптофана.
Признаки недостаточности аминокислот в организме
При недостаточном количестве аминокислотных соединений в организме формируется дисбаланс белкового обмена, в результате которого недостающие элементы «извлекаются» из соединительной ткани, мышц, крови и печени.
В первую очередь высвобожденные белки используются для питания мозга и обеспечения работы сердечно-сосудистой системы.
Расходуя собственные аминокислоты и не получая их с пищей, организм начинает слабеть и истощаться, это приводит к сонливости, выпадению волос, анемии, потере аппетита, ухудшению состояния кожи, задержке роста и умственному развитию.
Аминокислоты
Белки и аминокислоты, подготовка к ЕГЭ по химии
Белки (син. протеины) — высокомолекулярные органические вещества, построенные из остатков аминокислот. По
своему биологическому значению принадлежат к числу важнейших составных частей организма.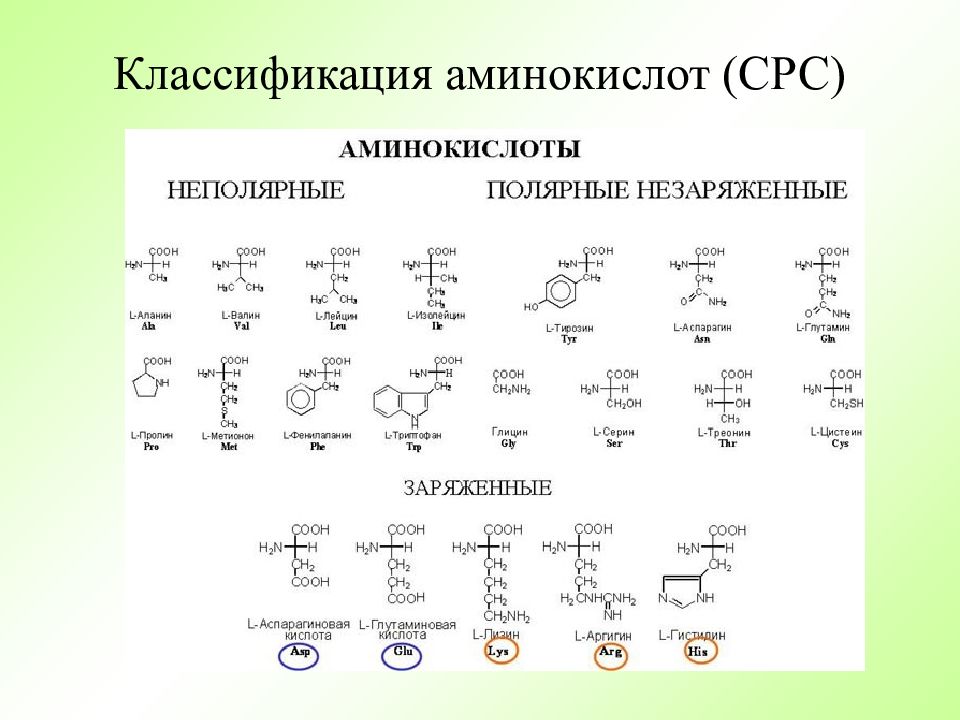
Несомненно, белки абсолютно необходимы для жизни растений, животных и грибов. Именно вследствие такого большого значения белки получили названия протеинов (греч. protos — первый, главный).
Качественной реакцией на белки служит ксантопротеиновая реакция. Ее проводят путем добавления к раствору белка HNO3(конц.) до тех пор, пока не прекратится выпадение осадка. Осадок окрашивается в характерный желтый цвет.
Аминокислота
Аминокислота — органическая кислота, содержащая, по меньшей мере, одну карбоксильную группу (COOH) и одну аминогруппу (NH2). Аминокислоты являются основной составляющей всех белков.
В построении белков участвуют 20 наиболее распространенных аминокислот. На данном этапе учить их наизусть не обязательно, эта задача настигнет вас на кафедре биохимии 😉
И все же для успешного изучения данной темы мы возьмем за основу две аминокислоты: глицин и аланин.
Я хочу вас обрадовать (надеюсь, что обрадую)). Если вы успешно изучили темы: карбоновые кислоты, амины — то вы уже знаете химические свойства аминокислот!
Они напоминают амфотерные соединения: по аминогруппе вступают в реакции с кислотами, по карбоксильной — с основаниями. Мы разберем их подробнее чуть ниже.
Получение аминокислот
Аминокислоты можно получить в реакции аммиака с галогенкарбоновыми кислотами.
Химические свойства аминокислот
- Основные свойства
- Кислотные свойства
- Пептидные связи
За счет наличия аминогруппы, аминокислоты проявляют основные свойства. Реагируют с кислотами.
По карбоксильной группе аминокислоты способны вступать в реакции с металлами, основными оксидами, основаниями и солями более слабых кислот.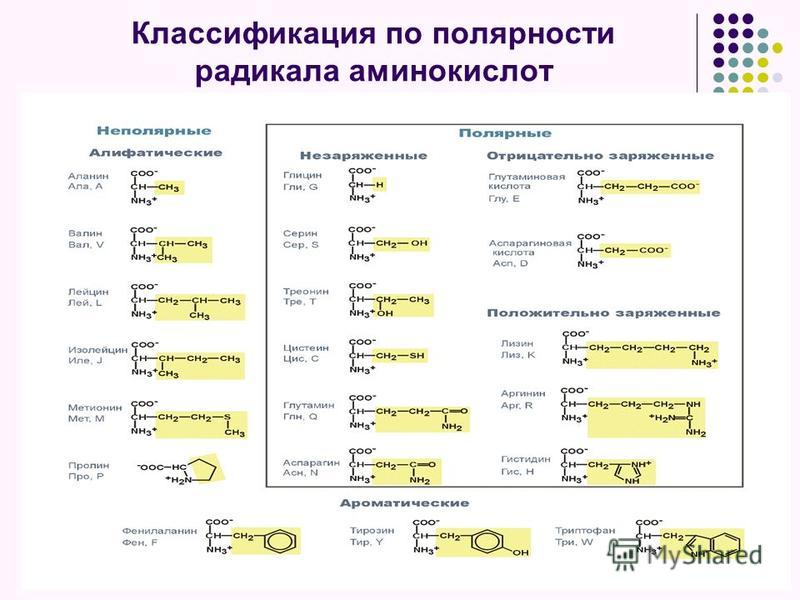
Аминокислоты способны вступать в реакцию этерификации, образуя сложные эфиры.
В молекуле белка аминокислоты связаны друг с другом пептидной связью. Она образуется между карбоксильной группой одной аминокислоты и аминогруппой другой аминокислоты.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.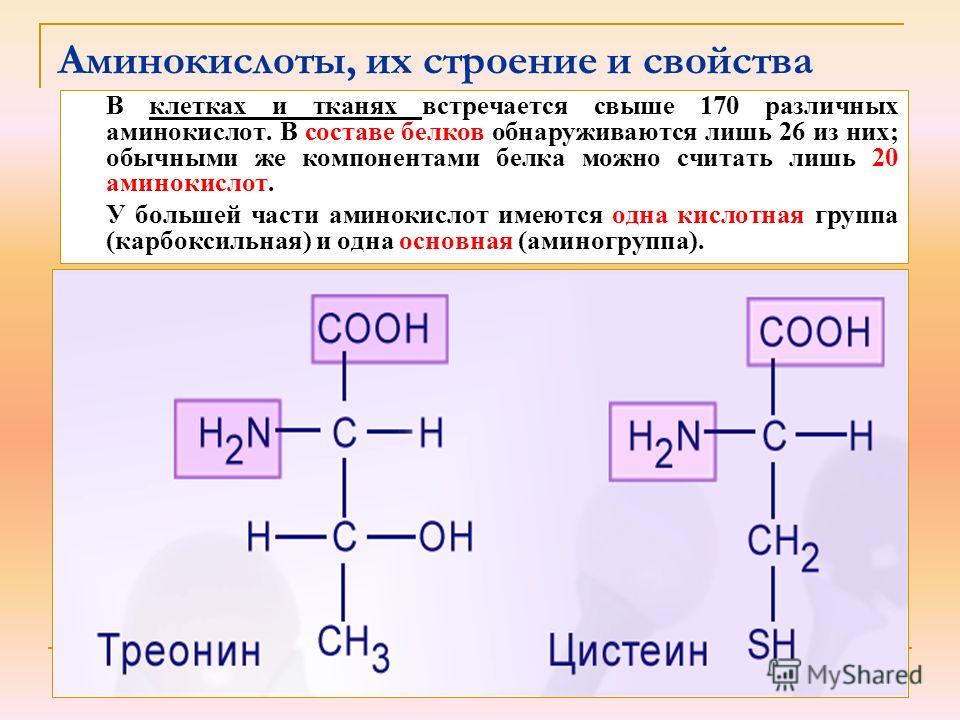
Свойства аминокислот: химические и физические
Cвойства аминокислот можно разделить на две группы: химические и физические.
Химические свойства аминокислот
В зависимости от соединений, аминокислоты могут проявлять различные свойства.
Взаимодействие аминокислот:
Аминокислоты как амфотерные соединения образуют соли и с кислотами, и со щелочами.
Как карбоновые кислоты аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
Взаимодействие и свойства аминокислот с основаниями:
Образуются соли:
NH2-CH2-COOH + NaOH NH2-CH2-COONa + h3O
Натриевая соль + 2-аминоуксусной кислоты Натриевая соль аминоуксусной кислоты (глицина) + вода
Взаимодействие со спиртами:
Аминокислоты могут реагировать со спиртами при наличии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
NH2-CH2-COOH + CH3OH NH2-CH2-COOCH3 + H2O.
Метиловый эфир / 2-аминоуксусной кислоты /
Взаимодействие с аммиаком:
Образуются амиды:
NH2-CH(R)-COOH + H-NH2 = NH2-CH(R)-CONH2 + H2O
Амид
Взаимодействие аминокислот с сильными кислотами:
Получаем соли:
HOOC-CH2-NH2 + HCl → [HOOC-CH2-NH3]Cl (или HOOC-CH2-NH2*HCl↑)
Таковы основные химические свойства аминокислот.
Физические свойства аминокислот
Перечислим физические свойства аминокислот:
- Бесцветные
- Имеют кристаллическую форму
- Большинство аминокислот со сладким привкусом, но в зависимости от радикала (R) могут быть горькими или безвкусными
- Хорошо растворяются в воде, но плохо растворяются во многих органических растворителях
- Аминокислоты имеют свойство оптической активности
- Плавятся с разложением при температуре выше 200°C
- Нелетучие
- Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток
Добавить интересную новость
Классификация аминокислот— исследования аминокислот
Классификации аминокислот многочисленны и различаются в зависимости от целевой аудитории. Знание того, как классифицируются аминокислоты, может иметь важное значение для вашего общего здоровья и жизнеспособности.
Знание того, как классифицируются аминокислоты, может иметь важное значение для вашего общего здоровья и жизнеспособности.
Вы узнаете
- 4 широко используемых классификации аминокислот
- Самая полезная классификация для здоровья человека
Классификация стандартных и нестандартных аминокислот
Большинство знакомых нам аминокислот известны как стандартные аминокислоты.Это аминокислоты, которые образуются в результате универсального генетического кодирования. Стандартные аминокислоты (также известные как канонические аминокислоты) являются «строительными блоками» белка. Это аминокислоты, которые вместе с ДНК помогают организму формироваться и функционировать.
Нестандартные аминокислоты не помогают строить белки. Из этого правила есть только три исключения. Селеноцистеин, пирролизин и N-формилметионин — нестандартные аминокислоты, которые все еще могут быть естественным образом включены в белки.
Они делают это, используя генетический код, который не использовался или находится в определенной позиции в аминокислотной цепи.Нестандартные аминокислоты также могут быть модифицированными формами стандартных аминокислот. Многие нестандартные аминокислоты используются в генной инженерии.
Классификация протеиногенных и непротеиногенных аминокислот
Протеиногенные аминокислоты в широком смысле определяются как аминокислоты, которые используются для образования белков. Многие из них вырабатываются организмом естественным образом. Однако есть протеиногенные аминокислоты, которые необходимо получать с пищей. Во всех случаях протеиногенные аминокислоты необходимы для здорового функционирования организма.Вы можете прочитать об этом более подробно в нашей статье «20 протеиногенных аминокислот».
Непротеиногенные аминокислоты не требуются для построения белков. Однако это не значит, что они не важны. Эти аминокислоты играют жизненно важную роль в качестве промежуточных продуктов метаболизма. Известно около 700 небелковых аминокислот, из которых около 300 — растительного происхождения. Их пути происхождения включают модификацию существующей аминокислоты или пути, или их собственные новые пути.
Известно около 700 небелковых аминокислот, из которых около 300 — растительного происхождения. Их пути происхождения включают модификацию существующей аминокислоты или пути, или их собственные новые пути.
Классификация аминокислот на основе питания человека
Один из наиболее распространенных способов классификации аминокислот основан на требованиях к здоровью человека. Некоторые аминокислоты могут быть синтезированы организмом. Они классифицируются как незаменимые аминокислоты. Есть одиннадцать незаменимых аминокислот. И наоборот, незаменимые аминокислоты необходимо получать из пищевых источников. Сбалансированная диета обычно обеспечивает поступление в организм достаточного количества незаменимых аминокислот
Существует также третья категория аминокислот, классифицируемая на основе питания.Это так называемые полузаменимые аминокислоты. Это аминокислоты, которые обычно считаются несущественными, хотя в периоды стресса они могут становиться частично незаменимыми. Например, если иммунная система нарушена, организм может бороться с выработкой определенных аминокислот. Следовательно, диета становится необходимым источником этих аминокислот.
Например, если иммунная система нарушена, организм может бороться с выработкой определенных аминокислот. Следовательно, диета становится необходимым источником этих аминокислот.
ВИДЕО: Классификация аминокислот на основе химических свойств
Существует множество различных химических свойств боковых цепей аминокислот, которые можно классифицировать.Эти варианты могут помочь упорядочить и классифицировать аминокислоты по группам с общими характеристиками.
Некоторые из общих химических свойств, используемых для классификации аминокислот, включают заряд боковой цепи, независимо от того, является ли она кислотной или основной, и имеет ли она способность связывать водород. В общих чертах, двадцать распространенных аминокислот можно разделить на неполярные (гидрофобные) и полярные (гидрофильные).
Неполярные аминокислоты можно разделить на алкильные или ароматические, а полярные аминокислоты можно разделить на нейтральные, кислотные или основные.В следующем видео более подробно рассматриваются различные химические свойства, которые помогают классифицировать различные группы аминокислот:
B1. Аминокислотный анализ и химическое секвенирование
Аминокислотный анализ и химическое секвенирование
Как описано во введении в белки, мы можем понять структуру белков на разном уровне сложности.
Рисунок: Анализ белков от низкого до высокого разрешения.
В предыдущем разделе главы мы узнали о заряде и свойствах химической реактивности изолированных аминокислот и аминокислот в белках.Анализ всего белка сложен, поскольку каждая отдельная аминокислота может быть представлена в последовательности много раз. Каждый белок имеет N-концевую и C-концевую аминокислоту и вторичную структуру. Некоторые белки существуют биологически как мультисубъединичные белки, что усложняет анализ, поскольку теперь белки будут иметь несколько N- и C-концевых концов. Кроме того, изолированные белки могут иметь химические модификации (посттрансляционные), которые увеличивают функциональность белков, но также усложняют анализ.Чтобы проиллюстрировать некоторые из этих проблем, просмотрите структуру программы RhoA ниже.
Обновленный RhoA — цитоплазматический белок — Сложность анализа белков Jmol14 (Java) | JSMol (HTML5)
Аминокислотный состав
При низком уровне разрешения мы можем определить аминокислотный состав белка путем гидролиза белка в 6 н. HCl, 100 ° C, в вакууме в течение различных интервалов времени. После удаления HCl гидролизат наносят на колонку для ионного обмена или гидрофобного взаимодействия, и аминокислоты элюируются и количественно оцениваются по известным стандартам.Не встречающаяся в природе аминокислота, такая как норлейцин, добавляется в известных количествах в качестве внутреннего стандарта для контроля количественного восстановления во время реакций. Разделенные аминокислоты часто дериватизируются нингидрином или фенилизотиоциантатом для облегчения их обнаружения. Реакция обычно длится 24, 36 и 48 часов, так как аминокислоты с ОН (например, ser) разрушаются. Временной ход позволяет экстраполировать концентрацию Ser в момент времени t = 0. Trp также разрушается во время процесса. Кроме того, амидные звенья в боковых цепях Gln и Asn гидролизуются с образованием Glu и Asp соответственно.
Кроме того, амидные звенья в боковых цепях Gln и Asn гидролизуются с образованием Glu и Asp соответственно.
- Анализ AA: протеиновый комплекс Университета штата Айова
Анализ N- и C-концевых аминокислот
Аминокислотный состав не дает последовательности белка. N-конец белка может быть определен путем реакции белка с фтординитробензолом (FDNB) или дансилхлоридом, который реагирует с любым свободным амином в белке, включая эпсилон-аминогруппу лизина.Аминогруппа белка связана с ароматическим кольцом DNB через амин и с дансильной группой через сульфонамид и, следовательно, устойчива к гидролизу. Белок гидролизуют в 6 н. HCl, а аминокислоты разделяют с помощью ТСХ или ВЭЖХ. Если белок представляет собой одноцепочечный белок с некоторыми остатками Lys, должно получиться два пятна. Меченая аминокислота, отличная от Lys, является N-концевой аминокислотой. С-концевая аминокислота может быть определена путем добавления карбоксипептидаз, ферментов, которые отщепляют аминокислоты от С-конца. Необходимо пройти курс времени, чтобы увидеть, какая аминокислота высвобождается первой. N-концевой анализ также может быть выполнен как часть секвенирования всего белка, как обсуждается ниже (реакция деградации Эдмана).
Необходимо пройти курс времени, чтобы увидеть, какая аминокислота высвобождается первой. N-концевой анализ также может быть выполнен как часть секвенирования всего белка, как обсуждается ниже (реакция деградации Эдмана).
Анализ на конкретные аминокислоты
Ароматические аминокислоты можно определить по их характерным профилям поглощения. Аминокислоты с конкретными функциональными группами могут быть определены химическими реакциями с конкретными модифицирующими группами, как показано в разделе 2A.
Рисунок: профили поглощения аминокислот
Аминокислотная последовательность — деградация по Эдману
Существует два метода определения полной последовательности белка.В одном белок секвенирован; в другом — ДНК, кодирующая белок, секвенируется, из чего может быть получена аминокислотная последовательность. Фактический белок можно секвенировать с помощью автоматической последовательной деградации по Эдману.
Рисунок: Деградация Эдмана
В этом методе белок, адсорбированный на твердой фазе, реагирует с фенилизотиоцианатом. В результате происходит внутримолекулярная циклизация и расщепление N-концевой аминокислоты, которая может быть отмыта от адсорбированного белка и обнаружена с помощью анализа ВЭЖХ.Выход в этой технике близок к 100%. Однако со временем накапливается больше цепей, в которых N-концевая аминокислота не удалена. Если его удалить на следующем этапе, две аминокислоты будут элюированы, создавая увеличивающийся «шум» на этапе элюирования, то есть будет обнаружено более 1 производного аминокислоты. Следовательно, максимальная длина пептида, который можно секвенировать, составляет около 50 аминокислот. Большинство белков больше этого размера. Следовательно, прежде чем белок может быть секвенирован, он должен быть расщеплен определенными ферментами, называемыми эндопротеазами, которые расщепляют белки после определенных боковых цепей.Например, трипсин расщепляет белки в цепи после Lys и Arg, тогда как химотрипсин расщепляет после ароматических аминокислот, таких как Trp, Tyr и Phe. Также можно использовать химическое расщепление небольшими молекулами.
В результате происходит внутримолекулярная циклизация и расщепление N-концевой аминокислоты, которая может быть отмыта от адсорбированного белка и обнаружена с помощью анализа ВЭЖХ.Выход в этой технике близок к 100%. Однако со временем накапливается больше цепей, в которых N-концевая аминокислота не удалена. Если его удалить на следующем этапе, две аминокислоты будут элюированы, создавая увеличивающийся «шум» на этапе элюирования, то есть будет обнаружено более 1 производного аминокислоты. Следовательно, максимальная длина пептида, который можно секвенировать, составляет около 50 аминокислот. Большинство белков больше этого размера. Следовательно, прежде чем белок может быть секвенирован, он должен быть расщеплен определенными ферментами, называемыми эндопротеазами, которые расщепляют белки после определенных боковых цепей.Например, трипсин расщепляет белки в цепи после Lys и Arg, тогда как химотрипсин расщепляет после ароматических аминокислот, таких как Trp, Tyr и Phe. Также можно использовать химическое расщепление небольшими молекулами. Цианогенбромид, CNBr, расщепляет белки после боковых цепей метионина. Отдельные белки необходимо расщеплять двумя разными методами, каждый пептидный фрагмент выделять и секвенировать. Затем порядок расщепленных пептидов с известной последовательностью может быть соединен вместе путем сравнения пептидных последовательностей, полученных с использованием различных методов расщепления.Многие белки также имеют дисульфидные связи, соединяющие боковые цепи Cys, удаленные друг от друга в полипептидной цепи. Протеолитическое или химическое расщепление белка привело бы к образованию фрагмента, содержащего два пептида, связанных дисульфидами. Деграция Эдмана высвободит из таких фрагментов две аминокислоты. Чтобы избежать этой проблемы, белок окисляют пермуравьиной кислотой, которая необратимо окисляет свободный Cys или дисульфиды Cys-Cys до остатков цистеиновой кислоты. Краткое описание этапов секвенирования белков показано ниже:
Цианогенбромид, CNBr, расщепляет белки после боковых цепей метионина. Отдельные белки необходимо расщеплять двумя разными методами, каждый пептидный фрагмент выделять и секвенировать. Затем порядок расщепленных пептидов с известной последовательностью может быть соединен вместе путем сравнения пептидных последовательностей, полученных с использованием различных методов расщепления.Многие белки также имеют дисульфидные связи, соединяющие боковые цепи Cys, удаленные друг от друга в полипептидной цепи. Протеолитическое или химическое расщепление белка привело бы к образованию фрагмента, содержащего два пептида, связанных дисульфидами. Деграция Эдмана высвободит из таких фрагментов две аминокислоты. Чтобы избежать этой проблемы, белок окисляют пермуравьиной кислотой, которая необратимо окисляет свободный Cys или дисульфиды Cys-Cys до остатков цистеиновой кислоты. Краткое описание этапов секвенирования белков показано ниже:
СТРАТЕГИЯ ПОСЛЕДОВАТЕЛЬНОСТИ БЕЛКОВ — 8 ШАГОВ
- Если белок содержит более одной полипептидной цепи, цепи разделяются и очищаются.
 Если дисульфидные связи соединяют две разные цепи, связь S-S должна быть расщеплена (как описано на этапе 2) и каждый пептид очищен независимо.
Если дисульфидные связи соединяют две разные цепи, связь S-S должна быть расщеплена (как описано на этапе 2) и каждый пептид очищен независимо. - Внутрицепочечные связи S-S между боковыми цепями Cys расщепляются пермуравьиной кислотой. (См. Выше для межцепочечных облигаций S-S).
- Определен аминокислотный состав каждой цепи
- Идентифицированы N-концевой и С-концевой остатки.
- Каждая полипептидная цепь расщепляется на более мелкие фрагменты, и определяется аминокислотный состав и последовательность каждого фрагмента.
- Шаг 5 повторяется с использованием другой процедуры расщепления для создания другого и перекрывающегося набора пептидных фрагментов.
- Полная аминокислотная последовательность белка реконструирована из последовательностей в перекрывающихся фрагментах.
- Позиция S-S находится. (См. Онлайн-набор задач — Белки)
Авторы и авторство
Незаменимые аминокислоты: определение, преимущества и продукты питания
Организму необходимо 20 различных аминокислот для поддержания хорошего здоровья и нормального функционирования. Люди должны получать девять из этих аминокислот, называемых незаменимыми аминокислотами, с пищей. Хорошие диетические источники включают мясо, яйца, тофу, сою, гречку, киноа и молочные продукты.
Люди должны получать девять из этих аминокислот, называемых незаменимыми аминокислотами, с пищей. Хорошие диетические источники включают мясо, яйца, тофу, сою, гречку, киноа и молочные продукты.
Аминокислоты — это соединения, которые образуют белки. Когда человек ест пищу, содержащую белок, его пищеварительная система расщепляет белок на аминокислоты. Затем организм комбинирует аминокислоты различными способами для выполнения функций организма.
Здоровый организм может вырабатывать другие 11 аминокислот, поэтому они обычно не нуждаются в поступлении в организм с пищей.
Аминокислоты укрепляют мышцы, вызывают химические реакции в организме, переносят питательные вещества, предотвращают болезни и выполняют другие функции. Дефицит аминокислот может привести к снижению иммунитета, проблемам с пищеварением, депрессии, проблемам с фертильностью, снижению умственной активности, замедлению роста у детей и многим другим проблемам со здоровьем.
Каждая из незаменимых аминокислот играет различную роль в организме, и симптомы дефицита соответственно различаются.
Существует много типов незаменимых аминокислот, в том числе:
Лизин
Лизин играет жизненно важную роль в наращивании мышц, поддержании прочности костей, помощи в восстановлении после травм или хирургических операций, а также в регулировании гормонов, антител и ферментов.Он также может оказывать противовирусное действие.
Существует не так много исследований дефицита лизина, но исследование на крысах показывает, что дефицит лизина может привести к вызванной стрессом тревоге.
Гистидин
Гистидин способствует росту, образованию клеток крови и восстановлению тканей. Он также помогает поддерживать особое защитное покрытие нервных клеток, которое называется миелиновой оболочкой.
В организме гистидин превращается в гистамин, который имеет решающее значение для иммунитета, репродуктивного здоровья и пищеварения.Результаты исследования, в котором приняли участие женщины с ожирением и метаболическим синдромом, показывают, что добавки гистидина могут снизить ИМТ и инсулинорезистентность.
Дефицит может вызвать анемию, а низкий уровень в крови чаще встречается у людей с артритом и заболеванием почек.
Треонин
Треонин необходим для здоровья кожи и зубов, так как он входит в состав зубной эмали, коллагена и эластина. Он помогает метаболизму жиров и может быть полезен для людей с расстройством желудка, тревожностью и легкой депрессией.
Исследование 2018 года показало, что дефицит треонина у рыб привел к снижению устойчивости этих животных к болезням.
Метионин
Метионин и заменимая аминокислота цистеин играют важную роль в здоровье и эластичности кожи и волос. Метионин также помогает сохранять ногти крепкими. Он способствует правильному всасыванию селена и цинка и удалению тяжелых металлов, таких как свинец и ртуть.
Валин
Валин необходим для умственной сосредоточенности, координации мышц и эмоционального спокойствия.Люди могут использовать добавки валина для роста мышц, восстановления тканей и получения энергии.
Дефицит может вызвать бессонницу и снижение умственной функции.
Изолейцин
Изолейцин способствует заживлению ран, укреплению иммунитета, регуляции уровня сахара в крови и выработке гормонов. Он в основном присутствует в мышечной ткани и регулирует уровень энергии.
Пожилые люди могут быть более подвержены дефициту изолейцина, чем молодые люди. Этот недостаток может вызвать мышечное истощение и тряску.
Лейцин
Лейцин помогает регулировать уровень сахара в крови и способствует росту и восстановлению мышц и костей.Он также необходим для заживления ран и выработки гормона роста.
Дефицит лейцина может привести к кожной сыпи, выпадению волос и усталости.
Фенилаланин
Фенилаланин помогает организму использовать другие аминокислоты, а также белки и ферменты. Организм превращает фенилаланин в тирозин, который необходим для определенных функций мозга.
Дефицит фенилаланина, хотя и встречается редко, может привести к плохой прибавке в весе у младенцев. Это также может вызвать экзему, усталость и проблемы с памятью у взрослых.
Это также может вызвать экзему, усталость и проблемы с памятью у взрослых.
Фенилаланин часто входит в состав искусственного подсластителя аспартама, который производители используют для приготовления диетических газированных напитков. Большие дозы аспартама могут повышать уровень фенилаланина в мозге, вызывать беспокойство и нервозность, а также влиять на сон.
Люди с редким генетическим заболеванием, называемым фенилкетонурией (ФКУ), не могут метаболизировать фенилаланин. В результате им следует избегать употребления продуктов, содержащих высокий уровень этой аминокислоты.
Триптофан
Триптофан необходим для нормального роста младенцев и является предшественником серотонина и мелатонина.Серотонин — нейромедиатор, регулирующий аппетит, сон, настроение и боль. Мелатонин также регулирует сон.
Триптофан является седативным средством и входит в состав некоторых снотворных. Одно исследование показывает, что добавление триптофана может улучшить умственную энергию и эмоциональную обработку у здоровых женщин.
Дефицит триптофана может вызвать состояние, называемое пеллагрой, которое может привести к деменции, кожной сыпи и проблемам с пищеварением.
Многие исследования показывают, что низкий уровень белка и незаменимых аминокислот влияет на мышечную силу и работоспособность.
Согласно исследованию 2014 года, недостаток незаменимых аминокислот может привести к снижению мышечной массы у пожилых людей.
Дополнительное исследование показывает, что аминокислотные добавки могут помочь спортсменам восстановиться после тренировки.
Раньше врачи считали, что за один прием пищи люди должны есть продукты, содержащие все девять незаменимых аминокислот.
В результате, если человек не ел мясо, яйца, молочные продукты, тофу или другую пищу со всеми незаменимыми аминокислотами, необходимо было комбинировать два или более растительных продукта, содержащих все девять, таких как рис и бобы.
Однако сегодня эта рекомендация иная. Люди, которые придерживаются вегетарианской или веганской диеты, могут получать свои незаменимые аминокислоты из различных растительных продуктов в течение дня, и им необязательно есть их все вместе за один прием пищи.
Поделиться на Pinterest Человеку следует поговорить со своим врачом, прежде чем принимать добавки с незаменимыми аминокислотами. Хотя 11 аминокислот не являются незаменимыми, людям могут потребоваться некоторые из них, если они находятся в состоянии стресса или болеют. В это время организм может быть не в состоянии производить достаточное количество этих аминокислот для удовлетворения повышенных потребностей.Эти аминокислоты являются «условными», что означает, что они могут потребоваться человеку в определенных ситуациях.
Иногда люди могут захотеть принимать добавки с незаменимыми аминокислотами. Лучше сначала проконсультироваться с врачом относительно безопасности и дозировки.
Хотя дефицит незаменимых аминокислот возможен, большинство людей может получить их в достаточном количестве, соблюдая диету, включающую белок.
Продукты, указанные в следующем списке, являются наиболее распространенными источниками незаменимых аминокислот:
- Лизин содержится в мясе, яйцах, сое, черной фасоли, киноа и семенах тыквы.

- Мясо, рыба, птица, орехи, семена и цельнозерновые продукты содержат большое количество гистидина.
- Творог и зародыши пшеницы содержат большое количество треонина.
- Метионин содержится в яйцах, зернах, орехах и семенах.
- Валин содержится в сое, сыре, арахисе, грибах, цельнозерновых и овощах.
- Изолейцин в большом количестве содержится в мясе, рыбе, птице, яйцах, сыре, чечевице, орехах и семенах.
- Источниками лейцина являются молочные продукты, соя, фасоль и бобовые.
- Фенилаланин содержится в молочных продуктах, мясе, птице, сое, рыбе, бобах и орехах.
- Триптофан содержится в большинстве продуктов с высоким содержанием белка, включая зародыши пшеницы, творог, курицу и индейку.
Это лишь несколько примеров продуктов, богатых незаменимыми аминокислотами. Все продукты, содержащие белок, будь то растительного или животного происхождения, будут содержать по крайней мере некоторые из незаменимых аминокислот.
Потребление незаменимых аминокислот имеет решающее значение для хорошего здоровья.
Ежедневное употребление разнообразных продуктов, содержащих белок, — лучший способ для людей получить достаточное количество незаменимых аминокислот.При современной диете и доступе к большому разнообразию продуктов дефицит редко встречается у людей с хорошим здоровьем.
Перед приемом пищевых добавок следует всегда проконсультироваться с врачом.
Карточки с аминокислотами
Срок
Определение
Аминогруппа.
Кислотная (карбоксилатная) группа.
Боковая цепь, обозначенная здесь как «R». Это часть, которая варьируется от одной аминокислоты к другой.
Все они присоединены к альфа-атому углерода.
Альфа-углерод хиральный, с S-абсолютной конфигурацией, что делает его L-аминокислотой (кроме случая, когда R = H).
Срок
Какая часть аминокислоты какая? (Основная, кислая и т. Д.)?
Определение
Обратите внимание, что аминогруппа является основной, а карбоксилатная группа является кислой.Это означает, что они могут существовать как в нейтральной, так и в ионной (заряженной) форме.
flashcardmachine.com/images/preview_card_back.gif»>
Срок
При PH 7, какова будет чистая плата?
Определение
при нейтральном pH (7,0) или pH тела (7,3-7,4) свободная аминокислота будет иметь протонированную аминогруппу и ионизированную карбоксилатную группу, поэтому чистый заряд (без учета боковой цепи) будет нуль.
Срок
Какие аминокислоты знаковые / заряженные?
flashcardmachine.com/images/preview_card_back.gif»>
Определение
Ионный / заряженный (Asp, Glu, His, Lys, Arg)
Термин
Какие аминокислоты полярны, но не заряжены?
Определение
Полярный, но не заряженный (Ser, Thr, Cys, Asn, Gln)
flashcardmachine.com/images/preview_card_back.gif»>
Термин
Какие аминокислоты большие с нейтральными боковыми цепями?
Определение
Гидрофобный, с большой нейтральной боковой цепью (Trp, Phe, Tyr, Leu, Ile, Val, Met, Pro)
Термин
Какие аминокислоты имеют небольшие нейтральные боковые цепи?
flashcardmachine.com/images/preview_card_back.gif»>
Определение
Малая нейтральная боковая цепь (Gly, Ala)
Срок
Определение
Тирозин имеет гидрофобное ароматическое кольцо, но также имеет полярную группу -ОН, поэтому некоторые тексты относят его к категории «полярных».И группа -ОН может ионизировать (возможно, 1% при нейтральном pH.
Срок
Тест на аминокислоты, пептиды, белки Карточки от Кэти Тран
Знание Геном TM
Сертифицировано Brainscape
Просмотрите более 1 миллиона курсов, созданных лучшими студентами, профессорами, издателями и экспертами, которые охватывают весь мир «усваиваемых» знаний.
Вступительные экзамены
Экзамены уровня A
Экзамены AP
Экзамены GCSE
Вступительные экзамены в магистратуру
Экзамены IGCSE
Международный Бакалавриат
5 национальных экзаменов
Вступительные экзамены в университет
Профессиональные сертификаты
Бар экзамен
Водитель Эд
Финансовые экзамены
Сертификаты управления
Медицинские и сестринские сертификаты
Военные экзамены
MPRE
Другие сертификаты
Сертификаты технологий
TOEFL
Иностранные языки
арабский
китайский язык
французкий язык
Немецкий
иврит
Итальянский
Японский
корейский язык
Лингвистика
Другие иностранные языки
португальский
русский
испанский
TOEFL
Наука
Анатомия
Астрономия
Биохимия
Биология
Клеточная биология
Химия
науки о Земле
Наука об окружающей среде
Генетика
Геология
Наука о жизни
Морская биология
Метеорология
Микробиология
Молекулярная биология
Естественные науки
Океанография
Органическая химия
Периодическая таблица
Физическая наука
Физика
Физиология
Растениеводство
Класс науки
Зоология
Английский
Американская литература
Британская литература
Классические романы
Писательское творчество
английский
Английская грамматика
Фантастика
Высший английский
Литература
Средневековая литература
Акустика
Поэзия
Пословицы и идиомы
Шекспир
Орфография
Vocab Builder
Гуманитарные и социальные исследования
Антропология
Гражданство
Гражданское
Классика
Связь
Консультации
Уголовное правосудие
География
История
Философия
Политическая наука
Психология
Религия и Библия
Социальные исследования
Социальная работа
Социология
Математика
Алгебра
Алгебра II
Арифметика
Исчисление
Геометрия
Линейная алгебра
Математика
Таблицы умножения
Precalculus
Вероятность
Статистические методы
Статистика
Тригонометрия
Медицина и уход
Анатомия
Системы тела
Стоматология
Медицинские курсы и предметные области
Медицинские осмотры
Медицинские специальности
Медицинская терминология
Разные темы здравоохранения
Курсы медсестер и предметные области
Медсестринские специальности
Другие области здравоохранения
Фармакология
Физиология
Радиология и диагностическая визуализация
Ветеринарная
Профессии
ASVAB
Автомобильная промышленность
Авиация
Парикмахерская
Катание на лодках
Косметология
Бриллианты
Электрические
Электрик
Пожаротушение
Садоводство
Домашняя экономика
Садоводство
HVAC
Дизайн интерьера
Ландшафтная архитектура
Массажная терапия
Металлургия
Военные
Борьба с вредителями
Сантехника
Полицейская
Сточные Воды
Сварка
Закон
Закон Австралии
Банкротство
Бар экзамен
Предпринимательское право
Экзамен в адвокатуру Калифорнии
Экзамен CIPP
Гражданский процесс
Конституционное право
Договорное право
Корпоративное право
Уголовное право
Доказательства
Семейное право
Экзамен в адвокатуру Флориды
Страховое право
Интеллектуальная собственность
Международный закон
Закон
Закон и этика
Правовые исследования
Судебные разбирательства
MBE
MPRE
Закон о аптеках
Право собственности
Закон о недвижимости
Экзамен в адвокатуре Техаса
Проступки
Трасты и имения
Здоровье и фитнес
Нетрадиционная медицина
Класс здоровья и фитнеса
Здоровье и человеческое развитие
Урок здоровья
Наука о здоровье
Человеческое развитие
Человеческий рост и развитие
Душевное здоровье
Здравоохранение
Спорт и кинезиология
Йога
Бизнес и финансы
Бухгалтерский учет
Бизнес
Экономика
Финансы
Управление
Маркетинг
Недвижимость
Технологии и машиностроение
Архитектура
Биотехнологии
Компьютерное программирование
Информационные технологии
Инженерное дело
Графический дизайн
Информационной безопасности
Информационные технологии
Информационные системы управления
Еда и напитки
Бармен
Готовка
Кулинарное искусство
Гостеприимство
Питание
Вино
Изобразительное искусство
Изобразительное искусство
История искусства
Танец
Музыка
Другое изобразительное искусство
Случайное знание
Астрология
Блэк Джек
Культурная грамотность
Знание реабилитации
Мифология
Национальные столицы
Люди, которых вы должны знать
Покер
Чаша для викторины
Спортивные викторины
Карты Таро
аминокислот | BioNinja
Понимание:
• В полипептидах, синтезированных на рибосомах
, есть 20 различных аминокислот.
Белки состоят из длинных цепочек повторяющихся мономеров, называемых аминокислотами
Все аминокислоты имеют общую основную структуру с центральным атомом углерода, связанным с:
- Аминовая группа (NH 2 )
- Карбоновая кислота группа (COOH)
- Атом водорода (H)
- Вариабельная боковая цепь (R)
Структура обобщенной аминокислоты
Существует 20 различных аминокислот, универсальных для всех живых организмов
- Еще две — селеноцистеин и пирролизин — являются модифицированными вариантами, обнаруженными только в определенных организмах
Понимание:
• Аминокислоты могут быть связаны друг с другом в любой последовательности, что дает огромный диапазон возможных полипептидов
Аминокислоты соединяются на рибосоме с образованием длинных цепей, называемых полипептидами , которые составляют белки
Каждый тип аминокислот отличается по составу вариабельной боковой цепи
Эти боковые цепи будут иметь различные химические свойства ( е.
 Известно около 700 небелковых аминокислот, из которых около 300 — растительного происхождения. Их пути происхождения включают модификацию существующей аминокислоты или пути, или их собственные новые пути.
Известно около 700 небелковых аминокислот, из которых около 300 — растительного происхождения. Их пути происхождения включают модификацию существующей аминокислоты или пути, или их собственные новые пути. Например, если иммунная система нарушена, организм может бороться с выработкой определенных аминокислот. Следовательно, диета становится необходимым источником этих аминокислот.
Например, если иммунная система нарушена, организм может бороться с выработкой определенных аминокислот. Следовательно, диета становится необходимым источником этих аминокислот. Аминокислотный анализ и химическое секвенирование
Аминокислотный анализ и химическое секвенирование 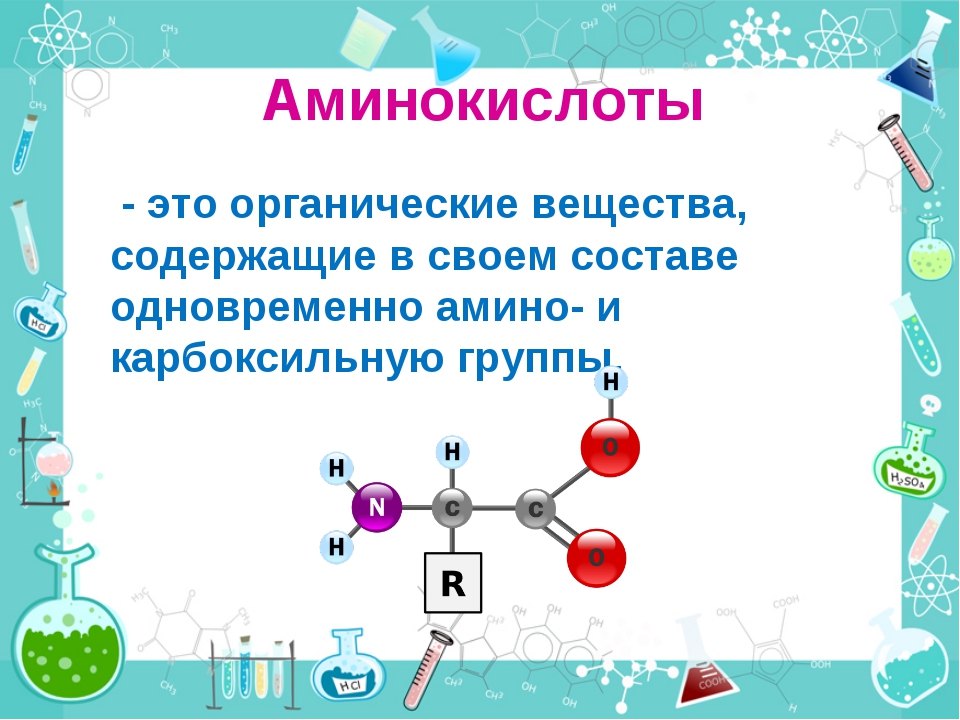
 Кроме того, амидные звенья в боковых цепях Gln и Asn гидролизуются с образованием Glu и Asp соответственно.
Кроме того, амидные звенья в боковых цепях Gln и Asn гидролизуются с образованием Glu и Asp соответственно. Необходимо пройти курс времени, чтобы увидеть, какая аминокислота высвобождается первой. N-концевой анализ также может быть выполнен как часть секвенирования всего белка, как обсуждается ниже (реакция деградации Эдмана).
Необходимо пройти курс времени, чтобы увидеть, какая аминокислота высвобождается первой. N-концевой анализ также может быть выполнен как часть секвенирования всего белка, как обсуждается ниже (реакция деградации Эдмана). В результате происходит внутримолекулярная циклизация и расщепление N-концевой аминокислоты, которая может быть отмыта от адсорбированного белка и обнаружена с помощью анализа ВЭЖХ.Выход в этой технике близок к 100%. Однако со временем накапливается больше цепей, в которых N-концевая аминокислота не удалена. Если его удалить на следующем этапе, две аминокислоты будут элюированы, создавая увеличивающийся «шум» на этапе элюирования, то есть будет обнаружено более 1 производного аминокислоты. Следовательно, максимальная длина пептида, который можно секвенировать, составляет около 50 аминокислот. Большинство белков больше этого размера. Следовательно, прежде чем белок может быть секвенирован, он должен быть расщеплен определенными ферментами, называемыми эндопротеазами, которые расщепляют белки после определенных боковых цепей.Например, трипсин расщепляет белки в цепи после Lys и Arg, тогда как химотрипсин расщепляет после ароматических аминокислот, таких как Trp, Tyr и Phe. Также можно использовать химическое расщепление небольшими молекулами.
В результате происходит внутримолекулярная циклизация и расщепление N-концевой аминокислоты, которая может быть отмыта от адсорбированного белка и обнаружена с помощью анализа ВЭЖХ.Выход в этой технике близок к 100%. Однако со временем накапливается больше цепей, в которых N-концевая аминокислота не удалена. Если его удалить на следующем этапе, две аминокислоты будут элюированы, создавая увеличивающийся «шум» на этапе элюирования, то есть будет обнаружено более 1 производного аминокислоты. Следовательно, максимальная длина пептида, который можно секвенировать, составляет около 50 аминокислот. Большинство белков больше этого размера. Следовательно, прежде чем белок может быть секвенирован, он должен быть расщеплен определенными ферментами, называемыми эндопротеазами, которые расщепляют белки после определенных боковых цепей.Например, трипсин расщепляет белки в цепи после Lys и Arg, тогда как химотрипсин расщепляет после ароматических аминокислот, таких как Trp, Tyr и Phe. Также можно использовать химическое расщепление небольшими молекулами. Цианогенбромид, CNBr, расщепляет белки после боковых цепей метионина. Отдельные белки необходимо расщеплять двумя разными методами, каждый пептидный фрагмент выделять и секвенировать. Затем порядок расщепленных пептидов с известной последовательностью может быть соединен вместе путем сравнения пептидных последовательностей, полученных с использованием различных методов расщепления.Многие белки также имеют дисульфидные связи, соединяющие боковые цепи Cys, удаленные друг от друга в полипептидной цепи. Протеолитическое или химическое расщепление белка привело бы к образованию фрагмента, содержащего два пептида, связанных дисульфидами. Деграция Эдмана высвободит из таких фрагментов две аминокислоты. Чтобы избежать этой проблемы, белок окисляют пермуравьиной кислотой, которая необратимо окисляет свободный Cys или дисульфиды Cys-Cys до остатков цистеиновой кислоты. Краткое описание этапов секвенирования белков показано ниже:
Цианогенбромид, CNBr, расщепляет белки после боковых цепей метионина. Отдельные белки необходимо расщеплять двумя разными методами, каждый пептидный фрагмент выделять и секвенировать. Затем порядок расщепленных пептидов с известной последовательностью может быть соединен вместе путем сравнения пептидных последовательностей, полученных с использованием различных методов расщепления.Многие белки также имеют дисульфидные связи, соединяющие боковые цепи Cys, удаленные друг от друга в полипептидной цепи. Протеолитическое или химическое расщепление белка привело бы к образованию фрагмента, содержащего два пептида, связанных дисульфидами. Деграция Эдмана высвободит из таких фрагментов две аминокислоты. Чтобы избежать этой проблемы, белок окисляют пермуравьиной кислотой, которая необратимо окисляет свободный Cys или дисульфиды Cys-Cys до остатков цистеиновой кислоты. Краткое описание этапов секвенирования белков показано ниже: Если дисульфидные связи соединяют две разные цепи, связь S-S должна быть расщеплена (как описано на этапе 2) и каждый пептид очищен независимо.
Если дисульфидные связи соединяют две разные цепи, связь S-S должна быть расщеплена (как описано на этапе 2) и каждый пептид очищен независимо.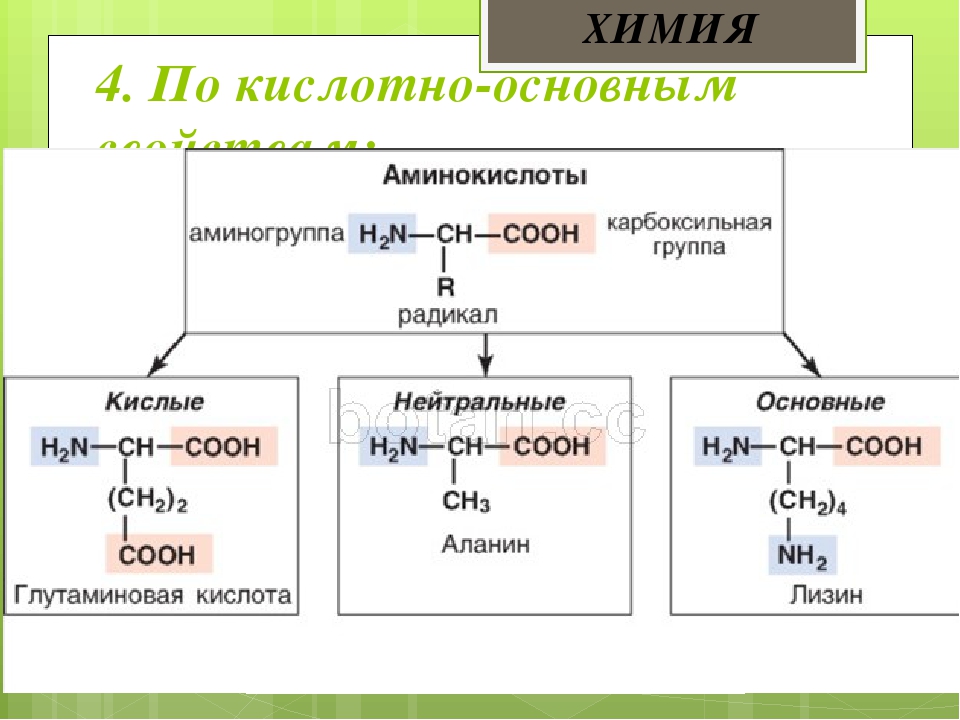 Люди должны получать девять из этих аминокислот, называемых незаменимыми аминокислотами, с пищей. Хорошие диетические источники включают мясо, яйца, тофу, сою, гречку, киноа и молочные продукты.
Люди должны получать девять из этих аминокислот, называемых незаменимыми аминокислотами, с пищей. Хорошие диетические источники включают мясо, яйца, тофу, сою, гречку, киноа и молочные продукты.


 Это также может вызвать экзему, усталость и проблемы с памятью у взрослых.
Это также может вызвать экзему, усталость и проблемы с памятью у взрослых.

| Аминогруппа. Кислотная (карбоксилатная) группа. Боковая цепь, обозначенная здесь как «R». Это часть, которая варьируется от одной аминокислоты к другой. 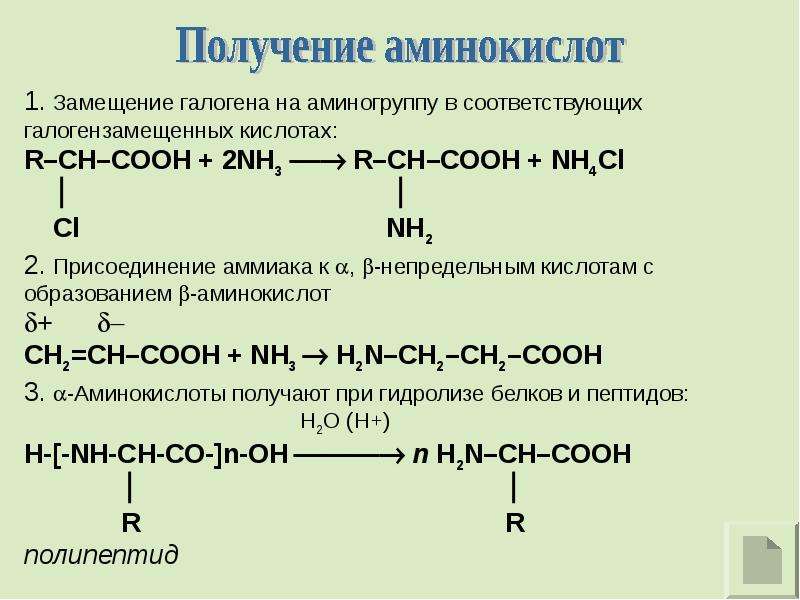 Все они присоединены к альфа-атому углерода. Альфа-углерод хиральный, с S-абсолютной конфигурацией, что делает его L-аминокислотой (кроме случая, когда R = H). |
| Какая часть аминокислоты какая? (Основная, кислая и т. Д.)? |
| Обратите внимание, что аминогруппа является основной, а карбоксилатная группа является кислой.Это означает, что они могут существовать как в нейтральной, так и в ионной (заряженной) форме. |
| При PH 7, какова будет чистая плата? |
| при нейтральном pH (7,0) или pH тела (7,3-7,4) свободная аминокислота будет иметь протонированную аминогруппу и ионизированную карбоксилатную группу, поэтому чистый заряд (без учета боковой цепи) будет нуль. |
| Какие аминокислоты знаковые / заряженные? |
| Ионный / заряженный (Asp, Glu, His, Lys, Arg) |
| Какие аминокислоты полярны, но не заряжены? |
| Полярный, но не заряженный (Ser, Thr, Cys, Asn, Gln) |
| Какие аминокислоты большие с нейтральными боковыми цепями? |
| Гидрофобный, с большой нейтральной боковой цепью (Trp, Phe, Tyr, Leu, Ile, Val, Met, Pro) |
| Какие аминокислоты имеют небольшие нейтральные боковые цепи? |
| Малая нейтральная боковая цепь (Gly, Ala) |
| Тирозин имеет гидрофобное ароматическое кольцо, но также имеет полярную группу -ОН, поэтому некоторые тексты относят его к категории «полярных».И группа -ОН может ионизировать (возможно, 1% при нейтральном pH. |
Вступительные экзамены
Экзамены уровня A
Экзамены AP
Экзамены GCSE
Вступительные экзамены в магистратуру
Экзамены IGCSE
Международный Бакалавриат
5 национальных экзаменов
Вступительные экзамены в университет
Профессиональные сертификаты
Бар экзамен
Водитель Эд
Финансовые экзамены
Сертификаты управления
Медицинские и сестринские сертификаты
Военные экзамены
MPRE
Другие сертификаты
Сертификаты технологий
TOEFL
Иностранные языки
арабский
китайский язык
французкий язык
Немецкий
иврит
Итальянский
Японский
корейский язык
Лингвистика
Другие иностранные языки
португальский
русский
испанский
TOEFL
Наука
Анатомия
Астрономия
Биохимия
Биология
Клеточная биология
Химия
науки о Земле
Наука об окружающей среде
Генетика
Геология
Наука о жизни
Морская биология
Метеорология
Микробиология
Молекулярная биология
Естественные науки
Океанография
Органическая химия
Периодическая таблица
Физическая наука
Физика
Физиология
Растениеводство
Класс науки
Зоология
Английский
Американская литература
Британская литература
Классические романы
Писательское творчество
английский
Английская грамматика
Фантастика
Высший английский
Литература
Средневековая литература
Акустика
Поэзия
Пословицы и идиомы
Шекспир
Орфография
Vocab Builder
Гуманитарные и социальные исследования
Антропология
Гражданство
Гражданское
Классика
Связь
Консультации
Уголовное правосудие
География
История
Философия
Политическая наука
Психология
Религия и Библия
Социальные исследования
Социальная работа
Социология
Математика
Алгебра
Алгебра II
Арифметика
Исчисление
Геометрия
Линейная алгебра
Математика
Таблицы умножения
Precalculus
Вероятность
Статистические методы
Статистика
Тригонометрия
Медицина и уход
Анатомия
Системы тела
Стоматология
Медицинские курсы и предметные области
Медицинские осмотры
Медицинские специальности
Медицинская терминология
Разные темы здравоохранения
Курсы медсестер и предметные области
Медсестринские специальности
Другие области здравоохранения
Фармакология
Физиология
Радиология и диагностическая визуализация
Ветеринарная
Профессии
ASVAB
Автомобильная промышленность
Авиация
Парикмахерская
Катание на лодках
Косметология
Бриллианты
Электрические
Электрик
Пожаротушение
Садоводство
Домашняя экономика
Садоводство
HVAC
Дизайн интерьера
Ландшафтная архитектура
Массажная терапия
Металлургия
Военные
Борьба с вредителями
Сантехника
Полицейская
Сточные Воды
Сварка
Закон
Закон Австралии
Банкротство
Бар экзамен
Предпринимательское право
Экзамен в адвокатуру Калифорнии
Экзамен CIPP
Гражданский процесс
Конституционное право
Договорное право
Корпоративное право
Уголовное право
Доказательства
Семейное право
Экзамен в адвокатуру Флориды
Страховое право
Интеллектуальная собственность
Международный закон
Закон
Закон и этика
Правовые исследования
Судебные разбирательства
MBE
MPRE
Закон о аптеках
Право собственности
Закон о недвижимости
Экзамен в адвокатуре Техаса
Проступки
Трасты и имения
Здоровье и фитнес
Нетрадиционная медицина
Класс здоровья и фитнеса
Здоровье и человеческое развитие
Урок здоровья
Наука о здоровье
Человеческое развитие
Человеческий рост и развитие
Душевное здоровье
Здравоохранение
Спорт и кинезиология
Йога
Бизнес и финансы
Бухгалтерский учет
Бизнес
Экономика
Финансы
Управление
Маркетинг
Недвижимость
Технологии и машиностроение
Архитектура
Биотехнологии
Компьютерное программирование
Информационные технологии
Инженерное дело
Графический дизайн
Информационной безопасности
Информационные технологии
Информационные системы управления
Еда и напитки
Бармен
Готовка
Кулинарное искусство
Гостеприимство
Питание
Вино
Изобразительное искусство
Изобразительное искусство
История искусства
Танец
Музыка
Другое изобразительное искусство
Случайное знание
Астрология
Блэк Джек
Культурная грамотность
Знание реабилитации
Мифология
Национальные столицы
Люди, которых вы должны знать
Покер
Чаша для викторины
Спортивные викторины
Карты Таро
Белки состоят из длинных цепочек повторяющихся мономеров, называемых аминокислотами
Аминокислоты соединяются на рибосоме с образованием длинных цепей, называемых полипептидами , которые составляют белки
