Белки это определение: Белки, жиры, углеводы. Справка — РИА Новости, 23.08.2010
Определение содержание органического белка в пищевых продуктах: какой метод выбрать?
При выборе наиболее оптимального метода определения белка в пищевых продуктах особое внимание следует уделить его безопасности для оператора и окружающей среды, времени анализа, вопросу подготовки специалиста, соответствию международным стандартам и пр. Кроме того, выбор должен базироваться на возможностях лаборатории в подборе оборудования, соответствующего поставленным задачам. Предлагаем Вам посмотреть видео, или прочесть статью.
Также предлагаем почитать подробную информацию о методе Кьельдаля и оборудовании для его реализации на специализированном сайте apk.hlr по ссылке. Детально о методе Дюма Вы можете почитать тут.
Определение содержание органического белка методом Кьельдаля
Метод был разработан в 1883 году датским химиком Иоганном Кьельдалем в лаборатории Carlsberg. Он позволяет количественно определять содержание органического белка в пробе. Основан на разрушении пептидной связи с последующим высвобождением молекулы азота и его количественного анализа с помощью титрования.
Он позволяет количественно определять содержание органического белка в пробе. Основан на разрушении пептидной связи с последующим высвобождением молекулы азота и его количественного анализа с помощью титрования.
Классический метод Кьельдаля предусматривает три простых этапа: разложение, дистилляцию и титрование. После титрования использованное количество титранта соответствует концентрации азота, который был в образце. Перерасчет на белок происходит с помощью коэффициента перерасчета F (6,25 = 0,16 г азота на 1 г белка). Полное время анализа одного составляет образца составляет около 2 часов. Метод достаточно чувствительный, предел определения – 0,1 мг азота.
Нагреватели, колбы, стеклянные холодильники – когда метод только открыли, все исполнялось исключительно в ручном режиме. Сегодня же все три этапа – разложение, дистилляция и титрование – могут быть легко выполнены с помощью автоматических систем для анализа белка по Кьельдалю:
- Минерализатора для разложения образца.

- Дистиллятора для отгонки аммиака.
- Скруббера для нейтрализации газов.
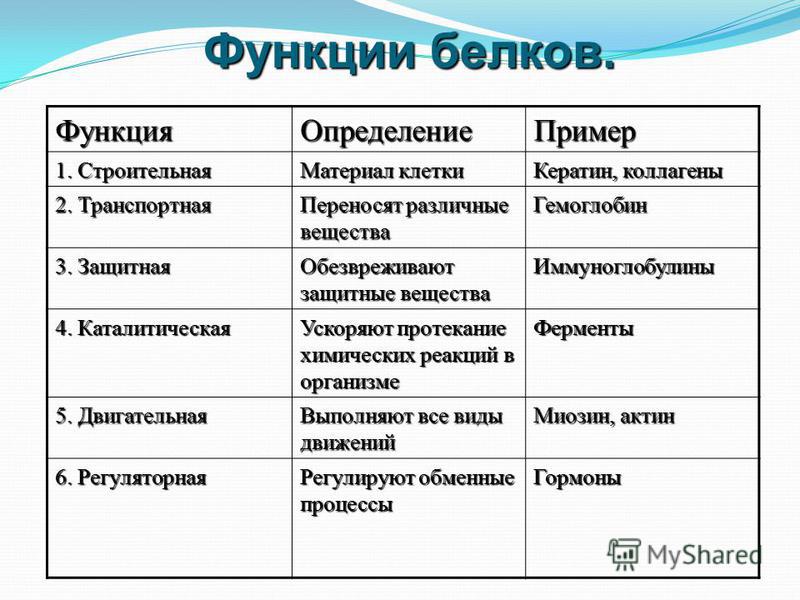
Преимущества метода Кьельдаля:
- Это референтный метод, который соответствует всем международным стандартам.
- Доступность оборудования, возможность поэтапной комплектации. Например, сначала можно приобрести анализатор, а потом дистиллятор.
- Все современные приборы анализа белка по методу ИК-спектрометрии калибруются на основе метода Кьедаля как эталонного.
Определение содержание органического белка методом Дюма
Создан химиком Жаном Батистом Дюма в 1848 году. Метод обеспечивает определение общего азота в образце благодаря его полному сжиганию в сфере кислорода. Является альтернативой методу Кьельдаля. Но кроме органического определяет еще и неорганический азот.
Как и по Кьельдалю, так и по Дюма используются коэффициенты пересчета азота на белок. После открытия метод Дюма широкого распространения не получил. Возможно из-за того, что физически выполнить его сложнее. Он предполагает очень высокую температуру сгорания – около 1000-1300 ⁰С.
Он предполагает очень высокую температуру сгорания – около 1000-1300 ⁰С.
Сегодня различные производители предлагают анализаторы по этому методу. Как они работают?
Вы берете образец (достаточно 100 мг, чтобы провести анализ) и заворачиваете его в фольгу. Он сгорает при высокой температуре. Далее образец восстанавливается в следующей камере, где есть соединения меди. Потом азот проходит очищение: побочные продукты сгорания абсорбируются путем прохождения через скрубберы. В результате получаем чистый восстановленный азот, который определяется с помощью детектора теплопроводимости (TCD).
Преимущества метода Дюма:
- Нет необходимости использовать прекурсоры, а значит, оформлять горы документации.
- Отсутствие потери азота на стадии переноса образцов.
- Существенно короче время анализа, включая этап пробоподготовки: Дюма – до 1 часа, Кьельдаля – до 3 часов.
- Исключение ошибки оператора. Забота о его здоровье и состоянии окружающей среды.
Сравнение методов Дюма и Кьельдаля
Метод Дюма | Метод Кьельдаля |
| Высокая производительность | Относительно низкая производительность |
| Короткое время анализа | Значительные затраты времени |
| Отсутствие больших затрат на обслуживание | Доступное по стоимости оборудование |
| Работает без присмотра | Требует вмешательство оператора |
| Отсутствие кислот или другой мокрой химии | Использование кислот и щелочей |
| Отсутствие вредных выбросов | Дорогостоящая утилизация выбросов |
Определение содержание органического белка экспресс-методом NIR-спектрометрии
Инфракрасное излучение с помощью светофильтров открыл Уильям Гершель в 1800 году. Прорыв в NIR-спектрометрии был сделан благодаря работе Уильяма Эбнея и Эдварда Фестинга. Они первыми сняли ИК-спектр органической жидкости в диапазоне 1-1,2 µм в 1881 году.
Прорыв в NIR-спектрометрии был сделан благодаря работе Уильяма Эбнея и Эдварда Фестинга. Они первыми сняли ИК-спектр органической жидкости в диапазоне 1-1,2 µм в 1881 году.
В основе метода лежит пропускание или отражение в ближнем инфракрасном диапазоне и последующее сравнение полученного спектра с результатами базы данных калибровок.
Главные преимущества метода ИК-спектрометрии:
- Значительное меньшие затраты времени по сравнению с другими методами: полный анализ можно сделать за 10 минут.
- За короткое время можно получить большое количество показателей.
- Отсутствие расходных материалов или реактивов.
- Малые затраты труда.
- Высокая точность может быть достигнута постоянным усовершенствованием калибровок.
Этот метод наиболее востребован на производстве цельнозерновых, комбикормов и мукомольной продукции.
Лидер среди предлагаемого на рынке оборудования NIR-спектрометрии – Infratec 1241/Nova от компании FOSS. Наличие в приборе большой базы калибровок, а также специальных модулей и кювет позволяет очень точно определять: влажность, белок, жир, зольность, клейковину, крахмал, бушельный вес, абсорбционную способность муки после помола и многие другие показатели.
Где еще используется NIR-спектрометрия?
| Этап | Продукты/Напитки | Корма для животных |
| R&D | Разработка продукта | Разработка рецептуры |
| Хранение | Определение качества сырья, проверка товаров | Определение качества сырья, проверка товаров |
| Производство | Контроль промежуточных этапов производства | Оптимизация рецептуры |
| Готовая продукция | Проверка соответствия состава маркировке | Соответствие маркировке |
Особенно важно использовать эффективный экспресс-метод для готовой продукции. Это дает возможность за короткий промежуток времени увидеть, насколько завершенным является ваш конечный продукт.
Явные преимущества перед методами Къельдаля и Дюма
- Метод ИК-спектрометрии предполагает анализ без разрушения образца.

- Отсутствует пробоподготовка, а результаты вы получите уже через 20-40 секунд.
- При анализе содержания белка методом ИК-спектрометрии не нужны расходные материалы.
- Нет необходимости специально обучать оператора – все операции здесь предельно просты.
- Прибор вы можете использовать как в лаборатории, так и на производстве.
- Отсутствие прекурсоров и вреда для окружающей среды избавляет от необходимости оформления большого количества документов.
- В отличие от двух других описанных методов ИК-спектрометрия не предполагает использования высоких температур.
| Обозначения | Кьельдаля | Дюма | ИК-спектрометрия |
| Представление образца | Разрушение (сжигание) | Разрушение (сжигание) | Без разрушения |
| Пробоподготовка | Да | Да | Отсутствует |
| Время анализа | 2-4 ч | 5 мин (подготовка – 1 час) | 20-40 с |
| Необходимость расходных материалов | Да | Да | Отсутствует |
| Подготовка специалиста | Высокая | Высокая | Низкая или отсутствует |
| Место анализа | Лаборатория | Лаборатория | Лаборатория или производство |
| Необходимость прекурсоров | Да | Нет | Нет |
| Работа с высокой температурой | Да (420 ⁰С) | Да (900 ⁰С) | Нет |
| Вред для окружающей среды | Высокий | Средний | Отсутствует |
Таким образом, владея полной информацией о возможностях и недостатках каждого метода и оценив задачи и объем работы собственной лаборатории, производитель сможет выбрать наиболее подходящий метод количественного определения белка и соответствующее оборудование для его надлежащего выполнения. А значит – доказать качество и установить правильную цену на свою продукцию.
А значит – доказать качество и установить правильную цену на свою продукцию.
Анар Рахметов,
эксперт группы пищевых технологий
ООО «ХИМЛАБОРРЕАКТИВ»
Справочная информация: Оборудование для определения белка в пищевых продуктах:
Белки острой фазы и маркеры воспаления
Воспаление – это основная защитная реакция организма на внедрение чужеродного агента, введение антигена или физическое повреждение тканей.
Острофазные белки – это белки коагуляции, транспортные белки, которые также выполняют функции медиаторов иммунной системы. Они синтезируются в печени, их концентрация существенно изменяется и зависит от стадии, течения заболевания и массивности повреждения, что и определяет ценность этих тестов для клинической лабораторной диагностики.
В Клинико-диагностической лаборатории производится определение следующих острофазных белков и маркеров воспаления:
- С-реактивный белок (СРБ) – один из самых чувствительных и ранних индикаторов воспаления.
 Часто используется для диагностики и мониторинга различных воспалительных процессов, дифференциальной диагностики между бактериальной и вирусной инфекциями, обнаружения послеоперационных осложнений, мониторинга эффективности лечебных мероприятий.
Часто используется для диагностики и мониторинга различных воспалительных процессов, дифференциальной диагностики между бактериальной и вирусной инфекциями, обнаружения послеоперационных осложнений, мониторинга эффективности лечебных мероприятий. - Гаптоглобин – увеличение содержания его в крови отмечается при острых воспалительных процессах, опухолях, нефротическом синдроме.
- Церрулоплазмин – возрастание его уровня наблюдается при острых и хронических инфекциях, циррозе печени, гепатитах, инфаркте миокарда, системных заболеваниях, злокачественных новообразованиях (в 1,5-2 раза).
- Определяются иммуноглобулины классов А, М и G (Ig A, Ig M, Ig G
Диагностика ревматизма
ASO (антистрептолизин) – является лабораторным критерием ревматизма.Повышение свидетельствует о сенсибилизации организма к стрептококковым антигенам. В период реконвалесценции показатель снижается по сравнению с острым периодом, поэтому может использоваться для наблюдения за динамикой течения, оценки степени активности ревматического процесса.
Ревматоидный фактор – определяется у больных ревматоидным артритом. Также обнаруживается у людей с иными видами аутоиммунной и хронической воспалительной патологией.
Белок общий в сыворотке
Это измерение концентрации суммарного белка (альбумины + глобулины) в жидкой части крови, результаты которого характеризуют обмен белков в организме.
Синонимы русские
Общий белок, общий белок сыворотки крови.
Синонимы английские
Total Protein, Serum Тotal Protein, Total Serum Protein, TProt, ТР.
Метод исследования
Колориметрический фотометрический метод.
Единицы измерения
Г/л (грамм на литр).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?

- Исключить физическое и эмоциональное перенапряжение за 30 минут до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Общее содержание белка в сыворотке крови отражает состояние белкового обмена.
Белки преобладают в составе плотного остатка сыворотки крови (жидкой части, не содержащей клеточных элементов). Они служат основным строительным материалом для всех клеток и тканей тела. Из белков построены ферменты, многие гормоны, антитела и факторы свертывания крови. Помимо этого, они выполняют функцию переносчиков гормонов, витаминов, минералов, жироподобных субстанций и других компонентов обмена веществ в крови, а также обеспечивают их транспортировку внутрь клеток. От количества белков в сыворотке зависит осмотическое давление крови, благодаря которому поддерживается баланс между содержанием воды в тканях тела и внутри сосудистого русла. Оно определяет способность воды удерживаться в составе циркулирующей крови и поддерживать упругость тканей.
Отклонение уровня общего белка крови от нормы может быть вызвано рядом физиологических состояний (не патологического характера) или являться симптомом различных заболеваний. Принято различать относительное отклонение (связанное с изменением содержания воды в циркулирующей крови) и абсолютное (вызванное изменениями в обмене – скорости синтеза/распада – сывороточных белков).
- Физиологическая абсолютная гипопротеинемия может возникать при длительном постельном режиме, у женщин во время беременности (особенно в ее последней трети) и кормления грудью, у детей в раннем возрасте, то есть в условиях недостаточного поступления белка с пищей или повышенной потребности в нем.
 В этих случаях показатель общего белка в крови снижается.
В этих случаях показатель общего белка в крови снижается. - Развитие физиологической относительной гипопротеинемии (понижения уровня общего белка в крови) связано с избыточным поступлением жидкости (повышенной водной нагрузкой).
- Относительная гиперпротеинемия (повышение уровня общего белка в крови) может быть вызвана избыточной потерей воды, как, например, при обильном потоотделении.
- Относительная патологическая (связанная с каким-либо заболеванием) гиперпротеинемия обусловлена значительной потерей жидкости и сгущением крови (при обильной рвоте, поносе или хроническом нефрите).
- Патологическая относительная гипопротеинемия наблюдается в обратных случаях – при избыточной задержке жидкости в циркулирующей крови (нарушение работы почек, ухудшение работы сердца, некоторые гормональные нарушения и т. д.).
- Абсолютное повышение общего белка крови может возникать при острых и хронических инфекционных заболеваниях из-за усиленной продукции иммунных глобулинов, при некоторых редких расстройствах здоровья, характеризующихся интенсивным синтезом ненормальных белков (парапротеинов), при заболеваниях печени и др.

Наибольшее клиническое значение имеет абсолютная гипопротеинемия. Абсолютное снижение концентрации общего белка в крови чаще всего происходит за счет уменьшения количества альбуминов. Нормальный уровень альбуминов в крови является показателем хорошего здоровья и правильного обмена веществ, и наоборот, пониженный говорит о низкой жизнеспособности организма. При этом потеря / разрушение / недостаточный синтез альбуминов является признаком и показателем степени тяжести некоторых заболеваний. Таким образом, анализ на общий белок крови позволяет выявить существенное снижение жизнеспособности организма в связи с какими-либо важными для здоровья причинами или сделать первый шаг в диагностике заболевания, связанного с нарушением белкового обмена.
Истощение запасов альбумина в крови может происходить при недоедании, заболеваниях желудочно-кишечного тракта и трудностях в усвоении пищи, хронических интоксикациях.
К заболеваниям, связанным с уменьшением количества альбуминов крови, относятся некоторые нарушения в работе печени (снижение синтеза белка в ней), почек (потеря альбуминов с мочой в результате нарушения механизма фильтрации крови в почках), определенные эндокринные расстройства (нарушения гормональной регуляции белкового обмена).
Для чего используется исследование?
- Как часть первого этапа комплексного обследования в процессе диагностики различных нарушений здоровья.
- Для выявления и оценки степени тяжести нарушений питания (при интоксикациях, недоедании, заболеваниях желудочно-кишечного тракта).
- В целях диагностики различных заболеваний, связанных с нарушениями белкового обмена, и для оценки эффективности их лечения.
- Для контроля за физиологическими функциями в процессе длительных клинических наблюдений.
- Для оценки функциональных резервов организма в связи с прогнозом в отношении текущего заболевания или предстоящими лечебными процедурами (лекарственная терапия, хирургическое вмешательство).
Когда назначается исследование?
- При первичной диагностике какого-либо заболевания.
- При симптомах истощения.
- При подозрении на заболевание, связанное с какими-либо нарушениями белкового обмена.

- Когда оценивают состояние обмена веществ или щитовидной железы.
- При обследовании функции печени или почек.
- При длительном клиническом наблюдении за ходом лечения заболеваний, связанных с нарушениями белкового обмена.
- Когда рассматривается возможность проведения хирургической операции.
- При профилактическом обследовании.
Что означают результаты?
Референсные значения (норма общего белка в крови)
|
Возраст |
Референсные значения |
|
0 — 7 мес. |
44 – 76 г/л |
|
7 — 12 мес. |
51 — 73 г/л |
|
1 — 3 года |
56 — 75 г/л |
|
3 — 18 лет |
60 — 80 г/л |
|
> 18 лет |
64 — 83 г/л |
Результаты анализа на общий белок в сыворотке крови позволяют оценить состояние здоровья, рациональность питания и функцию внутренних органов по эффективности их работы в отношении поддержания нормального белкового обмена. Если выявлено отклонение от нормы, для уточнения его причины требуется дальнейшее обследование.
Если выявлено отклонение от нормы, для уточнения его причины требуется дальнейшее обследование.
Причины повышения уровня общего белка в крови
- Острая и хроническая инфекция (включая туберкулез),
- нарушение функции коры надпочечников,
- аутоиммунные заболевания (ревматоидный артрит, системная красная волчанка, склеродермия),
- аллергические состояния,
- некоторые редкие системные заболевания,
- потеря жидкости (диабетический ацидоз, хронический понос и др.),
- дыхательная недостаточность,
- разрушение эритроцитов,
- активный хронический гепатит,
- некоторые редкие заболевания крови.
Причины понижения уровня общего белка в крови
- Задержка жидкости в связи с нарушением функции почек или ослаблением работы сердца,
- недостаточность поступления белка в организм или нарушение усвоения пищи в желудочно-кишечном тракте (вследствие голодания, недоедания, сужения пищевода, заболеваний кишечника воспалительного характера),
- снижение синтеза белка в печени (из-за гепатита, цирроза/атрофии печени, интоксикации),
- врождённые нарушения синтеза отдельных белков крови,
- повышенный распад белка (как результат злокачественных новообразований, гиперфункции щитовидной железы, послеоперационного состояния, длительной лихорадки, травмы, долгого лечения гормональными противовоспалительными препаратами),
- чрезмерная потеря белка при заболеваниях почек, сахарном диабете, кровотечениях,
- потеря белка вместе с жидкостью, которая накапливается в брюшной полости и полости плевры.

Что может влиять на результат?
Прием пищи может существенно повысить содержание белка в крови, в то время как после физической нагрузки оно снижается. На концентрацию белка также способны влиять употребление чая, кофе, алкоголя, лекарственных средств. Кроме того, для наиболее точного результата пациенту следует воздержаться от пищи со значительным количеством жиров.
Рентгеновский лазер ускорил определение структур белков, важных для медицины
Международная команда учёных, научилась определять пространственную структуру белка, полученную на рентгеновском лазере, используя атомы серы в его составе. Разработка является продолжением проекта группы профессора Вадима Черезова, профессора МФТИ и Университета Южной Калифорнии, по созданию эффективной методики исследования рецепторных белков. Подробное описание работы опубликовано в журнале Science Advances.
Рецепторные белки (GPCR) обеспечивают передачу сигналов внутрь клеток, тем самым позволяя им получать информацию об окружающей среде и взаимодействовать друг с другом. Благодаря этому мы можем видеть, испытывать чувства, поддерживать кровяное давление, т.е. всё, что необходимо для функционирования организма. Нарушения в работе этих белков приводят к возникновению тяжёлых заболеваний, например, слепоте. Разработка лекарств, восстанавливающих нормальное функционирование рецепторов, невозможна без точного понимания механизмов работы GPCR, который, подобно остальным белкам, определяется их пространственной структурой, иными словами тем, как свёрнут белок.
Благодаря этому мы можем видеть, испытывать чувства, поддерживать кровяное давление, т.е. всё, что необходимо для функционирования организма. Нарушения в работе этих белков приводят к возникновению тяжёлых заболеваний, например, слепоте. Разработка лекарств, восстанавливающих нормальное функционирование рецепторов, невозможна без точного понимания механизмов работы GPCR, который, подобно остальным белкам, определяется их пространственной структурой, иными словами тем, как свёрнут белок.
Наиболее подходящим методом для решения этой задачи является рентгеновская кристаллография. Для рентгеновских лучей кристалл является трёхмерной дифракционной решёткой, в которой излучение рассеивается на атомах.
Рис.1 Схема эксперимента по фемтосекундной рентгеновской кристаллографии. С помощью инжектора (1) кристаллы белка, растворённые в липидной среде (2) просвечиваются рентгеновским лучом (5), после чего рассеянный луч попадает на детектор (6). Давление в инжекторе создаётся с помощью гидравлического поршня(3), для сохранения прямой формы липидной струи специально подают поток газа (4).
Давление в инжекторе создаётся с помощью гидравлического поршня(3), для сохранения прямой формы липидной струи специально подают поток газа (4).
Отдельной проблемой при этом является получение кристалла белка. Для этого рецепторные белки необходимо извлечь из мембраны клетки и поместить в специальную липидную среду. Затем подбирая температуру и вещества, ускоряющие процесс осаждения, белок кристаллизуют.
Неприятной особенностью GPCR является то, что это очень подвижные и динамичные молекулы, часто меняющие свою пространственную структуру. Как следствие, для них сложно вырастить крупные кристаллы, которые необходимы для классической процедуры дифракции. Она предполагает достаточно продолжительное облучение кристалла под разными углами. Рентген ионизирует атомы, тем самым разрушая молекулы белка. Чтобы компенсировать этот эффект как раз и нужны большие кристаллы, размером в несколько десятков микрон.
Решение этой проблемы стало возможно благодаря новой экспериментальной методике рентгеновской дифракции. Её разработкой в течение последних нескольких лет занимается международная команда учёных из Университетов штата Аризоны и Цюриха, Национальной лаборатории SLAC в Стэнфорде, института iHuman при Университете в Шанхае, Института Биофизики Китайской Академии Наук, центра CFEL в Гамбурге, Университета Южной Калифорнии и МФТИ. Одним из лидеров этого коллектива является Вадим Черезов, профессор университета Южной Калифорнии и МФТИ. В основе методики лежит использование рентгеновских источников нового поколения — лазеров на свободных электронах. Излучение от них настолько мощное, что оно полностью ионизирует атомы в кристалле при прохождении через него, по сути, разрушая его. Однако, за счёт очень короткого времени лазерного импульса (порядка нескольких фемтосекунд, 10-15 с), получается заснять дифракционную картину до того, как атомы сдвинуться с места. Благодаря этому учёным удалось обойти трудности, связанные с размерами кристаллов.
Её разработкой в течение последних нескольких лет занимается международная команда учёных из Университетов штата Аризоны и Цюриха, Национальной лаборатории SLAC в Стэнфорде, института iHuman при Университете в Шанхае, Института Биофизики Китайской Академии Наук, центра CFEL в Гамбурге, Университета Южной Калифорнии и МФТИ. Одним из лидеров этого коллектива является Вадим Черезов, профессор университета Южной Калифорнии и МФТИ. В основе методики лежит использование рентгеновских источников нового поколения — лазеров на свободных электронах. Излучение от них настолько мощное, что оно полностью ионизирует атомы в кристалле при прохождении через него, по сути, разрушая его. Однако, за счёт очень короткого времени лазерного импульса (порядка нескольких фемтосекунд, 10-15 с), получается заснять дифракционную картину до того, как атомы сдвинуться с места. Благодаря этому учёным удалось обойти трудности, связанные с размерами кристаллов.
Поскольку кристалл разрушается моментально, то померить его в различных ориентациях невозможно. Для решения этой задачи учёные собирают и обрабатывают данные от множества кристаллов. С помощью специального инжектора липидная среда, в которой находятся кристаллы, подаётся под рентгеновский импульс. Весь процесс напоминает выдавливание зубной пасты из тюбика.
Для решения этой задачи учёные собирают и обрабатывают данные от множества кристаллов. С помощью специального инжектора липидная среда, в которой находятся кристаллы, подаётся под рентгеновский импульс. Весь процесс напоминает выдавливание зубной пасты из тюбика.
В результате получаются миллионы дифракционных изображений, которые необходимо обработать: отобрать изображения с кристаллами, найти их ориентацию, затем собрать в трёхмерную дифракционную картину. Для её расшифровки нужно знать два параметра: амплитуду и фазу отраженного излучения. Значения амплитуд измеряются на детекторе в ходе эксперимента, а вот определение фазы — это нетривиальная задача, для решения которой существует несколько методов.
Например, если нам известен некий белок, обладающий похожей структурой, то можно использовать его в качестве первого приближения. Очевидно, что такое возможно не во всех случаях.
Другой популярный метод — использовать эффект известный как аномальное рассеяние. Он возникает, когда длина рентгеновской волны близка к энергии электронного перехода в атомах, в результате происходит поглощение и переизлучение волны. Как следствие, меняются амплитуды и фазы. Если очень точно измерить амплитуды, то на основе разности между ними становится возможным восстановить фазы. Однако большинство атомов, входящих в состав белков (углерод, кислород, азот) для этого не подходят. Достаточно тяжёлым элементов, встречающимся практически во всех белках, является сера. Именно ей и воспользовались исследователи в текущей работе для восстановления фазы.
Он возникает, когда длина рентгеновской волны близка к энергии электронного перехода в атомах, в результате происходит поглощение и переизлучение волны. Как следствие, меняются амплитуды и фазы. Если очень точно измерить амплитуды, то на основе разности между ними становится возможным восстановить фазы. Однако большинство атомов, входящих в состав белков (углерод, кислород, азот) для этого не подходят. Достаточно тяжёлым элементов, встречающимся практически во всех белках, является сера. Именно ей и воспользовались исследователи в текущей работе для восстановления фазы.
Для этого потребовалась разработка специального программного обеспечения. Из 7 миллионов полученных изображений необходимо было отобрать те, которые имеют диффракционные отражения. Затем определить ориентацию кристалла и интенсивность всех отражений, после чего собрать получившиеся данные вместе. В итоге было отобрано 600 тысяч дифракционных картин, используя которые, получилось восстановить структуру белка с разрешением в 2,5Å. Соединив эти данные с данными, полученными при другой длине волны рентгеновского излучения, у исследователей получилось поднять разрешение до 1,9Å. Такая точность позволяет не только определять структуры рецепторных белков с высокой точностью, но и увидеть молекулы воды и липидов, которые окружают их, что имеет огромное значение для понимания механизма работы белка и моделирования его взаимодействия с другими веществами.
Соединив эти данные с данными, полученными при другой длине волны рентгеновского излучения, у исследователей получилось поднять разрешение до 1,9Å. Такая точность позволяет не только определять структуры рецепторных белков с высокой точностью, но и увидеть молекулы воды и липидов, которые окружают их, что имеет огромное значение для понимания механизма работы белка и моделирования его взаимодействия с другими веществами.
«Когда я участвовал в работе по определению структуры первого рецепторного белка, у меня ушёл примерно год на то, чтобы получить кристаллы достаточно большого размера для проведения классической рентгеновской дифракции. Мы надеемся, что разработанный нами метод позволит ускорить эту работу в несколько раз», — комментирует значимость исследования профессор Черезов.
Из существующих 800 рецепторных белков на сегодняшний день нам известны структуры только 34. Разработанная учёными экспериментальная методика позволит значительно ускорить их исследования. Что в свою очередь поможет в создании новых эффективных препаратов против огромного количества заболеваний.
Что в свою очередь поможет в создании новых эффективных препаратов против огромного количества заболеваний.
Рис.2 Конечная структура аденозинового А2А рецептора, изучавшегося в данной работе. Жёлтые сферы — атомы серы, синие сферы — молекулы воды, синими полосами показана липидная мембрана.
Нобелевский лауреат сообщил, что определение трехмерной структуры белка смогли ускорить — Наука
МОСКВА, 10 октября. /ТАСС/. Новый метод определения трехмерной структуры белков на основе генетического материала на порядки ускорил получение этой информации, что упростит, в частности, создание новых лекарств. Об этом рассказал лауреат Нобелевской премии по химии Курт Вютрих в ходе всероссийского фестиваля науки NAUKA 0+.
«Наконец стало возможным прогнозировать трехмерную структуру белка на основании последовательности генетического материала, то есть достаточно знать только информацию нуклеиновой кислоты, чтобы была возможность прогнозировать, каким образом будет складываться цепочка. <…> За неделю благодаря новому методу была получена информация о 350 тыс. различных структур белков. Представьте, мы почти 70 лет работали со структурой белков, потратили очень много времени, сил, человеческих ресурсов, денег, чтобы получить структуру всего лишь 150 тыс. белков», — сказал Вютрих.
<…> За неделю благодаря новому методу была получена информация о 350 тыс. различных структур белков. Представьте, мы почти 70 лет работали со структурой белков, потратили очень много времени, сил, человеческих ресурсов, денег, чтобы получить структуру всего лишь 150 тыс. белков», — сказал Вютрих.
По его словам, нарушение структуры белка является причиной многих заболеваний. Поэтому белки являются мишенями, «целями», на которые направлена разработка новых лекарств. При этом химическая структура всех биополимеров, ДНК, РНК и белков — это некая линейная структура, цепочка. И получение информации о такой цепи, ее положении в трехмерном пространстве — очень сложная работа.
«Разумеется, нужно еще посмотреть, насколько надежной является данная предиктивная модель и насколько она может заменить уже существующие методы, но мы ожидаем, что благодаря новому методу, благодаря развитию биотехнологических процессов можно будет повысить предикативность белковых структур. Сейчас очевидно, что это будет основой будущих экспериментов для определения структуры белков. Поэтому в будущее можно смотреть с большими надеждами, что у нас будут специальные инструменты для получения информации о трехмерных структурах в нашем теле», — добавил ученый.
Поэтому в будущее можно смотреть с большими надеждами, что у нас будут специальные инструменты для получения информации о трехмерных структурах в нашем теле», — добавил ученый.
Всероссийский фестиваль науки Nauka 0+ проходит в гибридном формате 8-10 октября в Москве. Это один из крупнейший просветительских проектов в области популяризации науки в мире. Он реализуется ежегодно с октября по ноябрь в 80 регионах РФ на более чем 400 площадках. Фестиваль организуют Министерство науки и высшего образования России, правительство Москвы, МГУ им. М. В. Ломоносова при поддержке РАН.
Центральная научно-методическая ветеринарная лаборатория
Белок (протеин) — это органическое соединение, являющееся исключительно важным питательным веществом, определяющим пищевую ценность зерна. Все белки, независимо от структуры, свойств и функций, построены из одних и тех же аминокислот, в состав которых входит азот.
Классическим способом определения белка является метод, разработанный в 1883 г. датским химиком Иоганном Кьельдалем. Это очень трудоемкий и продолжительный анализ, поэтому в современной лабораторной практике метод Кьельдаля часто пытаются заменить альтернативными методами, в том числе с использованием дорогостоящих программно-аппаратных комплексов.
датским химиком Иоганном Кьельдалем. Это очень трудоемкий и продолжительный анализ, поэтому в современной лабораторной практике метод Кьельдаля часто пытаются заменить альтернативными методами, в том числе с использованием дорогостоящих программно-аппаратных комплексов.
Но метод Кьельдаля до сих пор остается единственным общепризнанным методом определения белка и чаще всего используется в качестве эталонного для калибровки и настройки других методов определения массовой доли белка и приборов для экспресс-анализа.
Метод Кьельдаля позволяет с высокой точностью определять количество азота, являющегося составной частью белков. Метод включает в себя отбор и подготовку проб, мокрое озоление, отгонку с паром и определение концентрации аммония.
Процедура подготовки образца должна обеспечивать максимальную однородность, что повышает точность и воспроизводимость результата. Самым трудоемким и продолжительным этапом в методе Кьельдаля является стадия мокрого озоления образца в серной кислоте, при которой выделяется большое количество ядовитых паров диоксида и триоксида серы. Полученный после стадии разложения прозрачный раствор не годится для определения в нем аммонийного азота из-за большого содержания компонентов раствора.
Полученный после стадии разложения прозрачный раствор не годится для определения в нем аммонийного азота из-за большого содержания компонентов раствора.
Для отделения аммонийного азота он переводится в аммиачную форму (добавлением щелочи) и отгоняется с паром на дистилляторе. Дистилляторы могут также использоваться для отгонки аммонийного азота непосредственно из образцов без их предварительного разложения, что позволяет выделить содержание аммонийного азота из общего азота по Кьельдалю.
По вопросам определения содержания белка в зерне и продуктах его переработки по ГОСТ 10846-91, азота и сырого протеина в соответствии с ГОСТ 13496.4-93, обращайтесь в отделы по работе с заказчиком и обращению с объектами исследований ФГБУ ЦНМВЛ по данным адресам :
г. Рязань, ул.Костычева, д.17 . e-mail: [email protected]
Тел.: +7 (4912)40-49-06, 37-77-06
г. Тула, ул. Некрасова, д.1а. e-mail: [email protected]
Тел.: +7(4872)30-45-72, 30-45-73
г. Липецк, ул.Опытная, д.1. e-mail: [email protected]
Липецк, ул.Опытная, д.1. e-mail: [email protected]
Тел.: +7 (4742)79-73-65, 79-74-85.
Читать также: Об эпизоотической обстановке по бешенству на территории России во второй половине апреля 2018 года 10.05.2018 подробнее В Тюменской фитосанитарной лаборатории проверили партию свежей моркови из Киргизской Республики 12.03.2021 подробнее Представители ФГБУ ЦНМВЛ — участники Международного ветеринарного конгресса в Светлогорске 17.04.2019 подробнееБелок общий в сыворотке, определение
Анализ содержания общего белка в сыворотке крови позволяет оценить состояние белкового обмена в организме человека и выявить отклонения от нормы. Белки – ключевой строительный материал, из которого состоят органы и ткани, кроме того, они являются важным компонентом гормонов, ферментов, участвуют в транспортировке веществ между органами и тканями. Отклонение от нормы общего белка сыворотки в некоторых случаях говорит о различных заболеваниях.
Белки – ключевой строительный материал, из которого состоят органы и ткани, кроме того, они являются важным компонентом гормонов, ферментов, участвуют в транспортировке веществ между органами и тканями. Отклонение от нормы общего белка сыворотки в некоторых случаях говорит о различных заболеваниях.
Что понимается под общим белком?
Общий белок в сыворотке крови – это концентрация альбуминов и глобулинов, по ней определяется состояние обмена веществ. Альбумины синтезируются в печени из пищи. Их количество в плазме влияет на уровень осмотического давления, которое удерживает жидкость внутри кровеносных сосудов. Глобулины выполняют иммунную функцию (антитела), обеспечивают нормальное свертывание крови (фибриноген).Белки также ответственны за обеспечение правильного кислотно-щелочного равновесия (рН). Нарушения могут возникать при некоторых физиологических состояниях, однако в некоторых случаях они являются симптомами заболеваний. Абсолютная гипопротеинемия – снижение уровня белка, связанное с недостаточным поступлением в организм или увеличением потребности. Обычно она возникает из-за недостатка альбуминов и свидетельствует об истощении, недоедании, хронической интоксикации.
Обычно она возникает из-за недостатка альбуминов и свидетельствует об истощении, недоедании, хронической интоксикации.
Определение общего белка в сыворотке крови дает следующие результаты:
-
Нормальный уровень. Для взрослых старше 18 лет он составляет 64-83 г/л.
-
Общий белок в сыворотке понижен. Это может говорить о недоедании, нарушении синтеза, повышенном распаде белка, а также заболеваниях почек и других патологиях.
-
Общий белок в сыворотке повышен. Такое состояние возникает при инфекционных процессах в острой и хронической формах, аутоиммунных заболеваниях, сбоях в работе надпочечников, некоторых заболеваниях печени.
Как подготовиться к исследованию?
Анализ на общий белок в сыворотке требует соблюдения следующих правил подготовки:
-
Отказ от курения в течение минимум 30 минут перед забором крови.

-
Отказ от приема пищи на 12 часов до проведения исследования.
-
Ограничение физических и эмоциональных нагрузок минимум на 30 минут до обследования.
Кому назначается анализ?
Исследование может быть назначено при подозрении на нарушения белкового обмена – они возникают при различных патологиях внутренних органов. Пациента направят на анализ при симптомах истощения, при обследовании печени, почек, щитовидной железы.
Где провести обследование недорого?
Клинико-диагностический центр «Да Винчи» в Ростове-на-Дону предлагает проведение лабораторных анализов по невысокой стоимости, гарантируется точность результатов и вежливое профессиональное обслуживание. Позвоните и запишитесь на обследование!
Наименование услуги
Цена
Отзывы об услуге
Что такое полноценные белки? — Определение и примеры продуктов питания
Что такое полноценные белки?
Белок, содержащий все девять незаменимых аминокислот , считается полноценным.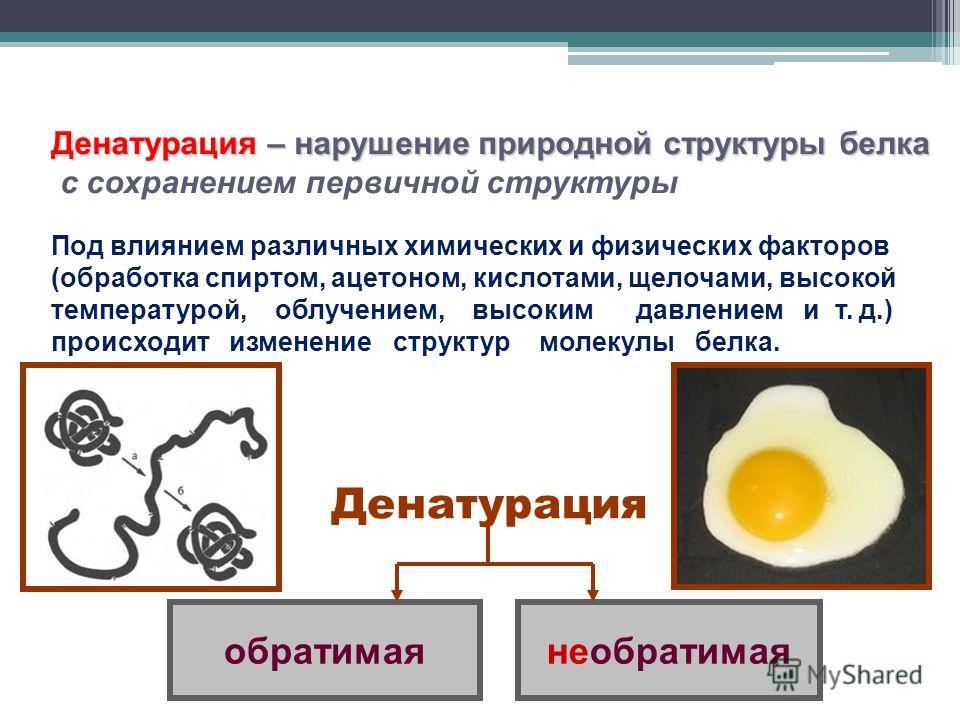 Незаменимые аминокислоты не могут вырабатываться в организме и должны поступать с пищей. Полноценными считаются только те источники белка, которые содержат все незаменимые аминокислоты. Девять незаменимых аминокислот включают гистидин, изолейцин, лейцин, лизин, метионин, фениланалин, треонин, триптофан и валин .Напротив, неполный белок содержит мало одной или нескольких незаменимых аминокислот и должен сочетаться с другими источниками белка для правильного использования.
Незаменимые аминокислоты не могут вырабатываться в организме и должны поступать с пищей. Полноценными считаются только те источники белка, которые содержат все незаменимые аминокислоты. Девять незаменимых аминокислот включают гистидин, изолейцин, лейцин, лизин, метионин, фениланалин, треонин, триптофан и валин .Напротив, неполный белок содержит мало одной или нескольких незаменимых аминокислот и должен сочетаться с другими источниками белка для правильного использования.
Примеры полноценных белков
Взрослые и дети, потребляющие продукты животного происхождения, постоянно потребляют полноценные белки. Следующие продукты содержат незаменимые аминокислоты:
- Мясо
- Птица
- Рыба
- Молоко
- Сыр
- Яйца
Хотя рис, кукуруза и бобы также содержат белок, они неполные и должны сочетаться, чтобы удовлетворить потребности организма.К счастью, потребление различных неполных источников белка также может обеспечить вас незаменимыми аминокислотами.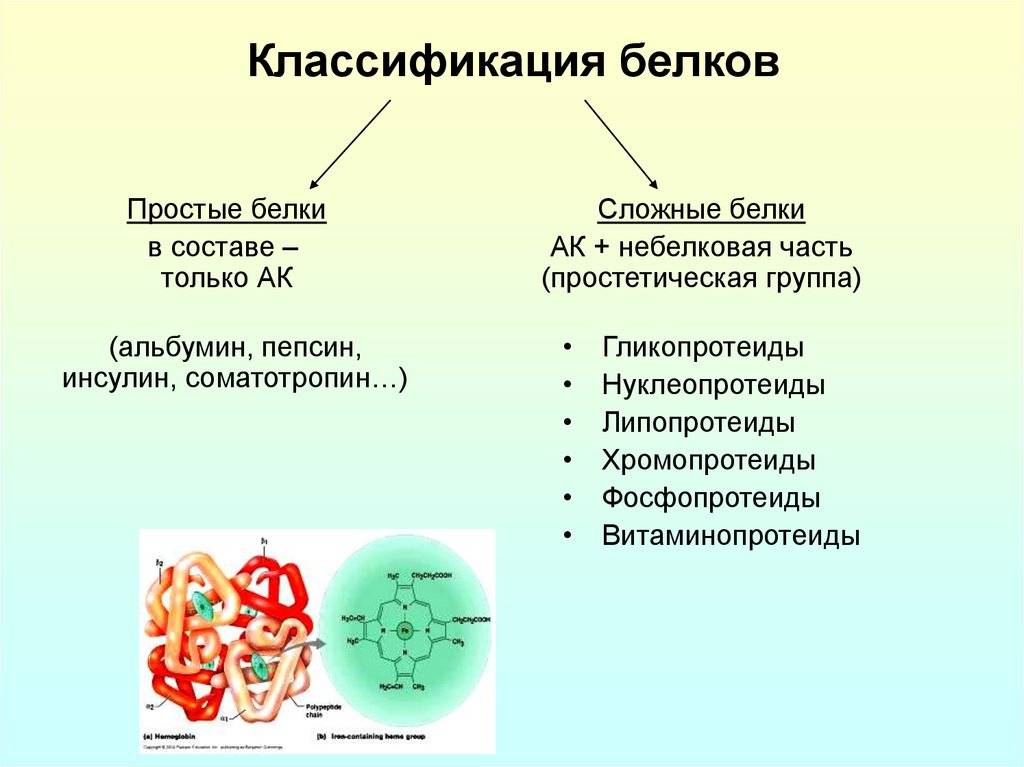 Лица с диетическими ограничениями, такие как вегетарианцы , должны рассмотреть другие источники белка, чтобы удовлетворить потребности организма. Люди, ограничивающие себя узким набором неполных белков, могут испытывать симптомы дефицита, такие как выпадение волос или усталость.
Лица с диетическими ограничениями, такие как вегетарианцы , должны рассмотреть другие источники белка, чтобы удовлетворить потребности организма. Люди, ограничивающие себя узким набором неполных белков, могут испытывать симптомы дефицита, такие как выпадение волос или усталость.
Резюме
Несмотря на то, что дефицит белка встречается редко, растущая популярность ограничительных диет, таких как вегетарианство, делает вопрос о полноценных белках жизненно важным.Люди, решившие исключить источники полноценных белков, должны изучить себя и соответствующим образом скорректировать свой рацион, чтобы правильно использовать незаменимые аминокислоты для поддержания здоровья.
Краткий урок
Полноценный белок — это белок, который при употреблении содержит все девять незаменимых аминокислот. Полноценные белки помогают поддерживать сбалансированное питание и вести здоровый образ жизни. Людям с диетическими ограничениями необходимо рассмотреть другие источники белка, чтобы удовлетворить потребности организма, иначе они могут начать испытывать симптомы дефицита, такие как выпадение волос или усталость.
Результаты обучения
Прочитав в этом уроке о полноценных белках, вы сможете делать следующее:
- Идентифицировать и описывать продукты, которые считаются полноценными белками
- Объясните разницу между полным и неполным белком
- Укажите, почему тем, кто придерживается ограничительной диеты, необходимо рассмотреть другие источники белка
Медицинская оговорка: информация на этом сайте предназначена только для вашего ознакомления и не может заменить профессиональную медицинскую консультацию.
определение белков по The Free Dictionary
Как плохое семя, которое захватывает весь сад, один аномальный белок может испортить другие белки поблизости и вызвать прогрессирование болезни Альцгеймера, предполагает новое исследование. Из этой первоначальной группы девять белков полосатого тела и десять белков гиппокампа были выбраны для идентификации с помощью MALDI. -ToF-MS. Связывание с dsRNA этими белками может привести к инициации активности hellcase, одновременно с конформационным изменением, которое приводит к рекрутированию дополнительных клеточных факторов, включая недавно идентифицированный белок IPS-1/MAVS (5,6). «Команда Biolex успешно произвела широкий спектр человеческих белков и моноклональных антител, включая плазминоген, белок, который содержит несколько крингл-доменов, подобных доменам NK4», — сказал Кунио Иватани, генеральный директор Kringle Pharma. «аминокислоты.» Организму требуется 21 из этих кислот для построения тканей, хотя не все белки содержат всю серию. Исследования показали, что соевый белок естественным образом содержит много питательных веществ, важных для здоровья, и не содержит насыщенных жиров и холестерина, связанных с некоторыми животными белками.Под редакцией эксперта в этой области и известной международной группы авторов, Белки в пищевой промышленности рассматривают, как белки могут быть использованы для улучшения питательных, текстурных и других качеств пищевых продуктов. Цитокины: белки (такие как интерлейкины, фактор некроза опухоли , и интерфероны), которые секретируются иммунными клетками. AxCell Biosciences, дочерняя компания Cytogen Corporation (Nasdaq:CYTO), использует технологию базы данных IBM DB2, чтобы помочь своим ученым наметить коммуникационные пути внутри клеток, которые позволяют белкам взаимодействовать и вызывать или предотвращать болезни.
«Команда Biolex успешно произвела широкий спектр человеческих белков и моноклональных антител, включая плазминоген, белок, который содержит несколько крингл-доменов, подобных доменам NK4», — сказал Кунио Иватани, генеральный директор Kringle Pharma. «аминокислоты.» Организму требуется 21 из этих кислот для построения тканей, хотя не все белки содержат всю серию. Исследования показали, что соевый белок естественным образом содержит много питательных веществ, важных для здоровья, и не содержит насыщенных жиров и холестерина, связанных с некоторыми животными белками.Под редакцией эксперта в этой области и известной международной группы авторов, Белки в пищевой промышленности рассматривают, как белки могут быть использованы для улучшения питательных, текстурных и других качеств пищевых продуктов. Цитокины: белки (такие как интерлейкины, фактор некроза опухоли , и интерфероны), которые секретируются иммунными клетками. AxCell Biosciences, дочерняя компания Cytogen Corporation (Nasdaq:CYTO), использует технологию базы данных IBM DB2, чтобы помочь своим ученым наметить коммуникационные пути внутри клеток, которые позволяют белкам взаимодействовать и вызывать или предотвращать болезни. Благодаря постоянной адаптации огромное количество наших лейкоцитов учатся распознавать конкретную бактерию, вирус, грибок или даже нормальную клетку, ставшую раковой, реагируя на уникальные белки на клеточной поверхности. Ключевые слова: макромолекулярная кристаллография; нейтронная кристаллография; кристаллография белков; белки; базы данных структурной биологии; рентгеноструктурный анализ. Латекс содержит значительное количество водорастворимых белков. Изделия из латекса, такие как перчатки, презервативы и хирургические накладки, соприкасаются с людьми, а загрязняющие белки представляют опасность для здоровья.
Благодаря постоянной адаптации огромное количество наших лейкоцитов учатся распознавать конкретную бактерию, вирус, грибок или даже нормальную клетку, ставшую раковой, реагируя на уникальные белки на клеточной поверхности. Ключевые слова: макромолекулярная кристаллография; нейтронная кристаллография; кристаллография белков; белки; базы данных структурной биологии; рентгеноструктурный анализ. Латекс содержит значительное количество водорастворимых белков. Изделия из латекса, такие как перчатки, презервативы и хирургические накладки, соприкасаются с людьми, а загрязняющие белки представляют опасность для здоровья.Как определить и изучить структурные белки как биополимерные материалы
Askarieh G, Hedhammar M, Nordling K, Saenz A, Casals C, Rising A. et al. Самосборка белков шелка пауков контролируется pH-чувствительным реле. Природа. 2010; 465: 236–8.
ПабМед КАС Google Scholar
Hagn F, Eisoldt L, Hardy JG, Vendrely C, Coles M, Scheibel T. et al. Законсервированный домен шелка паука действует как молекулярный переключатель, контролирующий сборку волокон.Природа. 2010; 465: 239–42.
et al. Законсервированный домен шелка паука действует как молекулярный переключатель, контролирующий сборку волокон.Природа. 2010; 465: 239–42.
ПабМед КАС Google Scholar
Tsuchiya K, Numata K. Химический синтез многоблочных сополипептидов, вдохновленный белками шелка паучьего драглайна. ACS Macro Lett. 2017;6:103–6.
КАС Google Scholar
Babb PL, Lahens NF, Correa-Garhwal SM, Nicholson DN, Kim EJ, Hogenesch JB. и другие. Геном Nephila clavipes подчеркивает разнообразие генов паучьего шелка и их сложную экспрессию.Нат Жене. 2017;49:895–903.
ПабМед КАС Google Scholar
Фоллрат Ф., Портер Д., Холланд С. Из паутины можно извлечь еще много уроков. Мягкая материя. 2011;7:9595–600.
КАС Google Scholar

Каташима Т., Малай А.Д., Нумата К. Химическая модификация и биосинтез шелкоподобных полимеров. Curr Opin Chem Eng. 2019;24:61–8.
Google Scholar
Гослайн Дж.М., Денни М.В., ДеМонт М.Е. Шелк паука как резина. Природа. 1984; 309: 551–2.
КАС Google Scholar
Гослайн Дж.М., Геретт П.А., Ортлепп К.С., Сэвидж К.Н. Механический дизайн паутины: от последовательности фиброина до механической функции. J Эксперт Биол. 1999; 202:3295–303.
ПабМед КАС Google Scholar
Малай А.Д., Аракава К., Нумата К. Анализ повторяющихся аминокислотных мотивов выявляет основные свойства белков шелка паучьего драглайна. Плос ОДИН. 2017;12:e0183397.
ПабМед ПабМед Центральный Google Scholar
Ядзава К., Исида К., Масунага Х., Хикима Т. , Нумата К. Влияние содержания воды на формирование бета-слоя, термическую стабильность, удаление воды и механические свойства шелковых материалов. Биомакромолекулы.2016;17:1057–66.
, Нумата К. Влияние содержания воды на формирование бета-слоя, термическую стабильность, удаление воды и механические свойства шелковых материалов. Биомакромолекулы.2016;17:1057–66.
ПабМед КАС Google Scholar
Yazawa K, Malay AD, Masunaga H, Numata K. Comms Mater. 2020;1:10.
Нумата К., Масунага Х., Хикима Т., Сасаки С., Секияма К., Таката М. Использование кристаллизации шелковых волокон на основе растяжения-деформации для дифференциации их функций в природе. Мягкая материя. 2015;11:6335–42.
ПабМед КАС Google Scholar
ван Бик Д.Д., Хесс С., Фоллрат Ф., Мейер Б.Х. Молекулярная структура шелка паучьего драглайна: укладка и ориентация белкового остова. Proc Natl Acad Sci USA. 2002; 99: 10266–71.
ПабМед Google Scholar
Сюй М., Льюис Р.В. Структура протеинового суперволокна: шелк паука-драглайна. Proc Natl Acad Sci USA. 1990; 87: 7120–4.
Proc Natl Acad Sci USA. 1990; 87: 7120–4.
ПабМед КАС Google Scholar
Чжан Ю.К. Применение натурального протеина шелка серицина в биоматериалах. Биотехнология Adv. 2002; 20:91–100.
ПабМед КАС Google Scholar
Малай А.Д., Сато Р., Ядзава К., Ватанабэ Х., Ифуку Н., Масунага Х. и др. Взаимосвязь между физическими свойствами и последовательностью в шелках тутового шелкопряда. Научный доклад 2016; 6: 27573.
ПабМед ПабМед Центральный Google Scholar
Холланд К., Нумата К., Рняк-Ковачина Дж., Сейб Ф.П. Биомедицинское использование шелка: прошлое, настоящее, будущее. Adv Health Mater. 2019;8:e1800465.
Google Scholar
Нумата К., Каплан Д.Л. Системы доставки биоактивных молекул на основе шелка. Adv Drug Deliv Rev. 2010; 62: 1497–508.
2010; 62: 1497–508.
ПабМед ПабМед Центральный КАС Google Scholar
Нумата К., Себе П., Каплан Д.Л.Механизм ферментативной деградации кристаллов бета-листов. Биоматериалы. 2010;31:2926–33.
ПабМед КАС Google Scholar
Нумата К., Каташима Т., Сакаи Т. Состояние воды, молекулярная структура и цитотоксичность шелковых гидрогелей. Биомакромолекулы. 2011;12:2137–44.
ПабМед КАС Google Scholar
Гупта П., Кумар М., Бхардвадж Н., Кумар Дж. П., Кришнамурти К.С., Нанди С.К.и другие. Имитация формы и функции нативных сосудистых каналов малого диаметра с использованием шелковых пленок с узором тутового дерева и других сортов. ACS Appl Mater Inter. 2016;8:15874–88.
КАС Google Scholar
Нумата К., Сато Р. , Ядзава К., Хикима Т., Масунага Х. Кристаллическая структура и физические свойства шелковых волокон Antheraea yamamai: Длинные поли(аланиновые) последовательности частично находятся в кристаллической области. Полимер. 2015;77:87–94.
, Ядзава К., Хикима Т., Масунага Х. Кристаллическая структура и физические свойства шелковых волокон Antheraea yamamai: Длинные поли(аланиновые) последовательности частично находятся в кристаллической области. Полимер. 2015;77:87–94.
КАС Google Scholar
Мандал Б.Б., Дас С., Чоудхури К., Кунду С.К. Влияние наличия RGD шелковой пленки и шероховатости поверхности на организацию цитоскелета и пролиферацию первичных клеток костного мозга крыс. Tissue Eng A. 2010; 16: 2391–403.
КАС Google Scholar
Ageitos JM, Yazawa K, Tateishi A, Tsuchiya K, Numata K. Группа бензилового эфира мономеров аминокислот повышает сродство к субстрату и расширяет субстратную специфичность ферментного катализатора в хемоферментной сополимеризации.Биомакромолекулы. 2016;17:314–23.
ПабМед КАС Google Scholar

Lee CH, Singla A, Lee Y. Биомедицинские применения коллагена. Инт Дж Фарм. 2001; 221:1–22.
ПабМед КАС Google Scholar
Oxlund H, Manschot J, Viidik A. Роль эластина в механических свойствах кожи. Дж. Биомех. 1988; 21: 213–8.
ПабМед КАС Google Scholar
Аарон Б.Б., Гослайн Дж.М. Эластин как эластомер со случайной сетью — механический и оптический анализ одиночных эластиновых волокон. Биополимеры. 1981; 20: 1247–60.
КАС Google Scholar
Киркпатрик С.Дж., Хайндс М.Т., Дункан Д.Д. Акустооптическая характеристика вязкоупругой природы воротниковой ткани эластина. Ткань англ. 2003; 9: 645–56.
ПабМед Google Scholar
Берглунд Д.Д., Нерем Р.М., Самбанис А. Включение интактных эластиновых каркасов в тканеинженерные сосудистые трансплантаты на основе коллагена.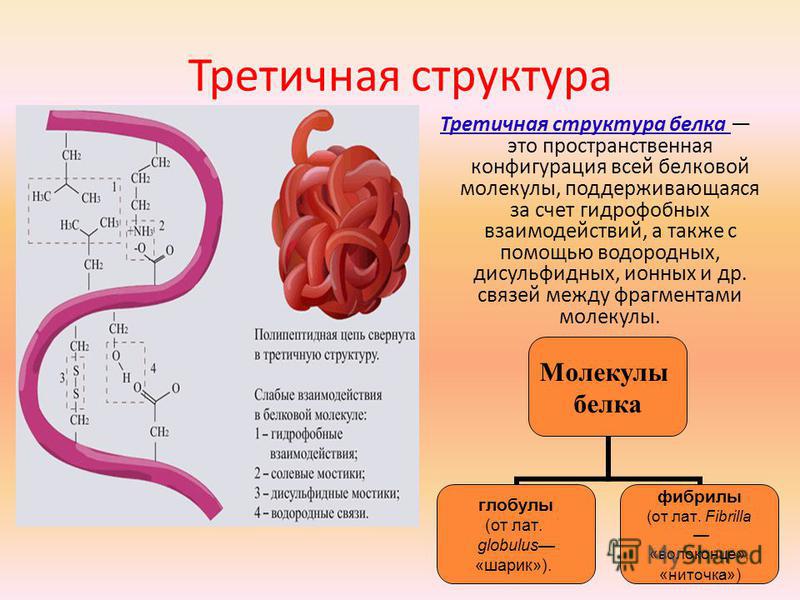 Ткань англ. 2004; 10:1526–35.
Ткань англ. 2004; 10:1526–35.
ПабМед КАС Google Scholar
Tatham AS, Shewry PR. Сравнительные структуры и свойства эластичных белков. Philos Trans R Soc Lond B. 2002; 357: 229–34.
КАС Google Scholar
Гослайн Дж., Лилли М., Кэррингтон Э., Геретт П., Ортлепп С., Сэвидж К. Эластичные белки: биологическая роль и механические свойства. Philos Trans R Soc Lond B. 2002; 357: 121–32.
КАС Google Scholar
Мамат Н., Ядзава К., Нумата К., Норма-Рашид Ю. Морфологические и механические свойства гибких резилиновых соединений на крыльях стрекоз ( Rhinocypha spp.). ПЛОС ОДИН. 2018;13:e0193147.
Google Scholar
Elvin CM, Carr AG, Huson MG, Maxwell JM, Pearson RD, Vuocolo T. et al. Синтез и свойства сшитого рекомбинантного прорезилина. Природа. 2005; 437: 999–1002.
Природа. 2005; 437: 999–1002.
ПабМед КАС Google Scholar
Qin GK, Lapidot S, Numata K, Hu X, Meirovitch S, Dekel M. et al. Экспрессия, перекрестное связывание и характеристика рекомбинантного хитин-связывающего резилина. Биомакромолекулы. 2009;10:3227–34.
ПабМед КАС Google Scholar
Цинь Г.К., Ривкин А., Лапидот С., Ху Х., Прейс И., Аринус С.Б. и другие. Рекомбинантные резилины, кодируемые экзонами, для эластомерных биоматериалов. Биоматериалы. 2011;32:9231–43.
ПабМед ПабМед Центральный КАС Google Scholar
Цинь Г.К., Ху С., Себе П., Каплан Д.Л. Механизм упругости резилина. Нац коммун. 2012;3:1003.
ПабМед ПабМед Центральный Google Scholar
Cao Y, Li H. Полипротеин GB1 является идеальным искусственным эластомерным белком. Нат Матер. 2007; 6: 109–14.
Нат Матер. 2007; 6: 109–14.
ПабМед КАС Google Scholar
Lv S, Dudek DM, Cao Y, Balamurali MM, Gosline J, Li H. Разработаны биоматериалы для имитации механических свойств мышц. Природа. 2010; 465:69–73.
ПабМед КАС Google Scholar
Даулинг Л.М., Крютер В.Г., Парри Д.А.Вторичная структура компонента 8c-1 альфа-кератина. Анальная аминокислотная последовательность Biochem J. 1986;236:705–12.
КАС Google Scholar
Доулинг Л.М., Крютер В.Г., Инглис А.С. Первичная структура компонента 8c-1, субъединичного белка промежуточных филаментов в кератине шерсти. Отношения с белками других промежуточных филаментов. Биохим Дж. 1986; 236:695–703.
ПабМед ПабМед Центральный КАС Google Scholar
Полинг Л., Кори Р. Б. Сложные спиральные конфигурации полипептидных цепей: строение белков альфа-кератинового типа. Природа. 1953; 171: 59–61.
Б. Сложные спиральные конфигурации полипептидных цепей: строение белков альфа-кератинового типа. Природа. 1953; 171: 59–61.
ПабМед КАС Google Scholar
Ямаути К., Ямаути А., Кусуноки Т., Кода А., Кониши Ю. Приготовление стабильного водного раствора кератинов, физико-химические и биоразлагаемые свойства пленок. J Biomed Mater Res. 1996; 31: 439–44.
ПабМед КАС Google Scholar
Като К., Шибаяма М., Танабэ Т., Ямаути К. Получение и физико-химические свойства кератиновых пленок, формованных под давлением. Биоматериалы. 2004; 25:2265–72.
ПабМед КАС Google Scholar
Katoh K, Tanabe T, Yamauchi K. Новый подход к изготовлению каркасов из кератиновых губок с контролируемым размером пор и пористостью. Биоматериалы. 2004; 25:4255–62.
ПабМед КАС Google Scholar

Крукс В. Дж., Дин Л. Л., Хуан К. Л., Кимбелл Дж. Р., Хорвиц Дж., Макфолл-Нгай М. Дж. Рефлектины: необычные белки отражающих тканей кальмаров. Наука. 2004; 303: 235–8.
ПабМед КАС Google Scholar
Крамер Р.М., Крукс-Гудсон В.Дж., Найк Р.Р. Самоорганизующиеся свойства белка рефлектина кальмара. Нат Матер. 2007; 6: 533–8.
ПабМед КАС Google Scholar
ДеМартини Д.Г., Изуми М., Уивер А.Т., Пандольфи Э., Морс Д.Э. Структуры, организация и функция белков рефлектинов в динамически настраиваемых рефлекторных клетках. Дж. Биол. Хим. 2015; 290:15238–49.
ПабМед ПабМед Центральный КАС Google Scholar
Naughton KL, Phan L, Leung EM, Kautz R, Lin QY, Van Dyke Y. et al. Самосборка белка рефлектина головоногих. Adv Mater. 2016; 28:8405–12.
ПабМед КАС Google Scholar

Guan Z, Cai TT, Liu ZM, Dou YF, Hu XS, Zhang P. et al. Происхождение гена рефлектина и иерархическая сборка его белка. Карр Биол. 2017;27:2833–42.
ПабМед КАС Google Scholar
Цинь Г.К., Деннис П.Б., Чжан Ю.Дж., Ху С., Бресснер Дж.Е., Сунь З.И. и другие. Оптические материалы на основе рекомбинантных рефлектинов. J Polym Sci Pol Phys. 2013; 51: 254–64.
КАС Google Scholar
Принц Дж.Т., МакГрат К.П., ДиДжироламо К.М., Каплан Д.Л. Конструирование, клонирование и экспрессия синтетических генов, кодирующих шелк паучьего драглайна. Биохимия. 1995; 34:10879–85.
ПабМед КАС Google Scholar
Нумата К., Хамасаки Дж., Субраманиан Б., Каплан Д.Л. Доставка генов опосредована рекомбинантными белками шелка, содержащими катионные и клеточно-связывающие мотивы. J Управление выпуском.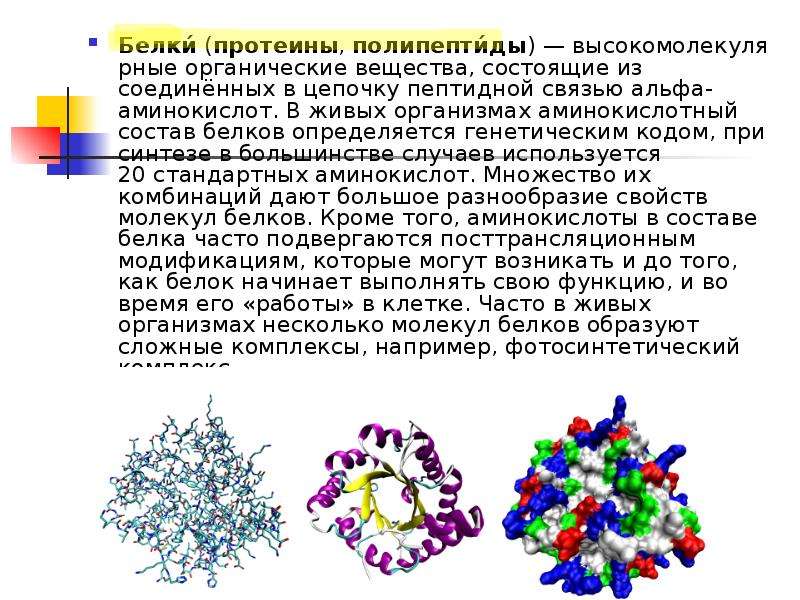 2010; 146:136–43.
2010; 146:136–43.
ПабМед ПабМед Центральный КАС Google Scholar
Нумата К., Каплан Д.Л. Носители генов на основе шелка с пептидами, дестабилизирующими клеточные мембраны. Биомакромолекулы. 2010;11:3189–95.
ПабМед ПабМед Центральный КАС Google Scholar
Нумата К., Рейган М.Р., Гольдштейн Р.Х., Розенблатт М., Каплан Д.Л. Носители генов на основе шелка паука для специфичной доставки к опухолевым клеткам. Биоконьюг Хим. 2011; 22:1605–10.
ПабМед ПабМед Центральный КАС Google Scholar
Нумата К., Субраманиан Б., Карри Х.А., Каплан Д.Л. Биоинженерные системы доставки генов на основе белков шелка. Биоматериалы. 2009; 30: 5775–84.
ПабМед ПабМед Центральный КАС Google Scholar
Fahnestock SR, Bedzyk LA. Производство синтетического протеина шелка паучьего драглайна в Pichia pastoris . Приложение Microbiol Biotechnol. 1997; 47:33–9.
Производство синтетического протеина шелка паучьего драглайна в Pichia pastoris . Приложение Microbiol Biotechnol. 1997; 47:33–9.
ПабМед КАС Google Scholar
Jansson R, Lau CH, Ishida T, Ramstrom M, Sandgren M, Hedhammar M. Функциональный шелк, собранный из рекомбинантного слитого белка паучьего шелка (Z-4RepCT), полученного в метилотрофных дрожжах Pichia pastoris . Biotechnol J. 2016;11:687–99.
ПабМед КАС Google Scholar
Ян Дж.Дж., Барр Л.А., Фанесток С.Р., Лю З.Б. Производство рекомбинантного белка, подобного шелку, с высоким выходом в трансгенных растениях путем нацеливания на белок.Трансгенный Рез. 2005; 14: 313–24.
ПабМед КАС Google Scholar
Scheller J, Guhrs KH, Grosse F, Conrad U. Производство белков шелка пауков в табаке и картофеле. Нац биотехнолог. 2001; 19: 573–57.
Нац биотехнолог. 2001; 19: 573–57.
ПабМед КАС Google Scholar
Гауптманн В., Вейхерт Н., Рахимова М., Конрад Ю. Паучья паутина из растений — задача создать спидроины природного размера.Biotechnol J. 2013;8:1183–92.
ПабМед КАС Google Scholar
Xu J, Dong QL, Yu Y, Niu BL, Ji DF, Li MW. и другие. Массовое производство паучьего шелка путем целенаправленной замены генов у Bombyx mori. Proc Natl Acad Sci USA. 2018; 115:8757–62.
ПабМед КАС Google Scholar
Higuchi-Takeuchi M, Numata K. Морские пурпурные фотосинтезирующие бактерии как хозяева устойчивого микробного производства.Фронт Биоэнг Биотех. 2019;7:258.
Google Scholar
Higuchi-Takeuchi M, Morisaki K, Numata K. Метод легкой трансформации морских пурпурных фотосинтезирующих бактерий с использованием химически компетентных клеток. Микробиологияоткрыть. 2020;9:e953.
Микробиологияоткрыть. 2020;9:e953.
Google Scholar
Higuchi-Takeuchi M, Numata K. Метаболические состояния, вызывающие ацетат, усиливают выработку полигидроксиалканоатов в морских пурпурных несерных бактериях в аэробных условиях.Фронт Биоэнг Биотех. 2019;7:118.
Google Scholar
Foong CP, Higuchi-Takeuchi M, Numata K. Оптимальные концентрации железа для связанного с ростом биосинтеза полигидроксиалканоатов в морских фотосинтетических пурпурных бактериях Rhodovulum sulfidophilum в фотогетеротрофных условиях. Плос ОДИН. 2019;14:e0212654.
ПабМед ПабМед Центральный КАС Google Scholar
Higuchi-Takeuchi M, Motoda Y, Kigawa T, Numata K. Полигидроксиалканоатсинтаза класса I из пурпурной фотосинтезирующей бактерии Rhodovulum sulfidophilum преимущественно существует в виде функционального димера в отсутствие субстрата. АСУ Омега. 2017;2:5071–8.
АСУ Омега. 2017;2:5071–8.
ПабМед ПабМед Центральный КАС Google Scholar
Higuchi-Takeuchi M, Morisaki K, Toyooka K, Numata K. Синтез высокомолекулярных полигидроксиалканоатов морскими фотосинтетическими пурпурными бактериями.Плос ОДИН. 2016;11:e0160981.
ПабМед ПабМед Центральный Google Scholar
Higuchi-Takeuchi M, Morisaki K, Numata K. Метод скрининга для выделения полигидроксиалканоат-продуцирующих пурпурных несерных фотосинтезирующих бактерий из природной морской воды. Фронт микробиол. 2016;7:1509.
ПабМед ПабМед Центральный Google Scholar
Филдс ГБ, Благородный РЛ.Твердофазный синтез пептидов с использованием 9-флуоренилметоксикарбониламинокислот. Int J Pept Protein Res. 1990; 35: 161–214.
ПабМед КАС Google Scholar

Меррифилд РБ. Твердофазный синтез пептидов. Adv Enzymol Ramb. 1969; 32: 221–96.
КАС Google Scholar
Bayer E, Mutter M. Жидкофазный синтез пептидов. Природа. 1972; 237: 512–3.
ПабМед КАС Google Scholar
Dawson PE, Muir TW, Clarklewis I, Kent SBH. Синтез белков нативным химическим лигированием. Наука. 1994; 266: 776–9.
ПабМед КАС Google Scholar
Johnson ECB, Kent SBH. Понимание механизма и катализа нативной химической реакции лигирования. J Am Chem Soc. 2006; 128:6640–6.
ПабМед КАС Google Scholar
Johnson ECB, Durek T, Kent SBN. Полный химический синтез, фолдинг и анализ небольшого белка на водосовместимой твердой подложке. Angew Chem Int Ed. 2006;45:3283–7.
КАС Google Scholar

Агуридас В., Эль Махди О., Димер В., Каргоет М., Монбалиу Дж. М., Мельник О. Нативное химическое лигирование и расширенные методы: механизмы, катализ, область применения и ограничения. Chem Rev. 2019; 119:7328–443.
ПабМед КАС Google Scholar
Гудман М., Хатчисон Дж. Механизмы полимеризации N-незамещенных N-карбоксиангидридов. J Am Chem Soc. 1966;88:3627
КАС Google Scholar
Деминг Т.Дж. Синтетические полипептиды для биомедицинских применений. Прог Полим Науки. 2007; 32: 858–75.
КАС Google Scholar
Кога К., Судо А., Эндо Т. Революционный бесфосгенный синтез N-карбоксиангидридов альфа-аминокислот с использованием дифенилкарбоната на основе активации альфа-аминокислот путем превращения в соли имидазолия.J Polym Sci Poly Chem. 2010;48:4351–5.
КАС Google Scholar
Yamada S, Koga K, Sudo A, Goto M, Endo T. Бесфосгеновый синтез полипептидов: полезный синтез гидрофобных полипептидов путем поликонденсации активированных уретановых производных аминокислот. J Polym Sci Poly Chem. 2013;51:3726–31.
КАС Google Scholar
Кобаяши С., Макино А.Ферментативный синтез полимеров: возможность для «зеленой» химии полимеров. Chem Rev. 2009; 109:5288–353.
ПабМед КАС Google Scholar
Кобаяши С., Уяма Х., Кимура С. Ферментативная полимеризация. Chem Rev. 2001; 101:3793–818.
ПабМед КАС Google Scholar
Нумата К. Полиаминокислоты/полипептиды как потенциальные функциональные и структурные материалы.Полим Дж. 2015;47:537–45.
КАС Google Scholar
Tsuchiya K, Numata K. Химиоферментативный синтез полипептидов для использования в качестве функциональных и структурных материалов. Макромол Биоски. 2017;17:1700177.
Макромол Биоски. 2017;17:1700177.
Google Scholar
Ma YN, Li ZB, Numata K. Синтетические короткие пептиды для быстрого изготовления монослойных клеточных листов. ACS Biomater Sci Eng. 2016;2:697–706.
КАС Google Scholar
Ma YA, Sato R, Li ZB, Numata K. Химиоферментативный синтез олиго(L-цистеина) для использования в качестве термостабильного биоматериала. Макромол Биоски. 2016;16:151–9.
ПабМед КАС Google Scholar
Бейкер П.Дж., Нумата К. Химиоферментативный синтез поли(L-аланина) в водной среде. Биомакромолекулы. 2012;13:947–51.
ПабМед КАС Google Scholar
Tsuchiya K, Kurokawa N, Gimenez-Dejoz J, Gudeangadi PG, Masunaga H, Numata K. Периодическое введение ароматических звеньев в полипептиды посредством химико-ферментативной полимеризации для получения специфических вторичных структур с высокой термостабильностью. Полим Дж. 2019;51:1287–98.
Полим Дж. 2019;51:1287–98.
КАС Google Scholar
Агеитос Дж. М., Бейкер П. Дж., Сугахара М., Нумата К.Катализируемый протеиназой К синтез линейных и звездчатых олиго(L-фенилаланиновых) конъюгатов. Биомакромолекулы. 2013;14:3635–42.
ПабМед КАС Google Scholar
Fagerland J, Finne-Wistrand A, Numata K. Краткий однореакторный химико-ферментативный синтез диблочных соолигопептидов L-лизина и L-аланина. Биомакромолекулы. 2014; 15:735–43.
ПабМед КАС Google Scholar
Tsuchiya K, Numata K. Химиоферментативный синтез полипептидов, содержащих не встречающуюся в природе аминокислоту 2-аминоизомасляную кислоту. хим. коммун. 2017;53:7318–21.
КАС Google Scholar
Yazawa K, Gimenez-Dejoz J, Masunaga H, Hikima T, Numata K. Химиоферментативный синтез пептида, содержащего нейлоновые мономерные звенья, для применения в термически обрабатываемом пептидном материале. Полим хим. 2017;8:4172–6.
Химиоферментативный синтез пептида, содержащего нейлоновые мономерные звенья, для применения в термически обрабатываемом пептидном материале. Полим хим. 2017;8:4172–6.
КАС Google Scholar
Ядзава К., Нумата К. Катализируемый папаином синтез полиглутамата, содержащего нейлоновый мономер. Полимеры. 2016;8:194.
Центральный пабмед Google Scholar
Hu X, Cebe P, Weiss AS, Omenetto F, Kaplan DL. Композиционные материалы на белковой основе. Матер сегодня. 2012;15:208–15.
КАС Google Scholar
Abascal NC, Regan L. Прошлое, настоящее и будущее белковых материалов.Открытая биол. 2018;8:180113.
ПабМед ПабМед Центральный КАС Google Scholar
ван Хест Дж. К., Тиррелл Д.А. Материалы на белковой основе — новый уровень структурного контроля. хим. коммун. 2001; 19:1897–904.
хим. коммун. 2001; 19:1897–904.
Google Scholar
Фаррелл Х.М., Малин Э.Л., Браун Э.М., Ци П.С. Структура мицеллы казеина: что можно узнать из синтеза молока и структурной биологии? Карр Опин Коллоид.Интерфейс. 2006; 11: 135–47.
КАС Google Scholar
Starcher B. Анализ на основе нингидрина для количественного определения общего содержания белка в образцах тканей. Анальная биохимия. 2001; 292:125–9.
ПабМед КАС Google Scholar
Brewer JM, Roberts CW, Stimson WH, Alexander J. Точное определение ассоциированного с адъювантом белка или пептида с помощью нингидринового анализа.вакцина. 1995; 13:1441–4.
ПабМед КАС Google Scholar
Doi E, Shibata D, Matoba T. Модифицированные колориметрические нингидриновые методы анализа пептидазы. Анальная биохимия. 1981; 118: 173–84.
Анальная биохимия. 1981; 118: 173–84.
ПабМед КАС Google Scholar
Нумата К., Бейкер П.Дж. Синтез адгезивных пептидов, подобных обнаруженным у синей мидии (Mytilus edulis), с использованием папаина и тирозиназы.Биомакромолекулы. 2014;15:3206–12.
ПабМед КАС Google Scholar
Gimenez-Dejoz J, Tsuchiya K, Numata K. Взгляд на стереоспецифичность хемоферментной полимеризации, опосредованной папаином, на основе моделирования квантовой механики / молекулярной механики. ACS Chem Biol. 2019;14:1280–92.
ПабМед КАС Google Scholar
Определение рекомбинантного белка | Рекомбинантный белок.ком
- Home » Определение рекомбинантного белка
Рекомбинантный белок представляет собой модифицированную форму белка, которая создается различными способами для производства больших количеств белков, модификации последовательностей генов и производства полезных коммерческих продуктов. Формирование рекомбинантного белка осуществляется в специализированных носителях, известных как векторы. Рекомбинантная технология представляет собой процесс, связанный с образованием рекомбинантного белка.
Формирование рекомбинантного белка осуществляется в специализированных носителях, известных как векторы. Рекомбинантная технология представляет собой процесс, связанный с образованием рекомбинантного белка.
Рекомбинантный белок представляет собой белок, кодируемый геном — рекомбинантной ДНК — который был клонирован в системе, поддерживающей экспрессию гена и трансляцию матричной РНК (см. систему экспрессии). Модификация гена с помощью технологии рекомбинантной ДНК может привести к экспрессии мутантного белка.Белки, коэкспрессированные в бактериях, не будут иметь посттрансляционных модификаций, т.е. фосфорилирование или гликозилирование; для этого необходимы эукариотические системы экспрессии.
Молекулы рекомбинантной ДНК (рДНК) представляют собой последовательности ДНК, полученные в результате использования лабораторных методов (молекулярного клонирования) для объединения генетического материала из нескольких источников с созданием последовательностей, которые иначе не были бы обнаружены в биологических организмах. Рекомбинантная ДНК возможна, потому что молекулы ДНК всех организмов имеют одинаковую химическую структуру; они различаются только последовательностью нуклеотидов в этой идентичной общей структуре.Следовательно, когда ДНК из чужеродного источника связывается с последовательностями хозяина, которые могут управлять репликацией ДНК, а затем вводится в организм хозяина, чужеродная ДНК реплицируется вместе с ДНК хозяина.
Рекомбинантная ДНК возможна, потому что молекулы ДНК всех организмов имеют одинаковую химическую структуру; они различаются только последовательностью нуклеотидов в этой идентичной общей структуре.Следовательно, когда ДНК из чужеродного источника связывается с последовательностями хозяина, которые могут управлять репликацией ДНК, а затем вводится в организм хозяина, чужеродная ДНК реплицируется вместе с ДНК хозяина.
Белки, полученные в результате экспрессии рекомбинантной ДНК в живых клетках, называются рекомбинантными белками. Когда рекомбинантная ДНК, кодирующая белок, вводится в организм-хозяин, рекомбинантный белок не обязательно будет продуцироваться. Экспрессия чужеродных белков требует использования специализированных векторов экспрессии и часто требует значительной реструктуризации чужеродной кодирующей последовательности.
Biologics International Corp (BIC) предоставляет нашим уважаемым клиентам быстрые, высококачественные и экономичные услуги по производству рекомбинантных белков .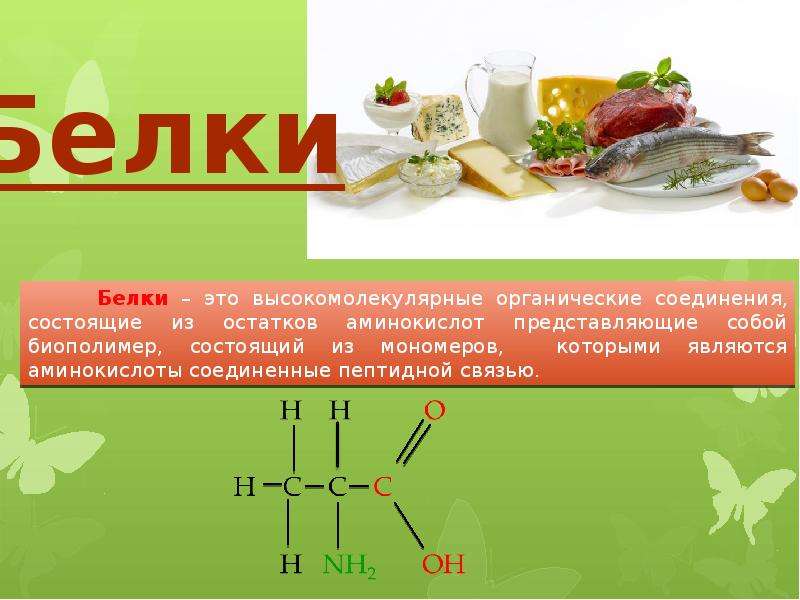 Мы предлагаем производство, а также белки дикого типа, мутантные и ортологические белки. Наши услуги могут продвинуть ваш проект от синтеза генов до экспрессии белков, очистки и создания стабильных клеточных линий. На сегодняшний день мы успешно доставили более 2000 рекомбинантных белков (ферменты, цитокины, факторы роста, гормоны, рецепторы, факторы транскрипции, антитела, фрагменты антител и т.), которые широко используются для получения антител, анализа активности ферментов, оценки эффективности in vivo , диагностики in vitro , а также для скрининга вакцин и других применений.
Мы предлагаем производство, а также белки дикого типа, мутантные и ортологические белки. Наши услуги могут продвинуть ваш проект от синтеза генов до экспрессии белков, очистки и создания стабильных клеточных линий. На сегодняшний день мы успешно доставили более 2000 рекомбинантных белков (ферменты, цитокины, факторы роста, гормоны, рецепторы, факторы транскрипции, антитела, фрагменты антител и т.), которые широко используются для получения антител, анализа активности ферментов, оценки эффективности in vivo , диагностики in vitro , а также для скрининга вакцин и других применений.
Выберите BIC в качестве надежного партнера для ваших исследований белков, и мы можем помочь вам ускорить ваши открытия своевременным и экономически эффективным способом на каждом этапе пути и по очень доступной цене. Свяжитесь с нами сегодня, чтобы поговорить с нашими специалистами по белкам.
Служба экспрессии и очистки белков
Экспрессия бактериального белка
| Бактериальная экспрессионная система | Детали | Время | |
| Тест на клонирование и экспрессию генов | |||
| Разработка стратегии | Мы разработаем оптимальный план в соответствии с требованиями заказчика и характеристиками белка. | 1 день | |
| Оптимизация кодонов | Мы оптимизировали кодон, чтобы максимизировать уровень экспрессии | 1~2 недели | |
| Генный синтез | |||
| Субклонирование гена в вектор экспрессии | Штаммы, отобранные для каждого проекта, доступны все распространенные экспрессионные штаммы | ||
| Конструирование экспрессионного штамма и маломасштабный тест | 2 недели | ||
| Экспериментальная экспрессия и очистка | |||
| Оптимизация экспрессии и культура бактериальных клеток | Результаты: 1~5 мг белка (растворимого, чистота >85%), Клонирующий вектор, Данные контроля качества и окончательный отчет. | 2~3 недели | |
| Многоэтапная очистка белков | |||
| Дополнительные услуги | |||
| Крупносерийное производство | Ферментация с высокой плотностью клеток (HCDF) до 500 л с содержанием клеток 23–130 г/л | 3~5 недель | |
| Удаление эндотоксинов | <0,01-1,0 ЕЭ/мкг, включая обнаружение эндотоксина (анализ LAL) и удаление эндотоксина Triton (фазовое разделение X-114 и т. д.) д.) | 1~2 недели | |
| Метаболическая маркировка | Мечение стабильными изотопами ( 13 C, 15 N), биотинилирование белков и др. | 1~2 недели | |
| Без тегов | Доступны методы ферментативного расщепления и ферментативные методы саморасщепления | 1~2 недели | |
| Высокопроизводительный Экспрессия белка | Наша высокая производительность позволяет нам получать большое количество высокоочищенных белков за короткое время | Индивидуально по вашему проекту | |
| Лиофилизация | 1 день | ||
ПРИМЕЧАНИЕ:
- Размер целевого белка, который вы предоставляете, предпочтительно составляет менее 100 кД.Если нет, пожалуйста, свяжитесь с нами.
- Как правило, мы предлагаем экспрессию и очистку белка с помощью специальных меток (HIS/GST/SUMO..)
- Мы также обеспечиваем экспрессию белков без меток или услуги по удалению меток, но за это взимается дополнительная плата.

- Мы гарантируем стабильность и растворимость белков, но не биологические и функциональные свойства белков.
- Если белок экспрессируется в виде телец включения, будет проведена рефолдинг, чтобы сделать белок растворимым.И если вы не хотите ренатурации, мы также можем предоставить SupernateIN TM и получить белки из супернатанта.
Система экспрессии клеток млекопитающих
| Система экспрессии млекопитающих | Детали | Время | |
| Оптимизация кодонов | Вектор клонирования | 3 недели | |
| Генный синтез | |||
| Плазмидная конструкция | |||
| Транзиторная экспрессия трансфекции | |||
| Подготовка ДНК для трансфекции | 1 мг белка (растворимого, чистота >90%) | 1~2 недели | |
| 1 л HEK293 или клеточной культуры CHO | 2 недели | ||
| Транзиторная экспрессия трансфекции | |||
| Многократная очистка | 1 неделя | ||
| ОК/КК | 1 неделя | ||
| Крупносерийное производство | Индивидуально по вашему проекту | ||
| Разработка линии стабильных клеток | |||
| Тест кривой гибели и оптимизация трансфекции | (опция 1) (опция 2) | 3~4 недели | |
| Подготовка клеток | |||
| Оценка временного выражения | |||
| Стабильная трансфекция | 6~8 недель | ||
| Скрининг положительных клонов/пула клеток | |||
| Скрининг и масштабирование положительных клонов | |||
| Усилитель MTX/MSX | (опция 3) | 7~8 недель | |
| Субклонирование и скрининг клонов отдельных клеток | |||
| Увеличение положительных клонов отдельных клеток | |||
| КК | |||
| Периодическая культура | Отчеты контроля качества | ||
| Испытание на стабильность | |||
| Тест на микоплазму | |||
| Идентификация и замораживание стабильных одноклеточных клонов | |||
Система экспрессии дрожжей
| Система экспрессии дрожжей | Время | |
| Тест на клонирование и экспрессию генов | ||
| Разработка стратегии | 1 день | |
| Оптимизация кодонов | 2~3 недели | |
| Генный синтез | ||
| Субклонирование гена в вектор экспрессии | ||
Строительство П. pastoris многокопийный интегрантный штамм pastoris многокопийный интегрантный штамм | 4~5 недель | |
| Экспрессия и оптимизация белка в небольшом масштабе | ||
| Экспериментальная экспрессия и очистка | ||
| 1-2 л Культура клеток дрожжей | 2~3 недели | |
| 1–5 мг белка (растворимого, чистота >80%) | ||
| Крупносерийное производство | ||
| Производство белка в килограммах/граммах | 4~7 недель | |
Система экспрессии клеток насекомых
| Система экспрессии клеток насекомых | Время | |
| Тест на клонирование и экспрессию генов | ||
| Разработка стратегии | 1 день | |
| Оптимизация кодонов | 2~3 недели | |
| Генный синтез | ||
| Субклонирование интересующего гена в бакуловирусный вектор переноса | ||
| Приготовление рекомбинантной бакмидной ДНК | 3~4 недели | |
| Бакуловирусное титрование | ||
| Экспериментальная экспрессия и очистка | ||
| Трансфекция клеток насекомых, получение запасов бакуловирусов P1 и P2 | 3~4 недели | |
| Экспериментальная экспрессия и очистка белка (500 мл культуры) | ||
| 1 мг белка (растворимого, чистота > 80%) | ||
Контроль качества
| Варианты обслуживания | Детали |
| СТРАНИЦА | Денатурация, восстановление, невосстановление, денситометрия (Bio-Rad ChemiDoc XRS+) |
| Концентрация | Анализ связывания красителя, A280, ОФ-ВЭЖХ |
| Вестерн-блоттинг | Anti-Tag или Anti-Target, колориметрический или хемилюминесцентный (ChemiDoc XRS+) |
| Аналитический SEC | Стандартные или специальные методы |
| ВЭЖХ с обращенной фазой | Стандартные или индивидуальные методы измерения чистоты и/или концентрации |
| Масс-спектрометр | Масса цельного белка по MALDI или ESI, расщепление в геле, ЖХ-МС/МС, квалифицированный партнер |
| Анализ активности | Поглощение, флуоресценция, люминесценция (от кюветы до 384-луночного планшета) |
| ИФА | Анти-метка или анти-мишень, белок клетки-хозяина, коммерческий или заказной |
| Другие | Запросить |
 bad-d:hover > b,.bad-f:hover > b,.bad-g:hover > b,.bad-h:hover > b{color:#006DCC;}
.bad-s:hover .fa-rt,.bad-d:hover .fa-rt,.bad-f:hover .fa-rt,.bad-g:hover .fa-rt,.bad-h:hover .fa-rt{граница:1px сплошная #006DCC;цвет:#006DCC; }
.bad-a:hover>img{box-shadow:0px 0px 8px 4px #ccc}
.fra-on{border:1px solid #ccc;фон: url(./image/data/2017/09/case-r.png) без повторения;размер фона: 50px 50px;позиция фона: 30px;высота : 95 пикселей; радиус границы: 5 пикселей;}
.fra-tw{граница:1px сплошная #ccc;фон: URL(./image/data/2017/09/difficulty-r.png) без повторов; размер фона: 55 пикселей 45 пикселей; положение фона: 30 пикселей; высота: 95 пикселей; радиус границы: 5 пикселей;}
.fra-th{граница:1px сплошной #ccc;фон: url(./image/data/2017/09/organization-r.png) без повторения;размер фона: 50px 50px;позиция фона: 30px;высота : 95 пикселей; радиус границы: 5 пикселей;}
.fra-fo{граница:1px сплошной #ccc;фон: url(./image/data/2017/09/experience-r.png) без повторения;размер фона: 55px 45px;позиция фона: 30px;высота : 95 пикселей; радиус границы: 5 пикселей;}
.
bad-d:hover > b,.bad-f:hover > b,.bad-g:hover > b,.bad-h:hover > b{color:#006DCC;}
.bad-s:hover .fa-rt,.bad-d:hover .fa-rt,.bad-f:hover .fa-rt,.bad-g:hover .fa-rt,.bad-h:hover .fa-rt{граница:1px сплошная #006DCC;цвет:#006DCC; }
.bad-a:hover>img{box-shadow:0px 0px 8px 4px #ccc}
.fra-on{border:1px solid #ccc;фон: url(./image/data/2017/09/case-r.png) без повторения;размер фона: 50px 50px;позиция фона: 30px;высота : 95 пикселей; радиус границы: 5 пикселей;}
.fra-tw{граница:1px сплошная #ccc;фон: URL(./image/data/2017/09/difficulty-r.png) без повторов; размер фона: 55 пикселей 45 пикселей; положение фона: 30 пикселей; высота: 95 пикселей; радиус границы: 5 пикселей;}
.fra-th{граница:1px сплошной #ccc;фон: url(./image/data/2017/09/organization-r.png) без повторения;размер фона: 50px 50px;позиция фона: 30px;высота : 95 пикселей; радиус границы: 5 пикселей;}
.fra-fo{граница:1px сплошной #ccc;фон: url(./image/data/2017/09/experience-r.png) без повторения;размер фона: 55px 45px;позиция фона: 30px;высота : 95 пикселей; радиус границы: 5 пикселей;}
. fra-on:hover,.fra-tw:hover,.fra-th:hover,.fra-fo:hover{box-shadow:0px 0px 6px 1px #ccc;}
@media(max-width:620px){.protein-s{размер шрифта:12px !важно;margin-top:5% !важно}.protein-em{размер шрифта:12px !важно;межбуквенный интервал:- 1px;}.btn-font{padding: 2px 4px !важно;margin:0px !важно;}}
@media(max-width:350px){.bad-s>b,.bad-d>b,.bad-f>b,.bad-g>b,.bad-h>b{размер шрифта:0,8 Эм}}
@media(max-width:700px){.btn-font{padding:5px 10px;размер шрифта:12px}}
@media (максимальная ширина: 1200 пикселей) {.protein-s {размер шрифта: 24 пикселей; верхнее поле: 15%}}
]]>
Белок
fra-on:hover,.fra-tw:hover,.fra-th:hover,.fra-fo:hover{box-shadow:0px 0px 6px 1px #ccc;}
@media(max-width:620px){.protein-s{размер шрифта:12px !важно;margin-top:5% !важно}.protein-em{размер шрифта:12px !важно;межбуквенный интервал:- 1px;}.btn-font{padding: 2px 4px !важно;margin:0px !важно;}}
@media(max-width:350px){.bad-s>b,.bad-d>b,.bad-f>b,.bad-g>b,.bad-h>b{размер шрифта:0,8 Эм}}
@media(max-width:700px){.btn-font{padding:5px 10px;размер шрифта:12px}}
@media (максимальная ширина: 1200 пикселей) {.protein-s {размер шрифта: 24 пикселей; верхнее поле: 15%}}
]]>
Белок— определение (v1) Национального исследовательского института генома человека (NHGRI)
{{Тип публикации | капитализировать }} рейтинг
Определение published_at»> {{Дата публикации}}Qeios ID: {{ публикация.qeios_id }}
Открытый доступ СС BYАвторские права: © {{publicationYear}} {{publication.presentation_authors[0].full_name + (publication.presentation_authors.length > 1 ? ‘et al’ : ») }}. Это публикация с открытым доступом, распространяемая на условиях CC BY 4.0 Лицензия, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания оригинального автора и источника.
Лиц. Информация Проверьте {{ тип публикации | капитализировать }} Источник информации об авторских правах и лицензии.
Связанные определения ({{ публикация.rank_siblings.length }})
Спасибо за ваш вклад в сообщество.
ЗакрыватьБаза данных определений доменов для белков со сложной междоменной геометрией
Abstract
Структурные домены белков необходимы для понимания эволюции и фолдинга белков и могут сильно отличаться от функциональных доменов и доменов, основанных на последовательности. Хотя существуют различные базы данных структурных доменов, определение доменов для некоторых белков нетривиально, а определения границ их доменов недоступны. Здесь мы представляем новую базу данных определенных вручную структурных доменов для репрезентативного набора белков из класса «многодоменных белков» SCOP. (http://prodata.swmed.edu/multidom/). Мы рассматриваем наши домены как мобильные эволюционные единицы, которые могут перестраиваться в процессе эволюции белков. Кроме того, их можно представить как конструктивно компактные и, возможно, независимо складывающиеся единицы. Мы также обнаружили, что представление доменов как единиц эволюции и складывания не всегда приводит к однозначному определению домена.Однако, в отличие от существующих баз данных, мы сохраняем и уточняем эти «альтернативные» определения доменов после тщательной проверки структурного сходства, функциональных сайтов и автоматизированных методов определения доменов. Мы предоставляем определения доменов, включая фактические границы остатков, для белков, которые не пытаются разделить известные базы данных, такие как SCOP и CATH. Наши альтернативные определения доменов подходят для поиска последовательности и структуры автоматизированными методами.
Здесь мы представляем новую базу данных определенных вручную структурных доменов для репрезентативного набора белков из класса «многодоменных белков» SCOP. (http://prodata.swmed.edu/multidom/). Мы рассматриваем наши домены как мобильные эволюционные единицы, которые могут перестраиваться в процессе эволюции белков. Кроме того, их можно представить как конструктивно компактные и, возможно, независимо складывающиеся единицы. Мы также обнаружили, что представление доменов как единиц эволюции и складывания не всегда приводит к однозначному определению домена.Однако, в отличие от существующих баз данных, мы сохраняем и уточняем эти «альтернативные» определения доменов после тщательной проверки структурного сходства, функциональных сайтов и автоматизированных методов определения доменов. Мы предоставляем определения доменов, включая фактические границы остатков, для белков, которые не пытаются разделить известные базы данных, такие как SCOP и CATH. Наши альтернативные определения доменов подходят для поиска последовательности и структуры автоматизированными методами. Кроме того, базу данных можно использовать для обучения и тестирования алгоритмов разграничения доменов.Поскольку наши домены представляют собой структурно компактные эволюционные единицы, база данных может быть полезна для изучения свойств и эволюции доменов.
Кроме того, базу данных можно использовать для обучения и тестирования алгоритмов разграничения доменов.Поскольку наши домены представляют собой структурно компактные эволюционные единицы, база данных может быть полезна для изучения свойств и эволюции доменов.
Образец цитирования: Маджумдар И., Кинч Л.Н., Гришин Н.В. (2009) База данных определений доменов белков со сложной междоменной геометрией. ПЛОС ОДИН 4(4): е5084. https://doi.org/10.1371/journal.pone.0005084
Редактор: Марк Исалан, Центр геномной регуляции, Испания
Получено: 10 февраля 2009 г .; Принято: 10 марта 2009 г .; Опубликовано: 8 апреля 2009 г.
Авторское право: © 2009 Majumdar et al.Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Это исследование было частично поддержано грантом GM67165 Национального института здравоохранения и Фондом Уэлча (грант I-1505) для NVG. Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Хотя белковые домены обычно представляют собой единицы белковой функции [1], их также можно визуализировать как структурно компактные полунезависимые строительные блоки [2], [3]. Следовательно, исторически при определении доменов использовались различные критерии; а именно функция, последовательность, эволюция, структура и соображения складывания. Определения домена, основанные на этих различных соображениях, не всегда согласуются друг с другом.Например, структурно компактная единица может не соответствовать единице с известной биологической функцией [4], так как функциональные сайты часто располагаются между структурными доменами. В этой статье мы представляем базу данных структурно определенных белковых доменов с учетом эволюционных механизмов. Выбранные нами структуры включают в себя некоторые из наиболее структурно сложных известных белков и занесены в каталог «мультидоменных белков» SCOP [5]. Надежные ручные базы данных, такие как SCOP и CATH [6], предоставляют остаточные границы только для доменов в некоторых из этих структур.
В этой статье мы представляем базу данных структурно определенных белковых доменов с учетом эволюционных механизмов. Выбранные нами структуры включают в себя некоторые из наиболее структурно сложных известных белков и занесены в каталог «мультидоменных белков» SCOP [5]. Надежные ручные базы данных, такие как SCOP и CATH [6], предоставляют остаточные границы только для доменов в некоторых из этих структур.
Домены структурно характеризуются наличием изолированных гидрофобных ядер. Кроме того, внутридоменные контакты остатков более обширны, чем между доменами [1], [7], [8]. Это несоответствие в контактах остатков может указывать на области зародышеобразования в процессе сворачивания. Таким образом, структурные домены также можно отнести к самостоятельным складчатым единицам [9]. Альтернативно, во время эволюции белка могут происходить модульные перестройки первичной последовательности путем вставок или делеций [10], [11].Эти эволюционные модули также могут быть визуализированы как домены и могут быть определены на основе совпадения с другими доменами в разных белках [12], [13]. Логическим продолжением этой модульности является поддержание непрерывности последовательности доменов. Наша работа использует обе эти точки зрения для определения доменов.
Логическим продолжением этой модульности является поддержание непрерывности последовательности доменов. Наша работа использует обе эти точки зрения для определения доменов.
Одним из ключевых преимуществ надежного набора эталонных доменов является поиск по сходству, когда эталонные домены могут использоваться в качестве запроса. Во-вторых, они также могут служить учебным набором для разработки автоматизированных методов определения предметной области.Такие эталонные домены обычно получают из существующих баз данных, таких как SCOP [5] или CATH [6]. SCOP предоставляет базу данных классификации белков, составленную вручную, состоящую из доменов, определяемых в основном гомологией. Например, если участок полипептидной цепи присутствует в нескольких белках, но соединен с разными, негомологичными участками, он считается доменом. Точно так же CATH обеспечивает иерархическую классификацию доменов на основе архитектуры (общая форма), топологии (складчатость) и гомологии, но использует комбинацию автоматических и ручных процедур. Для определения доменов также доступен ряд автоматизированных методов. Более надежные используют обнаружение подобия, особенно путем поиска первичной и третичной структур с использованием домена запроса. Однако использование этих сходств для поиска связанных структур хорошо работает только для больших доменов или более высокой идентичности [14], [15] и для которых доступны надежные определения домена запроса. В этой статье мы сравниваем наши определения доменов с определениями, полученными с помощью автоматизированных методов Domak [16] и PDP [17].Оба метода используют межостаточные контакты для обнаружения компактных структурных областей. Кроме того, Domak использует упаковку вторичной структуры и статистические параметры, полученные из набора эталонных доменов, как описано в литературе, для разграничения доменов. Альтернативно, PDP разлагает домены, минимизируя разрыв цепи между пространственно близкими остатками. Однако, несмотря на большое количество существующих баз данных и автоматизированных методов, совпадение в определении доменов между ними наблюдается только для простейших топологий белков [18].
Для определения доменов также доступен ряд автоматизированных методов. Более надежные используют обнаружение подобия, особенно путем поиска первичной и третичной структур с использованием домена запроса. Однако использование этих сходств для поиска связанных структур хорошо работает только для больших доменов или более высокой идентичности [14], [15] и для которых доступны надежные определения домена запроса. В этой статье мы сравниваем наши определения доменов с определениями, полученными с помощью автоматизированных методов Domak [16] и PDP [17].Оба метода используют межостаточные контакты для обнаружения компактных структурных областей. Кроме того, Domak использует упаковку вторичной структуры и статистические параметры, полученные из набора эталонных доменов, как описано в литературе, для разграничения доменов. Альтернативно, PDP разлагает домены, минимизируя разрыв цепи между пространственно близкими остатками. Однако, несмотря на большое количество существующих баз данных и автоматизированных методов, совпадение в определении доменов между ними наблюдается только для простейших топологий белков [18].
В результате этой работы мы разработали базу данных ручных определений доменов с заданными диапазонами остатков, основанную главным образом на комбинированных концепциях структурного сходства, компактности и непрерывности последовательностей. Эти определения доменов доступны в Интернете по адресу http://prodata.swmed.edu/multidom/. Наши определения доменов будут полезны не только для поиска сходства и разработки автоматизированных методов, но, возможно, также для изучения свойств и эволюции доменов.
Results
Мы предоставляем новую базу данных доменов, определенных вручную, с границами остатков для каждого домена, для набора топологически сложных белков (http://prodata.swmed.edu/multidom/). Наши определения доменов основаны на структурных, функциональных, последовательных и эволюционных соображениях после тщательного изучения соответствующей литературы и проверки доменов, определенных с помощью существующих автоматизированных методов. Мы предоставляем загружаемые сценарии PyMol [19], чтобы легко просматривать определения наших доменов для каждой цепочки, а также последовательности доменов и 3D-координаты для каждого домена. Определения доменов даны для репрезентативного набора (40% идентичности последовательности, всего 157 цепей) цепей PDB [20] из класса «многодоменных белков» в SCOP (версия 1.73) [5]. Цепи PDB в базе данных были классифицированы на 53 группы гомологичных белков. Эти группы соответствуют «складкам» SCOP в классе «многодоменных белков». Более крупные и разнообразные группы (например, полимеразы) были разделены на подгруппы.
Определения доменов даны для репрезентативного набора (40% идентичности последовательности, всего 157 цепей) цепей PDB [20] из класса «многодоменных белков» в SCOP (версия 1.73) [5]. Цепи PDB в базе данных были классифицированы на 53 группы гомологичных белков. Эти группы соответствуют «складкам» SCOP в классе «многодоменных белков». Более крупные и разнообразные группы (например, полимеразы) были разделены на подгруппы.
Альтернативные определения домена
домена в нашей базе данных представляют собой компактные эволюционные модули, которые могут окончательно сливаться или вставляться в первичную последовательность других доменов. Мы считаем, что это слияние или вставка домена вызвано одним эволюционным событием.Для некоторых белков это эволюционное рассмотрение модульных доменов может поддерживать альтернативные определения доменов (альтернативные эволюционные модули). Основываясь на структурном перекрытии терминальных расширений, одна и та же пара доменов может быть визуализирована как терминально слитая (непрерывная последовательность) или вставленная одна в другую (прерывистая последовательность). Для белков с большим количеством доменов такое альтернативное определение может быть возможно в отношении лишь нескольких или даже пары составляющих доменов.Кроме того, концепции доменной модульности исключают возникновение определенных структурно компактных областей в результате одного эволюционного события. Обычно они состоят из структурно компактной группы вставок в другие домены. Вместо того, чтобы исключить эти регионы из нашей базы данных, мы определяем их как еще одно альтернативное определение домена (составные домены). Эти альтернативные определения доменов объясняются ниже.
Для белков с большим количеством доменов такое альтернативное определение может быть возможно в отношении лишь нескольких или даже пары составляющих доменов.Кроме того, концепции доменной модульности исключают возникновение определенных структурно компактных областей в результате одного эволюционного события. Обычно они состоят из структурно компактной группы вставок в другие домены. Вместо того, чтобы исключить эти регионы из нашей базы данных, мы определяем их как еще одно альтернативное определение домена (составные домены). Эти альтернативные определения доменов объясняются ниже.
Альтернативные эволюционные модули.
Обычным явлением в многодоменных белковых структурах было наличие относительно коротких неглобулярных удлинений на N- или C-конце домена, которые взаимодействовали с соседним доменом.Известно, что такие терминальные удлинения стабилизируют ассоциированные домены (рис. 1а, синее N-концевое α-спиральное удлинение из наследственного домена 2 взаимодействует со слитым розовым наследственным доменом 1). Этот сценарий привел к непрерывной последовательности для каждого домена (рис. 1а, синий сегмент, за которым следует розовый сегмент). В качестве альтернативы, расширения могут быть результатом события вставки домена вблизи концов наследственного домена (голубой вставленный домен на рис. 1b разделяет розовый наследственный домен), вызывая разрыв последовательности в наследственном домене (синий сегмент на рис. 1b разделяет розовый сегмент).Поскольку каждый из этих сценариев в равной степени возможен с точки зрения эволюции, терминальные расширения определяются отдельно, и предоставляются альтернативные определения доменов: определения «по последовательности» включают расширение как часть непрерывного домена последовательности (рис. 1а), тогда как «по структуре» определения включают расширение как часть структурно взаимодействующей области (рис. 1b).
Этот сценарий привел к непрерывной последовательности для каждого домена (рис. 1а, синий сегмент, за которым следует розовый сегмент). В качестве альтернативы, расширения могут быть результатом события вставки домена вблизи концов наследственного домена (голубой вставленный домен на рис. 1b разделяет розовый наследственный домен), вызывая разрыв последовательности в наследственном домене (синий сегмент на рис. 1b разделяет розовый сегмент).Поскольку каждый из этих сценариев в равной степени возможен с точки зрения эволюции, терминальные расширения определяются отдельно, и предоставляются альтернативные определения доменов: определения «по последовательности» включают расширение как часть непрерывного домена последовательности (рис. 1а), тогда как «по структуре» определения включают расширение как часть структурно взаимодействующей области (рис. 1b).
Рисунок 1. Категории определения домена.
Схемы доменной архитектуры в виде блок-схемы, представляющие стратегию для категорий определения домена, показаны слева, с соответствующими структурами (1amu для a и b; 1qme для c и d) справа.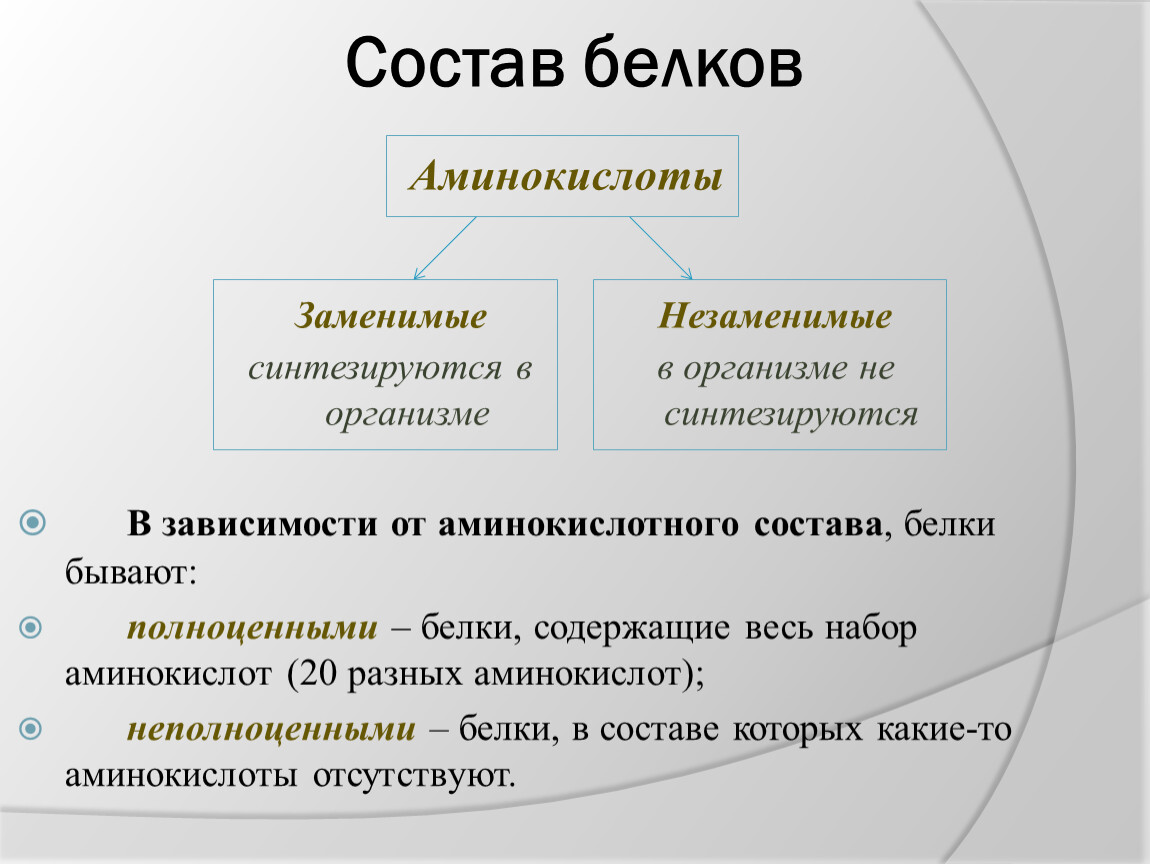 Схематическое представление последовательности, представляющее положение доменов в полипептидной цепи, показано ниже каждой блок-схемы. Номера остатков отмечены на линкерах, соединяющих домены, где N и C обозначают концы. Для ясности показаны только часть структуры белка и соответствующие схемы. Пунктирные линии указывают домены, опущенные в структурах. Терминальные расширения, которые выступают из одного домена, но взаимодействуют с другим доменом, определяются (а) близостью последовательностей («по последовательностям») или (б) близостью структур («по структуре»).Вставки выступающих доменов, которые взаимодействуют с соседними доменами, определяются (c) близостью последовательностей или (d) структурной близостью, что приводит к составному домену.
Схематическое представление последовательности, представляющее положение доменов в полипептидной цепи, показано ниже каждой блок-схемы. Номера остатков отмечены на линкерах, соединяющих домены, где N и C обозначают концы. Для ясности показаны только часть структуры белка и соответствующие схемы. Пунктирные линии указывают домены, опущенные в структурах. Терминальные расширения, которые выступают из одного домена, но взаимодействуют с другим доменом, определяются (а) близостью последовательностей («по последовательностям») или (б) близостью структур («по структуре»).Вставки выступающих доменов, которые взаимодействуют с соседними доменами, определяются (c) близостью последовательностей или (d) структурной близостью, что приводит к составному домену.
https://doi.org/10.1371/journal.pone.0005084.g001
Составные домены.
В дополнение к концевым расширениям некоторые домены включали относительно короткое нешаровидное расширение, которое выступало из домена (неконцевое расширение), но взаимодействовало с другим доменом.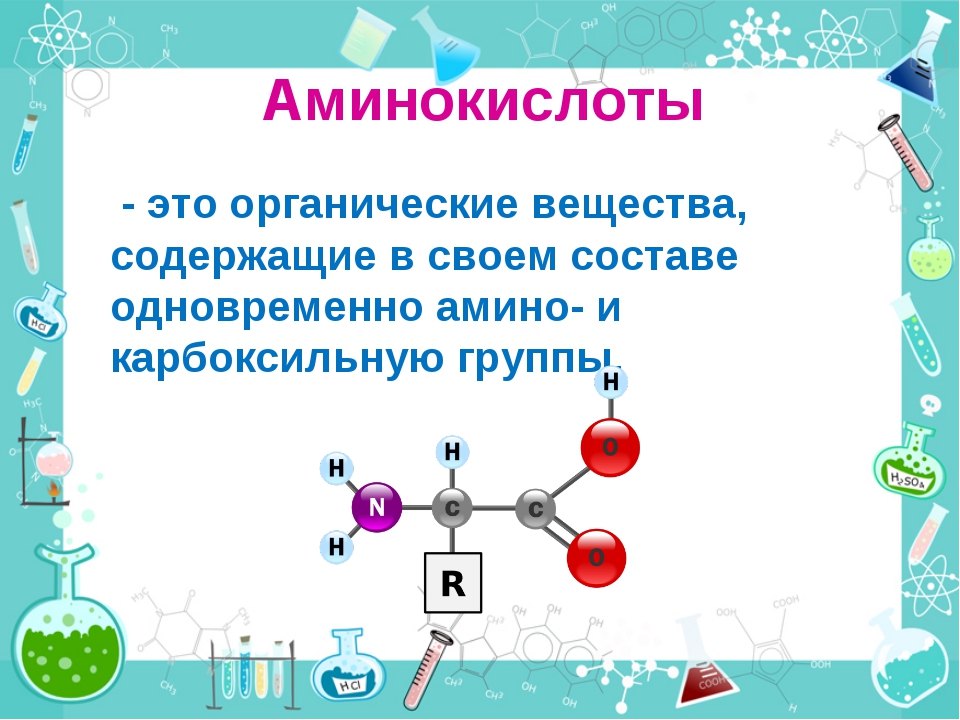 Например, β-шпилька, отходящая от середины профиллиноподобного сэндвич-домена α/β/α в пенициллин-связывающем белке, в 2 раза расширяет β-лист N-концевого домена (рис. 1c и d).Эта β-шпилька, вероятно, возникла как вставка в домен профиллина, которая стабилизирует ранее существовавшие взаимодействия с N-концевым доменом (на рис. 1с бирюзовая вставка в наследственный домен 2 взаимодействует с красным наследственным доменом 1). Сохранение вставки с выступающим доменом сохраняет непрерывность последовательности для обоих доменов (красный сегмент на рис. 1c, за которым следует бирюзовый сегмент) и подчиняется эволюционным предположениям о модульности домена. Альтернативно, вставка может быть структурно определена как принадлежащая N-концевому домену, с которым она взаимодействует.Такое назначение привело к «составному» домену, который можно было объяснить только несколькими событиями вставки, и привело к разрыву последовательности (красная вставка в бирюзовый домен на рис. 1d завершает красный составной домен).
Например, β-шпилька, отходящая от середины профиллиноподобного сэндвич-домена α/β/α в пенициллин-связывающем белке, в 2 раза расширяет β-лист N-концевого домена (рис. 1c и d).Эта β-шпилька, вероятно, возникла как вставка в домен профиллина, которая стабилизирует ранее существовавшие взаимодействия с N-концевым доменом (на рис. 1с бирюзовая вставка в наследственный домен 2 взаимодействует с красным наследственным доменом 1). Сохранение вставки с выступающим доменом сохраняет непрерывность последовательности для обоих доменов (красный сегмент на рис. 1c, за которым следует бирюзовый сегмент) и подчиняется эволюционным предположениям о модульности домена. Альтернативно, вставка может быть структурно определена как принадлежащая N-концевому домену, с которым она взаимодействует.Такое назначение привело к «составному» домену, который можно было объяснить только несколькими событиями вставки, и привело к разрыву последовательности (красная вставка в бирюзовый домен на рис. 1d завершает красный составной домен). Кроме того, также наблюдалось, что некоторые соседние неглобулярные домены образуют компактные глобулярные единицы с общими гидрофобными ядрами. Наша база данных также предоставляет составные определения доменов для этих кластеров доменов. Таким образом, мультидоменный набор белковых данных включал составные домены, состоящие из различных комбинаций вставок и доменов (вставка+вставка, вставка+домен или домен+домен).
Кроме того, также наблюдалось, что некоторые соседние неглобулярные домены образуют компактные глобулярные единицы с общими гидрофобными ядрами. Наша база данных также предоставляет составные определения доменов для этих кластеров доменов. Таким образом, мультидоменный набор белковых данных включал составные домены, состоящие из различных комбинаций вставок и доменов (вставка+вставка, вставка+домен или домен+домен).
Таким образом, наша база данных предоставляет четыре категории определений: «по структуре», «по последовательности», составные домены и расширения. Определения «по структуре» более применимы для поиска структурного сходства, поскольку концевые расширения, связанные с пространственно ближайшим доменом, могут быть важны для поиска удаленных гомологов. Определения «по последовательности», которые приписывают терминальные удлинения полипептидному сегменту с непрерывной последовательностью (аналогично SCOP), более полезны для стратегий поиска последовательности; поскольку такие области могут содержать мотивы консервативной последовательности. Категория «расширения» определяет расширенные области (концевые расширения, вставки и линкеры), которые различаются определениями «по структуре» и «по последовательности». Наконец, «составные» домены не представляют эволюционных единиц и являются чисто геометрическими, но могут быть полезны в исследованиях конвергентной эволюции.
Категория «расширения» определяет расширенные области (концевые расширения, вставки и линкеры), которые различаются определениями «по структуре» и «по последовательности». Наконец, «составные» домены не представляют эволюционных единиц и являются чисто геометрическими, но могут быть полезны в исследованиях конвергентной эволюции.
Сравнение с другими ручными и автоматическими методами определения домена
Определенные вручную домены в нашей базе данных относятся к трем альтернативным категориям (613 «по структуре», 612 «по последовательности» и 58 «составных»).Кроме того, база данных отдельно определяет 83 вставки, компоновщики и терминальные расширения, которые также являются частью определений домена. CATH [6], представляющая собой базу данных, созданную с использованием ручных и автоматических процедур, а также двумя автоматизированными методами, а именно PDP [17] и Domak [16], определила 273, 443 и 297 доменов соответственно для структур в нашей базе данных. Однако домены для 58 цепочек PDB (из 157) еще не были назначены CATH, когда этот проект был завершен. Мы определили по крайней мере два домена для каждой цепи в классе многодоменных белков (рис. 2а по структуре), при этом количество доменов, определенных для каждой цепи, постепенно уменьшалось с 2 до 6.Ручные определения также разбивают 13 цепей на 7 или более доменов и в основном представляют собой белки, участвующие в репликации и транскрипции, особенно полимеразы. Хотя SCOP [5] не всегда предоставлял диапазоны доменов для сравнения классов нескольких доменов, база данных редко определяет более трех доменов на цепочку в первых четырех классах структуры (рис. 2a SCOP). Номера доменов CATH были ближе всего к нашему ручному методу (рис. 2a CATH), при этом количество цепочек, содержащих 2–6 доменов, было очень похожим. Однако CATH определил 14 цепей как одиночные домены и несколько цепей с 7 или более доменами.Автоматизированные методы определения доменов, особенно DOMAK (рис. 2a DOMAK), имеют тенденцию назначать меньше доменов. PDP выполняется близко к ручному определению, однако с меньшим количеством доменов в цепочке (рис.
Мы определили по крайней мере два домена для каждой цепи в классе многодоменных белков (рис. 2а по структуре), при этом количество доменов, определенных для каждой цепи, постепенно уменьшалось с 2 до 6.Ручные определения также разбивают 13 цепей на 7 или более доменов и в основном представляют собой белки, участвующие в репликации и транскрипции, особенно полимеразы. Хотя SCOP [5] не всегда предоставлял диапазоны доменов для сравнения классов нескольких доменов, база данных редко определяет более трех доменов на цепочку в первых четырех классах структуры (рис. 2a SCOP). Номера доменов CATH были ближе всего к нашему ручному методу (рис. 2a CATH), при этом количество цепочек, содержащих 2–6 доменов, было очень похожим. Однако CATH определил 14 цепей как одиночные домены и несколько цепей с 7 или более доменами.Автоматизированные методы определения доменов, особенно DOMAK (рис. 2a DOMAK), имеют тенденцию назначать меньше доменов. PDP выполняется близко к ручному определению, однако с меньшим количеством доменов в цепочке (рис. 2a PDP). В отличие от наших определений, PDP определял цепочки как отдельные домены, тогда как количество цепочек с 7 и более доменами было очень схожим.
2a PDP). В отличие от наших определений, PDP определял цепочки как отдельные домены, тогда как количество цепочек с 7 и более доменами было очень схожим.
Рисунок 2. Сравнение определений доменов.
Определения категорий «По структуре» и «По последовательности» (см. рис. 1a, b) сравниваются с CATH и автоматизированными методами «PDP» и «DOMAK» для нашего набора структурных данных (см. методы).Данные для SCOP генерируются из цепочек PDB в классах SCOP с 1 по 4. Данные на вертикальной оси нормализованы к общему количеству цепочек или доменов PDB в соответствующем наборе данных. (a) Количество доменов, определенных в цепочке каждым методом. Данные «По последовательности» идентичны данным «По структуре» и не отображаются. (b) Количество полипептидных сегментов, включающих каждый домен. (c) Гистограмма, представляющая остаточные длины определенных доменов. Для ясности показаны только домены длиной до 215 остатков.
https://дои.org/10.1371/journal. pone.0005084.g002
pone.0005084.g002
Несмотря на то, что вручную было определено больше доменов для одной цепи по сравнению с автоматическими методами, ручное определение дало незначительно меньшее количество полипептидных сегментов на домен (рис. 2b). Это увеличение непрерывности последовательности ручных доменов является результатом наложения эволюционных предположений на расщепления: компактные области, состоящие из нескольких вставленных сегментов, не могли представлять отдельные эволюционные события и рассматривались в особой категории «составных» доменов.Разница в количестве полипептидных сегментов, присутствующих на домен, между ручными определениями категорий «по последовательности» и «по структуре» указывала на структуры, которые содержали концевые удлинения. Следовательно, домены, в которых терминальным расширениям была назначена непрерывная последовательность (по последовательности), имеют несколько меньшее количество сегментов, чем домены, в которых концевые расширения были назначены по структурной близости (по структуре). В отличие от ручного и автоматизированного определения доменов, SCOP редко вводил прерывистость последовательности в свою классификацию первых четырех структурных классов (SCOP на рис. 2b).CATH определил несколько большее количество сегментов на домен, чем наши определения.
В отличие от ручного и автоматизированного определения доменов, SCOP редко вводил прерывистость последовательности в свою классификацию первых четырех структурных классов (SCOP на рис. 2b).CATH определил несколько большее количество сегментов на домен, чем наши определения.
Для анализа размера домена наши ручные определения были сопоставимы с PDP, SCOP и CATH по проценту определенных доменов в диапазоне от 95 до 215 остатков в длину, при этом DOMAK смещался в сторону более длинных доменов (рис. 2c). Однако в этом диапазоне CATH определил больше доменов длиной от 125 до 185 остатков. В то время как все методы показали пик около 95 остатков на домен, CATH показал пик около 140 с последующим внезапным уменьшением размера домена.В отличие от других, наша база данных включала значительное количество доменов с менее чем 50 остатками и редко определенные домены длиной более 300 остатков. Наш ручной подход идентифицировал очень короткие домены (например, цинковые пальцы, обнаруженные при проверке цистеинов и гистидинов), которые не обнаруживались автоматическими методами. Кроме того, наши определения стремились предоставить меньшие компактные домены.
Кроме того, наши определения стремились предоставить меньшие компактные домены.
Во время нашей визуальной оценки мы обнаружили, что автоматические методы не могут предоставить согласованные определения доменов для большинства цепочек в наборе данных.Автоматизированные методы достигли консенсуса только в очень простых случаях, когда структурно компактные домены демонстрировали мало междоменных взаимодействий. Почти в каждом случае границы доменов из этих программ требовали дальнейшего уточнения, даже если номер домена и их общее расположение были правильными. Определения доменов, полученные из CATH, хотя и были неполными, но были более надежными. Однако мы заметили случайные несоответствия в определениях доменов между похожими белками. Эти проблемы и ограничения определения домена были хорошо задокументированы другими [18].Однако мы обнаружили, что даже эти ограниченные определения могут оказаться полезными, например, для предложения потенциальных ядер доменов. Литература помогла нам в наших функциональных соображениях для нескольких определений предметной области, например. в 1ecr [21] были проанализированы некомпактные функциональные области и остатки на границах доменов, чтобы их можно было отнести к правильному домену.
в 1ecr [21] были проанализированы некомпактные функциональные области и остатки на границах доменов, чтобы их можно было отнести к правильному домену.
Эволюционные соображения: пример разграничения доменов в ДНК/РНК-полимеразах
Для семейств белков с большим количеством доступных структур сочетание структурного сходства с эволюционными соображениями было особенно полезным при определении доменов.Наши модульные домены могут быть точно идентифицированы, а границы уточнены по структурному сходству консервативных доменов, положению вставки и общей топологии различных ассоциированных доменов и взаимодействию между ними. Мы иллюстрируем наш общий ход мыслей и трудности с определением домена на примере ДНК/РНК-полимераз. Общая архитектура полимераз включает три функциональных домена, обычно называемых «ладонь», «большой палец» и «палец», причем вездесущий пальмовый домен обеспечивает каталитическую активность ферментов [22].Мы разделили полимеразы на четыре группы на основе легкости структурного выравнивания и сходства трех общих доменов (рис. 3, I-IV).
3, I-IV).
Рисунок 3. Модульные домены в полимеразах.
Разнообразные полимеразные структуры, демонстрирующие организацию доменов различной сложности и связности, делятся на четыре помеченные подгруппы: i) ДНК-полимераза семейства Y, ii) ДНК-полимераза Кленова / полимеразы фага Т7, iii) обратная транскриптаза / РНК-зависимая РНК-полимераза и iv ) ДНК-полимераза I.а) Все полимеразные структуры обладают гомологичным каталитическим доменом Palm (зеленые мультяшные модели). Пальмовые домены представителей каждого подмножества полимераз изображены слева направо в одинаковой ориентации (i 1jx4; ii 1u4b, iii 1vrt и iv 1tgo). Цветные сферы отмечают границы пальмовых доменов: вставленный пальцевый домен (желтый), N-концевые домены (голубой и голубой) или С-концевой домен (пшеница). Дополнительные домены представлены в виде цветных сфер, соединенных от N- к С-концу пунктирной линией.b) Мультяшные модели структуры ДНК-полимеразы IV Sulfolobus solfataricus (i) ДНК-полимеразы I Bacillus stearothermophilus , (ii), обратной транскриптазы HIV-I (iii) и ДНК-полимеразы Thermococcus gorgonarius типа B (iv) ).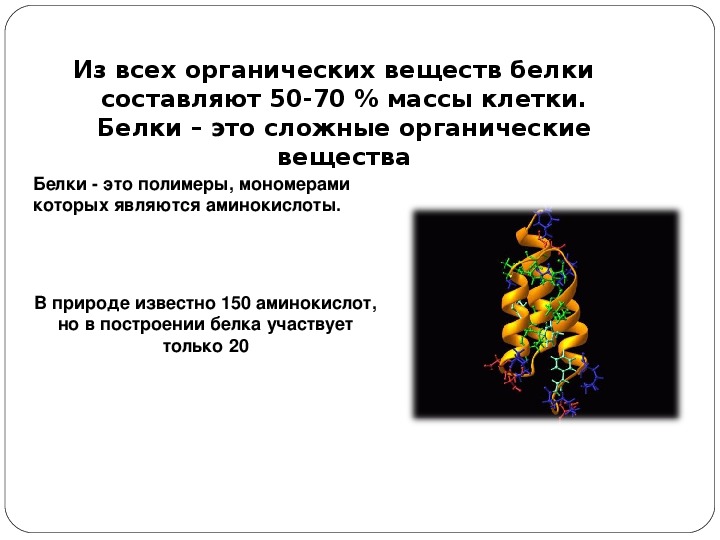 Окрашены, как в A. c) Непрерывность последовательности определенных доменов, представленных в виде блоков от N- до C-конца.
Окрашены, как в A. c) Непрерывность последовательности определенных доменов, представленных в виде блоков от N- до C-конца.
https://doi.org/10.1371/journal.pone.0005084.g003
В полимеразных структурах всех групп каталитический домен пальмы включает ферредоксин-подобную складку (рис. 3а, зеленый), которая по-разному декорирована рядом дополнительные домены.Сама ферредоксиноподобная складка содержала различные дополнительные вторичные структурные элементы, укладывавшиеся на фоне консервативного β-листа (рис. 3а): домен ладони в группе I включал С-концевое расширение α/β, группа II включала N-концевое спиральное удлинение и группа III и IV включала С-концевую β-шпильку. Наши домены сильно различаются по размеру и шаровидности (рис. 3b: голубые и оранжевые домены). Кроме того, эти разные домены могут по-разному комбинироваться в одной структуре. Наблюдались многочисленные вставки доменов; следовательно, хотя все домены были компактными и модульными, не все были непрерывными последовательности (рис. 3с).Например, разрыв последовательности в домене зеленой пальмы был вызван вставкой домена желтых пальцев. Наши эволюционные соображения могли бы объяснить каждую из этих вставок доменов как возникающую в результате отдельных отдельных эволюционных событий. Кроме того, также наблюдались «вложенные» вставки, которые могли произойти из-за каскада вставок доменов (например, структурно компактный пурпурный домен вставлен в желтый домен, где сам желтый домен был вставлен в зеленый домен на рис. 3II).
3с).Например, разрыв последовательности в домене зеленой пальмы был вызван вставкой домена желтых пальцев. Наши эволюционные соображения могли бы объяснить каждую из этих вставок доменов как возникающую в результате отдельных отдельных эволюционных событий. Кроме того, также наблюдались «вложенные» вставки, которые могли произойти из-за каскада вставок доменов (например, структурно компактный пурпурный домен вставлен в желтый домен, где сам желтый домен был вставлен в зеленый домен на рис. 3II).
В то время как домен ладони был наиболее консервативным и, следовательно, представлял собой эволюционную основную единицу полимеразных структур, домены большого пальца и пальца демонстрировали значительные топологические вариации. Структурное положение домена большого пальца было сохранено по отношению к ладони (рис. 3b, пшеница), хотя его последовательное расположение варьировало (рис. 3c, пшеница). Таким образом, определения домена большого пальца основывались на положении относительно ладони. Большие пальцы групп 1, III и IV были слиты с С-концом ладони, в то время как большие пальцы группы II были обнаружены N-концом ладони в виде вложенной вставки (рис. 3, светло-голубой).Кроме того, несмотря на сохранение преимущественно α-спиральной вторичной структуры, домены большого пальца демонстрировали низкое структурное сходство между группами и включали различные размеры и топологию α-спиралей. В отличие от доменов большого пальца, пальцы были определены на основе последовательного положения по отношению к домену ладони. Компонент пальцевого домена (рис. 3, желтый) всегда вставлялся в ладонный домен в одном и том же месте. Однако состав вторичной структуры пальцевого домена, топология и взаимодействие с соседними доменами различались.
Большие пальцы групп 1, III и IV были слиты с С-концом ладони, в то время как большие пальцы группы II были обнаружены N-концом ладони в виде вложенной вставки (рис. 3, светло-голубой).Кроме того, несмотря на сохранение преимущественно α-спиральной вторичной структуры, домены большого пальца демонстрировали низкое структурное сходство между группами и включали различные размеры и топологию α-спиралей. В отличие от доменов большого пальца, пальцы были определены на основе последовательного положения по отношению к домену ладони. Компонент пальцевого домена (рис. 3, желтый) всегда вставлялся в ладонный домен в одном и том же месте. Однако состав вторичной структуры пальцевого домена, топология и взаимодействие с соседними доменами различались.
Составные домены также наблюдались среди полимераз. Вместе с N-концевым доменом (рис. 3, голубой) вставки из пальцев групп III и IV образуют сложную глобулярную структуру с обширными междоменными взаимодействиями и общим гидрофобным ядром. Составной домен имел прерывистую последовательность (рисунок 3C, голубой, зеленый и желтый), и его образование нельзя было объяснить эволюционно одним событием вставки. Следовательно, мы не рассматриваем его как эволюционный модуль. Таким образом, составные домены представляли собой особый случай, когда расположение первичной последовательности и эволюционные соображения указывали на два отдельных домена, а структура предполагала комбинированное определение домена.
Составной домен имел прерывистую последовательность (рисунок 3C, голубой, зеленый и желтый), и его образование нельзя было объяснить эволюционно одним событием вставки. Следовательно, мы не рассматриваем его как эволюционный модуль. Таким образом, составные домены представляли собой особый случай, когда расположение первичной последовательности и эволюционные соображения указывали на два отдельных домена, а структура предполагала комбинированное определение домена.
Помимо ладони, большого пальца и пальцев, полимеразные структуры включали различные дополнительные домены. Один из таких доменов напоминал топологию укладки, подобную рибонуклеазе H (подобную РНКазе H) (рис. 3b, оранжевый). Было обнаружено, что этот РНКазо-подобный домен по-разному расположен в первичной последовательности (рис. 3с, оранжевый) среди полимераз. Структуры в группах II и IV включали РНКазо-Н-подобные домены, N-концевые по отношению к обычным полимеразным компонентам, тогда как в группе III домен был С-концевым. Во всех структурах группы I отсутствует РНКазо-Н-подобный домен.Эти вариации иллюстрируют модульную перестройку доменов среди полимераз [11] и дают дополнительные сведения о границах доменов.
Во всех структурах группы I отсутствует РНКазо-Н-подобный домен.Эти вариации иллюстрируют модульную перестройку доменов среди полимераз [11] и дают дополнительные сведения о границах доменов.
Обсуждение
Хотя биологи согласны с тем, что белки состоят из доменов и что анализ составляющих доменов важен для изучения всего белка, широко распространены разногласия относительно свойств и определения самих отдельных доменов. Таким образом, концепция домена (что такое домен?) и методы их определения в данном белке (как найти границы домена?) должны быть рассмотрены и являются необходимым условием для автоматизированного анализа различных свойств белка.Кроме того, возникают вопросы, касающиеся возможности предоставления согласованных определений доменов для белков на основе нескольких общих принципов. Эта работа, основанная на наборе топологически сложных белков, представляет собой шаг к достижению этих важных целей.
Что такое домен?
Пожалуй, самая большая трудность в предметных исследованиях — это отсутствие единого ответа на вопрос: что такое домен? Интересно, что можно предложить несколько «концепций» предметной области. Среди них стоит отметить следующие пять широко распространенных концепций.1) Функциональные домены характеризуются функциональной самостоятельностью и образуют единицы, достаточные для определенной, преимущественно ферментативной, активности. Поскольку функциональная характеристика белкового домена часто является основной целью, белковые домены обычно рассматриваются как функциональные домены. 2) Домены последовательности представляют собой области полипептидной цепи, которые могут быть обнаружены по сходству последовательностей и могут быть обнаружены в комбинации с другими доменами последовательности. Эти домены широко используются в анализе последовательностей, где неправильные границы подразумевают ошибочное разграничение консервативных областей.Поскольку на консервативные области полагаются методы поиска на основе профиля последовательности, такие как PSI-BLAST [23] и другие транзитивные стратегии для вывода о гомологии, важно правильное определение границ доменов.
Среди них стоит отметить следующие пять широко распространенных концепций.1) Функциональные домены характеризуются функциональной самостоятельностью и образуют единицы, достаточные для определенной, преимущественно ферментативной, активности. Поскольку функциональная характеристика белкового домена часто является основной целью, белковые домены обычно рассматриваются как функциональные домены. 2) Домены последовательности представляют собой области полипептидной цепи, которые могут быть обнаружены по сходству последовательностей и могут быть обнаружены в комбинации с другими доменами последовательности. Эти домены широко используются в анализе последовательностей, где неправильные границы подразумевают ошибочное разграничение консервативных областей.Поскольку на консервативные области полагаются методы поиска на основе профиля последовательности, такие как PSI-BLAST [23] и другие транзитивные стратегии для вывода о гомологии, важно правильное определение границ доменов. 3) Эволюционные домены представляют собой модули, которые могут перемещаться между белками посредством рекомбинации, транспозиции, перетасовки экзонов и других мутационных событий. Таким образом, их появление в контекстах разнородных доменов, при условии, что гомология может быть обнаружена по последовательности или структурному сходству, формирует основу определения эволюционного домена.4) Домены как единицы укладки были определены в первые дни изучения белков [2]. Эта концепция подразумевает, что изолированный домен способен к независимому фолдингу или, по крайней мере, обладает ядром фолдинга, которое может инициировать фолдинг белка. 5) Структурные домены определяются геометрически структурной компактностью, наличием гидрофобного ядра и более обширными аминокислотными взаимодействиями внутридоменными, а не междоменными. Такие домены необходимы для поиска структурного сходства.Для многих белков, например те, которые выглядят как «бусины на нитке» с доменами, которые хорошо отделены друг от друга, все 5 понятий могут привести к одному и тому же определению домена.
3) Эволюционные домены представляют собой модули, которые могут перемещаться между белками посредством рекомбинации, транспозиции, перетасовки экзонов и других мутационных событий. Таким образом, их появление в контекстах разнородных доменов, при условии, что гомология может быть обнаружена по последовательности или структурному сходству, формирует основу определения эволюционного домена.4) Домены как единицы укладки были определены в первые дни изучения белков [2]. Эта концепция подразумевает, что изолированный домен способен к независимому фолдингу или, по крайней мере, обладает ядром фолдинга, которое может инициировать фолдинг белка. 5) Структурные домены определяются геометрически структурной компактностью, наличием гидрофобного ядра и более обширными аминокислотными взаимодействиями внутридоменными, а не междоменными. Такие домены необходимы для поиска структурного сходства.Для многих белков, например те, которые выглядят как «бусины на нитке» с доменами, которые хорошо отделены друг от друга, все 5 понятий могут привести к одному и тому же определению домена. Однако критерии, используемые для формулирования этих пяти концепций предметной области, весьма различны, и согласованное объединение этих концепций не всегда возможно. Когда домены взаимодействуют более тесно, разные концепции неизбежно приводят к разным определениям. В этой работе делается попытка согласовать некоторые из этих концепций домена на некоторых из наиболее топологически сложных примеров белковых цепей.
Однако критерии, используемые для формулирования этих пяти концепций предметной области, весьма различны, и согласованное объединение этих концепций не всегда возможно. Когда домены взаимодействуют более тесно, разные концепции неизбежно приводят к разным определениям. В этой работе делается попытка согласовать некоторые из этих концепций домена на некоторых из наиболее топологически сложных примеров белковых цепей.
Альтернативные определения домена
Домены можно рассматривать как эволюционные единицы, которые потенциально могут перемещаться между белками, и являются естественной точкой зрения для исследований биоразнообразия. Это эволюционное соображение обеспечивает легкое руководство по идентификации доменов, когда сходство последовательностей между доменами из разных белков велико, даже если структуры доменов различаются. Однако когда труднее установить последовательность или даже структурное сходство с другими белками, определение домена становится особенно трудным. Эта трудность особенно заметна на границах доменов, где определение домена, как правило, возможно только с дополнительным учетом геометрических свойств, таких как структурная компактность и взаимодействие между остатками.
Эта трудность особенно заметна на границах доменов, где определение домена, как правило, возможно только с дополнительным учетом геометрических свойств, таких как структурная компактность и взаимодействие между остатками.
В результате биологической сложности и неопределенности эволюционных выводов одно определение домена может не отразить реальный процесс происхождения домена. Кроме того, из-за ограничений современных автоматизированных методов анализа последовательности и структуры такое определение одного домена может быть даже нежелательным.Вместо этого мы рассматриваем определения домена в 3 категориях; два из них («по последовательности» и «по структуре») представляют разные вероятные механизмы происхождения доменов, основанные на одних и тех же эволюционных соображениях. Третья категория «составных» доменов основана только на геометрических свойствах, а не на наших эволюционных соображениях. Мы также предоставляем дополнительную категорию «расширений», чтобы перечислить вызывающие полипептидные сегменты, которые различают определения «по последовательности» и «по структуре». Несмотря на эту специальную обработку, большинство доменов не различаются по определениям «по последовательности» и «по структуре» из-за отсутствия расширений.Тем не менее, мы перечисляем их отдельно в нашей базе данных для простоты использования автоматизированными методами. Таким образом, в нашей работе удается создать полную и непротиворечивую картину доменной структуры с эволюционной точки зрения для многих топологически сложных белков.
Несмотря на эту специальную обработку, большинство доменов не различаются по определениям «по последовательности» и «по структуре» из-за отсутствия расширений.Тем не менее, мы перечисляем их отдельно в нашей базе данных для простоты использования автоматизированными методами. Таким образом, в нашей работе удается создать полную и непротиворечивую картину доменной структуры с эволюционной точки зрения для многих топологически сложных белков.
Явно фиксированное относительное расположение доменов необходимо для функционирования многих белков. Однако достижение этого фиксированного позиционирования может быть затруднено из-за одного линкера между ними. Соответственно, один домен часто включает терминальное расширение, которое достигает соседнего домена, обеспечивая стабильность за счет дополнительных взаимодействий.Это расширение можно структурно представить как часть взаимодействующей области. С эволюционной точки зрения включение расширения как части взаимодействующего домена предполагает сценарий вставки домена. Можно также предусмотреть альтернативный сценарий, в котором расширение может развиться из выступающего домена, предоставляя определения доменов с непрерывной последовательностью. В большинстве случаев реальные эволюционные механизмы, которые приводят к этой ситуации, остаются неясными: то есть вставка домена или добавление расширения к одному из доменов.Последовательное разрешение этой неопределенности приводит к нашим альтернативным определениям предметной области; например «по структуре» и «по последовательности». Термины «по последовательности» и «по структуре» относятся только к присвоению конечного расширения доменам, а не к методу идентификации домена. Первый , в определениях «по структуре» расширения назначаются взаимодействующему домену по структуре. Это приводит к прерывистой последовательности «предкового» домена (рис. 1b) и подразумевает, что один домен был вставлен в другой.Даже если этот эволюционный сценарий неточен, структурное определение остается значимым, поскольку удлинение часто занимает место в структуре, которое содержит тот же самый вторичный структурный элемент в структурно сходном однодоменном белке.
Можно также предусмотреть альтернативный сценарий, в котором расширение может развиться из выступающего домена, предоставляя определения доменов с непрерывной последовательностью. В большинстве случаев реальные эволюционные механизмы, которые приводят к этой ситуации, остаются неясными: то есть вставка домена или добавление расширения к одному из доменов.Последовательное разрешение этой неопределенности приводит к нашим альтернативным определениям предметной области; например «по структуре» и «по последовательности». Термины «по последовательности» и «по структуре» относятся только к присвоению конечного расширения доменам, а не к методу идентификации домена. Первый , в определениях «по структуре» расширения назначаются взаимодействующему домену по структуре. Это приводит к прерывистой последовательности «предкового» домена (рис. 1b) и подразумевает, что один домен был вставлен в другой.Даже если этот эволюционный сценарий неточен, структурное определение остается значимым, поскольку удлинение часто занимает место в структуре, которое содержит тот же самый вторичный структурный элемент в структурно сходном однодоменном белке. Таким образом, рассмотрение удлинения как части взаимодействующего домена может быть полезным для поиска сходства на основе структуры и вывода о отдаленной гомологии. Второй , в определениях «по последовательности» расширению присваивается последовательность, непрерывная по отношению к домену, из которого оно простирается.Это определение приводит к меньшему количеству разрывов цепи внутри доменов. Следовательно, определение «по последовательности» приводит к минимально менее компактным и глобулярным структурным областям, чем наши определения «по структуре». Сохранение непрерывности последовательности и наличие последовательностей доменов без пробелов делает определения доменов «по последовательности» подходящими для анализа последовательностей. Многие определения доменов SCOP [5], не относящиеся к классу многодоменных белков, соответствуют нашим определениям «по последовательности», поскольку SCOP имеет тенденцию максимизировать непрерывность последовательностей доменов.
Таким образом, рассмотрение удлинения как части взаимодействующего домена может быть полезным для поиска сходства на основе структуры и вывода о отдаленной гомологии. Второй , в определениях «по последовательности» расширению присваивается последовательность, непрерывная по отношению к домену, из которого оно простирается.Это определение приводит к меньшему количеству разрывов цепи внутри доменов. Следовательно, определение «по последовательности» приводит к минимально менее компактным и глобулярным структурным областям, чем наши определения «по структуре». Сохранение непрерывности последовательности и наличие последовательностей доменов без пробелов делает определения доменов «по последовательности» подходящими для анализа последовательностей. Многие определения доменов SCOP [5], не относящиеся к классу многодоменных белков, соответствуют нашим определениям «по последовательности», поскольку SCOP имеет тенденцию максимизировать непрерывность последовательностей доменов. Третий , мы перечисляем все эти терминальные расширения отдельно в базе данных для простоты идентификации и анализа.
Третий , мы перечисляем все эти терминальные расширения отдельно в базе данных для простоты идентификации и анализа.
Несколько отростков и вставок могут объединяться и образовывать компактную область с четко выраженным гидрофобным ядром. Эти области часто могут содержать тесно взаимодействующие вторичные структурные элементы и даже могут иметь общий β-слой. По нашему мнению, эти регионы не образуют домен, так как не являются эволюционно подвижными единицами, а являются лишь геометрическим объединением, возникающим в результате расширения на другие домены.Эти компактные области легко идентифицировать визуально и часто определяют как домены с помощью автоматизированных методов определения доменов. Поэтому мы создали четвертую категорию , называемую составными доменами, для размещения этих регионов. В дополнение к тому, что они образуются из расширений и вставок, некоторые составные домены также включают вставленные неглобулярные домены. Во всех случаях составные домены имеют прерывистую последовательность, но образуют компактные пространственные тела, которые не могут возникнуть в результате одного эволюционного события, такого как вставка домена. Таким образом, эти области чисто геометрические и в наших определениях не несут эволюционного смысла. Мы определяем их просто потому, что они появляются в стабильных конформациях, и кажется правдоподобным, что подобные топологии могут быть обнаружены в качестве эволюционного домена в других белках в будущем.
Таким образом, эти области чисто геометрические и в наших определениях не несут эволюционного смысла. Мы определяем их просто потому, что они появляются в стабильных конформациях, и кажется правдоподобным, что подобные топологии могут быть обнаружены в качестве эволюционного домена в других белках в будущем.
Наши альтернативные определения доменов предлагают разные точки зрения на происхождение домена, исходя из нескольких общих принципов. Поскольку реальные доказательства происхождения домена либо недостижимы, либо неполны, мы решили не ограничиваться одним оптимальным определением домена.Кроме того, недавние разработки в области вычислительных ресурсов предполагают, что объединение более точных последовательностей и структурных поисков, начиная с разных наборов запросов, не будет ограничивать в ближайшем будущем.
Определение домена вручную
Мы выбрали набор белков, наиболее сложных с точки зрения определения домена: весь класс SCOP [5] «многодоменных белков». SCOP объединяет эти белки в один класс, поскольку они содержат топологически разные домены (например,г. все-альфа, все-бета, альфа/бета и альфа+бета) тесно связаны друг с другом как структурно, так и функционально. Таким образом, «складка» этих белков определяется как многодоменная структура, даже если отдельные домены можно отнести к другим складкам SCOP. В результате SCOP не предоставляет доменных границ для этих белков, хотя часто упоминает типы доменов и их возможные классификации. Определения доменов SCOP являются надежным справочным материалом; однако рассматривать структуры в классе многодоменных белков как одиночные домены неверно из-за отсутствия границ остатков.Наша база данных дает эталонный набор тщательно определенных доменных границ для репрезентативного набора этих топологически сложных белков. Количество представителей структуры в нашем наборе данных близко соответствует количеству записей на уровне «белкового домена» иерархии SCOP. Таким образом, мы считаем, что наша база данных охватывает все потенциальные схемы доменов, каталогизированные в классе многодоменных белков SCOP.
SCOP объединяет эти белки в один класс, поскольку они содержат топологически разные домены (например,г. все-альфа, все-бета, альфа/бета и альфа+бета) тесно связаны друг с другом как структурно, так и функционально. Таким образом, «складка» этих белков определяется как многодоменная структура, даже если отдельные домены можно отнести к другим складкам SCOP. В результате SCOP не предоставляет доменных границ для этих белков, хотя часто упоминает типы доменов и их возможные классификации. Определения доменов SCOP являются надежным справочным материалом; однако рассматривать структуры в классе многодоменных белков как одиночные домены неверно из-за отсутствия границ остатков.Наша база данных дает эталонный набор тщательно определенных доменных границ для репрезентативного набора этих топологически сложных белков. Количество представителей структуры в нашем наборе данных близко соответствует количеству записей на уровне «белкового домена» иерархии SCOP. Таким образом, мы считаем, что наша база данных охватывает все потенциальные схемы доменов, каталогизированные в классе многодоменных белков SCOP.
Независимые эксперты-люди определяют большинство доменов одинаково [24]. Это наблюдение подразумевает, что биологически значимые определения доменов требуют опытных суждений, и контрастирует с явным несоответствием между результатами автоматических методов.Такие разногласия мы наблюдали в ходе текущей работы. В наших определениях доменов мы ошибаемся в пользу меньших доменов, а не объединяем несколько полипептидных сегментов в более крупные домены. Для новых и необычных доменов мы подчеркиваем дупликации меньшего размера и небольшие (20–40 остатков) геометрические образования с определенными гидрофобными ядрами. Однако мы воздержались от разделения хорошо известных доменов, таких как единица складки Россмана, на более мелкие части, например. на два дубликата, образующих двойную складку.
Во время ручного определения домена мы неоднократно выполняли определенные шаги.Хотя не все эти шаги требовались для определения каждого домена, было замечено, что они достаточно часты, чтобы вызвать особое упоминание. Мы обсуждаем их примерно в том порядке, в котором они вызывались. 1) Обнаружение структурно сходных белков с использованием методов структуры и последовательности. Сходные, но не идентичные белки (гомологи) показали различное расположение доменов. Выравнивание этих гомологов указывало на доменные границы, по крайней мере, для некоторых из доменов, что облегчало разграничение оставшихся доменов.Иногда наблюдалось, что непохожие белки (с низким показателем сходства) содержат похожий домен, который мы затем могли выровнять и очертить. Некоторые гомологичные структуры показали дополнительные домены на разных стадиях роста. Чтобы быть последовательным, мы определяли эти дополнительные домены только в том случае, если можно было различить гидрофобное ядро, в противном случае полипептидные сегменты рассматривались как петли. 2) Найдите возможные дупликации в данном белке. Структурные повторы, вероятно, образованы дупликациями и, таким образом, представляют собой отдельные эволюционные домены.
Мы обсуждаем их примерно в том порядке, в котором они вызывались. 1) Обнаружение структурно сходных белков с использованием методов структуры и последовательности. Сходные, но не идентичные белки (гомологи) показали различное расположение доменов. Выравнивание этих гомологов указывало на доменные границы, по крайней мере, для некоторых из доменов, что облегчало разграничение оставшихся доменов.Иногда наблюдалось, что непохожие белки (с низким показателем сходства) содержат похожий домен, который мы затем могли выровнять и очертить. Некоторые гомологичные структуры показали дополнительные домены на разных стадиях роста. Чтобы быть последовательным, мы определяли эти дополнительные домены только в том случае, если можно было различить гидрофобное ядро, в противном случае полипептидные сегменты рассматривались как петли. 2) Найдите возможные дупликации в данном белке. Структурные повторы, вероятно, образованы дупликациями и, таким образом, представляют собой отдельные эволюционные домены. 3) Попытка распознать канонические домены, такие как складка Россмана, ферредоксин-подобная складка, пучок из 4 спиралей, иммуноглобулин, Sh4 и OB-баррели и т. д. Этот шаг был ограничен нашим опытом. Однако частое обращение к соответствующей литературе частично облегчало проблему. Единственное решение этих ограничений состоит в том, чтобы фактически иметь эталонный набор доменов, именно то, что эта текущая работа делает шаг к решению. Такой набор ссылок можно было бы использовать даже во время поиска структуры на шаге 1 выше. 4) Идентифицировать потенциальные домены на основе наличия отдельных β-листов.Отдельные домены чаще всего содержали β-листы целиком. В редких случаях домены содержали более одного листа, которые, однако, были переплетены последовательностью (например, бета-сэндвич). 5) Идентифицировать потенциальные домены на основе пространственных скоплений α-спиралей. Идентификация ядра домена с помощью шагов 4 и 5 обычно была легкой. Однако положение доменного интерфейса иногда было неясным.
3) Попытка распознать канонические домены, такие как складка Россмана, ферредоксин-подобная складка, пучок из 4 спиралей, иммуноглобулин, Sh4 и OB-баррели и т. д. Этот шаг был ограничен нашим опытом. Однако частое обращение к соответствующей литературе частично облегчало проблему. Единственное решение этих ограничений состоит в том, чтобы фактически иметь эталонный набор доменов, именно то, что эта текущая работа делает шаг к решению. Такой набор ссылок можно было бы использовать даже во время поиска структуры на шаге 1 выше. 4) Идентифицировать потенциальные домены на основе наличия отдельных β-листов.Отдельные домены чаще всего содержали β-листы целиком. В редких случаях домены содержали более одного листа, которые, однако, были переплетены последовательностью (например, бета-сэндвич). 5) Идентифицировать потенциальные домены на основе пространственных скоплений α-спиралей. Идентификация ядра домена с помощью шагов 4 и 5 обычно была легкой. Однако положение доменного интерфейса иногда было неясным. Различие между внутридоменными и междоменными остаточными контактами иногда было трудно заметить. Некоторую помощь в этом отношении оказала ориентация боковых цепей остатков.В редких случаях мы обращались за помощью к обнаружению структурного сходства (шаги 1 и 3). 6) Рассматривайте домены как эволюционные модули, отмечая непрерывность последовательности и события вставки домена. Предпосылкой для наших определений доменов было то, что все домены с разрывом последовательности могли возникать только из-за вставок других доменов. Было замечено, что большинство автоматических методов определения домена терпят неудачу на этом этапе. 7) Отнести любые неназначенные пептидные сегменты к уже идентифицированным ядрам домена. Короткие (<20 остатков) сегменты были отнесены к существующим доменам.Более длинные сегменты были либо определены как новые домены, либо отнесены к существующим доменам на основании присутствия предполагаемого гидрофобного ядра. 8) Точные границы доменов были уточнены на основе ориентации и взаимодействий боковых цепей, а также суперпозиции структурно подобных доменов.
Различие между внутридоменными и междоменными остаточными контактами иногда было трудно заметить. Некоторую помощь в этом отношении оказала ориентация боковых цепей остатков.В редких случаях мы обращались за помощью к обнаружению структурного сходства (шаги 1 и 3). 6) Рассматривайте домены как эволюционные модули, отмечая непрерывность последовательности и события вставки домена. Предпосылкой для наших определений доменов было то, что все домены с разрывом последовательности могли возникать только из-за вставок других доменов. Было замечено, что большинство автоматических методов определения домена терпят неудачу на этом этапе. 7) Отнести любые неназначенные пептидные сегменты к уже идентифицированным ядрам домена. Короткие (<20 остатков) сегменты были отнесены к существующим доменам.Более длинные сегменты были либо определены как новые домены, либо отнесены к существующим доменам на основании присутствия предполагаемого гидрофобного ядра. 8) Точные границы доменов были уточнены на основе ориентации и взаимодействий боковых цепей, а также суперпозиции структурно подобных доменов.
Возможные приложения для базы данных домена
Возможно несколько применений нашей базы данных домена. 1) Базу данных можно использовать для обучения и тестирования алгоритмов автоматического определения доменов, поскольку это единственная база данных, которая предоставляет определения доменов для топологически наиболее сложных белковых цепей.2) База данных может использоваться для изучения доменных взаимодействий, интерфейсов и топологии. Кроме того, разнообразие комбинаций доменов позволяет базе данных служить эталоном для возможных архитектур доменов. 3) Наши критерии ручного определения домена, наблюдения и подводные камни могут быть полезны при разработке алгоритма автоматического определения домена, который рассматривает модульные эволюционные единицы как домены. 4) Компактная природа наших структурных доменов указывает на возможные единицы сворачивания или ядра, и их анализ может улучшить понимание методов сворачивания белков и прогнозирования структуры.5) Биологи, заинтересованные в конкретных белках, каталогизированных в нашей базе данных, могут сделать вывод о функциональных и эволюционных единицах, которые могут быть выделены для биохимических исследований. 6) Хотя наши составные домены собраны из нескольких сегментов последовательности, которые не предполагают мобильных эволюционных единиц, такие собранные домены могут напоминать эволюционные домены в других белках. В качестве будущей работы такие результаты могут дать аналогичные пары доменов, полезные для анализа конвергенции в эволюции белков.
6) Хотя наши составные домены собраны из нескольких сегментов последовательности, которые не предполагают мобильных эволюционных единиц, такие собранные домены могут напоминать эволюционные домены в других белках. В качестве будущей работы такие результаты могут дать аналогичные пары доменов, полезные для анализа конвергенции в эволюции белков.
Материалы и методы
Подготовка набора данных
Набор данных структуры.
Для работы был использован набор данных из 157 цепей PDB [20], представляющих класс «мультидоменных белков» SCOP [5] (версия 1.73). Каждый представитель структуры был выбран из одного кластерного набора, предоставленного ASTRAL [25]. ASTRAL предоставил эти кластерные наборы, начиная с цепочек PDB в SCOP, с идентичностью последовательностей менее 40%. Модифицированные имена остатков в файлах PDB (обозначенные идентификатором записи MODRES) были преобразованы в соответствующие имена остатков стандартного генетического кода.Информация о вторичной структуре была сгенерирована PALSSE [26] и включена в файлы PDB.
Набор данных предполагаемого домена (из CATH [6] и автоматизированных методов).
Границы домена, определенные CATH (версия 3.0), были получены для справки и сравнения. Назначение структурных доменов с помощью PDP [17] и Domak [16] также помогло быстро идентифицировать потенциальные домены. Domak был запущен с несколькими параметрами, отличными от значений по умолчанию. Параметры были выбраны на основе ручного наблюдения за доменами, которые Домак определил для 100 случайно выбранных структур из PDB.Четыре из этих параметров были предназначены для увеличения охвата остатков и были установлены на идентичные значения (MIN_PEAK_BLO_C = MIN_PEAK_SS_ONLY_BLO_C = MIN_PEAK_BLO_DC = MIN_PEAK_SS_ONLY_BLO_DC = 80). Минимальная доля внутридоменных контактов («значение разделения») была увеличена для получения более отчетливых доменов (MIN_PEAK_C = MIN_PEAK_DC = MIN_PEAK_MC = 15). Наконец, была увеличена минимальная требуемая доля содержания вторичной структуры, выше которой будут использоваться исключительно контакты вторичной структуры (в отличие от контактов остатков) (MIN_SS_PER = 0. 8).
8).
Проверка характеристик домена
Визуальная проверка координат структуры была необходима для определения свойств, важных для определения домена. Ряд структурных характеристик помог определить границы доменов. Наиболее важными из этих характеристик были упаковка и топология вторичной структуры, глобулярность [3], [7] и гидрофобные ядра [27]. Кроме того, оценка структурного сходства и оценка эволюционных модулей помогли найти консервативные домены и определить доменные границы [10], [12].Сравнение полученных вручную определений доменов с определениями, полученными из доступных баз данных, автоматизированных методов и опубликованной литературы, помогло уточнить наши определения для сложных случаев.
Процедура определения домена вручную
Наш метод можно разделить на два этапа; начальный шаг (шаг 1) определения количества и общего положения доменов и (шаг 2) последующее уточнение границ доменов. Поскольку уточнение границ домена (шаг 2) также включает присвоение домену структурных расширений, этот шаг повлиял на последовательное расположение и модульное представление наших доменов. Эта последовательная перестановка иногда требовала изменения номеров доменов (шаг 1) из-за нашего представления о том, что домены можно перестраивать по модулям. Таким образом, мы следовали итеративному методу определения домена с помощью вышеупомянутых двух широких шагов.
Эта последовательная перестановка иногда требовала изменения номеров доменов (шаг 1) из-за нашего представления о том, что домены можно перестраивать по модулям. Таким образом, мы следовали итеративному методу определения домена с помощью вышеупомянутых двух широких шагов.
Идентификационный номер и общее положение доменов.
Набор данных о предполагаемых доменах (описанный выше) помог нам получить информацию о потенциальных доменах. В большинстве случаев структурно отличные компактные области легко разбивались на домены автоматизированными методами.Мы рассмотрели эти предполагаемые домены как ядра доменов и попытались переопределить домены, возникающие из этих ядер. Однако автоматизированные методы иногда показывали явные ошибки в определении домена. Крупные и легко узнаваемые складки, такие как Rossmann, и PIN-домен иногда были чрезмерно разделены. Для этих узнаваемых складок наше рассмотрение ядер доменов было изменено по сравнению с тем, что было предложено автоматическими методами. В комплементе более мелкие складки в непосредственной близости, такие как ферредоксин-подобные, РНКаза-H, 4-спиральный пучок, иммуноглобулин, баррели Sh4 и OB, были объединены автоматическими методами, и более одной складки были отнесены к одному домену.Для этих складок мы полагались на визуальную оценку упаковки вторичной структуры и предполагаемое присутствие гидрофобных областей для идентификации структурно компактных и глобулярных ядер доменов. Небольшие цинксвязывающие домены обнаруживали по присутствию ионов металлов и проксимальных остатков гистидина и цистеина. Соседние складки были тщательно изучены в отношении топологии на наличие признаков дублирования. Дублированные домены в структуре определялись ручным наблюдением и последовательностью и структурным выравниванием.
В комплементе более мелкие складки в непосредственной близости, такие как ферредоксин-подобные, РНКаза-H, 4-спиральный пучок, иммуноглобулин, баррели Sh4 и OB, были объединены автоматическими методами, и более одной складки были отнесены к одному домену.Для этих складок мы полагались на визуальную оценку упаковки вторичной структуры и предполагаемое присутствие гидрофобных областей для идентификации структурно компактных и глобулярных ядер доменов. Небольшие цинксвязывающие домены обнаруживали по присутствию ионов металлов и проксимальных остатков гистидина и цистеина. Соседние складки были тщательно изучены в отношении топологии на наличие признаков дублирования. Дублированные домены в структуре определялись ручным наблюдением и последовательностью и структурным выравниванием.
Уточнение границ доменов.
Границы доменов были уточнены для назначения доменов, которые были модульными как по последовательности, так и по структуре. Возможность того, что эти модули могут перестраиваться в процессе эволюции белка, рассматривалась и выражена в наших определениях. Уточнению границ способствовало сравнение всех похожих доменов в одном и том же надсемействе SCOP [5] в нашем наборе данных, которые мы считали эволюционно связанными. Сходство потенциальных доменов оценивали по структурным выравниваниям, сгенерированным DaliLite [28], где мы рассматривали выровненные остатки для определения консервативных областей домена.Таким образом, доменные границы были установлены согласованными между структурно сходными и, предположительно, эволюционно родственными доменами. Там, где подобные домены были недоступны, границы доменов определяли, наблюдая за геометрией основной цепи полипептида и остатков боковой цепи. Наше предположение, что модульные домены перестраиваются во время эволюции белка, сыграло роль в определении доменных границ. В местах вставки домена изучали геометрию полипептидного остова, чтобы соотнести пространственно проксимальные остатки с наследственным доменом.Кроме того, мы предположили большее взаимодействие боковой цепи между внутридоменными, а не междоменными остатками.
Уточнению границ способствовало сравнение всех похожих доменов в одном и том же надсемействе SCOP [5] в нашем наборе данных, которые мы считали эволюционно связанными. Сходство потенциальных доменов оценивали по структурным выравниваниям, сгенерированным DaliLite [28], где мы рассматривали выровненные остатки для определения консервативных областей домена.Таким образом, доменные границы были установлены согласованными между структурно сходными и, предположительно, эволюционно родственными доменами. Там, где подобные домены были недоступны, границы доменов определяли, наблюдая за геометрией основной цепи полипептида и остатков боковой цепи. Наше предположение, что модульные домены перестраиваются во время эволюции белка, сыграло роль в определении доменных границ. В местах вставки домена изучали геометрию полипептидного остова, чтобы соотнести пространственно проксимальные остатки с наследственным доменом.Кроме того, мы предположили большее взаимодействие боковой цепи между внутридоменными, а не междоменными остатками.
Непрерывность последовательности и определения альтернативных доменов.
Наша приверженность модульным определениям доменов обеспечила непрерывность последовательности для отдельных доменов; если также не присутствовали дополнительные вставленные домены (за исключением составных доменов, описанных далее в этом разделе). Таким образом, для n доменов, вставленных в домен A , было определено, что домен A состоит из n +1 полипептидных сегментов.Однако для некоторых пар соседних доменов было обнаружено, что один из доменов содержит концевые структурные расширения, взаимодействующие с соседним доменом. Альтернативные определения были предоставлены везде, где эти расширения были идентифицированы как вторичный структурный элемент (спираль α или слой β). Мы определили терминальное расширение « по структуре », обеспечивающее структурную компактность расширения до ядра домена. Это соображение привело к определению, в котором один домен был вставлен в другой. Кроме того, мы определили терминальный экстенсон « по последовательности », обеспечивающий непрерывность последовательности каждого домена. Эта альтернатива привела к определению, в котором домены оказались окончательно слитыми по последовательности, без разрывов ни в одном из них. Составные домены составляют третью категорию наших определений доменов и основаны только на структурной компактности. В редких случаях вторичные структурные расширения и вставки к доменам, а также неглобулярные домены образовывали структурно компактную область, в которой можно было обнаружить гидрофобное ядро.Мы определяем эти области как составные домены, хотя они имеют прерывистую последовательность, но не содержат вставленных доменов.
Кроме того, мы определили терминальный экстенсон « по последовательности », обеспечивающий непрерывность последовательности каждого домена. Эта альтернатива привела к определению, в котором домены оказались окончательно слитыми по последовательности, без разрывов ни в одном из них. Составные домены составляют третью категорию наших определений доменов и основаны только на структурной компактности. В редких случаях вторичные структурные расширения и вставки к доменам, а также неглобулярные домены образовывали структурно компактную область, в которой можно было обнаружить гидрофобное ядро.Мы определяем эти области как составные домены, хотя они имеют прерывистую последовательность, но не содержат вставленных доменов.
Благодарности
Hua Cheng предоставил альтернативный набор ручных определений доменов для некоторых белков и полезное обсуждение. Мод. Waseem Akhtar провел полезное обсуждение и просмотрел рукопись.
Вклад авторов
Инициатор и спроектировал эксперименты: Н. Г. Выполняли опыты: И.М. Проанализированы данные: ИМ ЛНК Н.Г.Предоставленные реагенты/материалы/инструменты для анализа: NG. Написал статью: ИМ ЛНК НГ. Настроили онлайн-базу данных и составили рукопись: IM. Определенные вручную домены: IM LNK NG. В редакции рукописи: ЛНК Н.Г. Автор проекта: Н.Г.
Г. Выполняли опыты: И.М. Проанализированы данные: ИМ ЛНК Н.Г.Предоставленные реагенты/материалы/инструменты для анализа: NG. Написал статью: ИМ ЛНК НГ. Настроили онлайн-базу данных и составили рукопись: IM. Определенные вручную домены: IM LNK NG. В редакции рукописи: ЛНК Н.Г. Автор проекта: Н.Г.
Каталожные номера
- 1. Джанин Дж., Чотия С. (1985) Домены в белках: определения, расположение и структурные принципы. Методы Enzymol 115: 420–430.
- 2. Phillips DC (1966) Трехмерная структура молекулы фермента.Sci Am 215: 78–90.
- 3. Ветлауфер Д.Б. (1973)Нуклеация, быстрая укладка и глобулярные внутрицепочечные области в белках. Proc Natl Acad Sci U S A 70: 697–701.
- 4. Роуз Г.Д. (1979)Иерархическая организация доменов в глобулярных белках. Дж. Мол. Биол. 134: 447–470.
- 5.
Мурзин А.Г., Бреннер С.Е., Хаббард Т., Чотия С. (1995) SCOP: база данных структурной классификации белков для исследования последовательностей и структур.
 Дж. Мол. Биол. 247: 536–540.
Дж. Мол. Биол. 247: 536–540. - 6. Грин Л.Х., Льюис Т.Е., Аддоу С., Кафф А., Даллман Т. и др. (2007) База данных доменной структуры CATH: новые протоколы и уровни классификации дают более полный ресурс для изучения эволюции. Рез. нуклеиновых кислот 35: D291–297.
- 7. Левитт М., Чотиа С. (1976) Структурные паттерны глобулярных белков. Природа 261: 552–558.
- 8. Zehfus MH, Rose GD (1986) Компактные единицы в белках. Биохимия 25: 5759–5765.
- 9.Ветлауфер Д.Б., Ристоу С. (1973)Познание трехмерной структуры белков. Annu Rev Biochem 42: 135–158.
- 10. Hegyi H, Bork P (1997) О классификации и эволюции белковых модулей. J Protein Chem 16: 545–551.
- 11. Рассел Р.Б. (1994) Вставка домена. Белок Eng 7: 1407–1410.
- 12. Барон М., Норман Д.Г., Кэмпбелл И.Д. (1991) Белковые модули. Trends Biochem Sci 16: 13–17.
- 13.
Оренго К.А., Джонс Д.Т., Торнтон Дж.
 М. (1994)Суперсемейства белков и суперскладки доменов.Природа 372: 631–634.
М. (1994)Суперсемейства белков и суперскладки доменов.Природа 372: 631–634. - 14. Chothia C, Lesk AM (1986) Связь между расхождением последовательности и структурой в белках. EMBO J 5: 823–826.
- 15. Мурзин А.Г. (1998) Насколько далеко заходит дивергентная эволюция белков. Curr Opin Struct Biol 8: 380–387.
- 16. Сиддики А.С., Бартон Г.Дж. (1995)Непрерывные и прерывистые домены: алгоритм автоматического создания надежных определений белковых доменов. Белковая наука 4: 872–884.
- 17. Александров Н., Шиндялов И. (2003) PDP: синтаксический анализатор белковых доменов. Биоинформатика 19: 429–430.
- 18. Веретник С., Борн П.Е., Александров Н.Н., Шиндялов И.Н. (2004) На пути к последовательному назначению структурных доменов в белках. Дж. Мол Биол 339: 647–678.
- 19. DeLano WL (2002) Система молекулярной графики PyMOL
- 20.
Berman HM, Westbrook J, Feng Z, Gilliland G, Bhat TN, et al.
 (2000) Банк данных о белках.Нуклеиновые кислоты, рез. 28: 235–242.
(2000) Банк данных о белках.Нуклеиновые кислоты, рез. 28: 235–242. - 21. Камада К., Хориучи Т., Осуми К., Симамото Н., Морикава К. (1996)Структура белка-терминатора репликации в комплексе с ДНК. Природа 383: 598–603.
- 22. Августин М.А., Хубер Р., Кайзер Дж.Т. (2001)Кристаллическая структура ДНК-зависимой РНК-полимеразы (ДНК-примаза). Nat Struct Biol 8: 57–61.
- 23. Альтшул С.Ф., Мэдден Т.Л., Шаффер А.А., Чжан Дж., Чжан З. и др. (1997) Gapped BLAST и PSI-BLAST: новое поколение программ поиска белковых баз данных.Нуклеиновые кислоты Рез. 25: 3389–3402.
- 24. Кинч Л.Н., Врабл Дж.О., Кришна С.С., Маджумдар И., Садреев Р.И. и др. (2003) CASP5 оценка предсказаний цели распознавания складки. Белки 53: Приложение 6395–409.
- 25. Chandonia JM, Hon G, Walker NS, Lo Conte L, Koehl P, et al. (2004) Сборник ASTRAL в 2004 г. Nucleic Acids Res 32: D189–192.
- 26.
Маджумдар И.
 , Кришна С.С., Гришин Н.В. (2005) PALSSE: программа для выделения линейных вторичных структурных элементов из белковых структур.BMC Биоинформатика 6: 202.
, Кришна С.С., Гришин Н.В. (2005) PALSSE: программа для выделения линейных вторичных структурных элементов из белковых структур.BMC Биоинформатика 6: 202. - 27. Swindells MB (1995)Процедура обнаружения структурных доменов в белках. Наука о белках 4: 103–112.
- 28. Холм Л., Парк Дж. (2000) Рабочий стол DaliLite для сравнения структуры белков. Биоинформатика 16: 566–567.
Определение белкового продукта | Law Insider
Связанный с
Белковый продуктЛицензионный продукт означает любой продукт или его часть, который: полезно при выполнении Лицензионной услуги.
сложное изделие означает изделие, состоящее из нескольких компонентов, которые можно заменять, допуская разборку и повторную сборку изделия.
Биоаналог продукта означает в отношении конкретного продукта в стране фармацевтический продукт, который (a) содержит аналитически сравнимый или идентичный активный ингредиент (ингредиенты), как такой продукт, (b) одобрен для использования в такой стране в соответствии с процессом утверждения регулирующими органами, регулирующим утверждение непатентованных, взаимозаменяемых или биоподобных биологических препаратов на основе действующих на тот момент стандартов для утверждения регулирующими органами в такой стране, независимо от того, было ли такое одобрение регулирующих органов полностью или частично основано на клинических данных, полученных Сторонами в соответствии с к настоящему Соглашению или было получено с использованием какого-либо другого типа сокращенного или ускоренного процесса утверждения и (c) продается в той же стране, что и такой Продукт, любой Третьей стороной, которая не является Сублицензиатом BMS или ее Аффилированных лиц и не приобрела такой продукт в цепочка распространения, включающая любую из BMS, ее Аффилированных лиц или ее Сублицензиатов.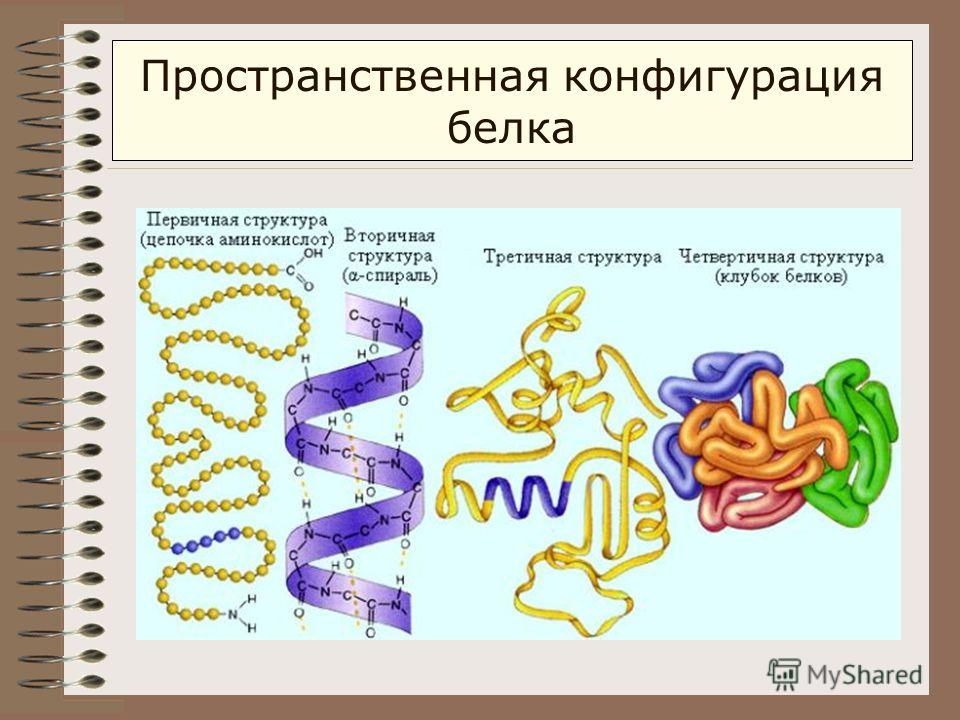
Комбинированный продукт означает продукт, который состоит или содержит совместное соединение в качестве активного ингредиента вместе с одним (1) или более другими активными ингредиентами и продается либо в виде фиксированной дозы/единицы, либо в виде отдельных доз/единиц в единый пакет.
Терапевтический продукт означает продукт медицинского назначения, отнесенный к категории терапевтических продуктов в Первом приложении к Закону;
Совместный продукт означает любой продукт, который содержит одно или несколько открытых соединений РНКи в качестве активного ингредиента(ов).
Яичный продукт означает все или часть содержимого яйца, отделенного от скорлупы и пастеризованного на предприятии по переработке пищевых продуктов, с добавлением или без добавления ингредиентов, предназначенного для потребления человеком, такого как высушенные, замороженные или жидкие яйца. . Сюда не входят продукты, которые содержат яйца только в относительно небольшой пропорции, например, смеси для тортов.
Лицензированное соединение означает (a) 3,4-диаминопиридин, химическая структура которого указана в Приложении B-2; и (b) любые производные, изомеры, метаболиты, пролекарства, кислотные формы, основные формы, солевые формы или модифицированные версии такого соединения в (а).
Непатентованный продукт означает в отношении Продукта в конкретной регулирующей юрисдикции любой фармацевтический продукт, который (a) (i) содержит те же активные фармацевтические ингредиенты, что и такой Продукт, для того же пути введения, что и этот Продукт, и одобрен регулирующим органом в такой стране; или (ii) имеет рейтинг A/B (определение приведено ниже) в отношении такого Продукта или иным образом одобрен Регулирующим органом в такой стране в качестве замещающего дженерика для такого Продукта; и (b) продается в такой юрисдикции Третьей стороной, которая не является Сублицензиатом и не приобрела такой продукт у Aptose или ее Аффилированных лиц или Сублицензиатов. Для целей этого определения «рейтинг A/B» означает для США «терапевтически эквивалентный», как определено FDA, с применением определения «терапевтически эквивалентного», изложенного в предисловии к действующему на тот момент изданию FDA. публикация «Одобренные лекарственные препараты с оценкой терапевтической эквивалентности» и, за пределами США, такое эквивалентное определение соответствующего регулирующего органа.
Для целей этого определения «рейтинг A/B» означает для США «терапевтически эквивалентный», как определено FDA, с применением определения «терапевтически эквивалентного», изложенного в предисловии к действующему на тот момент изданию FDA. публикация «Одобренные лекарственные препараты с оценкой терапевтической эквивалентности» и, за пределами США, такое эквивалентное определение соответствующего регулирующего органа.
Молочный продукт означает масло, натуральный или плавленый сыр, сухое цельное молоко, обезжиренное сухое молоко, сухую пахту, сухую сыворотку, сгущенное цельное или обезжиренное молоко, сгущенное цельное молоко и сгущенное обычное или обезжиренное молоко с сахаром.
Продукт каннабиса означает каннабис, который подвергся процессу, в ходе которого растительный материал был преобразован в концентрат, включая, помимо прочего, концентрированный каннабис, или пищевой или местный продукт, содержащий каннабис или концентрированный каннабис и другие ингредиенты.
Средство для полировки пола означает средство, предназначенное для восстановления изношенного покрытия пола в сочетании с машиной для полировки пола и специальной губкой.
Роялти-продукт означает либо (a) Роялти-продукт Alnylam, либо (b) Роялти-продукт Inex.
Парообразный продукт означает негорючий продукт, содержащий никотин, в котором используется нагревательный элемент, источник питания, электронная схема или другие электрические, химические или механические средства, независимо от формы или размера, которые могут использоваться для производства пара из никотина или в раствор или другая форма. Парообразные продукты включают электронную сигарету (электронную сигарету), электронную сигару, электронную сигариллу, электронную трубку или аналогичный продукт или устройство, а также картридж для пара или другой контейнер с никотином в растворе или другой форме, который предназначен для использования с или в электронная сигарета (электронная сигарета), электронная сигара, электронная сигарилла, электронная трубка или аналогичный продукт или устройство.
Молочный продукт или «молочный продукт» означает творог, сухой творожный творог, обезжиренный творог, обезжиренный творог, сливки, легкие сливки, легкие взбитые сливки, жирные сливки, жирные взбитые сливки, взбитые сливки, взбитые легкие сливки, сметана, сметана кисломолочная, сметана кисломолочная, полукислая, кислая полукислая, кислая полукислая, кислая полукислая, восстановленное или рекомбинированное молоко и молочные продукты, концентрированное молоко, концентрированные молочные продукты, обезжиренное молоко, обезжиренное молоко, концентрат замороженного молока, ароматизированное молоко, гоголь-моголь, пахта, кисломолочный продукт, кисломолочный обезжиренный молочный продукт, кисломолочный обезжиренный молочный продукт, йогурт, нежирный йогурт, обезжиренный йогурт, подкисленное молоко, подкисленное обезжиренное молоко, кисломолочное обезжиренное молоко, молоко с пониженным содержанием натрия, обезжиренное молоко с пониженным содержанием натрия, обезжиренное молоко с пониженным содержанием натрия, молоко со сниженным содержанием лактозы, обезжиренное молоко со сниженным содержанием лактозы, обезжиренное молоко со сниженным содержанием лактозы, асептически обработанное и упакованное молоко, молочные продукты с добавлением безопасных и подходящий микробный организм s и любой другой молочный продукт, полученный путем добавления или удаления молочного жира или добавления безопасных и подходящих необязательных ингредиентов для обогащения белком, витаминами или минералами. Если продукт не считается молочным продуктом в этом подразделе, молочный продукт не включает диетические продукты, детские смеси, мороженое или другие десерты, сыр или масло. Молочные продукты включают следующее:
Если продукт не считается молочным продуктом в этом подразделе, молочный продукт не включает диетические продукты, детские смеси, мороженое или другие десерты, сыр или масло. Молочные продукты включают следующее:
Аэрозольный продукт для покрытия означает находящийся под давлением продукт для покрытия, содержащий пигменты или смолы, который распределяет ингредиенты продукта с помощью пропеллента и упакован в одноразовую банку для ручного нанесения или для использования в специализированных оборудование для наземного движения/маркировки.
Лицензионные продукты означает материальные материалы, которые в процессе производства, использования, продажи или импорта подпадают под действие одного или нескольких пунктов Лицензионных патентных прав, которые не были признаны непатентоспособными, недействительными или не имеющими юридической силы необжалуемое или не подлежащее обжалованию решение суда компетентной юрисдикции.
Продукт означает производимый продукт, даже если он предназначен для последующего использования в другой производственной операции;
Лицензированный производитель означает физическое или юридическое лицо, имеющее лицензию на производство медицинского каннабиса.
Табачные изделия означает любое вещество, содержащее табачный лист, включая, помимо прочего, сигареты, сигары, трубочный табак, табак для кальяна, нюхательный табак, жевательный табак, табак для макания, биди, бланты, сигареты с гвоздикой или любые другие табачные изделия. ; и любой продукт или состав вещества, содержащий биологически активное количество никотина, который производится, продается, предлагается для продажи или иным образом распространяется с расчетом на то, что продукт или вещество будет введено в организм человека путем вдыхания; но не включает какие-либо продукты для прекращения курения, специально одобренные США.S. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов для лечения никотиновой или табачной зависимости.
Лицензированные соединения означает любое соединение(я) EZH3, которое:
Связанный продукт в контексте настоящего LSA № 4 означает, что каждая поставляемая единица указанных Авторизованных устройств SEC будет содержать Adobe PostScript(R)3( ТМ).
Пищевой продукт каннабиса означает продукт каннабиса, который предназначен для использования, полностью или частично, для потребления человеком, включая жевательную резинку, но не ограничиваясь ею, но исключая продукты, указанные в Разделе 15 (начиная с Раздела 32501). ) Продовольственного и сельскохозяйственного кодекса.Съедобный продукт каннабиса не считается пищевым продуктом, как это определено в разделе 109935 Кодекса здоровья и безопасности, или наркотиком, как это определено в разделе 109925 Кодекса здоровья и безопасности.
Комбинированные продукты означает любой продукт, содержащий как фармацевтически активный агент или ингредиент, который составляет Лицензионный продукт, так и один или несколько других фармацевтически активных агентов или ингредиентов, которые не являются Лицензированными продуктами.
Конечный продукт означает продукт, который не используется в производстве других продуктов и предназначен для использования на открытом воздухе, при условии, что конечный продукт не испортился или иным образом не стал потенциальным источником загрязняющих веществ.

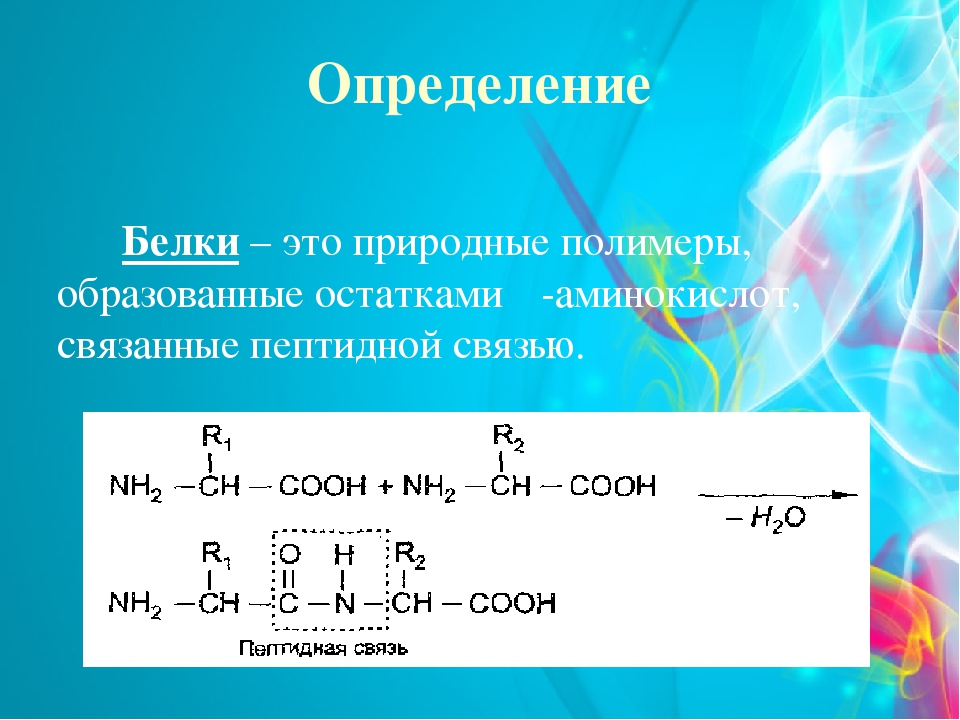

 Часто используется для диагностики и мониторинга различных воспалительных процессов, дифференциальной диагностики между бактериальной и вирусной инфекциями, обнаружения послеоперационных осложнений, мониторинга эффективности лечебных мероприятий.
Часто используется для диагностики и мониторинга различных воспалительных процессов, дифференциальной диагностики между бактериальной и вирусной инфекциями, обнаружения послеоперационных осложнений, мониторинга эффективности лечебных мероприятий.
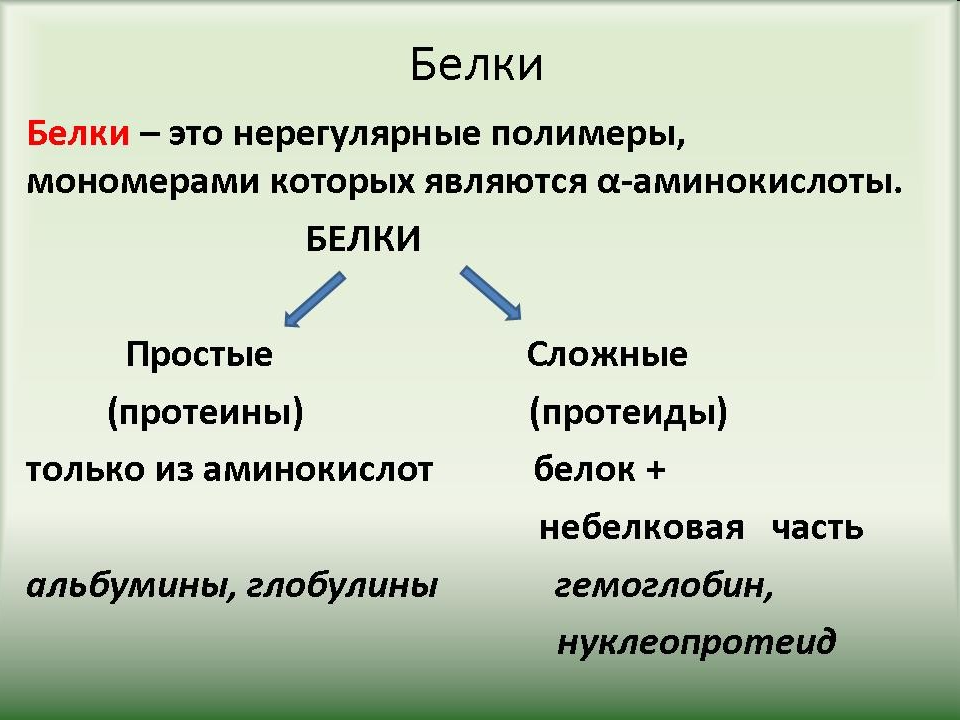 В этих случаях показатель общего белка в крови снижается.
В этих случаях показатель общего белка в крови снижается.




 Дж. Мол. Биол. 247: 536–540.
Дж. Мол. Биол. 247: 536–540. М. (1994)Суперсемейства белков и суперскладки доменов.Природа 372: 631–634.
М. (1994)Суперсемейства белков и суперскладки доменов.Природа 372: 631–634. (2000) Банк данных о белках.Нуклеиновые кислоты, рез. 28: 235–242.
(2000) Банк данных о белках.Нуклеиновые кислоты, рез. 28: 235–242. , Кришна С.С., Гришин Н.В. (2005) PALSSE: программа для выделения линейных вторичных структурных элементов из белковых структур.BMC Биоинформатика 6: 202.
, Кришна С.С., Гришин Н.В. (2005) PALSSE: программа для выделения линейных вторичных структурных элементов из белковых структур.BMC Биоинформатика 6: 202.