Аминокислоты обозначения: 404 — Категория не найдена
Аминокислоты, обозначение — Справочник химика 21
Аминокислоты обычно называют как соответствующие им карбоновые кислоты с добавлением приставки амиЛо-и цифры или буквы греческого алфавита для обозначения положения аминогруппы в цепи. Например [c.168]
Последовательность аминокислот в молекуле инсулина человека показана на рис. 14.4. Следует обратить внимание, что символ Су—S использован для обозначения половины молекулы цистина. Мостик S—S находится между шестым и одиннадцатым остатком в цепи А, благодаря чему образуется кольцо имеются также две связи S—S, соединяющие цепь А с цепью Б. [c.393]
В белке волос и шерсти, а также других кератинах а-спирали многократно скручены друг с другом в многожильные тяжи, которые образуют видимые глазом нити. Цепи белков шелка вытянуты во всю длину (а не свернуты в спираль) и соединены с параллельными цепями водородными связями в листы, показанные на рис.
НОМЕНКЛАТУРА СТЕРЕОХИМИЧЕСКАЯ, предназначена для обозначения строения молекул пространств, изомеров. Для обозначения энантиомеров пользуются В, Ь- или Я, З-номенклатурой. В первом случае конфигурацию соед. (аминокислоты, оксикислоты, сахара), имеющих в Фишера формуле амино- или оксигруппу слева, обозначают знаком справа — В (рис. 1). В К, З-системе прежде всего опре-
Название Сокращённое аминокислоты обозначение [c.481]
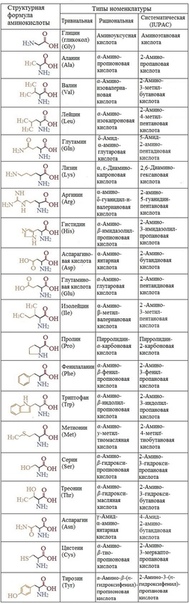
Структурные формулы сложных пептидов, как видно из приведенной схемы синтеза брадикинина, очень громоздки и неудобны. Поэтому принято пользоваться сокращенной записью формул, в которой аминокислотные остатки обозначаются несколькими буквами, происходящими от тривиальных названий аминокислот. Обозначения, принятые в советской химической литературе, приведены в табл. 33 на стр. 794—797. В зарубежной литературе аминокислоты обозначают первыми тремя латинскими буквами их названия.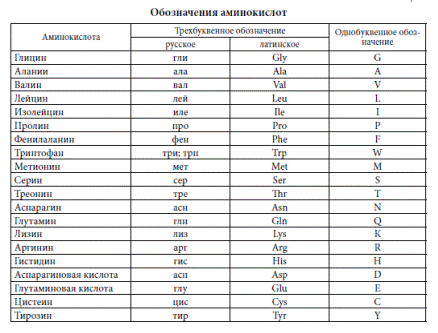
Наименование остатка и аминокислоты Обозначение Краткое обозначе- ние Радикал—R [c.26]
Название аминокислоты Обозначения остатков в пептидах или белках Молекулярный пес, г Содержание азота, °/о Растворимость в воде при 25°, °, о (вес.) ,./ Оптическое вращение природного изомера, [я)ц
ГАСТРИН, пептидный гормон. Первичная структура Г. человека Пироглу — Гли — Про — Три — Лей — Глу — Глу — Глу — Глу — Глу — Ала — Тир — (НЗОз) — Гли— Три — Мет — Асп — Фен — Nh3 (мол. м. 2200 букв, обозначения см. в ст. а-Аминокислоты). У животных различается аминокислотными остатками в положениях 5, 8 н 10. Фрагмент 6—17 сохраняет полную, а С-кон-цевой тетрапептидный фрагмент — /12 часть биол. активности природного Г. Вырабатывается эндокринными клетками слизистой оболочки антрального отдела желудка. Стимулирует секрецию к-ты в желудке. Лек. ср-ва получ. синтезом биологически активных фрагментов Г. и их аналогов.
синтезом биологически активных фрагментов Г. и их аналогов.
Заметим, что в состав защищенного участка входит инициирующий кодон AUG и что последовательности расположенных вслед за ним кодонов в точности соответствуют известной последовательности аминокислот N-конца вирусного белка оболочки. Еще одна интересная особенность этой последовательности состоит в том, что два участка, обозначенные фигурными скобками со звездочками, могут спариваться друг с другом. В результате инициирующий кодон может образовывать петлю (шпильку). Такие шпильки в инициаторных участках РНК образуются не всегда, однако они встречаются достаточно часто. [c.242]
Для образования названия аминокислот атом углерода, расположенный по соседству с главной функциональной группой в молекуле (т. е. рядом с карбоксилом в случае карбоновых кислот), обозначают буквой а, следующие — буквами Р. V. е. Эти обозначения используются главным образом в тривиальных названиях карбоновых кислот.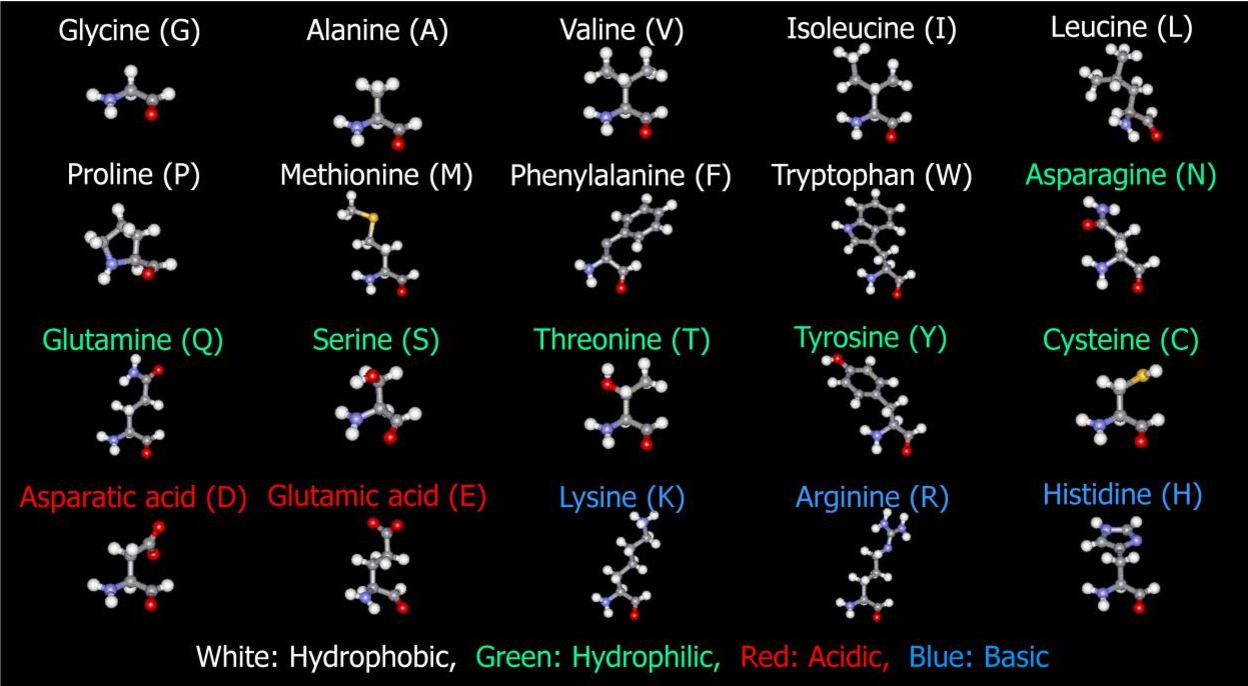
Несмотря на широкое использование символов в и ь для обозначения абсолютной конфигурации, этот метод не лишен недостатков. Определение принадлежности того или иного энантиомера к о- или ь-ряду может зависеть от того, к какому соединению его относят. Известны случаи, когда энантиомер можно путем пяти или шести стадий связать с известным соединением о-ряда, а другим путем, также из пяти или шести стадий, этот энантиомер можно связать с ь-энантиомером того же соединения. В таких случаях приходится делать произвольное отнесение к о- или ь-ряду. Из-за отмеченного недостатка, а также из-за некоторых других в настоящее время система оь-обозна-чений используется редко исключение составляют такие соединения, как углеводы и аминокислоты.
По принятой для обозначения пространственного строения номенклатуре аминокислоты с такой конфигурацией относятся к Ь-ряду. Аминокислоты противоположной О-конфигурации в белках, как правило, не встречаются.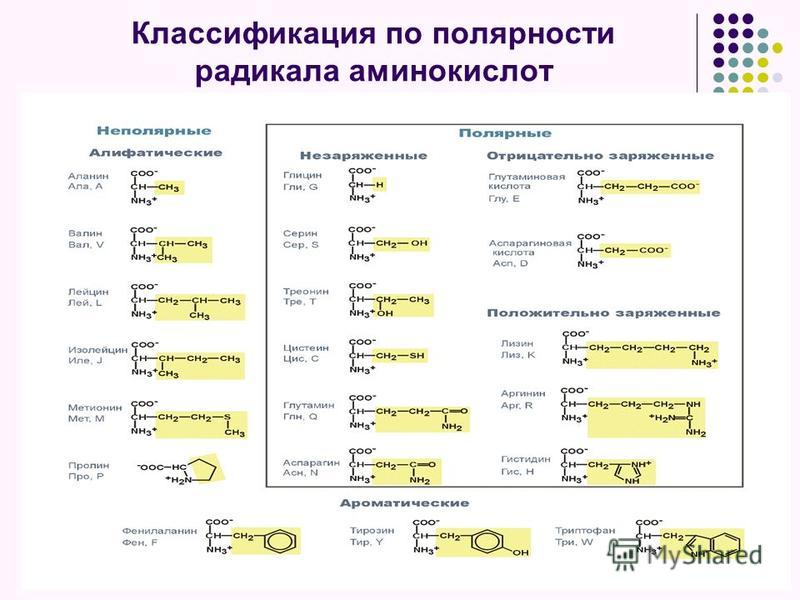
Система ро—сигма позволяет обозначать конфигурацию, исходя как из моделей, так и из проекционных формул, и воспроизводить непосредственно как модель, так и проекционную формулу Нужно только помнить, что при движении по цепи атомов углерода, как показано на стр. 160, заместитель, находящийся слева, обозначается буквой р, а заместитель, находящийся справа, обозначается буквой а. Это означает, что в общепринятой вертикальной проекции оксикислот, аминокислот и сахаров обозначение р будет эквивалентно В-конфигурации, а обозначение о— -конфигурации.
Изображая строение грамицидина С, мы воспользовались принятыми в химии белков сокращенными обозначениями аминокислот (лей — лейцин, фал — фенилаланин, про— пролин, вал — валин, ори — орнитин).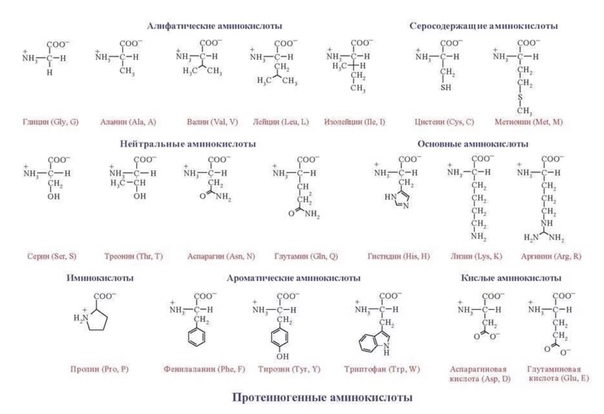 При такой записи считают, что начало сокращенного обозначения соответствует аминному концу молекулы, конец— ее карбоксильрюму концу, т. е. обозначение, например, вал расшифровывается как —ЫН—СН(СзН7)—СО—. [c.343]
При такой записи считают, что начало сокращенного обозначения соответствует аминному концу молекулы, конец— ее карбоксильрюму концу, т. е. обозначение, например, вал расшифровывается как —ЫН—СН(СзН7)—СО—. [c.343]
В принципе любое соединение, которое содержит одновременно и кислотную функциональную группу, и аминогруппу, является аминокислотой. Однако чаще всего этот термин применяется для обозначения карбоновых кислот, аминогруппа которых находится в а-положении по отношению к карбоксильной группе. Ни один из известных нам живых организмов не обходится без аминокислот. Аминокислоты, как правило, входят в состав полимеров — белков. Белки служат питательными веществами, регулируют обмен веществ, способствуют поглощению кислорода, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения и главным опорным материалом живых организмов, участвуют в передаче генетической информации и т. д.
Glu-Ala-Phe-Pro-Leu-Glu-Phe-ОН (мол.
Правильная аминокислота (обозначенная Я), возможно, взаимодействует предпочтительнее по сравнению с большинством (вероятно, со всеми) других аминокислот (обозначены X). Если связалась неправильная аминокислота, то возможно кинетическое корректирование в результате конформационных изменений, индуцированных тРНК, или же химическое корректирование, обусловленное неполноценным переносом на тРНК.
В атом номере ж/риала опубликованы также разработанные ШРАС Правила ном. н-клатуры аминокислот, стероидов, вита.млнов и каротнноидов (стр, 5575), Руководство по физико-химическим обозначениям и терминологии (стр. 5517) и Правила номенклатуры неорганических соединений (стр. 5523). [c.
 304]
304]На рис. 179 показана типичная схема расположения аминокислот на выходе аминокислотного анализатора ( hromaspek фирмы Rank Hilger ) с сохранением примерного соотношения расстояний между пиками, обозначенными вертикальными отрезками. Как видно из рисунка, пики аминокислот легко можно разбить на три группы [c.516]
Проекции Фишера для двух возможных структур аминокислот изображены выше. Та аминокислота, в проекции которой карбоксильная группа располагается наверху, группа К — внизу, а аминогруппа — справа от углеродной цепи, называется -энантиомером. Это обозначение такое же, как для а-гидроксикислот (разд. 15.1.2), но отличается от обозначения углеводов, что может привести к путанице (разд. 12.3). При обозначении хиральности аминокислот с помощью символов и 5 (разд. 12.3) теоретически порядок старшинства группы может меняться при достаточно существенных изменениях структуры боковой цепи. Практически боковые цепи большинства биологически важных аминокислот имеют такое старшинство МНо-и СО2Н-ГРУПП, при котором обозначения п, ь и 7 , 5 совпадают, т. е. о и 1, =5 (исключение составляют цистеин и цистин). [c.292]
е. о и 1, =5 (исключение составляют цистеин и цистин). [c.292]
Мет — Асп — Тре — ОН (мол. м. 3485 букв, обозначения см, в ст. а-Аминокислоты). Для сохранения биол, активности Г. необходима структурная целостность его молекулы. Секретируется а-клетками островков поджелудочной железы, В-во, подобное Г,, вырабатывается также в слизистой оболочке кишечника. Г, участвует в регуляции углеводного обмена, является физиол, антагонистом инсулина. Усиливает распад и тормозит синтез гликогена в печени, стимулирует образование глюкозы из аминокислот и секрецию инсулина, вызывает распад жиров. При введении в организм повышает уровень сахара в крови, [c.139]
Антиподы с 2р-положением аминогруппы относят к й-ряду,. антиподы с 2а-.положением аминогруппы—к -ряду. Таким образом, семейства -аминокислот родственны по конфигурации семействам а-оксикислот. Подробнее о стереохнмических обозначениях аминокислот см. 187. [c.377]
Если название начинается с умножающей (ди-, три-, тетра-и т. п.) или какой-либо другой (мезо-, пер- и т. п.) приставки, которая пишется слитно, оно включается в алфавит по первой букве такой приставки. Обозначения перед названием, набираемые курсивом и отделяемые, дефисом, в алфавит не включаются. Например в соответствующем по первой букве названия месте двузамещенные производные бензола помещаются в порядке орто-, мета-, пара- геометрические изомеры в последовательности цис , затем транс- оптические антиподы —б -, затем /- и /- в случае моносахаридов первым помещается о-изомер, затем ь- и оь- а в случае природных аминокислот — вначале Ь-, а затем в- и о ь-соединения. [c.119]
п.) или какой-либо другой (мезо-, пер- и т. п.) приставки, которая пишется слитно, оно включается в алфавит по первой букве такой приставки. Обозначения перед названием, набираемые курсивом и отделяемые, дефисом, в алфавит не включаются. Например в соответствующем по первой букве названия месте двузамещенные производные бензола помещаются в порядке орто-, мета-, пара- геометрические изомеры в последовательности цис , затем транс- оптические антиподы —б -, затем /- и /- в случае моносахаридов первым помещается о-изомер, затем ь- и оь- а в случае природных аминокислот — вначале Ь-, а затем в- и о ь-соединения. [c.119]
ВАЗОПРЕССЙН (от лат. vas-сосуд и presso-давлю) (анти-диуретич. гормон, адиуретин), пептидный гормон гипофиза. Первичная структура В. у большинства млекопитающих, в т.ч. у человека (аргииин-вазопрессин, мол. м. 1084 букв, обозначения см. в ст. Аминокислоты) [c.342]
Буквы А, Г, У, Ц в таблице обозначают основания РНК — соотв, аденин, гуанин, урацил, цитозин буквенные обозначения аминокислот (напр. , фен, сер, лей) см. в ст. а-Амино-кислиты. Амбер , — охра , смыс,тенных кодонов, к-рые не кодируют аминокислоты, а служат сигналами окончания синтеза полипептидной цеии. Первое основание кодона обозначается буквами в вертикальном ряду слева, второе — в горизонтальном ряду сверху, третье — в вертикальном ряду справа. Реализация ] к, происходит в два этапа транскрипции н трансляции,. а ра[c.125]
, фен, сер, лей) см. в ст. а-Амино-кислиты. Амбер , — охра , смыс,тенных кодонов, к-рые не кодируют аминокислоты, а служат сигналами окончания синтеза полипептидной цеии. Первое основание кодона обозначается буквами в вертикальном ряду слева, второе — в горизонтальном ряду сверху, третье — в вертикальном ряду справа. Реализация ] к, происходит в два этапа транскрипции н трансляции,. а ра[c.125]
Орн — орнитин, остальные буквенные обозначения см. в ст, а-Аминокислоты). В клетках бактерий Ba iLlus brevis Г. образуется по нематричному механизму с участием фермента грамицидин С-синтетазы. Активен против грамотрицат. бактерий, однако из-за токсичности примен, в медицине только как ср-во местного действия. Г, и мн, его аналоги синтезированы. [c.142]
HjN — line — Гли — Асн — Лей — Сер — Тре — Цис — Мет — Лей — Гли — е — Тир — Тре — Глн — Асп — Фен — Асн — Лиз — Фен — Гис — Тре — Фен — Про — Глн — Тре — Ала — Лей — Гли — Вал — Гли — Ала — Про — NHj (мол. м. 3600 буквенные обозначения см. в ст. а-Аминокислоты). У животных различается аминокислотными остатками в положениях 10—32. Для проявления биол. действия К. обязательно сохранение всей его пептидной цепи. У большинства млекопитающих К. вырабатывается парафолликулярными или клетками щитовидной железы. К. понижает содержание Са и Р в крови. Действует в осн. на скелет, где тормозит резорбтивные процессы антагонист паратгормона. Выделяют К. из щитовидной железы животных или синтезируют. Примен. в медицине для подавления резорбции костей. [c.236]
в ст. а-Аминокислоты). У животных различается аминокислотными остатками в положениях 10—32. Для проявления биол. действия К. обязательно сохранение всей его пептидной цепи. У большинства млекопитающих К. вырабатывается парафолликулярными или клетками щитовидной железы. К. понижает содержание Са и Р в крови. Действует в осн. на скелет, где тормозит резорбтивные процессы антагонист паратгормона. Выделяют К. из щитовидной железы животных или синтезируют. Примен. в медицине для подавления резорбции костей. [c.236]
Илей—Глн—Асп—Цис—Про—Лей—Гли— ONHa (мол. м. 1007 букв, обозначения см. в ст. а-Аминокислоты). Вырабатывается нейросекреторными клетками гипоталамуса, накапливается в гипофизе. Стимулирует сокрагцеыие гладкой мускулатуры матки и секрецию молока молочными железами. Выделяют из гипофизов животных или синтезируют. Примен. в медицине. [c.403]
Подобное структурное сходство дает основание ожидать, что пазвания аминокислот уже говорят о природе их радикалов.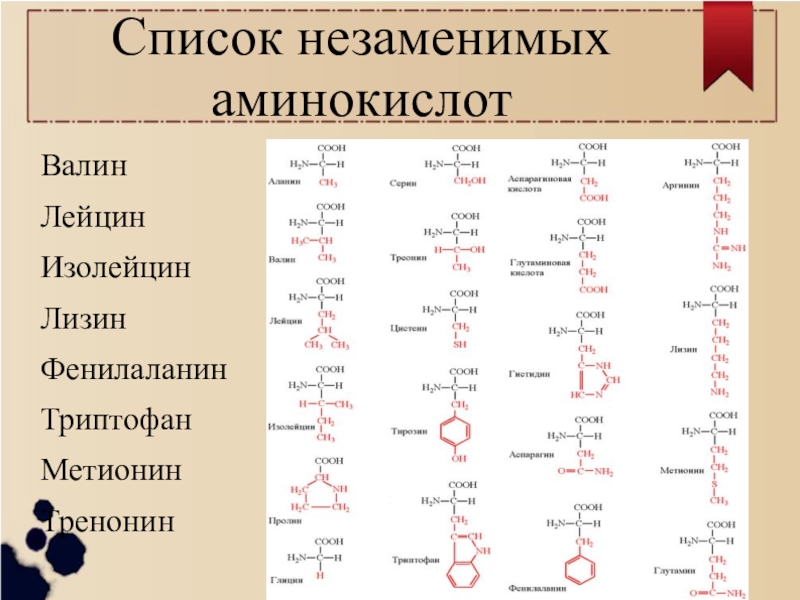 К сонтривиальные названия не позволят сделать заключение о природе радикала, если мы не знаем заранее, какой структуре соответствует данное название. Вот почему мы вынуждены запоминать для канедой аминокислоты ее название и структуру. Возможно, удобнее было бы пользоваться номенклатурой ШРАС для обозначения аминокислот, однако тривиальные названия уже прочно вошли в обиход органической химии и, что еще важнее, биохимии. [c.384]
К сонтривиальные названия не позволят сделать заключение о природе радикала, если мы не знаем заранее, какой структуре соответствует данное название. Вот почему мы вынуждены запоминать для канедой аминокислоты ее название и структуру. Возможно, удобнее было бы пользоваться номенклатурой ШРАС для обозначения аминокислот, однако тривиальные названия уже прочно вошли в обиход органической химии и, что еще важнее, биохимии. [c.384]
Полипептиды называются как производные С-концевой аминокислоты, причем первой пишут название N-концевой аминокислоты, а последней — С-концевую аминокислоту. В таком порядке пишут как полные названия составляющих аминокислот, так и их сокращенные обозначения. Так, гли-цилаланин — это дипептид, состоящий из глицина (N-концевая аминокислота) и аланина (С-концевая аминокислота). В сокращенном виде его название пишут так gly-ala. Аланилглицин (ala-gly) — это изомерный дипептид, в котором N-концевой аминокислотой является аланин, а С-концевой — глицин. [c.400]
[c.400]
Пептид. Общий термин для обозначения полиамидов, построенных из а-аминокислот. Дипептидами, трипептпдами,. .. полипептидами называют полиамиды, состоящие из двух, трех и т. д. аминокислот. [c.413]
Г.-белки с мол. м. от 10-15 тыс. до 200-300 тыс. Они проявляют свою каталитич. активность, как правило, в отсутствие к.-л. кофакторов лишь в нек-рых случаях необходимы ионы металлов-гл. обр. Zn » , Со » , Са , Mg » . Для небольшого числа Г. известна первичная, а для нек-рых и пространств, структура молекулы (напр., для лизоци-ма, пепсина, трипсина, химотрипсина). Отмечено значит, сходство структуры ферментов одного подкласса, особенно в области активного центра. Так, мн. протеиназы имеют в активном центре одинаковую последовательность аминокислот Gly Asp Ser Gly Gly Pro (обозначения см. в ст. Аминокислоты]. Близкое строение имеет и активный центр ряда эстераз. [c.561]
Понижение давления возможно также в результате ингибирования фермента пептиднлдипептидазы (кининазы-Щ к-рый катализирует превращение неактивного декапептида ангиотензина-1 в сильный прессорный октапептид ангио-тензин-П и инактивирует брадикинин, расширяющий сосуды.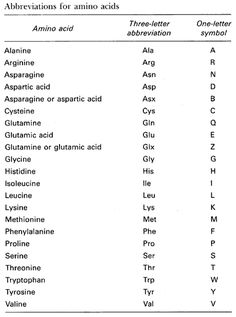 К таким ингибиторам относятся, напр., тепротид-5-Oxo-Pro-Trp-Pro-Arg-Pro-Gln-iso-Leu-Pro-OH (буквенные обозначения см. в ст. Аминокислоты), каптоприл (X). [c.572]
К таким ингибиторам относятся, напр., тепротид-5-Oxo-Pro-Trp-Pro-Arg-Pro-Gln-iso-Leu-Pro-OH (буквенные обозначения см. в ст. Аминокислоты), каптоприл (X). [c.572]
Amino acids | Protocol (Translated to Russian)
Аминокислоты это органические соединения, состоящие преимущественно из углерода, водорода, кислорода и азота. Хотя существуют сотни аминокислот, есть двадцать, которые функционируют как строительные блоки белков. Эти двадцать аминокислот часто называют трех-или однобуквенными аббревиатурами.
Все аминокислоты имеют центральный альфа-углерод, функционирующий как хиральный центр для большинства аминокислот. Он присоединен к аминогруппе, карбоксильной группе, атому водорода и переменной R-группе. Хиральная молекула имеет четыре отдельные группы, расположенные вокруг определенного атома, известного как хиральный центр.
Поскольку в качестве группы R глицин имеет атом водорода, он не имеет четырех отдельных групп и, следовательно, не имеет хирального центра. Эти четыре группы могут образовывать две различные конфигурации, которые являются стереоизомерами, называемыми L-и D-изомерами. Эти изомеры представляют собой зеркальные изображения, которые не накладываются друг на друга.
Эти четыре группы могут образовывать две различные конфигурации, которые являются стереоизомерами, называемыми L-и D-изомерами. Эти изомеры представляют собой зеркальные изображения, которые не накладываются друг на друга.
Аминокислоты, используемые в синтезе белка, всегда являются L-изомерами. Аминогруппа аминокислоты может действовать как основание и принимать протон, приводя к положительному заряду, тогда как карбоксильная группа может действовать как кислота и отдавать протон, приводя к отрицательному заряду. При физиологическом pH аминокислоты обычно существуют как двухзарядные и называются цвиттерионами, молекулами с равным числом положительных и отрицательных зарядов.
Каждая аминокислота имеет уникальную группу R, которая отвечает за их различные характеристики, включая их размер, растворимость и заряд. Аминокислоты широко классифицируются на две категории в зависимости от их R-групп:неполярные и полярные. Неполярные аминокислоты можно разделить на алифатические и ароматические.
Полярные аминокислоты можно разделить на кислые, основные и незаряженные при нейтральном pH. Алифатические группы это углеводороды с одинарными связями, существующие в виде прямых, разветвленных или циклических цепей. Аминокислоты с алифатическими группами R представляют собой глицин, простейшую аминокислоту;аланин, валин, лейцин и изолейцин, которые чрезвычайно гидрофобны и связываются друг с другом с образованием стабильных ядерных структур в белках;метионин, серосодержащая аминокислота;и пролин, который имеет алифатическое кольцо.
Ароматические группы это углеводороды, существующие в виде ненасыщенных колец с чередующимися одинарными и двойными связями. Ароматические аминокислоты это фенилаланин, тирозин и триптофан, все из которых имеют большие размеры и способны участвовать в гидрофобных взаимодействиях. Кислые аминокислоты это аспартат и глутамат.
У них есть карбоксильные группы, которые отдают протон, чтобы стать отрицательно заряженной. Основные аминокислоты это лизин, аргинин и гистидин. На их боковых цепях есть аминогруппы, которые принимают протон, чтобы стать положительно заряженной.
На их боковых цепях есть аминогруппы, которые принимают протон, чтобы стать положительно заряженной.
Полярные незаряженные аминокислоты это серин, треонин, цистеин, аспарагин и глутамин. Они гидрофильны и содержат различные полярные функциональные группы:гидроксильные группы в серине и треонине, сульфгидрильную группу в цистеине и амидные группы в аспарагине и глутамине.
Глоссарий | EXCEMED
Этот глоссарий призван обеспечить точные определения ключевых терминов. Слова, выделенные курсивом, имеют отдельные пояснения. Если вы считаете, что некоторые термины должны быть добавлены в словарь, пожалуйста, отправьте сообщение по электронной почте info@excemed.org с вашим предложением.
Кликните на одно сообщение выше, чтобы перейти на страницу, начиная с этого сообщения.
B
- Bh5
- Сокращенное название тетрагидробиоптерина (кофактора фенилаланингидроксилазы ), который часто используется в медицинских исследованиях.

См.: Сапроптерин
Синонимы: tetrahydrobiopterin
Перейти к началу
H
- HPA
Распространенное сокращенное название гиперфенилаланинемии.
Перейти к началу
I
- IQ
«Коэффициент умственного развития», широко распространенный показатель умственного развития, который определяется при помощи тестов. IQ представляет собой соотношение умственного и физического развития человека, которое выражается в процентах.
Перейти к началу
P
- PEG-PAL
Аммиаклиаза фенилаланина — это фермент , получаемый из растений, который расщепляет фенилаланин , но при этом не требует тетрагидробиоптерин в качестве кофермента .
 PEG-PAL — это пегилированный инъекционный состав аммиаклиазы фенилаланина, который исследуется в клинических условиях на людях с фенилкетонурией. В данный момент PEG-PAL еще не утвержден как официальное терапевтическое средство.
PEG-PAL — это пегилированный инъекционный состав аммиаклиазы фенилаланина, который исследуется в клинических условиях на людях с фенилкетонурией. В данный момент PEG-PAL еще не утвержден как официальное терапевтическое средство.- Phe
- Сокращенное название фенилаланина.
Перейти к началу
А
- Аминокислота
Аминокислоты — это маленькие молекулы с определенной структурой, с карбоксильными и аминными группами, отделенными от центрального атома углерода с боковой связью, которая позволяет различать разные аминокислоты. Все белки состоят их цепочек аминокислот, связанных вместе, некоторые аминокислоты имеют огромное значение для нервной системы. Существует около 20 аминокислот, которые важны для физиологии человека. MБольшинство из них синтезируется в теле человека, но некоторые не синтезируются, а должны поступать извне в процессе питания (« Незаменимые аминокислоты «).
 Люди, которые страдают фенилкетонурией и соблюдают диету с низким содержанием фенилаланина, не могут получать с пищей достаточное количество белков; для получения незаменимых аминокислот им могут потребоваться продукты лечебного питания
Люди, которые страдают фенилкетонурией и соблюдают диету с низким содержанием фенилаланина, не могут получать с пищей достаточное количество белков; для получения незаменимых аминокислот им могут потребоваться продукты лечебного питания- Аммиаклиаза фенилаланина
См.: PEG-PAL
- Аспартам
Аспартам — это искусственный заменитель сахара, имеет разные коммерческие названия. Аспартам высвобождает фенилаланин в процессе обмена веществ, поэтому людям с фенилкетонурией следует избегать его употребления.
- Атипичная гиперфенилаланинемия
Этот термин используется в отношении к пациентам с недостатком тетрагидробиоптерина, а также для того, чтобы охарактеризовать людей с легкой формой гиперфенилаланинемии , которая возникает в результате определенной мутации гена фенилаланингидроксилазы.
- Аутосомно-рецессивная наследственность
Вид наследования мутации гена, который несущественно влияет на фенотип человека, из-за того что другая (немутированная) копия гена обеспечивает достаточную активность белка, кодированного геном .
 Например, у пациентов с одной мутированной и одной нормальной копией фенилаланингидроксилазы (один из родителей является носителем мутации гена) не выражается клинический фенотип фенилкетонурии, характеризуемый гиперфенилаланинемией . Наследование двух мутированных копий (по одной от каждого родителя) в результате будет выражено фенотипом фенилкетонурии.
Например, у пациентов с одной мутированной и одной нормальной копией фенилаланингидроксилазы (один из родителей является носителем мутации гена) не выражается клинический фенотип фенилкетонурии, характеризуемый гиперфенилаланинемией . Наследование двух мутированных копий (по одной от каждого родителя) в результате будет выражено фенотипом фенилкетонурии.
Перейти к началу
Б
- Белое вещество
В ЦНС содержится «серое вещество», которое образовано телами нервных клеток, и «белое вещество», которое состоит в основном из нервных волокон (аксонов). Недостаточная регуляция фенилаланина в крови в течение длительного времени может негативно повлиять на белое вещество в головном мозге.
- Болезнь Фёллинга
Ранний термин для обозначения фенилкетонурии, связанный с именем врача Асбьёрна Фёллинга, который открыл зависимость синдрома прогрессирующей умственной отсталости , известной в наше время как фенилкетонурия , от избытка фенилаланина .

- Большие нейтральные аминокислоты
- Этот термин описывает некоторые аминокислоты в соответствии с их химической структурой (большие неионизированные боковые цепи) и, как правило, относится к: фенилаланину, тирозину , триптофану, валину, изолейцину, лейцину, метионину и гистидину. Людям с фенилкетонурией иногда назначают добавки с LNAA.
Синонимы: LNAA
Перейти к началу
В
- Веконосовые складки
Складки кожи верхнего века, которые закрывают внутренние уголки глаз.
- Восприимчивый к тетрагидробиоптерину
Этот термин используется для описания людей с фенилкетонурией, которые положительно реагируют на лечение сапроптерином или на нагрузочную пробу на тетрагидробиоптерин . Такие люди с медицинской точки зрения потенциально подходят для долгосрочного лечения сапроптерином с целью регуляции уровня фенилаланина в крови.

- Вставка
- Мутация , при которой дополнительная ДНК (одна или более пар оснований) выпадает из гена.
Перейти к началу
Г
- Ген
- Последовательность ДНК, которая определяет структуру определенного белка. Количество мутаций в гене фенилаланингидроксилазы , которые, как известно, например, ухудшают способность фермента преобразовывать фенилаланин в тирозин , приводя тем самым к фенилкетонурии.
- Генетическая гетерогенность
Каждый человек уникален в отношении его ДНК. Генетическая гетерогенность — это термин, который используется для описания ряда мутаций в определенном гене у разных индивидуумов одной группы. Много разных мутаций генов могут вызвать фенилкетонурию, поэтому данная численность людей обладает генетической гетерогенностью высокой степени.
- Генная терапия
Метод лечения, в котором применяется изменение самого генетического кода пациента.
 Например, в экспериментальных исследованиях производится поиск метода генной терапии, который позволит создать рабочую копию фенилаланингидроксилазы для пациентов с фенилкетонурией, которые страдают от недостатка этого фермента . Однако, в настоящее время эти исследования являются теоретическими, а использование их результатов для лечения фенилкетонурии возможно лишь в далеком будущем.
Например, в экспериментальных исследованиях производится поиск метода генной терапии, который позволит создать рабочую копию фенилаланингидроксилазы для пациентов с фенилкетонурией, которые страдают от недостатка этого фермента . Однако, в настоящее время эти исследования являются теоретическими, а использование их результатов для лечения фенилкетонурии возможно лишь в далеком будущем.- Генотип
- Данный термин описывает образец мутаций , которые присутствуют в определенных генах на уровне ДНК индивидуума. Генотип пациентов с фенилкетонурией во многом, хотя не полностью, прогнозирует их фенотип фенилкетонурии. Например, мутации R408W или IVS-12 существенно снижают активность фенилаланингидроксилазы и приводят к среднему или тяжелому фенотипу фенилкетонурии. Другие мутации , как, например, E390G, Y414C, или A300S, не столь сильно угнетают активность фермента , поэтому питательная переносимость фенилаланина выше, а фенотип фенилкетонурии является менее тяжелым.
 У пациентов с фенилкетонурии часто наблюдаются разные мутации в каждой копии гена фенилаланингидроксилазы .
У пациентов с фенилкетонурии часто наблюдаются разные мутации в каждой копии гена фенилаланингидроксилазы . - Гетерозиготный
- У каждого из нас есть две копии каждого гена . Организм с определенной мутацией только одного гена (при отсутствии мутации другого) называется гетерозиготным в отношении данной мутации.
- Гипертония
Повышенный мышечный тонус.
- Гиперфенилаланинемия
Повышенный уровень фенилаланина в крови. Уровень фенилаланина в крови, который разделяет нормальное содержание фенилаланина в крови и гиперфенилаланинемию , в соответствии с положениями рекомендаций , изменяется с возрастом.
- Гиперфенилаланинемия без фенилкетонурии
У людей с гиперфенилаланинемией без фенилкетонурии наблюдается незначительное повреждение фенилаланингидроксилазы . Это часто возникает по причине мутации только одной из двух имеющихся копий гена фенилаланингидроксилазы или по причине мутаций, которые незначительно ухудшают функцию фермента .
 При этом наблюдается слегка повышенный уровень фенилаланина в крови, который является недостаточным для диагностирования фенилкетонурии и, как правило, не требует лечения.
При этом наблюдается слегка повышенный уровень фенилаланина в крови, который является недостаточным для диагностирования фенилкетонурии и, как правило, не требует лечения.- Гипотония
Пониженный мышечный тонус.
- Гликопротеин
Источник белка, полученный из молочной сыворотки, в которой не содержится фенилаланина . Гликопротеин иногда используется в качестве белковой пищевой добавки ( продукта лечебного питания ) для пациентов с фенилкетонурией.
- Гомозиготный
- У каждого из нас есть две копии каждого гена . Организм с идентичной мутацией обоих генов называется гомозиготным в отношении данной мутации.
- Губной желобок
Желобок посредине над верхней губой, который тянется от носа до верха губы.
Перейти к началу
Д
- Двигательные навыки
Способность групп мышц выполнять контролируемые точные движения.
 Измерение двигательных навыков иногда назначается в качестве нейропсихологических тестов , для того чтобы следить за развитием людей с фенилкетонурией.
Измерение двигательных навыков иногда назначается в качестве нейропсихологических тестов , для того чтобы следить за развитием людей с фенилкетонурией.- Делеция
Мутация , при которой ДНК (одна или более пар оснований) выпадает из гена.
- Дефицит тетрагидробиоптерина
См.: Недостаток тетрагидробиоптерина
- Диагностирующий тест(ы)
- Диагностирующие тесты используются для определения болезней у населения. В большинстве стран все новорожденные дети проверяются на наличие фенилкетонурии и других наследственных нарушений обмена веществ в первые дни или недели жизни. При необходимости может быть назначено лечение с целью предотвратить долгосрочные негативные последствия болезни.
- Диарея
Симптом, для которого характерны частые ежедневные испражнения и жидкий стул.
 Диарея может быть вызвана разными факторами: у больных фенилкетонурией причиной диареи может быть сохранение низких концентраций фенилаланина в крови в течение длительного времени. Более длительный период низких концентраций фенилаланина может привести к снижению скорости роста, атрофии кожи (которое можно ошибочно принять за экзему) и диарее, которая может свидетельствовать о слабой функции кишечника или неспособности кишечника синтезировать новые клетки. С другой стороны, диарея, так же как рвота или повышение температуры, может стать причиной катаболизма и последующего повышения концентрации фенилаланина в крови.
Диарея может быть вызвана разными факторами: у больных фенилкетонурией причиной диареи может быть сохранение низких концентраций фенилаланина в крови в течение длительного времени. Более длительный период низких концентраций фенилаланина может привести к снижению скорости роста, атрофии кожи (которое можно ошибочно принять за экзему) и диарее, которая может свидетельствовать о слабой функции кишечника или неспособности кишечника синтезировать новые клетки. С другой стороны, диарея, так же как рвота или повышение температуры, может стать причиной катаболизма и последующего повышения концентрации фенилаланина в крови.- Диета с низким содержанием фенилаланина
Фенилкетонурия характеризуется неспособностью регулировать уровень фенилаланина в крови, при этом в обычном режиме питания данный уровень может подняться до токсического. Следовательно, пациентам требуется специальная диета с низким содержанием фенилаланина , которая обычно дополняется назначением продуктов лечебного питания.

- Допустимая норма фенилаланина
- Количество фенилаланина , которое пациент может принять с пищей без риска последующего превышения допустимого уровня фенилаланина в крови.
- Дофамин
- Важный нейромедиатор в ЦНС . Дофамин участвует во многих функциях ЦНС , включая точное управление движениями (недостаток дофаминергических клеток наблюдается при болезни Паркинсона) и когнитивную деятельность. По предположению, вызванное недостатком миелина нарушение функций переднего мозга, регулируемых дофамином, при долговременном заболевании гиперфенилаланинемией может стать причиной повреждения когнитивной функции . Для осуществления биосинтеза дофамина требуется тирозин . Высокий уровень фенилаланина в крови сдерживает проникновение тирозина в мозг (для фенилаланина и тирозина требуется один и тот же переносчик больших нейтральных аминокислот в гематоэнцефалический барьер). Это может быть очередным фактом негативного воздействия гиперфенилаланинемии на функцию дофаминергических систем мозга.

Перейти к началу
З
- Заменитель белка
Пациенты с фенилкетонурией, как правило, не могут принимать в пищу продукты — натуральные источники белка, в которых содержится фенилаланин . Заменители белка ( продукты лечебного питания ) являются источниками белка, в которых нет фенилаланина , но есть другие аминокислоты , необходимые для полноценного питания.
Перейти к началу
И
- Интроны
- Интроны — это последовательности ДНК в гене , которые не переносятся в зрелый белок. Последовательности РНК, возникающие на основе интронов, выпадают во время процессинга начальной ДНК для формирования окончательного мессенджера РНК, который будет использоваться для трансляции в белок.
- Исполнительная функция
- Термин, который описывает некоторые из высших функций головного мозга.
 К исполнительным функциям относятся воля, понимание, суждение, согласованное использование ресурсов (например, памяти) для достижения поставленных целей, планирование задач, разработка стратегий или создание комплекса действий для выполнения более объемной задачи, исправление ошибок, решение проблем, выработка соответствующего поведения с учетом полученной информации, реагирование на действия, которые еще не изучены, надлежащее поведение в ситуациях, в которых требуется преодолеть искушение или силу привычки. Исследования людей с фенилкетонурией выявили ухудшени исполнительной функции в сравнении с людьми, которые не страдают данным заболеванием.
К исполнительным функциям относятся воля, понимание, суждение, согласованное использование ресурсов (например, памяти) для достижения поставленных целей, планирование задач, разработка стратегий или создание комплекса действий для выполнения более объемной задачи, исправление ошибок, решение проблем, выработка соответствующего поведения с учетом полученной информации, реагирование на действия, которые еще не изучены, надлежащее поведение в ситуациях, в которых требуется преодолеть искушение или силу привычки. Исследования людей с фенилкетонурией выявили ухудшени исполнительной функции в сравнении с людьми, которые не страдают данным заболеванием.
Перейти к началу
К
- Классическая фенилкетонурия
Этот термин обычно используется для описания пациентов с мутациями гена фенилаланингидроксилазы , который приводит к снижению активности ферментов , вплоть до отсутствия таковой.
 Вполне вероятно, что у таких пациентов будет развиваться тяжелая форма гиперфенилаланинемии (уровень фенилаланина в крови, как правило, выше 1200 μmol/л) и при этом будет необходима диета с низким содержанием фенилаланина . Для пациентов с классической фенрилкетонурией нехарактерна восприимчивость к лечению сапроптерином .
Вполне вероятно, что у таких пациентов будет развиваться тяжелая форма гиперфенилаланинемии (уровень фенилаланина в крови, как правило, выше 1200 μmol/л) и при этом будет необходима диета с низким содержанием фенилаланина . Для пациентов с классической фенрилкетонурией нехарактерна восприимчивость к лечению сапроптерином .- Кофактор
Некоторым ферментам требуется другая молекула для передачи их функции — кофактор. Тетрагидробиоптерин является кофактором фенилаланингидроксилазы ( фермента , недостаток которого наблюдается при фенилкетонурии).
- Куван (Kuvan®)
- Kuvan® — это дигидрохлорид сапроптерина фармацевтическая композиция тетрагидробиоптерина(растворимые таблетки), которая официально применяется для лечения фенилкетонурии во многих странах.
Перейти к началу
Л
- Легкая форма гиперфенилаланинемии
К легкой форме гиперфенилаланинемии относятся небольшие концентрации фенилаланина в крови, которые считаются недостаточными для диагностирования фенилкетонурии и применения диеты с низким содержанием фенилаланина .

- Легкая форма фенилкетонурии
Низкий или средний уровень фенилаланина в крови, который обнаруживается у людей с мутациями гена фенилаланингидроксилазы и только частично подавляет функцию фермента.
Перейти к началу
М
- Материнская фенилкетонурия
Если мать болеет фенилкетонурией, то развивающийся плод подвергается негативному воздействию высокого уровня фенилаланина в крови. Женщинам с фенилкетонурией в период беременности или во время планирования беременности следует принять меры для регуляции уровня фенилаланина в крови. Для плода последствия материнской фенилкетонурии с отсутствием регуляции (если уровень фенилаланина в крови выше 1200 μmol/л) представляют высокий риск (более 90% случаев) умственной отсталости и микроцефалии . Также возможны физические недостатки ( нарушение строения лица) или врожденный порок сердца.

- Меланин
Меланин — это гормон, который вызывает потемнение кожи, например, при реакции на солнечный свет. Высокий уровень фенилаланина в крови человека, не соблюдающего лечение фенилкетонурии, подавляет выработку меланина в организме. В результате этого у пациентов с фенилкетонурией часто бывает светлая кожа.
- Метаболит
Химическое вещество, которое вырабатывается в организме, обычно в результате функционирования ферментов . Обычно эти вещества используются в последующих биохимических реакциях, расщепляются дальше или выводятся с мочой. Например, птерины в моче (измеряются для диагностики дефицита тетрагидробиоптерина ) являются метаболитами тетрагидробиоптерина.
- Миелин
Оболочка, которая состоит из определенных клеток (олигодендроцитов в ЦНС , шванновских клеток — в периферийной), которые покрывают и изолируют нервы, а также повышают скорость передачи нервных импульсов.
 Недостаточная регуляция уровня фенилаланина в крови в течение длительного времени, как известно, может вызвать повреждение миелина в головном мозге. Однако, остается неясным, каким образом данное явление связано с подавлением исполнительных и когнитивных функций, что наблюдается у пациентов с фенилкетонурией.
Недостаточная регуляция уровня фенилаланина в крови в течение длительного времени, как известно, может вызвать повреждение миелина в головном мозге. Однако, остается неясным, каким образом данное явление связано с подавлением исполнительных и когнитивных функций, что наблюдается у пациентов с фенилкетонурией.- Миссенс-мутация
Миссенс- мутация — это мутация одного основания гена , при которой в конечном белке одна аминокислота заменяется другой. Например, миссенс- мутация R408W изменяет ДНК таким образом, что нуклеотид CGG (аргинин) заменяется на TGG (триптофан). Эта замена аминокислоты значительно подавляет активность фенилаланингидроксилазы в образовавшемся белке.
- Молчащая мутация
Не все мутации ДНК меняют активность получаемого белка. Например, нуклеотид, изменяясь с ЦAA на ЦАГ, производит в итоговом белке глутамин, в любом случае, и белок будет идентичен любому генотипу.
 Данная молчащая мутация была описана применительно к фенилаланингидроксилазе .
Данная молчащая мутация была описана применительно к фенилаланингидроксилазе .
Перейти к началу
Н
- Нагрузочная проба
См.: Нагрузочная проба на тетрагидробиоптерин
- Нагрузочная проба на тетрагидробиоптерин
Медицинское исследование с целью обнаружить у людей восприимчивость к лечению сапроптерином . Положительный результат определяется согласно количеству снижения фенилаланина в крови после лечения (обычно, но не всегда, 30%-снижение уровня фенилаланина в крови сравнивается с уровнем, измеренным непосредственно перед лечением). В данный момент в разных центрах используются разные виды нагрузочных проб.
- Нарушение строения
Нарушенное физическое развитие. Распространенным последствием материнской фенилкетонурии является нарушение строения лица, для которого характерна широкая переносица, веконосовые складки, широкий губной желобок, низко расположенные уши, поднятые ноздри и меленькие губы.

- Натуральный белок
Натуральный белок — это белок, который содержится в обычных продуктах питания, в отличие от искусственного белка в продуктах лечебного питания.
- Недостаток тетрагидробиоптерина
Состояние, при котором генные мутации ослабляют выработку тетрагидробиоптерина, кофермента фенилаланингидроксилазы . Активность любого из нескольких ферментов может стать неполноценной (ГТФ циклогидролаза I; 6-пирувоил- тетрагидробиоптерин синтаза; сепиаптеринредуктаза 1; дигадроптеринредуктаза). Некоторые, но не все формы недостатка тетрагидробиоптерина являются признаками гиперфенилаланинемии , что требует диеты с низким содержанием фенилаланина . Около 1-2% случаев гиперфенилаланинемии обнаружены при обычном осмотре новорожденных по выявленному дефициту тетрагидробиоптерина.
Тетрагидробиоптерин также требует продуцирования ключевых нейромедиаторов в ЦНС , а некоторые формы дефицита тетрагидробиоптерина имеют симптомы, возникающие вследствие измененной активности нейромедиаторов .

- Незаменимые аминокислоты
Аминокислоты , которые не синтезируются в организме и должны быть получены с питанием. Для пациентов с фенилкетонурией источником незаменимых аминокислот являются продукты лечебного питания.
- Нейропсихологическое тестирование
Долговременная гиперфенилаланинемия нарушает функцию головного мозга. Для отслеживания развития головного мозга у молодых людей, страдающих фенилкетонурией, а также для измерения ряда фугкций головного мозга, как, например, когнитивная функция , память, двигательные навыки и др. необходимо проведение нейропсихологических тестов.
- Нейротоксический
Вызывающий повреждение нервных клеток. Долговременное повышение уровня фенилаланина при отсутствии лечения или несвоевременном лечении фенилкетонурии является нейротоксическим для головного мозга и вызывает умственную отсталость или прочие отрицательные последствия.

- Несвоевременное лечение
В контексте фенилкетонурии несвоевременное лечение — это отсутствие диеты с низким содержанием фенилаланина у людей с фенилкетонурией с первых дней или недель жизни. Несвоевременное лечение людей с фенилкетонурией почти всегда приводит к нарушениям развития, которые характерны при фенилкетонурии (как, например, тяжелая умственная отсталость).
- Нонсенс-мутация
Нонсенс-мутацией называется преобразование нуклеотида аминокислоты в терминирующий кодон (стоп-кодон) . В результате этого образуется укороченный белок, у которого отсутствует биологическая активность. Мутация R111X изменяет нуклеотид ДНК с ЦГА (аргинин) на ТГА (стоп).
- Носитель (мутации гена)
- У ребенка может развиться классическая фенилкетонурия , если он наследует от своих родителей (по одной копии от каждого) два мутированных гена фенилаланингидроксилазы , фермента , которого недостаточно у людей с фенилкетонурией.
 Люди с одной мутацией гена не страдают от фенилкетонурии, однако, они являются носителями мутации. Два носителя мутации гена фенилаланингидроксилазы (который подавляет активность фермента ) в результате получают: — В одном случае из четырех у них рождается ребенок с фенилкетонурией (две мутированные копии гена ),
— в одном случае из четырех у них рождается ребенок без мутаций , вызывающих фенилкетонурию (нет мутированных копий гена), и
— в одном случае из двух у них рождается ребенок-носитель первой или второй мутации .
Люди с одной мутацией гена не страдают от фенилкетонурии, однако, они являются носителями мутации. Два носителя мутации гена фенилаланингидроксилазы (который подавляет активность фермента ) в результате получают: — В одном случае из четырех у них рождается ребенок с фенилкетонурией (две мутированные копии гена ),
— в одном случае из четырех у них рождается ребенок без мутаций , вызывающих фенилкетонурию (нет мутированных копий гена), и
— в одном случае из двух у них рождается ребенок-носитель первой или второй мутации .
Перейти к началу
О
- Обменное поглощение
См.: Обменное поглощение фенилаланина
- Обменное поглощение фенилаланина
Показатели обменного поглощения фенилаланина — это информация о продуктах, которая указывает, сколько фенилаланина в них содержится. Эти показатели помогают людям с фенилкетонурией планировать свою диету и определить, какую пищу можно есть свободно (в пределах разумного), какую — только в строго регулируемых количествах, а от какой пищи вообще следует отказаться.

Перейти к началу
П
- Переносчик больших нейтральных аминокислот
Головной мозг отделен от остального организма барьером (гематоэнцефалическим барьером), который выполняет многие функции, включая точную модуляцию химической среды ЦНС . Большие нейтральные аминокислоты (в том числе и фенилаланин ) необходимы для полноценной деятельности мозга, например, синтеза важных нейромедиаторов, таких как дофамин , норэпинефрин (норадреналин) или серотонин (5-окситриптамин). LNAA переносятся через гематоэнцефалический барьер в мозг при помощи особого белка-переносчика и могут затем использоваться нервными клетками.
- Приверженность лечению
- Термин «приверженность лечению» помогает описать, насколько точно пациент следует программе, которую ему назначил специалист. Следовательно, люди могут хорошо или плохо соблюдать назначения врача (напр.
 , принимать прописанные лекарства в нужном количестве в нужное время), специальную диету (напр., прием рекомендуемых продуктов питания в правильных количествах и отказ от нежелательных продуктов, и т.д.). Это касается людей с фенилкетонурией, которые соблюдают диету с низким содержанием фенилаланина или проходят сапроптериновую терапию , к примеру. Термины «приверженность лечению» и « соблюдение указаний врача » являются взаимозаменяемыми.
, принимать прописанные лекарства в нужном количестве в нужное время), специальную диету (напр., прием рекомендуемых продуктов питания в правильных количествах и отказ от нежелательных продуктов, и т.д.). Это касается людей с фенилкетонурией, которые соблюдают диету с низким содержанием фенилаланина или проходят сапроптериновую терапию , к примеру. Термины «приверженность лечению» и « соблюдение указаний врача » являются взаимозаменяемыми. - Проба Гатри
- Метод массового скрининга новорожденных на фенилкетонурию, который до сих пор используется в некоторых странах. Для этого теста берут пробу крови из пятки, помещают ее на фильтровальную бумагу и отправляют в лабораторию. Из бумаги внутри пятна крови выбивают маленькие круглые кусочки, которые помещают на агаровый гель с содержащимися в нем бактериями Bactilis subtilis , для роста которых требуется фенилаланин . В состав геля также входит β-2-тиенилаланин — вещество, которое подавляет рост бактерий путем сдерживания использования фенилаланина этими бактериями.
 Повышение локальной концентрации фенилаланина (в крови младенца, больного гиперфенилаланинемией ) позволяет преодолеть подавление роста бактерий, и в течение одного дня вокруг положительного образца наблюдается рост кольца бактерий. По диаметру бактериальной колонии можно оценить степень концентрации фенилаланина в образце. Во многих странах проба Гатри заменена более новыми методами, например, тандемной масс-спектрометрией.
Повышение локальной концентрации фенилаланина (в крови младенца, больного гиперфенилаланинемией ) позволяет преодолеть подавление роста бактерий, и в течение одного дня вокруг положительного образца наблюдается рост кольца бактерий. По диаметру бактериальной колонии можно оценить степень концентрации фенилаланина в образце. Во многих странах проба Гатри заменена более новыми методами, например, тандемной масс-спектрометрией. - Продукты лечебного питания
Пациенты с фенилкетонурией, как правило, не могут принимать в пищу продукты — натуральные источники белка, поскольку в них содержится фенилаланин . Продукты лечебного питания (иногда их называют заменителями белка ) являются источниками белка, в которых нет фенилаланина , но есть другие аминокислоты , необходимые для полноценного питания.
- Птерины (в моче)
- Группа веществ ( метаболитов ), которые вырабатываются в организме в процессе расщепления тетрагидробиоптерина .
 При недостатке тетрагидробиоптерина у пациентов измеряются свойства птеринов в моче, для того чтобы определить, у какого из ферментов, участвующих в выработке тетрагидробиоптерина, нарушена функция. См. тж. дефицит тетрагидробиоптерина .
При недостатке тетрагидробиоптерина у пациентов измеряются свойства птеринов в моче, для того чтобы определить, у какого из ферментов, участвующих в выработке тетрагидробиоптерина, нарушена функция. См. тж. дефицит тетрагидробиоптерина .См.: Недостаток тетрагидробиоптерина
- Пяточная проба
Проба крови для скрининга новорожденных на фенилкетонурию, а также на другие заболевания обычно берется из пятки младенца при помощи укола иглой.
Перейти к началу
Р
- Развитие
- Термин с широким значением, охватывает физические и когнитивные изменения, которые происходят вместе с ростом человека; термин обычно относится к молодым людям. Для поддержки нормального развития людей, страдающих фенилкетонурией, важна оптимизация питания — например, диета с низким содержанием фенилаланина.
- Разновидность фенилкетонурии
Термин обычно используется для описания пациентов с фенилкетонурией с некоторой остаточной активностью фенилаланингидроксилазы .
 Уровень фенилаланина в крови обычно ниже, чем в случае классической фенилкетонурии, хотя диета с низким содержанием фенилаланинина в большинстве случаев все еще необходима. Люди с остаточной активностью фенилаланингидроксилазы в большей степени поддаются лечению с помощью сапроптерина, чем люди с классической формой фенилкетонурии.
Уровень фенилаланина в крови обычно ниже, чем в случае классической фенилкетонурии, хотя диета с низким содержанием фенилаланинина в большинстве случаев все еще необходима. Люди с остаточной активностью фенилаланингидроксилазы в большей степени поддаются лечению с помощью сапроптерина, чем люди с классической формой фенилкетонурии.- Рекомендация
- С точки зрения медицины к рекомендациям обычно относятся документы, в которых установлены оптимальные методы и режим лечения в определенной области. В рекомендациях обычно содержатся подробные обзоры медицинских заключений, которыми подтверждаются определенные методы лечения с указаниями по их оптимальному применению. Врачи не обязаны следовать всем этим рекомендациям, в отдельных случаях они могут выносить свою клиническую оценку.
Перейти к началу
С
- Сапроптерин
Химическое название формы тетрагидробиоптерина ( Bh5 ): вещество, возникающее естественным образом, необходимое для активности фенилаланингидроксилазы ( фермента , недостаток которого наблюдается при фенилкетонурии).
 В группе пациентов с фенилкетонурией ( восприимчивый к тетрагидробиоптерину фенотип — обычно, но не обязательно — пациенты с более легкой формой фенилкетонурии), лечение сапроптерином повышает активность фенилаланингидроксилазы и обеспечивает регуляцию фенилаланина в крови.
В группе пациентов с фенилкетонурией ( восприимчивый к тетрагидробиоптерину фенотип — обычно, но не обязательно — пациенты с более легкой формой фенилкетонурии), лечение сапроптерином повышает активность фенилаланингидроксилазы и обеспечивает регуляцию фенилаланина в крови.- Своевременное лечение
В контексте фенилкетонурии своевременное лечение — это назначение и поддержка диеты с низким содержанием фенилаланина с первых дней или недель жизни человека для смягчения негативного воздействия повышенного уровня фенилаланина в крови на развитие человека.
- Сдвиг рамки считывания
- В синтезе белка ДНК вначале считывается матричной РНК, созданной из цепочки нуклеотидов. В генетическом коде набор из трех смежных оснований (нуклеотидов) в цепочке РНК кодирует каждую аминокислоту белка. Нуклеотиды также обеспечивают другую информацию, например, о завершении. Рамка считывания состоит из последовательности этих нуклеотидов .
 Если количество пар оснований, которые вставляются или удаляются из ДНК, не кратно трем, то происходит мутация со сдвигом рамки. С этого момента происходит изменение рамки считывания. Например, рассмотрим следующую цепочку РНК, в которой основания показаны как рамка считывания шести нуклеотидов, которые завершаются стоп-кодоном. … UUA UAC AGU AAA GCC UAG Лейцин Тирозин Серин Лизин Аланин СТОП Теперь предположим, что вставляется дополнительное отдельное основание
( миссенс-мутация , выделена красным): … UUC AUA CAG UAA AGC CUA Фенилаланин Изолейцин Глутамин СТОП Не считан
Если количество пар оснований, которые вставляются или удаляются из ДНК, не кратно трем, то происходит мутация со сдвигом рамки. С этого момента происходит изменение рамки считывания. Например, рассмотрим следующую цепочку РНК, в которой основания показаны как рамка считывания шести нуклеотидов, которые завершаются стоп-кодоном. … UUA UAC AGU AAA GCC UAG Лейцин Тирозин Серин Лизин Аланин СТОП Теперь предположим, что вставляется дополнительное отдельное основание
( миссенс-мутация , выделена красным): … UUC AUA CAG UAA AGC CUA Фенилаланин Изолейцин Глутамин СТОП Не считан - Скрининг новорожденных
Процедура тестирования всех новорожденных на определенные заболевания, как, например, фенилкетонурию, для своевременного оказания медицинской помощи с целью предотвращения длительного вредного воздействия выявленного заболевания на ребенка. Также называется « скрининг новорожденных ».
- Скрининг новорожденных
См.
 : Скрининг новорожденных
: Скрининг новорожденных- Соблюдение указаний врача
- По значению подобно приверженности лечению, употребляется для того, чтобы охарактеризовать, насколько пациент соблюдает программу лечения, согласованную между ним и его лечащим врачом. Соблюдение диеты с низким содержанием фенилаланина — главный аспект лечения фенилкетонурии, например, когда недостаточное соблюдение указаний врача зачастую может привести к гиперфенилаланинемии, и при этом повышает риск осложнений при фенилкетонурии со стороны нервной системы, как, например, ухудшение исполнительной и когнитивной деятельности.
- Содержание фенилаланина/тирозина
Большая часть тирозина в организме обычно вырабатывается из фенилаланина с помощью фермента — фенилаланингидроксилазы . Если функция фенилаланингидроксилазы нарушена, как при фенилкетонурии, то уровни этих двух аминокислот могут быть нарушены (высокий уровень фенилаланина , низкий уровень тирозина ).
 Это имеет важное значение, в особенности для функции головного мозга, для обеспечения которой требуются и фенилаланин , и тирозин . Для некоторых людей, страдающих фенилкетонурией, достижение нормального соотношения между уровнями фенилаланина и тирозина может быть важнейшим аспектом их лечения с применением диеты с низким содержанием фенилаланина и, в некоторых случаях, продуктов лечебного питания с добавкой тирозина.
Это имеет важное значение, в особенности для функции головного мозга, для обеспечения которой требуются и фенилаланин , и тирозин . Для некоторых людей, страдающих фенилкетонурией, достижение нормального соотношения между уровнями фенилаланина и тирозина может быть важнейшим аспектом их лечения с применением диеты с низким содержанием фенилаланина и, в некоторых случаях, продуктов лечебного питания с добавкой тирозина.- Специальная диета
- Пациенты с фенилкетонурией должны строго регулировать прием фенилаланина, им необходима специальная диета с низким содержанием фенилаланина (см. Продукты лечебного питания ).
См.: Продукты лечебного питания
- Сращивание
Прерывание последовательности пар оснований ДНК для ввода новой ДНК или удаления уже существующей. Процесс мутации сращивания IVS10 распространен среди населения с фенилкетонурией, при этом активность фенилаланингидроксилазы существенно уменьшается.

Перейти к началу
Т
- Тандемная масс-спектрометрия
Передовая техника для массового осмотра новорожденных, которая позволяет сделать анализ крови младенцев на фенилкетонурию, а также другие наследственные заболевания. Это наиболее продвинутая методология скрининга из всех доступных сегодня, которая во многих странах почти заменила старые методы ( проба Гатри , флуорометрическое обследование ).
- Терминирующий кодон (стоп-кодон)
Последовательность трех нуклеотидов (оснований) в ДНК/РНК, которая дает команду, чтобы остановить транскрипцию ДНК в РНК или выработку белка.
- Тетрагидробиоптерин
Вещество, возникающее естественным образом, необходимое для активности фенилаланингидроксилазы ( фермента , недостаток которого наблюдается при фенилкетонурии). В Японии доступна фармакологическая технология изготовления тетрагидробиоптерина.

- Тир
- Сокращенное название тирозина, аминокислоты , которая главным образом вырабатывается с помощью преобразования фенилаланина ферментом фенилаланингидроксилазой.
См.: Фенилкетонурия
- Триплет (кодон)
Последовательность из трех нуклеотидов в ДНК/РНК, которая кодирует отдельную аминокислоту или определяет окончание синтеза цепи ( стоп-кодон ).
Перейти к началу
У
- Умственная отсталость
- Недостаточное развитие интеллектуальных способностей. Если не проводить лечение фенилкетонурии в раннем детстве, то это может привести к серьезной умственной отсталости.
См.: Cretinism
- Уровень фенилаланина
Измеряемый уровень фенилаланина в крови.
 Показатель уровня фенилаланина в крови используется для диагностики фенилкетонурии и в случае подтверждения — для назначения диеты с низким содержанием фенилаланина или другого лечения фенилкетонурии. Рекомендуемый уровень фенилаланина в крови может изменяться в зависимости от возраста.
Показатель уровня фенилаланина в крови используется для диагностики фенилкетонурии и в случае подтверждения — для назначения диеты с низким содержанием фенилаланина или другого лечения фенилкетонурии. Рекомендуемый уровень фенилаланина в крови может изменяться в зависимости от возраста.
Перейти к началу
Ф
- Фенилаланингидроксилаза
- Это фермент ( ген EC 1.14.16.1, локус 12q24.1), который преобразует фенилаланин (полученный из продуктов питания) в другую аминокислоту , тирозин . У людей с фенилкетонурией в генах фенилаланингидроксилазы имеется мутация , которая сокращает или совсем блокирует ее активность. Мутации в обеих копиях гена фенилаланингидроксилазы являются причиной клинической фенилкетонурии.
Синонимы: PAH
- Фенилкетонурия
- Наследственное аутосомно-рецессивное заболевание, вызванное мутацией гена фермента фенилаланингидроксилазы , который в обычном состоянии преобразовывает фенилаланин в тирозин .
 Возникающая вследствие этого концентрация фенилаланина в крови является токсичной для центральной нервной системы , если уровень фенилаланина не регулируется при помощи специальной диеты или другого метода лечения (см. Сапроптерин , Аминокислоты ).
Возникающая вследствие этого концентрация фенилаланина в крови является токсичной для центральной нервной системы , если уровень фенилаланина не регулируется при помощи специальной диеты или другого метода лечения (см. Сапроптерин , Аминокислоты ).См.: Аминокислота Сапроптерин
- Фенотип
Данный термин служит для характеристики внешности человека в медицинском смысле. Например, тех людей, у которых реакция на лечение сапроптерином выражается в значительном снижении уровня фенилаланина в крови, можно охарактеризовать как «фенотип с восприимчивостью к тетрагидробиоптерину при фенилкетонурии».
- Ферменты
- Ферменты — это белки, которые действуют в качестве катализатора жизненно важных биохимических реакций. Фенилаланингидроксилаза — это фермент, который отвечает за преобразование фенилаланина в тирозин , недостаток которого возникает при фенилкетонурии.

- Флуориметрический анализ
Этот метод применяется в некоторых странах для скрининга новорожденных на фенилкетонурию и другие наследственные нарушения обмена веществ. Подобно другим методам, с его помощью измеряется уровень фенилаланина в крови. Во многих странах данный метод был заменен тандемной масс-спектрометрией.
Перейти к началу
Ц
- ЦНС
- центральная нервная система: головной и спинной мозг.
Перейти к началу
Ш
- Шаперон («наставник»)
Шаперон (молекулярный шаперон) служит для сохранения структуры и функции другой молекулы, как правило, протеина. Например, тетрагидробиоптерин является коферментом для фенилаланингидроксилазы . Подгруппа пациентов (обычно, но не исключительно, с легкой формой фенилкетонурии) реагирует на лечение тетрагидробиоптерином , что выражается в повышении активности фенилаланингидроксилазы и снижении уровня фенилаланина в крови. Считается, что мутация фенилаланингидроксилазы изменяет ее активность путем изменения ее 3-мерной структуры. Тетрагидробиоптерин , как считают исследователи, помогает сохранить структуру мутантного белка фенилаланингидроксилазы таким образом, что активность фермента сохраняется. Это может также предотвратить разрушение белка фенилаланингидроксилазы или его инактивацию другими ферментами . Таким образом, тетрагидробиоптерин действует как «молекулярный шаперон».
Перейти к началу
Э
- Экзема
Экзема — это состояние кожи, которое характеризуется воспалением, сухостью, шелушением и зудом. Как правило, наблюдается образование везикул (пузырьков), после чего может возникнуть эритема (покраснение), эдема (припухлости), появление бугорков на коже (папул), а затем утолщение и огрубение кожи. Экзема является широко распространенной особенностью фенилкетонурии, если при этом не соблюдается диета с низким содержанием фенилаланина с первых дней жизни.
- Экзоны
Экзоны и интроны являются частями генов в их последовательности ДНК. Экзон — это участок гена, который будет представлен в образованном белке. Участки РНК, к которым относятся интроны , удаляются из гена для формирования зрелой РНК, которая переводится в белок.
- Эпилепсия
Эпилепсия — это состояние, при котором несогласованная электрическая активность в мозге приводит к потере сознания и судорогам. Эпилепсия является широко распространенной особенностью фенилкетонурии, если при этом не соблюдается диета с низким содержанием фенилаланина с первых дней жизни.
Перейти к началу
Аминокислоты — это… Что такое Аминокислоты?
| В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 10 апреля 2012. |
Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
История
Открытие аминокислот в составе белков
Физические свойства
Аминокислоты — бесцветные кристаллические вещества, хорошо растворимые в воде. Многие из них обладают сладким вкусом.
Общие химические свойства
Все аминокислоты амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
- NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
- NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, т.е. находятся в состоянии внутренних солей.
- NH2 —CH2COOH N+H3 —CH2COO—
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
- NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
- HOOC —CH2 —NH —H + HOOC —CH2 —NH2→ HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Получение
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
- CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3→ NH2 —CH2COOH + NH4Cl
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметричный атом углерода (треонин и изолейцин содержат два асимметричных атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-форму, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах.
Данную особенность «живых» аминокислот весьма трудно объяснить, так как в реакциях между оптически неактивными веществами L и D-формы образуются в одинаковых количествах. Возможно, выбор одной из форм (L или D) — просто результат случайного стечения обстоятельств: первые молекулы, с которых смог начаться матричный синтез, обладали определенной формой, и именно к ним «приспособились» соответствующие ферменты.
D-аминокислоты в живых организмах
Аспарагиновые остатки в метаболически неактивных структурных белках претерпевают медленную самопроизвольную неферментативную рацемизацию: так в белках дентина и эмали зубов L-аспартат переходит в D-форму со скоростью ~0,1 % в год[2], что может быть использовано для определения возраста млекопитающих. Рацемизация остатков аспарагиновой также отмечена при старении коллагена, предполагается, что такая рацемизация специфична для аспарагиновой кислоты и протекает за счет образования сукцинимидного кольца при внутремолекулярном ацилировании пептидного азота свободной карбоксильной группой аспарагиновой кислоты[3].
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов. Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих.
В состав некоторых пептидов входят D-аминокислоты, образующиеся при посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин, субтилин и эпидермин.
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путем нерибосомного синтеза в клетках грибов и бактерий. Видимо, в этом случае исходным материалом для синтеза служат также L-аминокислоты, которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
Протеиногенные аминокислоты
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O). Это так называемые 21-я и 22-я аминокислоты.
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся не решённым. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
Структурные формулы 20-ти протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
Для запоминания однобуквенного обозначения протеиногенных аминокислот используется мнемоническое правило (последний столбец).
Классификация
По радикалу
- Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан
- Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, аспарагин, глутамин, тирозин
- Полярные заряженные отрицательно при pH<7: аспартат, глутамат
- Полярные заряженные положительно при pH>7: лизин, аргинин, гистидин
По функциональным группам
- Алифатические
- Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
- Оксимоноаминокарбоновые: серин, треонин
- Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
- Амиды моноаминодикарбоновых: аспарагин, глутамин
- Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
- Серосодержащие: цистеин, метионин
- Ароматические: фенилаланин, тирозин, триптофан, (гистидин)
- Гетероциклические: триптофан, гистидин, пролин
- Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз
- Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
- Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
- Семейство глутамата: глутамат, глутамин, аргинин, пролин.
- Семейство пирувата: аланин, валин, лейцин.
- Семейство серина: серин, цистеин, глицин.
- Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
По способности организма синтезировать из предшественников
- Незаменимые
- Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан, аргинин, гистидин.
- Заменимые
- Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
По характеру катаболизма у животных
Биодеградация аминокислот может идти разными путями. По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы: глюкогенные (при распаде дают метаболиты, не повышающие уровень кетоновых тел, способные относительно легко становиться субстратом для глюконеогенеза: пируват, α-кетоглутарат, сукцинил-KoA, фумарат, оксалоацетат), кетогенные (распадаются до ацетил-KoA и ацетоацетил-KoA, повышающие уровень кетоновых тел в крови животных и человека и преобразующиеся в первую очередь в липиды), глюко-кетогенные (при распаде образуются метаболиты обоих типов).
- Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
- Кетогенные: лейцин, лизин.
- Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
«Миллеровские» аминокислоты
«Миллеровские» аминокислоты — обобщенное название аминокислот, получающихся в условиях, близких к эксперименту Стенли Л. Миллера 1953 года. Установлено образование в виде рацемата множества различных аминокислот, в том числе: глицин, аланин, валин, изолейцин, лейцин, пролин, серин, треонин, аспартат, глутамат
Родственные соединения
В медицине ряд веществ, способных выполнять некоторые биологические функции аминокислот, также (хотя и не совсем верно) называют аминокислотами:
Применение
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта.
Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глутаминовой кислоты[4].
Примечания
См. также
Ссылки
Miller S. L. Production of amino acids under possible primitive earth conditions. Science, v. 117, May 15, 1953
Miller S. L. and H. C. Urey. Organic compound synthesis on the primitive earth. Science, v. 130, July 31, 1959
Miller Stanley L. and Leslie E. Orgel. The origins of life on the earth. Englewood Cliffs, NJ, Prentice-Hall, 1974.
- Общая биология. Учебник для 9 — 10 классов средней школы. Под ред. Ю. И. Полянского. Изд. 17-е, перераб. — М.: Просвещение, 1987. — 288с. [1]
| B05A |
| ||
|---|---|---|---|
| B05B |
| ||
| B05C |
| ||
| B05D |
| ||
| B05X |
| ||
| B05Z |
Гомоцистеин, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер.
Гомоцистеин: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.Показания для назначения исследования
Гомоцистеин — это аминокислота, промежуточный продукт метаболизма (обмена) других аминокислот – метионина и цистеина. Гомоцистеин не поступает с пищей, а образуется только в организме. В норме эта аминокислота «живет» в организме очень короткое время, после чего превращается в другие соединения. Для осуществления таких превращений необходимы витамины В6, В12 и фолиевая кислота. При нарушениях метаболизма гомоцистеина из-за дефекта ферментных систем или из-за недостатка необходимых витаминов он в больших количествах накапливается внутри клеток, а затем поступает в кровь.
Избыток гомоцистеина может приводить к образованию тромбов, повреждению стенки сосудов, делая ее более рыхлой, к отложению в ней холестерина и кальция с образованием атеросклеротических бляшек. Суженные атеросклеротическими бляшками сосуды и склонность к образованию тромбов значительно повышают вероятность полного закрытия просвета сосудов, в частности сосудов сердца и мозга с развитием инфаркта миокарда и ишемического инсульта, соответственно. Вероятность повреждения сосудистой стенки значительно возрастает при сахарном диабете.
Таким образом, одним из показаний для назначения анализа на гомоцистеин является определение риска сердечно-сосудистых заболеваний, в том числе у пациентов с сахарным диабетом.
Отмечено, что риск болезни Альцгеймера и старческого слабоумия (деменции) возрастает при повышении уровня гомоцистеина, поэтому при подозрении на эти заболевания определение уровня гомоцистеина может оказаться полезным.
При физиологически протекающей беременности уровень гомоцистеина крови снижается практически в два раза, причем в первом триместре более чем на 30%, достигая наименьшего значения в конце второго триместра. Такое снижение может быть связано с увеличением объема циркулирующей крови, гормональными изменениями. В случае повышения уровня гомоцистеина вероятно развитие осложнений беременности – выкидышей, эклампсии (судорог с потерей сознания, резким подъемом артериального давления и даже летальным исходом), тромбоза вен и т.д. В связи с этим определение уровня гомоцистеина назначают беременным, у которых наблюдается повышение артериального давления, отеки, белок в моче — протеинурия.
Повышение гомоцистеина встречается при некоторых генетических заболеваниях, например, при гомоцистинурии.
Подготовка к процедуре
Как и любое плановое исследование, сдачу анализа крови на гомоцистеин надо проводить вне острых вирусных и бактериальных заболеваний, через две недели после выздоровления.
Прием некоторых лекарственных препаратов может повлиять на результаты анализа; необходимо обсудить с лечащим врачом перечень используемых лекарств и, возможно, отменить некоторые из них, если это не повлияет на качество жизни.Взятие крови необходимо проводить утром натощак, после 8-14 часов ночного голодания. Воду пить разрешается. Допустимо сдавать анализ днем, через 4-6 часов после необильного приема пищи.
Срок исполнения
Анализ выполняется в течение одного рабочего дня.
Что может повлиять на результаты
Результат анализа на гомоцистеин может оказаться некорректным, если пациент принимает противоопухолевые гормональные препараты, цитостатики, противоэпилептические средства, а также лекарства, действие которых направлено на снижение уровня холестерина, глюкозы и некоторые другие.
Почечная недостаточность, нарушение функции щитовидной железы, злоупотребление алкоголем, курение, употребление большого количества кофе также способны повышать уровень гомоцистеина, что должно быть учтено врачом при интерпретации результатов анализа.
Нормальные показатели
| Возраст | Пол | Уровень гомоцистеина, мкмоль/л |
| 5 дней — 1 год | оба | 2,87 – 9,99 |
| 1 год – 7лет | оба | 2,76 – 7,62 |
| 7 – 12 лет | оба | 3,43 – 8,45 |
| 12 – 15 лет | женский | 4,07 – 10,36 |
| мужской | 4,71 – 10,40 | |
| 15 – 19 лет | женский | 4,92 – 11,88 |
| мужской | 5,5– 13,39 | |
| >19 лет | женский | 4,44 – 13,56 |
| мужской | 5,46 – 16,20 | |
Расшифровка показателей
Значения различаются в зависимости от возраста и пола пациента. С возрастом содержание гомоцистеина повышается. Уровень гомоцистеина у мужчин выше, чем у женщин.
Что значат пониженные показатели
Снижение гомоцистеина может выявляться на начальных стадиях сахарного диабета, при повышенной функции щитовидной железы – гипертиреозе, при беременности (в 1-ом и 2-ом триместрах), а также при генетическом заболевании — синдроме Дауна.
Со снижением уровня гомоцистеина может быть ассоциирован прием некоторых лекарств — например, препаратов эстрогена, отхаркивающих средств и некоторых других.
Что значат повышенные показатели
Повышение гомоцистеина встречается при дефиците фолиевой кислоты, витаминов В6 и В12, при почечной недостаточности, эндокринных нарушениях – сахарном диабете и гипотиреозе (снижении функции щитовидной железы)
Повышение гомоцистеина может сопутствовать различным тяжелым осложнениям беременности.
Снижение когнитивных (познавательных) функций в пожилом возрасте (старческое слабоумие, болезнь Альцгеймера) может быть ассоциировано с повышением гомоцистеина.
Уровень гомоцистеина имеет тенденцию к повышению в результате приема цитостатиков, сахароснижающих средств, препаратов мужских половых гормонов андрогенов и др.
Дополнительное обследование при отклонении показателя от нормы
Анализ на гомоцистеин назначают обычно терапевты или врачи общей практики, неврологи, акушеры-гинекологи и эндокринологи.
При оценке сердечно-сосудистых рисков, кроме определения гомоцистеина изучают липидный спектр, высокочувствительный С-реактивный белок, глюкозу, гликированный гемоглобин, С-пептид, инсулин и др.
Нередко вместе с гомоцистеином определяют уровень витаминов В6, В12, фолиевой кислоты.
Источники:
- Кишкун А.А. Клиническая лабораторная диагностика: учебное пособие. 2-е издание, переработанное и дополненное. – М.: ГЭОТАР-Медиа. 2019. 1000 с.
- Зобова Д.А., Козлов С.А. Роль гомоцистеина в патогенезе некоторых заболеваний. Известия высших учебных заведений. Поволжский регион. Журнал. № 3(39). 2016. С. 132-144.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Информация проверена экспертом
Лишова Екатерина Александровна
Высшее медицинское образование, опыт работы — 19 лет
Генетический алфавит пополнился двумя буквами | Научные открытия и технические новинки из Германии | DW
С тех пор, как ученые расшифровали структуру ДНК — носителя наследственной информации во всех живых организмах — прошло более 60 лет. Исследователи, в частности, выяснили, что с химической точки зрения ДНК является полимером, макромолекула которого состоит из повторяющихся звеньев — нуклеотидов, что каждый нуклеотид представляет собой комбинацию из азотистого основания, сахара-дезоксирибозы и фосфатной группы, и что в молекуле ДНК встречаются лишь четыре вида азотистых оснований — аденин, гуанин, тимин и цитозин.
Они обозначаются буквами А, Г, Т и Ц, которые принято именовать генетическим алфавитом, ведь именно последовательность азотистых оснований в молекуле ДНК и является тем кодом, что обеспечивает хранение, передачу из поколения в поколение и реализацию программы развития и функционирования всех живых организмов. В популярной литературе утвердился своего рода образ-штамп: алфавитом, состоящим из четырех букв А, Г, Т, и Ц, написана книга жизни.
Ученым четырех букв генетического алфавита недостаточно
Однако в последние годы исследователи, работающие в сфере так называемой синтетической биологии, почувствовали, что столь скудного алфавита им для реализации некоторых интересных идей уже не хватает. А потому взялись за создание искусственных, не существующих в природе нуклеотидных оснований. Теперь американским ученым удалось внедрить их в геном живой бактерии — кишечной палочки Escherichia coli. Результаты работы опубликованы в журнале Nature.
Тут важно иметь в виду, что молекула ДНК практически всегда состоит из двух цепочек (двойная спираль) и что азотистые основания одной цепочки соединены водородными связями с азотистыми основаниями другой цепочки, причем аденин образует пары только с тимином, а гуанин — только с цитозином. Теперь американские генетики обогатили геном энтеробактерии парой искусственных нуклеотидных оснований. Обозначения этих субстанций больше напоминают компьютерные пароли доступа повышенной надежности, чем пригодные в практике названия: одно вещество именуется d5SICSTP, другое dNaMTP. Но сами разработчики предпочитают называть их для простоты соответственно X и Y.
Природные нуклеотиды гидрофильны, искусственные — гидрофобны
Оба искусственных азотистых основания ученые синтезировали так, чтобы они по своим химическим свойствам существенно отличались от природных. Руководитель проекта Флойд Роумсберг (Floyd Romesberg), профессор химии в Исследовательском институте Скриппса в Ла-Холья, штат Калифорния, говорит: «Природные пары азотистых оснований характеризуются чрезвычайно высокой гидрофильностью, они образуют между собой водородные связи. Мы же хотели, чтобы наши искусственные основания с ними не смешивались — как жир и вода, — поэтому изначально конструировали их так, чтобы они были гидрофобными».
На поиск подходящих субстанций у профессора Роумсберга и его коллег ушло более десяти лет. С одной стороны, это должны были быть вещества, вообще не встречающиеся в природе. С другой стороны, имеющаяся в любой живой клетке ферментная система репарации, исправляющая повреждения ДНК, должна была не замечать данную аномалию, не воспринимать эти искусственные субстанции как чужеродные и подлежащие удалению. Все клеточные механизмы должны были работать как обычно, обрабатывать наследственную информацию так же, как если бы она была записана алфавитом из стандартных четырех букв, а не из шести. И в процессе деления клетки репликация этой необычной молекулы ДНК должна была, как положено, приводить к образованию двух дочерних копий, идентичных исходной родительской.
Многое пока неясно, но перспективы интересные
«Мы уже много лет занимаемся созданием неприродных нуклеотидов, — поясняет профессор Роумсберг. — Мы испробовали более 300 вариантов. Однако лишь теперь мы подобрали, наконец, такую пару нуклеотидных оснований, которую удалось интегрировать в живую бактерию. И добиться нормальной репликации этой необычной ДНК».
Пока, правда, неясно, выживет ли бактерия, если в ее геном внедрить не одну пару оснований X-Y, а множество таких пар. Неясно также, долго ли проживет такая полусинтетическая кишечная палочка и долго ли в ней будут сохраняться чужеродные буквы генетического алфавита. По крайней мере, в журнале Nature речь идет лишь о 24 репликациях в течение 15 часов. А самое главное, неясно, способны ли искусственные нуклеотиды участвовать в производстве белков.
Но профессор Роумсберг надеется, что генетический код из шести вместо четырех букв позволит придать бактерии целый ряд полезных биохимических свойств, которых она изначально не имела: «Если вы расширите генетический код за счет неприродных нуклеотидов, кодирующих дополнительные аминокислоты, то это даст возможность получать новые белки с необычными свойствами. Например, так можно производить лучшие лекарства — и быстрее».
Безопасность гарантированая самой природой
Никакой опасности для окружающей среды такие бактерии не представляют, подчеркивает ученый. Напротив, они гораздо легче поддаются контролю, чем генетически модифицированные микроорганизмы, полученные методами традиционной генной инженерии. «Мы должны снабжать наши бактерии неприродными компонентами ДНК, — поясняет профессор Роумсберг. — Бактерии не могут синтезировать эти нуклеотиды самостоятельно, нам приходится их кормить. С этой целью мы добавляем вещества Х и Y в питательную среду, а в геном кишечной палочки мы внедрили растительный ген, который придает водоросли — а теперь и нашей бактерии — способность поглощать нуклеотиды из окружающей среды. Если же прекратить подкормку бактерий искусственными нуклеотидами, все неприродное из ДНК кишечной палочки быстро исчезнет».
Значит, если даже такой полусинтетический микроорганизм ускользнет из лаборатории, выжить ему не суждено. Или же он откажется от неприродных компонентов в своем геноме и превратится в самую обычную бактерию, какой и был изначально.
Классификация аминокислот и для чего они нужны
Аминокислоты представляют собой структурные химические единицы, образующие белки, и на 16% состоят из азота. Важность аминокислот для организма определяется той огромной ролью, которую играют белки во всех процессах жизнедеятельности.
Каждый белок в организме уникален и существует для специальных целей. Белки не являются взаимозаменяемыми. Они синтезируются в организме из аминокислот, которые образуются в результате расщепления белков, находящихся в пищевых продуктах. Именно аминокислоты являются наиболее ценными элементами питания.
Некоторые аминокислоты выполняют роль нейромедиаторов (нейротрансмиттеров) или являются их предшественниками. Нейромедиаторы — это химические вещества, передающие нервный импульс с одной нервной клетки на другую, и, следовательно, некоторые аминокислоты необходимы для нормальной работы головного мозга. Аминокислоты способствуют тому, что витамины и минералы адекватно выполняют свои функции. Некоторые аминокислоты непосредственно снабжают энергией мышечную ткань.
Существует около 28 аминокислот. В организме человека многие из них синтезируются в печени. Однако некоторые из них не могут быть синтезированы в организме, поэтому человек обязательно должен получать их с пищей. Такие аминокислоты называются незаменимыми и к ним относятся гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Аминокислоты, которые синтезируются в печени, являются заменимыми и включают аланин, аргинин, аспарагин, аспартовую кислоту, цитруллин, цистеин, гамма-аминомасляную кислоту, глютамовую кислоту, глютамин, глицин, орнитин, пролин, серии, таурин, тирозин.Процесс синтеза белков постоянно идет в организме. В случае, когда хоть одна незаменимая аминокислота отсутствует, образование белков приостанавливается. Это может привести к самым различным серьезным проблемам — от нарушения пищеварения до депрессии и замедления роста.
К дефициту аминокислот могут привести нарушение процессов всасывания из желудочно-кишечного тракта, инфекционные заболевания, травмы, стресс, прием некоторых лекарственных препаратов, процесс старения и дисбаланс других питательных веществ в организме (даже если вы потребляете достаточное количество белка).
Следует учесть, что потребление большого количества белков не поможет решить любые проблемы, более того это не способствует сохранению здоровья. Избыток потребления белков создает дополнительную нагрузку для почек и печени, которым надо перерабатывать продукты метаболизма белков, основным из них является аммиак. Аммиак очень токсичен для организма, поэтому печень немедленно перерабатывает его в мочевину, которая затем поступает с током крови в почки, где отфильтровывается и выводится наружу. До тех пор, пока количество белка не слишком велико, а печень работает хорошо, аммиак нейтрализуется сразу же и не причиняет никакого вреда. Но, если его слишком много и печень не справляется с его обезвреживанием (в результате неправильного питания, нарушения пищеварения и/или заболеваний печени) — в крови создается токсический уровень аммиака. При этом может возникнуть масса серьезных проблем со здоровьем, вплоть до печеночной энцефалопатии и комы. Слишком высокая концентрация мочевины также вызывает повреждение почек и боли в спине. Следовательно, важным является не количество, а качество потребляемых с пищей белков.В настоящее время можно получать незаменимые и заменимые аминокислоты в виде биологически активных пищевых добавок. Это особенно важно при различных заболеваниях и при применении редукционных диет. Вегетарианцам необходимы такие добавки, содержащие незаменимые аминокислоты, чтобы организм получал все необходимое для нормального синтеза белков.
Имеются разные виды биологически активных пищевых добавок, содержащих аминокислоты. Аминокислоты входят в состав некоторых поливитаминов, белковых смесей и в состав других продуктов, которые содержат комплексы аминокислот или содержащие одну или две аминокислоты, и эти продукты представлены в различных формах (в капсулах, таблетках, жидкостях и порошках). Большинство этих аминокислот получены из белков животного или растительного происхождения, а также из дрожжевых протеинов.
При выборе добавки, содержащей аминокислоты, предпочтение следует отдавать продуктам, содержащим L-кристаллические аминокислоты, стандартизированные по Американской Фармакопее (USP). Большинство аминокислот существует в виде двух форм, химическая структура одной является зеркальным отображением другой. Они называются D- и L-формами, например D-цистин и L-цистин. D означает dextra (правая на латыни), a L — levo (соответственно, левая). Эти термины обозначают направление вращения спирали, являющейся химической структурой данной молекулы. Белки животных и растительных организмов созданы в основном L-формами аминокислот (за исключением фенилаланина, который представлен D,L- формами). Таким образом, пищевые добавки, содержащие L-аминокислоты, могут считаться более подходящими.Отдельные аминокислоты принимают натощак, лучше всего утром или между приемами пищи с небольшим количеством витаминов В6 и С. Если вы принимаете комплекс аминокислот, включающий все незаменимые, это лучше делать через 30 мин после или за 30 мин до еды. Отдельные аминокислоты и комплекс аминокислот не следует принимать одновременно. Более того, аминокислоты не следует принимать в течение длительного времени, особенно в высоких дозах.
кодов, используемых в описании последовательности
Нуклеотид
Коды нуклеотидных оснований
Коды нуклеотидных оснований, которые используются в Международном стандарте
База данных нуклеотидных последовательностей выглядит следующим образом.
Данные последовательности выражаются только строчными буквами. Заглавная буква будет
будет автоматически преобразован в строчную букву.
| Символ | Значение | Пояснение |
|---|---|---|
| а | а | аденин |
| в | c | цитозин |
| г | г | гуанин |
| т | т | тимин в ДНК; урацил в РНК |
| м | а или с | амино |
| р | а или г | пурин |
| Вт | a или t | |
| с | с или г | |
| y | c или t | пиримидин |
| к | г или т | кето |
| в | a или c или g | нет |
| ч | a или c или t | не г |
| г | а или г или т | не c |
| б | c или g или t | а не |
| n | a или c или g или t | любой |
[Ссылки]
Модифицированные базовые сокращения
Пример описания измененной базы в строке FEATURES.
Пример
ОСОБЕННОСТИ Местоположение / Квалификаторы
Modified_base 15
/ mod_base = "m2g"
| Сокращение | Модифицированное базовое описание |
|---|---|
| ac4c | 4-ацетилцитидин |
| chm5u | 5- (карбоксигидроксилметил) уридин |
| см | 2’-O-метилцитидин |
| смнм5с2у | 5-карбоксиметиламинометил-2-тиоуридин |
| cmnm5u | 5-карбоксиметиламинометилуридин |
| dhu | дигидроуридин |
| FM | 2’-O-метилпсевдоуридин |
| галл. Q | бета, D-галактозилкеуозин |
| г | 2’-O-метилгуанозин |
| i | инозин |
| i6a | N6-изопентениладенозин |
| m1a | 1-метиладенозин |
| м1ф | 1-метилпсевдоуридин |
| m1g | 1-метилгуанозин |
| m1i | 1-метилинозин |
| m22g | 2,2-диметилгуанозин |
| м2a | 2-метиладенозин |
| кв.м | 2-метилгуанозин |
| м3 | 3-метилцитидин |
| m4c | N4-метилцитозин |
| m5c | 5-метилцитидин |
| m6a | N6-метиладенозин |
| m7g | 7-метилгуанозин |
| mam5u | 5-метиламинометилуридин |
| mam5s2u | 5-метоксиаминометил-2-тиоуридин |
| человек q | бета, D-маннозилкеуозин |
| мкм5s2u | 5-метоксикарбонилметил-2-тиоуридин |
| мкм5u | 5-метоксикарбонилметилуридин |
| mo5u | 5-метоксиуридин |
| ms2i6a | 2-метилтио-N6-изопентениладенозин |
| ms2t6a | N — ((9-бета-D-рибофуранозил-2-метилтиопурин-6-ил) карбамоил) треонин |
| mt6a | N — ((9-бета-D-рибофуранозилпурин-6-ил) N-метилкарбамоил) треонин |
| мв | метиловый эфир уридин-5-оксиуксусной кислоты |
| o5u | уридин-5-оксиуксусная кислота (v) |
| osyw | выбутоксозин |
| п | псевдоуридин |
| q | queuosine |
| s2c | 2-тиоцитидин |
| s2t | 5-метил-2-тиуридин |
| s2u | 2-тиуридин |
| s4u | 4-тиуридин |
| m5u | 5-метилуридин |
| t6a | N — ((9-бета-D-рибофуранозилпурин-6-ил) карбамоил) треонин |
| тм | 2’-O-метил-5-метилуридин |
| мкм | 2’-O-метилуридин |
| yw | wybutosine |
| x | 3- (3-амино-3-карбоксипропил) уридин, (acp3) u |
| ДРУГОЕ | Другое (/ примечание квалификатор に 修飾 塩 基 を 記載 し ま す) |
[Ссылки]
Аминокислота
Коды аминокислот
Код аминокислоты, который используется с Международным нуклеотидом.
База данных последовательностей выглядит следующим образом.
Эти аминокислоты описаны в аббревиатуре из одной буквы.
/ квалификатор перевода CDS
характерная черта.
Перечисленные сокращения аминокислот являются допустимыми значениями квалификаторов.
/ transl_except и
/ anticodon.
Те, которые не включены в «Аминокислотные коды», см.
Модифицированные и необычные аминокислоты.
| Сокращение | Аббревиатура из 1 буквы | Название аминокислоты |
|---|---|---|
| Аля | А | Аланин |
| Арг | R | Аргинин |
| Асн | N | Аспарагин |
| Асп | D | Аспарагиновая кислота |
| Cys | С | Цистеин |
| Gln | Q | Глютамин |
| клей | E | Глутаминовая кислота |
| Гли | G | Глицин |
| Его | H | Гистидин |
| Иль | I | Изолейцин |
| лей | л | лейцин |
| Lys | К | Лизин |
| Мет | M | метионин |
| Phe | F | Фенилаланин |
| Pro | -П, | Proline |
| Пил | O | пирролизин |
| Ser | S | Серин |
| сек | U | Селеноцистеин |
| Thr | т | Треонин |
| Трп | Вт | Триптофан |
| Тир | Y | Тирозин |
| Вал | В | Валин |
| Asx | B | Аспарагиновая кислота или аспарагин |
| Glx | Z | Глутаминовая кислота или глутамин |
| Хаа | X | Любая аминокислота |
| Xle | Дж | Лейцин или изолейцин |
| СРОК | кодон терминации |
[Ссылки]
Модифицированные и необычные аминокислоты
Для других аминокислот, не входящих в состав аминокислот. Используются коды, аббревиатуры, указанные ниже.Все эти амино кислоты обозначаются одной буквенной аббревиатурой «X» в / квалификатор перевода CDS характерная черта.
| Сокращение | Название аминокислоты |
|---|---|
| Aad | 2-аминоадипиновая кислота |
| бат | 3-аминоадипиновая кислота |
| балла | бета-аланин, бета-аминопропионовая кислота |
| Абу | 2-аминомасляная кислота |
| 4Abu | 4-аминомасляная кислота, пиперидиновая кислота |
| Acp | 6-Аминокапроновая кислота |
| Ахе | 2-аминогептановая кислота |
| Aib | 2-аминоизомасляная кислота |
| бАиб | 3-аминоизомасляная кислота |
| апм | 2-аминопимелиновая кислота |
| Дбу | 2,4-диаминомасляная кислота |
| Des | Десмозин |
| Dpm | 2,2’-Диаминопимелиновая кислота |
| Дпр | 2,3-диаминопропионовая кислота |
| EtGly | N-этилглицин |
| EtAsn | N-этиласпарагин |
| Hyl | Гидроксилизин |
| Ахил | алло-гидроксилизин |
| 3Hyp | 3-гидроксипролин |
| 4Hyp | 4-гидроксипролин |
| Ide | Изодесмозин |
| ПРОДОЛЖИТЕЛЬНОСТЬ | алло-изолейцин |
| MeGly | N-метилглицин, саркозин |
| Мел | N-метилизолейцин |
| MeLys | 6-N-метиллизин |
| MeVal | N-метилвалин |
| НВА | Норвалин |
| Nle | Норлейцин |
| Орн | Орнитин |
| ДРУГОЕ | Другое ((Аминокислота, не найденная в этом списке, должна быть описана в квалификаторе / примечание) |
[Ссылки]
Связанные страницы
Dr.Маргарет Окли Дейхофф
Доктор Маргарет Окли ДейхоффБиологический проект> Биохимия> Химия аминокислот
Доктор Маргарет Окли Дейхофф Заметка о докторе Дейхоффе
Биофизический
Общество
Происхождение однобуквенного код для аминокислот
Происхождение однобуквенного кода для аминокислот происходит от исторический интерес, и, по сути, эта история может помочь студенту изучить код.Причина появления кода достаточно проста — в самом начале В дни биоинформатики самые быстрые компьютеры были довольно неуклюжими. Доктор Маргарет Окли Дейхофф, возможно, основательница области биоинформатики, сократил код с трехбуквенного обозначения до однобуквенного кода в попытке уменьшить размер файлов данных, необходимых для описания последовательности аминокислот в протеине. Список аминокислот, три буквы и однобуквенный код, и объяснение выбора однобуквенного кода приводится ниже.Обратите внимание, что в белках обычно содержится 20 аминокислот, и 26 букв в алфавите. В результате используется большая часть букв.
Чтобы разработать однобуквенный код для аминокислот, доктор Дейхофф попытался чтобы код было как можно проще запомнить. Конечно, если имя Каждая аминокислота начинается с другой буквы, код действительно будет простым. Для 6 аминокислот первая буква названия уникальна, поэтому код простой.Это:
| Аминокислота | Трехбуквенный код | Однобуквенный код | Пояснение |
Цистеин | Cys Его Иль Встретил Ser Val | C H Я M S V | Первая буква имени Первая буква имени Первая буква имени Первая буква имени Первая буква имени Первая буква имени |
Для других аминокислот первая буква имени не уникальна для одна аминокислота, поэтому Dr.Dayhoff присвоил буквы A, G, L, P и T. аминокислоты аланин, глицин, лейцин, пролин и треонин соответственно, которые встречаются в белках чаще, чем другие аминокислоты, имеющие те же первые буквы.
| Аминокислота | Трехбуквенный код | Однобуквенный код | Пояснение |
| Аланин Глицин Лейцин Пролин Треонин | Ала Gly Leu Pro Thr | A G L П Т | Первая буква имени Первая буква имени Первая буква имени Первая буква имени Первая буква имени |
Некоторые другие аминокислоты фонетически наводят на размышления.
Что касается оставшихся 5 аминокислот, доктор Дейхофф пытался найти легко запоминающаяся связь между одной буквой и аминокислотой. Она назначила буквам аспарагиновую кислоту, аспарагин, глутаминовую кислоту и глутамин. D, N, E и Q соответственно, отмечая, что D и N ближе к началу алфавит, чем E и Q, и что Asp меньше Glu, а Asn меньше чем Gln.
К тому времени, как доктор Дейхофф добрался до лизина, осталось не так много букв, поэтому она использовала букву K, объяснив, что K по крайней мере рядом с L в алфавите.
| Аминокислота | Трехбуквенный код | Однобуквенный код | Пояснение |
| Лизин | Lys | K |
|
Заметка о Dr.Маргарет Окли Дейхофф (1925-1983)
Профессиональный некролог
Д-р Маргарет Окли Дейхофф была профессором Медицинского университета Джорджтауна. Центр и известный биохимик-исследователь Национального фонда биомедицинских исследований. где она была пионером в применении математики и вычислительных методов в области биохимии. Доктор Дайхофф посвятила свою карьеру применению развивающиеся вычислительные технологии для поддержки достижений в биологии и медицине, прежде всего создание баз данных белков и нуклеиновых кислот и инструментов для опросить базы данных.Ее докторская степень была получена в Колумбийском университете. на химическом факультете, где она разработала вычислительные методы для расчета энергии молекулярного резонанса нескольких органических соединений. Она защитила докторскую учится в Институте Рокфеллера (ныне Университет Рокфеллера) и в университете штата Мэриленд и присоединился к недавно созданному Национальному фонду биомедицинских исследований. в 1959 г.
Работа доктора Дейхофф с белками началась в 1961 году, когда она разработала инструменты для помощь химикам-белкам в определении аминокислотных последовательностей за счет автоматического перекрывающиеся последовательности пептидов.Она продолжала инициировать «Атлас последовательности и структуры белков », а также для разработки многих используемых инструментов сегодня в проектировании и использовании баз данных. В 1980 году доктор Дейхофф разработал онлайновая система баз данных, к которой можно получить доступ по телефонной линии, первая База данных последовательностей доступна для опроса удаленными компьютерами. Доктор Маргарет Окли Дейхофф, основательница области биоинформатики, умерла раньше поле было признано отдельной областью для исследования.Она была, действительно, первопроходец.
Доктор Дейхофф был чрезвычайно активен в Биофизическом обществе и служил общество как его секретарь и президент. Одним из ее интересов было в расширении возможностей женщин для успешного карьерного роста в науке. Она хорошо знала о многих проблемах, с которыми сталкиваются женщины в науке, и работала трудно поощрять и наставлять женщин в научной карьере. Поэтому это соответствует тому, что награда Margaret Oakley Dayhoff была учреждена для поощрения молодых женщин к участию в конкурсе. карьера в научных исследованиях.Эта награда предназначена для женщин очень многообещающие, которые еще не достигли высокого признания в структура академического сообщества. Он вводится через Биофизический Общество и кандидаты оцениваются по достижениям и перспективам в областях внутри цель Биофизического общества.
Закрыть окно
Биологический проект> Биохимия> Химия аминокислот
Биологический проект
Департамент биохимии и молекулярной биохимии Биофизика
Университет Аризоны
25 августа 2003 г.
Связаться с командой разработчиков
http: // www.biology.arizona.edu
Все права защищены © 2003. Все права защищены.
Незаменимые аминокислоты: таблица, сокращения и структура
Аминокислота AlaАланин, обнаруженный в белке в 1875 году, составляет 30% остатков в шелке. Его низкая реакционная способность способствует простой, удлиненной структуре шелка с небольшим количеством поперечных связей, что придает волокнам прочность, сопротивление растяжению и гибкость.В биосинтезе белков участвует только l-стереоизомер.
Аминокислота ArgУ человека аргинин вырабатывается при переваривании белков. Затем он может быть преобразован организмом в оксид азота, химическое вещество, которое, как известно, расслабляет кровеносные сосуды.
Благодаря своему сосудорасширяющему действию аргинин был предложен для лечения людей с хронической сердечной недостаточностью, высоким уровнем холестерина, нарушением кровообращения и высоким кровяным давлением, хотя исследования по этим направлениям все еще продолжаются.Аргинин также может быть получен синтетическим путем, и родственные аргинину соединения можно использовать для лечения людей с дисфункцией печени из-за их роли в стимулировании регенерации печени. Хотя аргинин необходим для роста, но не для поддержания организма, исследования показали, что аргинин имеет решающее значение для процесса заживления ран, особенно у людей с плохим кровообращением.
Аминокислота AsnВ 1806 году аспарагин был очищен из сока спаржи, что сделало его первой аминокислотой, выделенной из природного источника.Однако только в 1932 году ученые смогли доказать, что аспарагин присутствует в белках. Только l-стереоизомер участвует в биосинтезе белков млекопитающих. Аспарагин важен для удаления токсичного аммиака из организма.
Аминокислота AspОткрытая в 1868 году в белках аспарагиновая кислота обычно содержится в животных белках, однако только l-стереоизомер участвует в биосинтезе белков. Растворимость этой аминокислоты в воде обусловлена наличием рядом с активными центрами ферментов, таких как пепсин.
Аминокислота CysЦистеин особенно богат белками волос, копыт и кератином кожи, который был выделен из мочевого камня в 1810 году и из рога в 1899 году. Впоследствии он был химически синтезирован. и структура решена в 1903–1904 гг.
Серосодержащая тиоловая группа в боковой цепи цистеина является ключевой для его свойств, обеспечивая образование дисульфидных мостиков между двумя пептидными цепями (как в случае с инсулином) или образование петли в одной цепи, влияя на окончательную структуру белка.Две молекулы цистеина, связанные между собой дисульфидной связью, составляют аминокислоту цистин, которая иногда указывается отдельно в общих списках аминокислот. Цистеин вырабатывается в организме из серина и метионина и присутствует только в l-стереоизомере в белках млекопитающих.
Люди с генетическим заболеванием цистинурия не могут эффективно реабсорбировать цистин в кровоток. Следовательно, в их моче накапливается высокий уровень цистина, где он кристаллизуется и образует камни, которые блокируют почки и мочевой пузырь.
Аминокислота GlnГлутамин был впервые выделен из свекольного сока в 1883 году, выделен из белка в 1932 году и впоследствии химически синтезирован в следующем году. Глютамин — самая распространенная в нашем организме аминокислота, которая выполняет несколько важных функций. У людей глутамин синтезируется из глутаминовой кислоты, и этот этап преобразования жизненно важен для регулирования уровня токсичного аммиака в организме, образуя мочевину и пурины.
Аминокислота GluГлутаминовая кислота была выделена из глютена пшеницы в 1866 году и химически синтезирована в 1890 году.Обычно встречается в белках животных, только l-стереоизомер встречается в белках млекопитающих, которые люди могут синтезировать из обычного промежуточного продукта α-кетоглутаровой кислоты. Мононатриевая соль l-глутаминовой кислоты, глутамат натрия (MSG) обычно используется в качестве приправы и усилителя вкуса. Карбоксильная боковая цепь глутаминовой кислоты может действовать как донор и акцептор аммиака, который токсичен для организма, обеспечивая безопасную транспортировку аммиака в печень, где он превращается в мочевину и выводится почками.Свободная глутаминовая кислота также может разлагаться до диоксида углерода и воды или превращаться в сахара.
Аминокислота Gly
Глицин был первой аминокислотой, выделенной из белка, в данном случае желатина, и единственной неактивной оптически (без d- или l-стереоизомеров ). Структурно простейшая из α-аминокислот, она очень инертна при включении в белки. Тем не менее, глицин играет важную роль в биосинтезе аминокислоты серина, кофермента глутатиона, пуринов и гема, жизненно важной части гемоглобина.
Аминокислота His
Гистидин был выделен в 1896 году, и его структура была подтверждена химическим синтезом в 1911 году. Гистидин является прямым предшественником гистамина, а также важным источником углерода в синтезе пуринов. При включении в белки боковая цепь гистидина может действовать как акцептор и донор протонов, передавая важные свойства при объединении с ферментами, такими как химотрипсин, и ферментами, участвующими в метаболизме углеводов, белков и нуклеиновых кислот.
Для младенцев гистидин считается незаменимой аминокислотой, взрослые могут в течение короткого периода времени обходиться без диетического питания, но по-прежнему считается незаменимой.
Аминокислота Ile
Изолейцин был выделен из сахарной патоки свеклы в 1904 году. Гидрофобная природа боковой цепи изолейцина важна для определения третичной структуры белков, в которые она входит.
У людей, страдающих редким наследственным заболеванием, называемым болезнью мочи кленового сиропа, есть дефектный фермент в пути разложения, который является общим для изолейцина, лейцина и валина.Без лечения метаболиты накапливаются в моче пациента, вызывая характерный запах, который и дал название состоянию.
Аминокислота лей
Лейцин был выделен из сыра в 1819 году и из мышц и шерсти в кристаллическом состоянии в 1820 году. В 1891 году он был синтезирован в лаборатории.
Только l-стереоизомер присутствует в белке млекопитающих и может расщепляться на более простые соединения ферментами организма.Некоторые связывающие ДНК белки содержат области, в которых лейцины расположены в конфигурации, называемые лейциновыми застежками-молниями.
Аминокислота Lys
Лизин был впервые выделен из казеина молочного белка в 1889 году, а его структура была выяснена в 1902 году. Лизин важен для связывания ферментов с коферментами и играет важную роль в способ функционирования гистонов.
Многие зерновые культуры содержат очень мало лизина, что привело к его дефициту у некоторых групп населения, которые сильно зависят от них в продуктах питания, а также у вегетарианцев и людей, сидящих на низкожирной диете.Следовательно, были предприняты усилия по разработке штаммов кукурузы, богатых лизином.
Аминокислота Met
Метионин был выделен из казеина молочного белка в 1922 году, и его структура была решена лабораторным синтезом в 1928 году. Метионин является важным источником серы для многих соединений в организме, включая цистеин и таурин. Благодаря содержанию серы метионин помогает предотвратить накопление жира в печени и помогает выводить токсины и шлаки метаболизма.
Метионин — единственная незаменимая аминокислота, которая не присутствует в значительных количествах соевых бобов и поэтому производится коммерчески и добавляется во многие продукты из соевого шрота.
Аминокислота Phe
Фенилаланин был впервые выделен из природного источника (ростки люпина) в 1879 году и впоследствии химически синтезирован в 1882 году. Человеческий организм обычно способен расщеплять фенилаланин на тирозин, однако У людей с наследственной фенилкетонурией (ФКУ) фермент, который выполняет это преобразование, неактивен.Если не лечить, фенилаланин накапливается в крови, вызывая задержку умственного развития у детей. Примерно 10 000 детей рождаются с этим заболеванием, поэтому диета с низким содержанием фенилаланина в раннем возрасте может облегчить его последствия.
Аминокислота Pro
В 1900 году пролин был синтезирован химическим путем. На следующий год он был выделен из казеина из молочного белка, и его структура оказалась такой же. Люди могут синтезировать пролин из глутаминовой кислоты, которая присутствует только как l-стереоизомер в белках млекопитающих.Когда пролин включается в белки, его особая структура приводит к резким изгибам или перегибам в пептидной цепи, что в значительной степени способствует окончательной структуре белка. Пролин и его производное гидроксипролин составляют 21% аминокислотных остатков волокнистого белка коллагена, необходимого для соединительной ткани.
Аминокислота Ser
Серин был впервые выделен из белка шелка в 1865 году, но его структура не была установлена до 1902 года.Люди могут синтезировать серин из других метаболитов, включая глицин, хотя только l-стереоизомер присутствует в белках млекопитающих. Серин важен для биосинтеза многих метаболитов и часто важен для каталитической функции ферментов, в которые он включен, включая химотрипсин и трипсин.
Нервные газы и некоторые инсектициды действуют путем объединения с остатком серина в активном центре ацетилхолинэстеразы, полностью ингибируя фермент. Активность эстеразы необходима для расщепления нейромедиатора ацетилхолина, в противном случае накапливается опасно высокий уровень, что быстро приводит к судорогам и смерти.
Аминокислота Thr
Треонин был выделен из фибрина в 1935 году и синтезирован в том же году. Только l-стереоизомер появляется в белках млекопитающих, где он относительно инертен. Хотя он играет важную роль во многих реакциях у бактерий, его метаболическая роль у высших животных, включая человека, остается неясной.
Аминокислота Trp
Структура триптофана, выделенная из казеина (молочного белка) в 1901 году, была установлена в 1907 году, но только l-стереоизомер присутствует в белках млекопитающих.В кишечнике человека бактерии расщепляют пищевой триптофан, выделяя такие соединения, как скатол и индол, которые придают фекалиям неприятный аромат. Триптофан превращается в витамин B3 (также называемый никотиновой кислотой или ниацином), но не в достаточной степени, чтобы поддерживать наше здоровье. Следовательно, мы также должны принимать витамин B3, несоблюдение этого правила приводит к его дефициту, называемому пеллагрой.
Аминокислота Tyr
В 1846 году тирозин был выделен в результате разложения казеина (сырного белка), после чего он был синтезирован в лаборатории и его структура была определена в 1883 году.Присутствующий только в l-стереоизомере в белках млекопитающих, люди могут синтезировать тирозин из фенилаланина. Тирозин является важным предшественником гормонов надпочечников адреналина и норадреналина, гормонов щитовидной железы, включая тироксин, а также пигмента волос и кожи меланина. В ферментах остатки тирозина часто связаны с активными центрами, изменение которых может изменить специфичность фермента или полностью уничтожить активность.
Страдающие серьезным генетическим заболеванием фенилкетонурия (ФКУ) неспособны превращать фенилаланин в тирозин, в то время как у пациентов с алкаптонурией метаболизм тирозина нарушен, и моча становится отчетливой и темнеет при контакте с воздухом.
Val аминокислота
Структура валина была установлена в 1906 году после его первого выделения из альбумина в 1879 году. В белке млекопитающих присутствует только l-стереоизомер. Валин может разлагаться в организме на более простые соединения, но у людей с редким генетическим заболеванием, называемым болезнью мочи кленового сиропа, неисправный фермент прерывает этот процесс и может оказаться фатальным при отсутствии лечения.
A2. Стереохимия аминокислот — Биология LibreTexts
Все аминокислоты хиральные, за исключением глицина, боковая цепь которого представляет собой H.Как и в случае с липидами, биохимики используют номенклатуру L и D. Все встречающиеся в природе белки всех живых организмов состоят из L аминокислот. Абсолютная стереохимия связана с L-глицеральдегидом, как и в случае триацилглицеридов и фосфолипидов. Большинство встречающихся в природе хиральных аминокислот — это S, за исключением цистеина. Как показано на приведенной ниже диаграмме, абсолютная конфигурация аминокислот может быть показана с обозначением H, направленным назад, группами COOH, направленными влево, группой R, вправо и группой Nh4, направленными вверх.Вы можете запомнить это с помощью мнемоники CORN.
Рисунок: стереохимия аминокислот.
Почему Biochemistry до сих пор использует D и L для сахаров и аминокислот? Это объяснение (взято из приведенной ниже ссылки) кажется разумным.
«Кроме того, однако, химики часто нуждаются в однозначном определении конфигурации в отсутствие какого-либо эталонного соединения, и для этой цели идеально подходит альтернативная (R, S) система, поскольку она использует правила приоритета для определения конфигураций.Эти правила иногда приводят к абсурдным результатам, когда они применяются к биохимическим молекулам. Например, как мы видели, все общие аминокислоты являются L, потому что все они имеют точно такую же структуру, включая положение группы R, если мы просто запишем группу R как R. Однако не все они имеют та же конфигурация в системе (R, S): L-цистеин также является (R) -цистеином, но все остальные L-аминокислоты являются (S), но это просто отражает решение человека придать атому серы более высокий приоритет чем атом кислорода, и не отражает реальной разницы в конфигурации.Более серьезные проблемы могут иногда возникать в реакциях замещения: иногда инверсия конфигурации может не привести к изменению префикса (R) или (S); а иногда сохранение конфигурации может привести к изменению префикса.
Отсюда следует, что не только консерватизм или непонимание системы (R, S) заставляет биохимиков продолжать использовать D и L: просто система DL удовлетворяет их потребности намного лучше. Как уже упоминалось, химики также используют D и L, когда они соответствуют их потребностям.Приведенное выше объяснение того, почему система (R, S) мало используется в биохимии, является почти полной противоположностью реальности. Эта система на самом деле является единственным практическим способом однозначного представления стереохимии сложных молекул с несколькими асимметричными центрами, но она неудобна для регулярных серий молекул, таких как аминокислоты и простые сахара. «
Если бы я сказал вам нарисовать правильную стереохимию молекулы с 1 хиральным C (например, S-изомер) и дал вам заместители, вы могли бы легко сделать это, следуя правилам приоритета R, S.Однако как бы вы нарисовали правильный изомер для L-изомера аминокислоты аланина? Вы не смогли бы сделать это без предварительного знания абсолютной конфигурации родственной молекулы, L-глицеральдегида, или если вы не помните мнемоническую кукурузу. Этот недостаток, однако, более чем компенсируется тем фактом, что разные L-аминокислоты с одинаковой абсолютной стереохимией могут быть помечены как R или S, что делает эту номенклатуру непривлекательной для биохимиков.
Авторы и авторство
Таблица аминокислотс объяснением всех типов
Как лучше всего организм получает аминокислоты?
Аминокислоты в основном поступают с пищей.Большинство людей могут получать достаточное количество аминокислот, соблюдая сбалансированную диету. Однако другим — например, спортсменам, работникам физического труда, людям с заболеваниями и пожилым людям — может быть полезно иметь больше аминокислот, чем они могут получить с пищей.
Помимо диеты, вы можете добавить в организм больше аминокислот двумя способами.
Добавки пероральные
Поскольку так много аминокислотных процедур связано с улучшением спортивных результатов, существует множество вариантов.Добавки доступны в виде таблеток или порошков для добавления или приготовления напитков. Их можно приобрести в Интернете или в местных аптеках.
Организм усваивает пероральные аминокислотные добавки так же, как и из пищи — через пищеварительную систему. Это также означает, что некоторые добавки будут потеряны / не могут быть усвоены, поскольку они расщепляются организмом.
Внутривенные инфузии
Инфузиидля внутривенного вливания состоят из специальных ингредиентов, которые обычно выбираются для достижения определенных целей в отношении здоровья.Поскольку внутривенные инфузии направляют препараты непосредственно в кровоток, они на 100% усваиваются организмом и могут начать действовать быстрее.
IV инфузии также увлажняют организм, позволяя вымывать тяжелые металлы и другие токсины. Хотя внутривенные инфузии безопасны при правильном проведении, они должны назначаться и контролироваться медицинским работником.
Как мне может помочь внутривенное лечение?
Наши процедуры представляют собой современные смеси, разработанные для удовлетворения ваших потребностей. Вот несколько примеров:
- Energy Boost: Эта внутривенная процедура предназначена для восстановления и восстановления общего состояния здоровья и энергии.Витамины комплекса B поддерживают сердечно-сосудистую систему и помогают иммунной функции, витамин B12 повышает уровень энергии и концентрацию, а витамин C поддерживает ваши мышцы, кровеносную и иммунную системы.
- Желудочный грипп: Это лечение поможет вам быстрее избавиться от симптомов желудочного гриппа. В дополнение к ингредиентам, содержащимся в Energy Boost, Pepcid помогает облегчить изжогу и снизить уровень кислоты в желудке. Зофран также является частью этого лечения, чтобы облегчить симптомы тошноты и рвоты.
- Weight Loss: Наша процедура для похудания представляет собой смесь наших ингредиентов Energy Boost с Lipostat plus, смесью аминокислот, минералов и витаминов, которые помогают ускорить обмен веществ и вывести токсины из организма. Мы также добавляем L-карнитин, который помогает сжигать жир и поддерживать энергию.
- All-Inclusive: Наша комплексная внутривенная терапия предназначена для омоложения и восстановления. В дополнение к комплексным витаминам группы B, витамину B 12, витамину C и Lipostat Plus мы также добавляем магний для поддержания здоровья мышц, сердечно-сосудистой системы и иммунитета.Прогресс глутатиона снабжает ваше тело мощными антиоксидантами, которые выводят токсины из организма и повышают энергию и ясность ума.
- NAD + Boost: Для тех, кто серьезно относится к своему здоровью и хочет обратить вспять старение и повысить уровень энергии, наша терапия NAD + IV может помочь вам почувствовать себя и выглядеть лучше. Наши процедуры предназначены для повышения энергии и поддержки иммунитета, одновременно устраняя туман в мозгу и улучшая память и концентрацию.
Связанный:
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Глава 2: Структура белка — химия
Глава 2: Структура белка 2.1 Структура и свойства аминокислот 2.2 Образование пептидной связи и структура первичного белка 2.3 Структура вторичного белка 2.4 Супервторичная структура и белковые мотивы2,5 Структура третичного и четвертичного белка 2.6 Сворачивание, денатурация и гидролиз белков 2.7 Ссылки
2.1 Структура и свойства аминокислот
Белки являются одними из наиболее распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул. Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить для транспортировки, хранения или перепонки; или они могут быть токсинами или ферментами. Каждая клетка живой системы может содержать тысячи различных белков, каждый из которых выполняет уникальную функцию. Их структуры, как и их функции, сильно различаются.Однако все они представляют собой полимеры альфа-аминокислот, расположенные в линейной последовательности и связанные друг с другом ковалентными связями.
Структура альфа-аминокислотОсновным строительным блоком белков являются альфа (α) аминокислот . Как следует из их названия, они содержат функциональную группу карбоновой кислоты и функциональную группу амина. Обозначение альфа используется, чтобы указать, что эти две функциональные группы отделены друг от друга одной углеродной группой.Помимо амина и карбоновой кислоты, альфа-углерод также присоединен к водороду и одной дополнительной группе, которая может различаться по размеру и длине. На схеме ниже эта группа обозначена как R-группа. В живых организмах в качестве строительных блоков белка используются 20 аминокислот. Они отличаются друг от друга только положением R-группы. Основная структура аминокислоты показана ниже:
Рисунок 2.1 Общая структура альфа-аминокислоты
Всего 20 альфа-аминокислот, которые обычно включаются в белковые структуры (рисунок 2.Икс). Различные R-группы имеют разные характеристики в зависимости от природы атомов, включенных в функциональные группы. Есть R-группы, которые преимущественно содержат углерод и водород и очень неполярны или гидрофобны. Другие содержат полярные незаряженные функциональные группы, такие как спирты, амиды и тиолы. Некоторые аминокислоты являются основными (содержащие функциональные аминогруппы) или кислотными (содержащими функциональные группы карбоновых кислот). Эти аминокислоты способны образовывать полные заряды и могут взаимодействовать с ионами.Каждая аминокислота может быть сокращена с использованием трехбуквенного и однобуквенного кода.
Рис. 2.2 Структура 20 альфа-аминокислот, используемых в синтезе белка. R-групп обозначены обведенными / окрашенными участками каждой молекулы. Цвета указывают на определенные классы аминокислот: гидрофобные — зеленый и желтый, гидрофильные полярные незаряженные — оранжевый, гидрофильные кислые — синие, гидрофильные основные — розовые.
Щелкните здесь, чтобы загрузить версию таблицы аминокислот
Неполярные (гидрофобные) аминокислоты
Неполярные аминокислоты в значительной степени можно подразделить на два более конкретных класса: алифатических аминокислот и ароматических аминокислот. алифатических аминокислот (глицин, аланин, валин, лейцин, изолейцин и пролин) обычно содержат разветвленные углеводородные цепи, от простейших — от глицина до более сложных структур лейцина и валина. Пролин также классифицируется как алифатическая аминокислота, но обладает особыми свойствами, поскольку углеводородная цепь циклизуется с концевым амином, создавая уникальную 5-членную кольцевую структуру. Как мы увидим в следующем разделе, посвященном первичной структуре, пролин может значительно изменить трехмерную структуру из-за структурной жесткости кольцевой структуры, когда он включен в полипептидную цепь и обычно находится в областях белка, где возникают складки или повороты.
ароматических аминокислот (фенилаланин, тирозин и триптофан), , как следует из их названия, содержат ароматические функциональные группы в своей структуре, что делает их в значительной степени неполярными и гидрофобными из-за высокого содержания углерода / водорода. Однако следует отметить, что гидрофобность и гидрофильность представляют собой скользящую шкалу, и каждая из различных аминокислот может иметь разные физические и химические свойства в зависимости от своей структуры. Например, гидроксильная группа, присутствующая в тирозине, увеличивает его реакционную способность и растворимость по сравнению с фенилаланином.
Метионин, одна из серосодержащих аминокислот обычно классифицируется как неполярные, гидрофобные аминокислоты, поскольку концевая метильная группа создает функциональную группу тиоэфира, которая обычно не может образовывать постоянный диполь внутри молекулы и сохраняет низкую растворимость.
Полярные (гидрофильные) аминокислотыПолярные гидрофильные аминокислоты можно подразделить на три основных класса: полярные незаряженные, кислотные и основные функциональные группы.В пределах полярного незаряженного класса боковые цепи содержат гетероатомы (O, S или N), которые способны образовывать постоянные диполи в R-группе. К ним относятся гидроксил- и сульфоксил-содержащие аминокислоты, серин, треонин и цистеин и амидосодержащие аминокислоты, глутамин и аспаригин. Две аминокислоты, глутаминовая кислота (глутамат) и аспарагиновая кислота (аспартат) составляют кислые аминокислоты и содержат боковые цепи с функциональными группами карбоновых кислот, способными полностью ионизироваться в растворе.Основные аминокислоты , лизин, аргинин и гистидин содержат функциональные аминогруппы, которые можно протонировать для получения полного заряда.
Многие из аминокислот с гидрофильными R-группами могут участвовать в активном сайте ферментов. Активный центр — это часть фермента, которая напрямую связывается с субстратом и осуществляет реакцию. Белковые ферменты содержат каталитических групп , состоящих из R-групп аминокислот, которые способствуют образованию и разрушению связей.Аминокислоты, которые играют значительную роль в специфичности связывания активного сайта, обычно не примыкают друг к другу в первичной структуре, но образуют активный сайт в результате сворачивания при создании третичной структуры, как вы увидите позже в глава.
Белковые структуры, построенные из основных аминокислот, могут состоять из сотен аминокислот. Таким образом, для простоты 20 аминокислот, используемых для синтеза белка, имеют аббревиатуры как трехбуквенного, так и однобуквенного кода (Таблица 2.1). Эти сокращения обычно используются для обозначения белковых последовательностей в биоинформатических и исследовательских целях.
Таблица 2.1 Сокращения для α-аминокислотМысленный вопрос: Триптофан содержит функциональную группу амина, почему триптофан не является основным?
Ответ: Триптофан содержит индольную кольцевую структуру, которая включает функциональную группу амина. Однако из-за близости и электроноакцепторной природы ароматической кольцевой структуры неподеленная пара электронов на азоте недоступна для принятия протона.Вместо этого они участвуют в образовании связей p- внутри нескольких различных резонансных структур, возможных для индольного кольца. На рис. 2.3A показаны четыре возможные резонансные структуры для индола. И наоборот, в структуре имидазольного кольца, обнаруженной в гистидине, есть два атома азота, один из которых участвует в образовании резонансных структур (азот № 1 на рисунке 2.3B) и не может принимать протон, а другой (азот № 3 ), которая имеет неподеленную пару электронов, которая может принять протон.
Рис. 2.3 Сравнение структурной доступности неподеленной пары электронов на азоте для принятия протона в кольцевой структуре индола и иммидизола . (A) Показаны четыре резонансные структуры индольной кольцевой структуры, демонстрирующие, что неподеленная пара электронов на азоте участвует в образовании pi -связей. (B) Кольцевая структура имидазола имеет один азот (1), который участвует в резонансных структурах (не показаны) и не может принимать протон, в то время как второй азот (3) имеет неподеленную пару электронов, доступных для принятия протона. как показано.
Работай самостоятельно:В приведенном выше примере опишите с помощью химической диаграммы, почему амидные атомы азота, содержащиеся в аспарагине и глутамине, не являются основными.
Альфа-аминокислоты — хиральные молекулы
Если вы изучите структуру альфа-углерода в каждой из аминокислот, вы заметите, что все аминокислоты, кроме глицина, являются хиральными молекулами (Рисунок 2.4) Хиральная молекула — это молекула, которая не накладывается на свое зеркальное отображение. Подобно левой и правой руке, у которых есть большой палец и пальцы в одном порядке, но являются зеркальными, а не одинаковыми, к хиральным молекулам прикреплены одни и те же предметы в одном и том же порядке, но они являются зеркальными, а не одинаковыми. Варианты зеркального отображения хиральных молекул имеют физические свойства, которые почти идентичны друг другу, что очень затрудняет их различение или разделение.Из-за этой природы им дано специальное название стереоизомера — энантиомеры , и фактически сами соединения получили такое же название! Эти молекулы действительно различаются тем, как они вращают простой поляризованный свет, и тем, как они реагируют и взаимодействуют с биологическими молекулами. Молекулы, вращающие свет в правостороннем направлении, называются правовращающими и обозначаются буквой D. Молекулы, которые вращают свет в левом направлении, называются левовращающими и обозначаются буквой L, чтобы отличить один энантиомер от другого.D- и L-формы аланина показаны на рисунке 2.4B.
Хотя большинство аминокислот могут существовать как в левосторонней, так и в правосторонней формах, жизнь на Земле состоит почти исключительно из левосторонних аминокислот. Протеогенные аминокислоты, включенные в белки рибосомами, всегда находятся в L-конформации. Некоторые бактерии могут включать D-аминокислоты в пептиды, не кодируемые рибосомами, но D-аминокислоты в природе используются редко. Интересно, что когда мы обсудим структуру сахаров в главе XX, мы обнаружим, что сахара, которые включены в углеводные структуры, почти исключительно находятся в D-конформации.Никто не знает, почему это так. Однако доктор. Джон Кронин и Сандра Пиццарелло показали, что из аминокислот, которые падают на Землю из космоса на метеоритах, больше находится в L-конформации, чем в D-конформации. Таким образом, тот факт, что мы состоим преимущественно из L-аминокислот, может быть вызван аминокислотами из космоса.
Почему аминокислоты в космосе благоприятствуют L-конформации? Никто точно не знает, но известно, что излучение также может существовать в левосторонней и правосторонней формах. Итак, существует теория, называемая гипотезой Боннера , которая предполагает, что преобладающие формы излучения в космосе (т. Е.от вращающейся нейтронной звезды, например) может привести к селективному образованию гомохиральных молекул, таких как L-аминокислоты и D-сахара. Это все еще спекулятивно, но недавние открытия метеоритов делают эту гипотезу гораздо более правдоподобной.
Рис. 2.4 Хиральность аминокислот. За исключением простейшей аминокислоты, глицина, все другие аминокислоты, которые включены в белковые структуры, имеют хиральную природу. (A) Демонстрирует хиральность структуры основной альфа-аминокислоты при использовании неспецифической R-группы.(B) Пара энантиомеров D- и L-аланина, верхняя диаграмма представляет модель шара и клюшки, а нижняя диаграмма представляет линейную структуру.
Изображение (A) из NASA
Обратите внимание, что обозначения D и L — это особые термины, используемые для того, как молекула вращает простой поляризованный свет. Это не означает абсолютную стереоконфигурацию молекулы. Абсолютная конфигурация относится к пространственному расположению атомов хирального молекулярного объекта (или группы) и его стереохимическому описанию. E.грамм. R или S , имея в виду Rectus или Sinister , соответственно.
Абсолютные конфигурации хиральной молекулы (в чистом виде) чаще всего получают с помощью рентгеновской кристаллографии. Альтернативными методами являются оптическая вращательная дисперсия, колебательный круговой дихроизм, использование реагентов хирального сдвига в протонном ЯМР и визуализации кулоновского взрыва. После получения абсолютной конфигурации назначение R или S основано на правилах приоритета Кан – Ингольда – Прелога, , которые можно просмотреть, перейдя по ссылке и на рисунке 2.5. Все хиральные аминокислоты, кроме цистеина, также находятся в S-конформации. Цистеин содержит атом серы, из-за чего R-группа имеет более высокий приоритет, чем функциональная группа карбоновой кислоты, что приводит к R-конформации для абсолютной стереохимии. Однако цистеин действительно вращает простой поляризованный свет в левовращающем или левовращающем направлении. Таким образом, R- и S-обозначения не всегда соответствуют D- и L-конформации.
Рисунок 2.5 Абсолютная конфигурация определяется обозначениями Rectus (R) и Sinister (S). В системе Кан-Ингольда Прелога для наименования хиральных центров группы, присоединенные к хиральному центру, ранжируются в соответствии с их атомным номером, причем наивысший атомный номер получает наивысший приоритет (A на диаграмме выше), а наименьший атомный номер получает наименьший приоритет (D на диаграмме выше). Затем зритель с самым низким приоритетом не видит, чтобы правильно сориентировать молекулу для дальнейшей оценки.Затем отслеживается путь приоритетов №1, №2 и №3 (соответствующих A, B и C выше). Если путь идет по часовой стрелке, хиральному центру присваивается R-обозначение, тогда как если путь идет против часовой стрелки, ему присваивается S-обозначение.
Изображение из Википедия
Аминокислоты — цвиттерионы
В химии цвиттер-ион представляет собой молекулу с двумя или более функциональными группами, из которых по крайней мере одна имеет положительный, а другая отрицательный электрический заряд, а суммарный заряд всей молекулы равен нулю при определенном pH.Поскольку они содержат по крайней мере один положительный и один отрицательный заряд, цвиттерионы также иногда называют внутренними солями . Заряды на различных функциональных группах уравновешивают друг друга, и молекула в целом может быть электрически нейтральной при определенном pH. Значение pH, при котором это происходит, называется изоэлектрической точкой .
В отличие от простых амфотерных соединений, которые могут образовывать только или катионные или анионные частицы, цвиттерион одновременно имеет оба ионных состояния.Аминокислоты являются примерами цвиттерионов (рис. 2.6). Эти соединения содержат аммонийную и карбоксилатную группы, и их можно рассматривать как возникающие в результате своего рода внутримолекулярной кислотно-основной реакции: аминогруппа депротонирует карбоновую кислоту.
Рис. 2.6 Аминокислоты — это цвиттерионы. Аминокислота содержит как кислотные (фрагмент карбоновой кислоты), так и основные (фрагмент амина) центры. Изомер справа — это цвиттерионная форма.
Поскольку аминокислоты являются цвиттерионами, а некоторые из них также содержат потенциал для ионизации в своих R-группах, их состояние заряда in vivo , и, таким образом, их реакционная способность может варьироваться в зависимости от pH, температуры и сольватационного статуса локальных микросреда, в которой они расположены.Таблица стандартных значений pK и для аминокислот показана в таблице 2.1 и может использоваться для прогнозирования состояния ионизации / заряда аминокислот и получаемых ими пептидов / белков. Однако следует отметить, что статус сольватации в микроокружении аминокислоты может изменять относительные значения pK и этих функциональных групп и обеспечивать уникальные реактивные свойства в активных центрах ферментов (таблица 2.1). Более подробное обсуждение эффектов десольватации будет дано в главе XX, посвященной механизмам ферментативных реакций.
Таблица 2.1Версия для печати значений pKa
Как видно из таблицы 2.1, семь аминокислот содержат R-группы с ионизируемыми боковыми цепями и обычно находятся в активных центрах ферментов. Напомним, что pK a определяется как pH, при котором ионизированная и неионизированная формы ионизируемой функциональной группы в молекуле существуют в равных концентрациях. Таким образом, когда функциональная группа сдвигается выше или ниже ее значения pK или , произойдет сдвиг в концентрациях ионизированных и неионизированных форм, в пользу одного состояния по сравнению с другим.На рис. 2.7 показаны различные R-группы в их неионизированном и ионизированном состояниях и их предпочтительные состояния выше или ниже значения pK a .
Рис. 2.7 Ионизируемые функциональные группы в обычных аминокислотах. Во всех аминокислотах как функциональная группа карбоновой кислоты (C-конец), так и функциональная группа амина (N-конец) способны к ионизации. Кроме того, семь аминокислот (аспарагиновая кислота, глутаминовая кислота, аргинин, гистидин, лизин, тирозин и цистеин) также содержат ионизируемые функциональные группы в своих R-группах.Предпочтительные состояния функциональной группы показаны либо выше, либо ниже их соответствующих значений pK a .
Обычно ионизируемая группа будет благоприятствовать протонированному состоянию в условиях pH ниже ее соответствующих значений pK a и будет благоприятствовать депротонированному состоянию в условиях pH выше ее соответствующего значения pK a . Таким образом, значения pK a можно использовать, чтобы помочь предсказать общие состояния заряда аминокислот и их результирующих пептидов / белков в определенной среде.Например, если мы посмотрим на кривую титрования основной аминокислоты, гистидина (рис. 2.8). При достижении каждого pK a состояние заряда аминокислоты изменяется в пользу депротонированного состояния. Таким образом, гистидин будет медленно прогрессировать от общего заряда +2 при очень низком pH (полностью протонированный) до общего заряда -1 при очень высоком pH (полностью депротонирован).
Рис. 2.8. Состояние ионизации гистидина в средах с различным pH. (A) Кривая титрования гистидина от низкого pH до высокого pH.Указывается каждая точка эквивалентности (pK a ). (B) Показывает благоприятное состояние ионизации гистидина после прохождения каждого pK значения .
Изображение адаптировано из L. Van Warren
Дополнительная практика:
Нарисуйте глутаминовую кислоту и спрогнозируйте общее состояние заряда аминокислоты при pH = 1, pH = 3, pH = 7 и pH = 12.
Образование цистеиновых и дисульфидных связей
Цистеин также является уникальной аминокислотой, поскольку эта боковая цепь способна подвергаться обратимой окислительно-восстановительной реакции ( редокс ) с другими остатками цистеина, создавая ковалентную дисульфидную связь в окисленном состоянии (Рисунок 2.9). Вспомните, что когда молекулы окисляются, они теряют электроны, а когда молекулы восстанавливаются, они приобретают электроны. Во время биологических окислительно-восстановительных реакций ионы водорода ( протонов, ) часто удаляются с электронами из молекулы во время окисления и возвращаются во время восстановления. Таким образом, если реакция теряет или набирает протоны, это хороший признак того, что она также теряет или получает электроны и что происходит окислительно-восстановительная реакция.Таким образом, получение или потеря протонов может быть простым способом идентифицировать этот тип реакции.
Дисульфидные связи являются неотъемлемой частью образования трехмерной структуры белков и поэтому могут сильно влиять на функцию получаемого белка. В клеточных системах образование / разрыв дисульфидной связи является ферментно-опосредованной реакцией и может использоваться в качестве механизма для контроля активности белка. Дисульфидные связи будут обсуждаться более подробно в разделе 2.xx данной главы и в главе XX.
Рис. 2.9. Цистеин может окисляться с образованием дисульфидных связей. Во время образования дисульфидной связи два цистеина окисляются с образованием молекулы цистина. Это требует потери двух протонов и двух электронов.
назад к началу2.2 Образование пептидной связи и структура первичного белка
В клеточных системах белки связаны друг с другом большим ферментным комплексом, который содержит смесь РНК и белков.Этот комплекс называется рибосомой . Таким образом, поскольку аминокислоты связаны друг с другом с образованием определенного белка, они размещаются в очень определенном порядке, который диктуется генетической информацией, содержащейся в молекуле информационной РНК (мРНК). Этот специфический порядок аминокислот известен как первичная последовательность белка . Механизм трансляции, используемый рибосомой для синтеза белков, будет подробно обсуждаться в главе XX.В этой главе основное внимание будет уделено химической реакции, происходящей во время синтеза, и физическим свойствам полученных пептидов / белков.
Первичная последовательность белка связана вместе с использованием синтеза дегидратации (потеря воды), которые объединяют карбоновую кислоту вышележащей аминокислоты с аминогруппой нижележащей аминокислоты с образованием амидной связи (рис. 2.10). ). Аналогично, обратная реакция гидролиз требует включения молекулы воды для разделения двух аминокислот и разрыва амидной связи.Примечательно, что рибосома служит ферментом, который опосредует реакции синтеза дегидратации, необходимые для создания белковых молекул, тогда как класс ферментов, называемых протеазами , необходим для гидролиза белка.
В белковых структурах амидная связь между аминокислотами известна как пептидная связь . Последующие аминокислоты будут добавлены на конце карбоновой кислоты растущего белка.Таким образом, белки всегда синтезируются направленным образом, начиная с амина и заканчивая хвостом карбоновой кислоты. Новые аминокислоты всегда добавляются к хвосту карбоновой кислоты, а не к амину первой аминокислоты в цепи. Направленность синтеза белка определяется рибосомой и известна как синтез N- в C .
Рис. 2.10. Образование пептидной связи. Добавление двух аминокислот для образования пептида требует синтеза дегидратации.
Как отмечалось выше в разделе цвиттерионов, амидные связи имеют резонансную структуру, которая не позволяет атомной неподеленной паре электронов действовать как основание (рис. 2.11).
Рисунок 2.11 Резонансная структура амида. Во время амидного резонанса неподеленные пары электронов из азота участвуют в образовании pi -связи с карбонильным углеродом, образующим двойную связь. Таким образом, амидные атомы азота не являются основными. Кроме того, связь C-N в амидной структуре зафиксирована в пространстве и не может вращаться из-за характера связи p-.
Изображение В.К. Чанг
Вместо этого они участвуют в образовании связи p- с карбонильным углеродом. Кроме того, связь C-N в амидной структуре зафиксирована в пространстве и не может вращаться из-за характера связи p-. Это создает фиксированные физические положения R-групп в растущем пептиде в конформациях цис, или транс, . Поскольку R-группы могут быть довольно объемными, они обычно чередуются по обе стороны от растущей белковой цепи в конформации транс .Конформация цис является предпочтительной только с одной конкретной аминокислотой, пролином . Это связано с циклической структурой R-группы пролина и стерическими препятствиями, которые возникают, когда пролин принимает конформацию транс (рис. 2.12). Таким образом, остатки пролина могут иметь большое влияние на трехмерную структуру полученного пептида.
Рисунок 2.12 Конформация Cis и Trans R-групп аминокислот. Верхняя диаграмма отображает конформации цис и транс двух соседних аминокислот, обозначенных как X и Y, которые обозначают любую из 20 аминокислот, за исключением пролина. В конформации транс R-группа из аминокислоты X повернута в сторону и находится на другой стороне молекулы по сравнению с R-группой из аминокислоты Y. Эта конформация дает наименьшее количество стерических препятствий по сравнению с cis конформация, в которой R-группы расположены с одной стороны и в непосредственной близости друг от друга.На нижней диаграмме любая аминокислота X расположена перед остатком пролина. Из-за циклизации пролиновой R-группы с амидным азотом в основной цепи это смещает положение пролиновой R-группы, чтобы быть ближе к R-группе от аминокислоты X, когда она принимает конформацию trans . Таким образом, пролин отдает предпочтение конформации цис , которая имеет меньшие стерические препятствия.
Белки представляют собой очень большие молекулы, содержащие много аминокислотных остатков, связанных вместе в очень определенном порядке.Белки имеют размер от 50 аминокислот до самого большого известного белка, содержащего 33 423 аминокислоты. Макромолекулы, содержащие менее 50 аминокислот, известны как пептидов (рис. 2.13).
Рис. 2.13. Пептиды и белки — это макромолекулы, состоящие из длинных цепочек аминокислот, соединенных вместе амидными связями. Порядок и природа аминокислот в первичной последовательности белка определяют структуру укладки белка на основе окружающей среды белка (то есть, если он находится внутри клетки, он, вероятно, окружен водой в очень полярной среде. , тогда как если белок встроен в плазматическую мембрану, он будет окружен очень неполярными углеводородными хвостами).
Благодаря большому количеству аминокислот, которые могут быть включены в каждое положение в белке, существуют миллиарды различных возможных комбинаций белков, которые можно использовать для создания новых белковых структур! Например, подумайте о трипептиде, полученном из этого пула аминокислот. В каждой позиции есть 20 различных опций, которые могут быть включены. Таким образом, общее возможное количество образующихся трипептидов будет 20 X 20 X 20 или 20 3 , что равняется 8000 различных вариантов трипептидов! А теперь подумайте, сколько вариантов было бы для небольшого пептида, содержащего 40 аминокислот.Было бы 20 40 вариантов, или ошеломляющие 1,09 X 10 52 возможных вариантов последовательности! Каждый из этих вариантов будет различаться по общей форме белка, поскольку природа боковых цепей аминокислот помогает определить взаимодействие белка с другими остатками в самом белке и с окружающей его средой.
Характер аминокислот по всему белку помогает белку складываться и формировать его трехмерную структуру. Именно эта трехмерная форма требуется для функциональной активности белка (т. Е. форма белка = функция белка ). Что касается белков, находящихся в водной среде клетки, гидрофобные аминокислоты часто находятся внутри структуры белка, тогда как водолюбивые гидрофильные аминокислоты будут находиться на поверхности, где они могут образовывать водородные связи и взаимодействовать с молекулами воды. Пролин уникален, потому что он имеет единственную R-группу, которая образует циклическую структуру с аминогруппой в основной цепи. Эта циклизация заставляет пролин принимать конформацию цис , а не конформацию транс в основной цепи.Этот сдвиг в структуре часто означает, что пролины представляют собой положения, в которых происходят изгибы или изменения направления внутри белка. Метионин уникален тем, что он служит исходной аминокислотой почти для всех многих тысяч белков, известных в природе. Цистеины содержат тиоловые функциональные группы и, таким образом, могут окисляться другими остатками цистеина с образованием ковалентных дисульфидных связей в структуре белка (рис. 2.14). Дисульфидные мостики добавляют дополнительную стабильность трехмерной структуре и часто требуются для правильного сворачивания и функционирования белка (Рисунок 2.14).
Рис. 2.14. Дисульфидные связи. Дисульфидные связи образуются между двумя остатками цистеина в пептидной или белковой последовательности или между различными пептидными или белковыми цепями. В приведенном выше примере изображены две пептидные цепи, которые образуют гормон инсулин. Дисульфидные мостики между двумя цепями необходимы для правильного функционирования этого гормона, регулирующего уровень глюкозы в крови.
Изображение предоставлено: CNX OpenStax через Wikimedia Commons
Форма и функция белка
Первичная структура каждого белка приводит к уникальному паттерну сворачивания, который характерен для этого конкретного белка.Таким образом, первичная последовательность — это линейный порядок аминокислот, поскольку они связаны вместе в белковой цепи (рис. 2.15). В следующем разделе мы обсудим сворачивание белка, которое приводит к образованию вторичных, третичных, а иногда и четвертичных белковых структур.
Рис. 2.15. Первичная структура белка представляет собой линейную последовательность аминокислот.
(кредит: модификация работы Национального исследовательского института генома человека)
назад к началу2.3 Структура вторичного белка
В предыдущем разделе мы отметили жесткость, создаваемую связью CN в амидной связи, когда аминокислоты соединяются друг с другом, и узнали, что это заставляет R-группы аминокислот благоприятствовать конфромации транс (за исключением пролина, который благоприятствует конформации цис ). Эта жесткость каркаса белка ограничивает потенциал сворачивания и структуру получаемого белка. Однако связи, прикрепленные к α-углероду, могут свободно вращаться и вносить свой вклад в гибкость и уникальные паттерны сворачивания, наблюдаемые внутри белков.Чтобы оценить возможные модели вращения, которые могут возникнуть вокруг α-углерода, обычно измеряются торсионные углы Phi (Φ) и Psi (ψ). Угол кручения Phi (Φ) измеряет вращение вокруг связи α-углерод-азот, оценивая угол между двумя соседними карбонильными атомами углерода, когда вы смотрите прямо вниз по связи α-углерод-азот в плоскость бумаги (рис. 2.16). ). И наоборот, торсионный угол Psi (ψ) измеряет вращение вокруг связи α-углерод-карбонильный углерод, оценивая угол между двумя соседними атомами азота, когда вы смотрите прямо вниз на связь α-углерод-карбонильный углерод (Рисунок 2.16).
Рисунок 2.16 Торсионные углы Phi (Φ) и Psi (ψ). (A) Торсионный угол Phi (Φ) является мерой вращения вокруг связи между α-углеродом и амидным азотом. Он измеряется как угол между двумя карбонильными атомами углерода, примыкающими к связи, показанный на нижней панели. (B) Торсионный угол Psi (ψ) является мерой вращения вокруг связи между α-углеродом и карбонильным углеродом. Он измеряется как угол между двумя атомами азота, примыкающими к связи, показанный на нижней панели.
В то время как связи вокруг α-углерода могут вращаться свободно, предпочтительные торсионные углы ограничены меньшим набором возможностей, поскольку соседние атомы избегают конформаций, которые имеют высокие стерические препятствия, связанные с ними. Г. Рамачандран создал компьютерные модели небольших пептидов для определения стабильных конформаций торсионных углов Phi (Φ) и Psi (ψ). С его результатами он создал так называемый график Рамачандрана, который графически отображает области перекрытия наиболее благоприятных углов кручения Phi (Φ) и Psi (ψ) (Рисунок 2.17)
Рис. 2.17 График Рамачандрана. Благоприятный и очень благоприятный торсионные углы Phi (Φ) и Psi (ψ) обозначены желтым и красным соответственно. Указаны углы связи для общих вторичных белковых структур.
Изображение изменено с: J. Cooper
Внутри каждого белка небольшие участки белка могут принимать специфические повторяющиеся паттерны сворачивания. Эти специфические мотивы или узоры называются вторичной структурой .Две из наиболее распространенных вторичных структурных особенностей включают альфа-спираль и бета-гофрированный лист (рис. 2.18). Внутри этих структур внутримолекулярные взаимодействия, особенно водородная связь между амином основной цепи и карбонильными функциональными группами, имеют решающее значение для поддержания трехмерной формы.
Рис. 2.18. Вторичные структурные особенности в структуре белка. Правая альфа-спираль и бета-складчатый лист являются общими структурными мотивами, обнаруженными в большинстве белков.Они удерживаются вместе за счет водородной связи между амином и карбонильным кислородом в основной цепи аминокислоты.
Изображение изменено из: The School of Biomedical Sciences Wiki
Альфа-спираль
Для альфа-спиральных структур очень распространена правая спираль, тогда как левые спирали очень редки. Это связано с торсионными углами Phi (Φ) и Psi (ψ), необходимыми для получения левой альфа-спиральной структуры.Чтобы получить правильную ориентацию левой спирали, белку придется складываться и закручиваться под множеством неблагоприятных углов. Таким образом, они не очень распространены в природе.
Для правой альфа-спирали каждый виток спирали содержит 3,6 аминокислотных остатка (рис. 2.19). Группы R (вариантные группы) полипептида выступают из цепи α -спираль. Основная цепь полипептида образует повторяющуюся спиральную структуру, которая стабилизируется водородными связями между кислородом карбонила и водородом амина.Эти водородные связи возникают с регулярными интервалами, по одной водородной связи на каждую четвертую аминокислоту, и заставляют основную цепь полипептида образовывать спираль. Каждая аминокислота продвигает спираль вдоль своей оси на 1,5 Å. Каждый виток спирали состоит из 3,6 аминокислот; следовательно, шаг спирали составляет 5,4 Å. На спираль приходится в среднем десять аминокислотных остатков. Различные аминокислоты по-разному склонны к образованию α -спирали. Аминокислоты, которые предпочитают принимать спиральные конформации в белках, включают метионин, аланин, лейцин, глутамат и лизин.Пролин и глицин почти не склонны к образованию спиралей.
Рис. 2.19. Структура правой альфа-спирали. (A) Модель шара и рукояти, вид сбоку. Всего для образования одного витка α -спирали требуется 3,6 аминокислоты. Водородная связь между кислородом карбонила и азотом 4-й аминокислоты стабилизирует спиральную структуру. На показанной структуре черные атомы представляют собой альфа-углерод, серый — карбонильные углероды, красный — кислород, синий — азот, зеленый — R-группы и светло-фиолетовый — атомы водорода.(B) Расширенный вид сбоку, линейная структура и модель заполнения пространства (C) Расширенный вид сверху, линейная структура и модель заполнения пространства
Изображение A изменено с: Максим Изображение B и C от: Генри Якубовски
Ключевые моменты об альфа-спирали:
- Альфа-спираль более компактна, чем полностью вытянутая полипептидная цепь с углами phi / psi 180 o
- В белках среднее количество аминокислот в спирали составляет 11, что дает 3 витка.
- Левая альфа-спираль, хотя и разрешенная при осмотре графика Рамачандрана, наблюдается редко, поскольку аминокислоты, используемые для построения структуры белка, являются L-аминокислотами и смещены в сторону образования правой спирали. Когда левосторонние спирали все же образуются, они часто имеют решающее значение для правильного сворачивания белка, стабильности белка или непосредственно участвуют в формировании активного центра.
Рисунок 2.20 Левосторонняя структура альфа-спирали. На этой диаграмме левая альфа-спираль, показанная желтым цветом, является частью витка шпильки в структуре белка и стабилизирована двумя дисульфидными мостиками, показанными желтым цветом.
Рисунок из: Annavarapu, S., Nanda, V. (2009) BMC Struct Biol 9, 61
- Ядро спирали плотно упаковано. В спирали нет отверстий и пор.
- Все R-группы простираются наружу и от оси спирали. R-группы могут быть гидрофильными или гидрофобными и могут располагаться в определенных положениях на спирали, образуя амфипатические области на белке, или полностью гидрофобные спирали могут также проходить через плазматическую мембрану, как показано на рис. 2.21
Рис. 2.21. Расположение R-групп в альфа-спиральных структурах. R-группы могут быть расположены внутри альфа-спирали для создания амфипатических областей в белке, где гидрофильные остатки расположены на одной стороне спирали, а гидрофобные — на другой, как показано на виде сбоку (A) или сверху вниз ( ДО Н.Э).R-группы также могут быть полностью гидрофобными в альфа-спиралях, охватывающих плазматическую мембрану, как показано на (D).
Рисунок изменен по: Khara, J.S., et al. (2017) Acta Biomat 57: 103-114 и Ryu, H., et al. (2019) Int J Mol Sci 20 (6) 1437
- Некоторые аминокислоты чаще встречаются в альфа-спиралях, чем другие. Вот аминокислоты, которые обычно НЕ встречаются в альфа-спиральных структурах: Gly слишком мал и конформационно гибок, чтобы его можно было найти с высокой частотой в альфа-спиралях, а Pro слишком жесткий и в цис -конформации. Pro часто нарушает спиральную структуру, вызывая изгибы белка. Некоторые аминокислоты с боковыми цепями, которые могут связывать Н-связь ( Ser, Asp, и Asn ) и не слишком долго, по-видимому, действуют как конкуренты донора и акцептора Н-связи основной цепи и дестабилизируют альфа спирали. R-группы с ранним ветвлением, такие как Val и Ile, дестабилизируют альфа-спираль из-за стерических взаимодействий объемных боковых цепей с основной цепью спирали.
- Сводная информация о склонностях аминокислот к альфа-спиралям (а также к бета-структуре)
- Альфа-кератины, основной компонент волос, кожи, меха, клювов и ногтей, почти полностью представляют собой альфа-спираль.
Jmol: Обновлено Изолированная спираль из антифриза белка Jmol14 (Java) | JSMol (HTML5)
Бета-плиссированный лист: В β-складчатом листе «складки» образованы водородными связями между атомами в основной цепи полипептидной цепи.Группы R присоединены к атомам углерода и проходят выше и ниже складок складки в конформации транс . Складчатые сегменты выстраиваются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом азота в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе остова пептида (рис. 2.21).
Рисунок 2.21 Бета-гофрированная листовая структура. β-гофрированный лист может быть ориентирован в параллельной или антипараллельной ориентации, как показано на (A) выше, с β-гофрированным листом, представленным красными стрелками.Направление стрелки указывает ориентацию белка, при этом стрелка проходит в направлении от N к C. Водородная связь между карбонилом основной цепи и функциональными аминогруппами основной цепи стабилизировала как антипараллельные (B слева), так и параллельные (B справа) β-складчатые листовые структуры.
Изображение (A) с: Xenoblast Изображение (B) с: Fvasconcellos
Другие мотивы вторичной структуры:
Другие важные вторичные структуры включают витков, петель, шпильки и гибких линкеров .Существует множество различных классификаций витков в структуре белка, включая α-витков, β-витков, γ-витков, δ-витков и π-витков . β-витки (наиболее распространенная форма) обычно содержат четыре аминокислотных остатка (рис. 2.22). Пролин и глицин обычно встречаются в поворотных мотивах, поскольку цис-конформация пролина способствует более резким конформационным изгибам, в то время как минимальная боковая цепь глицина позволяет более плотно упаковывать аминокислоты, чтобы способствовать структуре поворота.
Рис. 2.22. Схема β-витков типа I и II.
Фотография из: Muskid
ω-петля — это универсальный термин для более длинных, расширенных или нерегулярных петель без фиксированной внутренней водородной связи. Шпилька — это особый случай поворота, при котором направление основной цепи белка меняется на противоположное и фланкирующие элементы вторичной структуры взаимодействуют. Например, шпилька beta соединяет две антипараллельные β-нити с водородными связями.Иногда повороты обнаруживаются внутри гибких линкеров или петель, соединяющих белковые домены. Линкерные последовательности различаются по длине и обычно богаты полярными незаряженными аминокислотами. Гибкие линкеры позволяют соединительным доменам свободно скручиваться и вращаться для рекрутирования своих связывающих партнеров через динамику белковых доменов.
назад к началу2.4 Супервторичная структура и белковые мотивы
Между вторичной структурой и третичной структурой белков находятся более крупные трехмерные особенности, которые были идентифицированы во множестве различных белковых структур.Они известны как супервторичная структура и как белок мотивов . Супервторичная структура обычно состоит из двух вторичных структур, связанных вместе витком, и включает спираль-виток-спираль, спираль-петля-спираль, α-α-углы, β-β-углы и β-шпилька-β (рис. 2.23).
Рисунок 2.23 Примеры сверхвторичных структур. (A) β-шпилька-β-структуры характеризуются резким поворотом шпильки, который не нарушает водородные связи двух β-складчатых листовых структур.(B) Предполагаемая структура спирали-поворот-спираль белка Taspase1, (C) угловая структура α-α, присутствующая в белке Myoglobin.
Изображение A предоставлено: Isabella Daidone Изображение B: Johannes van den Boom, et al. (2016) PLosONE 11 (3): e0151431
Изображение C изменено с: Belles14104
Белковые мотивы представляют собой более сложные структуры, созданные из вторичных и сверхвторичных структурных компонентов, повторяющихся модальностей, визуализируемых во многих белковых структурах.
Бета-нити имеют тенденцию закручиваться в правильном направлении, чтобы минимизировать конформационную энергию. Это приводит к образованию интересных структурных мотивов, обнаруженных во многих типах белков. Две из этих структур включают скрученные листы или седла, а также бета-стволы (рис. 2.24)
Рис. 2.24. Общие структурные мотивы бета-нити. (A) Скрученный лист для правой руки, вид сверху и сбоку, (B) Вид сбоку бета-ствола и (C) Вид сверху бета-ствола
Автор изображения: Генри Якубовски
Структурные мотивы могут выполнять определенные функции в белках, такие как обеспечение связывания субстратов или кофакторов.Например, складка Россмана отвечает за связывание с кофакторами нуклеотидов, такими как никотинамидадениндинуклеотид (NAD + ) (рис. 2.25). Складка Россмана состоит из шести параллельных бета-нитей, которые образуют протяженный бета-лист. Первые три нити соединены α-спиралями, в результате чего получается структура бета-альфа-бета-альфа-бета. Этот образец дублируется один раз, чтобы получить перевернутый тандемный повтор, содержащий шесть нитей. В целом жилы расположены в порядке 321456 (1 = N-концевой, 6 = C-концевой).Пять скрученных нитей, подобных Россманну, расположены в порядке 32145. Общая третичная структура складки напоминает трехслойный сэндвич, в котором начинка состоит из удлиненного бета-листа, а два ломтика хлеба образованы соединяющимися параллельными альфами. спирали.
Рис. 2.25. Фолд Россмана. (A) Структура никотинамид-адениндинуклеотида (NAD + ) (B) Мультяшная диаграмма складки Россмана (спирали A-F красные и нити 1-6 желтые) из E.coli фермент малатдегидрогеназа. Показано, что кофактор NAD + связывается как молекула, заполняющая пространство. (C) Схематическая диаграмма шестицепочечной складки Россмана.
Изображение изменено с: Boghog
Одной из особенностей складки Россмана является ее специфичность связывания кофакторов. Наиболее консервативный сегмент складок Россмана — это первый бета-альфа-бета сегмент. Поскольку этот сегмент находится в контакте с ADP-частью динуклеотидов, таких как FAD, NAD и NADP, его также называют «ADP-связывающей бета-бета складкой».
Интересно, что подобные структурные мотивы не всегда имеют общего эволюционного предка и могут возникнуть в результате конвергентной эволюции. Так обстоит дело с TIM Barrel, консервативной белковой складкой, состоящей из восьми α-спиралей и восьми параллельных β-цепей, которые чередуются вдоль пептидного остова. Структура названа в честь триозофосфатизомеразы, консервативного метаболического фермента. Бочки TIM — одна из самых распространенных белковых складок. Одна из самых интригующих особенностей представителей этого класса белков заключается в том, что хотя все они демонстрируют одну и ту же третичную складку, между ними очень мало сходства последовательностей.По крайней мере 15 различных семейств ферментов используют этот каркас для создания соответствующей геометрии активного сайта, всегда на С-конце восьми параллельных бета-цепей цилиндра.
Рисунок 2.26 Ствол TIM. бочек TIM считаются α / β-складками белка, потому что они включают в себя чередующийся паттерн α-спиралей и β-цепей в одном домене. В цилиндре TIM спирали и нити (обычно по 8 штук) образуют соленоид, который изгибается вокруг себя и замыкается в форме пончика, топологически известной как тороид.Параллельные β-нити образуют внутреннюю стенку бублика (следовательно, β-бочонок), тогда как α-спирали образуют внешнюю стенку бублика. Каждая β-нить соединяется со следующей соседней нитью в цилиндре через длинную правую петлю, которая включает одну из спиралей, так что раскрашивание ленты N-C на виде сверху (A) происходит в радужном порядке вокруг бочка. Ствол TIM также можно рассматривать как состоящий из 8 перекрывающихся правосторонних супервторичных структур β-α-β, как показано на виде сбоку (B).
Изображение изменено с: WillowW
Хотя ленточная диаграмма TIM Barrel показывает отверстие в центральном ядре белка, боковые цепи аминокислот на этом изображении не показаны (рис. 2.26). Ядро белка на самом деле плотно упаковано, в основном с объемными гидрофобными аминокислотными остатками, хотя необходимо несколько глицинов, чтобы дать пространство для маневра для сильно ограниченного центра 8 приблизительных повторов, чтобы соответствовать друг другу. В упаковочных взаимодействиях между цепями и спиралями также преобладает гидрофобность, и разветвленные алифатические остатки валина, лейцина и изолейцина составляют около 40% от общего количества остатков в β-цепях.
По мере того, как наши знания о бесчисленном множестве структурных мотивов, обнаруженных в сокровищнице природы белковых структур, продолжают расти, мы продолжаем понимать, как структура белка связана с функцией, и мы можем лучше охарактеризовать вновь приобретенные последовательности белка с помощью in silico технологии.
назад к началу2.5 Структура третичного и четвертичного белка
Полная трехмерная форма всего белка (или сумма всех вторичных структурных мотивов) известна как третичная структура белка и является уникальной и определяющей особенностью этого белка (Рисунок 2.27). В первую очередь, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Природа групп R, обнаруженных в задействованных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур, таких как альфа-спираль. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Незаряженные неполярные боковые цепи могут образовывать гидрофобные взаимодействия.Взаимодействие между боковыми цепями цистеина может приводить к образованию дисульфидных связей.
Рис. 2.27. Структура третичного белка. Третичная структура белков определяется множеством химических взаимодействий. К ним относятся гидрофобные взаимодействия, ионные связи, водородные связи и дисульфидные связи.
Изображение предоставлено: School of Biomedical Sciences Wiki
Все эти взаимодействия, сильные и слабые, определяют окончательную трехмерную форму белка.Когда белок теряет свою трехмерную форму, он обычно больше не функционирует.
В природе некоторые белки образованы из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичную структуру . Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, из-за которых он в основном собирается в шар.Инсулин начинается как единый полипептид и теряет некоторые внутренние последовательности во время клеточного процессинга, которые образуют две цепи, удерживаемые вместе дисульфидными связями, как показано на рисунке 2.14. Затем три из этих структур группируются, образуя неактивный гексамер (рис. 2.28). Гексамерная форма инсулина — это способ для организма хранить инсулин в стабильной и неактивной конформации, чтобы он был доступен для высвобождения и реактивации в мономерной форме.
Рисунок 2.28 Гормон инсулина — хороший пример четвертичной структуры. Инсулин вырабатывается и хранится в организме в виде гексамера (единица из шести молекул инсулина), а активной формой является мономер. Гексамер представляет собой неактивную форму с долговременной стабильностью, которая служит средством защиты высокореактивного инсулина, но при этом остается легкодоступным.
Рисунок: Исаак Йонемото
Прогнозирование паттерна сворачивания белка на основе его первичной последовательности — чрезвычайно сложная задача из-за присущей аминокислотным остаткам гибкости, которые можно использовать для образования различных вторичных признаков.Как описано Fujiwara и др., Классификация SCOP (структурная классификация белков) и SCOPe (расширенная версия) являются основными базами данных, дающими подробные и всесторонние описания всех известных структур белков. Классификация SCOP основана на иерархических уровнях: первые два уровня, семейство и суперсемейство , описывают близкие и дальние эволюционные отношения, тогда как третий, крат , описывает геометрические отношения и структурные мотивы внутри белка.В рамках схемы складчатой классификации большинство белков отнесено к одному из четырех структурных классов: (1) все α-спирали, (2) все β-листы, (3) α / β для белков с дисперсными структурами и (4) α + β для белков с участками, в которых преобладает тот или иной тип паттерна.
На основании их формы, функции и местоположения белки в широком смысле могут быть охарактеризованы как волокнистые, глобулярные, мембранные или неупорядоченные.
Волокнистые белки характеризуются удлиненными белковыми структурами.Эти типы белков часто объединяются в филаменты или пучки, образуя структурные каркасы в биологических системах. У животных два наиболее распространенных семейства волокнистых белков — это α-кератин и коллаген.
α-кератин α-кератин — ключевой структурный элемент, из которого состоят волосы, ногти, рога, когти, копыта и внешний слой кожи. Благодаря своей плотно намотанной структуре, он может функционировать как один из самых прочных биологических материалов и находить различное применение у млекопитающих, от хищных когтей до волос для тепла.α-кератин синтезируется путем биосинтеза белка с использованием транскрипции и трансляции, но когда клетка созревает и наполняется α-кератином, она умирает, создавая прочную несосудистую единицу ороговевшей ткани.
Первые последовательности α-кератинов были определены Ханукоглу и Фуксом. Эти последовательности показали, что существует два различных, но гомологичных семейства кератинов, которые были названы кератином типа I и кератином типа II. У человека 54 гена кератина, 28 из которых кодируют тип I, а 26 — тип II. Белки типа I являются кислыми, что означает, что они содержат больше кислых аминокислот, таких как аспарагиновая кислота, в то время как белки типа II являются основными, что означает, что они содержат больше основных аминокислот, таких как лизин. Эта дифференциация особенно важна для α-кератинов, потому что при синтезе его субъединицы димера, спиральной спирали , одна белковая спираль должна быть типа I, а другая — типа II (рис. 2.29). Даже в пределах типа I и II есть кислые и основные кератины, которые особенно дополняют друг друга в каждом организме.Например, в коже человека K5, α-кератин типа II, соединяется в основном с K14, α-кератином I типа, с образованием комплекса α-кератина клеточного слоя эпидермиса кожи.
Димеры Coiled-coil затем собираются в протофиламенты, очень стабильный левосторонний супспиральный мотив, который далее мультимеризуется, образуя филаменты, состоящие из множества копий мономеров кератина (рис. 2.29). Основная сила, которая удерживает структуры coiled-coil, связанные друг с другом, — это гидрофобные взаимодействия между аполярными остатками вдоль спиральных сегментов кератина.
Рисунок 2.29. Формирование промежуточной нити. Промежуточные филаменты состоят из супспирального комплекса α-кератина. Первоначально два мономера кератина (A) образуют структуру димера спиральной спирали (B) Два димера спиральной спирали соединяются, образуя шахматный тетрамер (C), тетрамеры начинают соединяться вместе (D), в конечном итоге формируя лист из восьми тетрамеров (E ). Затем лист из восьми тетрамеров скручивают в левую спираль, образуя конечную промежуточную нить (E). Электронная микрофотография промежуточной нити показана в верхнем левом углу.
Автор изображения: Правительство США
Коллаген
Волокнистый белок Коллаген является наиболее распространенным белком у млекопитающих, составляя от 25% до 35% всего белка в организме. Он находится преимущественно во внеклеточном пространстве в различных соединительных тканях организма. Коллаген содержит уникальную четвертичную структуру из трех белковых цепей, соединенных вместе, образуя тройную спираль.В основном он находится в фиброзных тканях, таких как сухожилия, связки и кожа.
В зависимости от степени минерализации коллагеновые ткани могут быть жесткими (кость), податливыми (сухожилия) или иметь градиент от жесткого к податливому (хрящ). Его также много в роговице, кровеносных сосудах, кишечнике, межпозвонковых дисках и дентине зубов. В мышечной ткани он служит основным компонентом эндомизия. Коллаген составляет от одного до двух процентов мышечной ткани и составляет 6% веса сильных сухожильных мышц.Фибробласт — наиболее распространенная клетка, вырабатывающая коллаген. Желатин, который используется в пище и промышленности, представляет собой необратимо гидролизованный коллаген. Кроме того, в качестве пищевых добавок используются порошки частично или полностью гидролизованного коллагена. Коллаген имеет множество медицинских применений при лечении заболеваний костей и кожи.
Название коллаген происходит от греческого ( kólla ), что означает «клей», и суффикса -gen , обозначающего «производящий». Это относится к раннему использованию соединения в процессе кипячения кожи и сухожилий лошадей и других животных для получения клея.
Более 90% коллагена в организме человека относится к типу I. Однако по состоянию на 2011 год было идентифицировано, описано и разделено на несколько групп в соответствии с формируемой ими структурой 28 типов коллагена. Пять наиболее распространенных типов:
- Тип I: кожа, сухожилие, сосудистая сеть, органы, кость (основной компонент органической части кости)
- Тип II: хрящ (основной коллагеновый компонент хряща)
- Тип III: сетчатый (основной компонент ретикулярных волокон), обычно встречается вместе с типом I
- Тип IV: образует базальную пластинку, секретируемый эпителием слой базальной мембраны
- Тип V: поверхности клеток, волосы и плацента
Здесь мы сосредоточимся на уникальных свойствах коллагена типа I.Коллаген I типа имеет необычный аминокислотный состав и последовательность:
.- Глицин содержится почти в каждом третьем остатке.
- Пролин составляет около 17% коллагена.
- Коллаген содержит две необычные производные аминокислоты, не вставленные непосредственно во время трансляции. Эти аминокислоты находятся в определенных местах относительно глицина и посттрансляционно модифицируются различными ферментами, оба из которых требуют витамина С в качестве кофактора (рис. 2.30).
- Гидроксипролин, производный от пролина
- Гидроксилизин, полученный из лизина — в зависимости от типа коллагена различное количество гидроксилизинов гликозилировано (в основном с присоединенными дисахаридами).
Рисунок 2.30. Гидроксилирование пролина и лизина во время посттрансляционной модификации коллагена типа I. Ферменты пролилгидроксилаза и лизилгидроксилаза необходимы для гидроксилирования остатков пролина (A) и лизина (B) соответственно. (Примечание: хотя положение 3 показано выше, пролиловые остатки альтернативно могут быть гидроксилированы в положении 4). Ферменты гидроксилазы модифицируют аминокислотные остатки после того, как они были включены в белок в качестве посттрансляционной модификации, и требуют витамина С (аскорбата) в качестве кофактора.(C) Дальнейшая модификация остатков гидроксилизина путем гликозилирования может привести к включению дисахарида (галактоза-глюкоза) в гидрокси-кислород.
Большинство коллагена образуется аналогичным образом. Процесс синтеза коллагена типа I описан ниже и демонстрирует сложность сворачивания и обработки белка (рис. 2.31).
- Внутри клетки
- Два типа альфа-цепей образуются во время трансляции на рибосомах вдоль грубого эндоплазматического ретикулума (RER): альфа-1 и альфа-2 цепи.Эти пептидные цепи (известные как препроколлаген) имеют регистрирующие пептиды на каждом конце и сигнальный пептид.
- Полипептидные цепи высвобождаются в просвет RER.
- Сигнальные пептиды расщепляются внутри RER, и теперь эти цепи известны как про-альфа-цепи.
- Внутри просвета происходит гидроксилирование аминокислот лизина и пролина. Этот процесс зависит от кофактора аскорбиновой кислоты (витамина С).
- Происходит гликозилирование определенных остатков гидроксилизина.
- Тройная альфа-спиральная структура образована внутри эндоплазматического ретикулума из двух цепей альфа-1 и одной цепи альфа-2.
- Проколлаген доставляется в аппарат Гольджи, где он упаковывается и секретируется путем экзоцитоза.
- Вне камеры
- Регистрационные пептиды расщепляются, а тропоколлаген образуется проколлагеновой пептидазой.
- Множественные молекулы тропоколлагена образуют фибриллы коллагена посредством ковалентного сшивания (альдольная реакция) лизилоксидазой, которая связывает остатки гидроксилизина и лизина.Множественные коллагеновые фибриллы образуют коллагеновые волокна.
- Коллаген может быть прикреплен к клеточным мембранам через несколько типов белков, включая фибронектин, ламинин, фибулин и интегрин.
Рисунок 2.31. Синтез коллагена типа I. Полипептидные цепи синтезируются в эндоплазматическом ретикулуме и высвобождаются в просвет, где они гидроксилируются и гликозилируются. Тройная спираль проколлагена образуется и транспортируется через аппарат Гольджи, где подвергается дальнейшей обработке.Проколлаген секретируется во внеклеточный матрикс, где расщепляется на тропоколлаген. Тропоколлаген собирается в коллагеновые фибриллы, где происходит сшивание и водородные связи с образованием конечного коллагенового волокна.
Изображение изменено: E.V. Вонг и Британская энциклопедия
Дефицит витамина С вызывает цингу, серьезное и болезненное заболевание, при котором дефектный коллаген препятствует образованию прочной соединительной ткани. Десны портятся и кровоточат, с потерей зубов; кожа меняет цвет, а раны не заживают.До 18 века это состояние было печально известно среди длительных военных, особенно военно-морских, экспедиций, во время которых участников лишали продуктов, содержащих витамин С.
Аутоиммунное заболевание, такое как красная волчанка или ревматоидный артрит, может поражать здоровые коллагеновые волокна. Кортизол стимулирует расщепление коллагена до аминокислот, предполагая, что стресс может усугубить эти болезненные состояния.
Многие бактерии и вирусы выделяют факторы вирулентности, такие как фермент коллагеназа, который разрушает коллаген или препятствует его производству.
назад к началуГлобулярные белки
Глобулярные белки или сферопротеины представляют собой сферические («шарообразные») белки и являются одним из распространенных типов белков. Глобулярные белки в некоторой степени растворимы в воде (образуют коллоиды в воде), в отличие от волокнистых или мембранных белков. Существует несколько классов складок глобулярных белков, поскольку существует множество различных архитектур, которые могут складываться в примерно сферическую форму.
Термин глобин может более конкретно относиться к белкам, включая глобиновую складку. Глобиновая складка представляет собой обычную трехмерную складку в белках и определяет суперсемейство глобиноподобных белков (рис. 2.32). Эта складка обычно состоит из восьми альфа-спиралей, хотя некоторые белки имеют дополнительные продолжения спиралей на концах. Глобиновая складка встречается в одноименных семействах белков глобина: гемоглобинах и миоглобинах, а также в фикоцианинах.Поскольку миоглобин был первым белком, структура которого была решена, глобиновая складка была, таким образом, первой обнаруженной белковой складкой. Поскольку глобиновая складка содержит только спирали, она классифицируется как полностью альфа-белковая складка.
Рисунок 2.32 Глобиновая складка. (A) Пример глобиновой складки, переносящего кислород белка миоглобина (PBD ID 1MBA) из моллюска Aplysia limacina. (B) Структура тетрамерного белка гемоглобина, содержащего в общей сложности четыре глобиновых складки.
Изображение A: Википедия Изображение B: Zephyris
Термин глобулярный белок довольно старый (датируется, вероятно, 19 веком) и сейчас несколько архаичен, учитывая сотни тысяч белков и более элегантный и описательный словарь структурных мотивов. Сферическая структура индуцируется третичной структурой белка. Неполярные (гидрофобные) аминокислоты молекулы связаны внутри молекулы, тогда как полярные (гидрофильные) аминокислоты связаны снаружи, что позволяет диполь-дипольным взаимодействиям с растворителем, что объясняет растворимость молекулы.
В отличие от волокнистых белков, которые выполняют преобладающую структурную функцию, глобулярные белки могут действовать как:
- Ферменты, катализируя органические реакции, происходящие в организме в мягких условиях и с высокой специфичностью. Эту роль выполняют разные эстеразы.
- Посланники, передающие сообщения для регулирования биологических процессов. Эту функцию выполняют гормоны, например, инсулин и т. Д.
- Транспортеры других молекул через мембраны
- Запасы аминокислот.
- Регуляторные роли также выполняются глобулярными белками, а не волокнистыми белками.
- Структурные белки, например актин и тубулин, которые являются глобулярными и растворимыми как мономеры, но полимеризуются с образованием длинных жестких волокон
Многие из белков, которые будут подробно описаны в следующих главах, относятся к этому классу белков.
Мембранные белкиМембранные белки — это белки, которые являются частью биологических мембран или взаимодействуют с ними.Они включают: 1) интегральные мембранные белки, которые являются частью мембраны или постоянно прикреплены к ней, и 2) периферические мембранные белки, которые временно прикрепляются к мембране через интегральные белки или липидный бислой. Интегральные мембранные белки далее классифицируются как трансмембранные белки, которые проходят через мембрану, или интегральные монотопные белки, которые прикрепляются только к одной стороне мембраны.
Мембранные белки, такие как растворимые глобулярные белки, волокнистые белки и неупорядоченные белки, являются обычными. Обладая символической важностью в медицине, мембранные белки являются мишенью для более 50% всех современных лекарственных препаратов. Подсчитано, что 20–30% всех генов в большинстве геномов кодируют мембранные белки. По сравнению с другими классами белков, определение структур мембранных белков остается проблемой в значительной степени из-за сложности создания экспериментальных условий, которые могут сохранить правильную конформацию белка в изоляции от его естественной среды (рис. 2.33).
Мембранные белки выполняют множество функций, жизненно важных для выживания организмов:
- Белки мембранных рецепторов передают сигналы между внутренней и внешней средой клетки.
- Транспортные белки перемещают молекулы и ионы через мембрану. Их можно разделить на категории в соответствии с базой данных классификации транспортеров.
- Мембранные ферменты могут обладать многими видами активности, такими как оксидоредуктаза, трансфераза или гидролаза.
- Молекулы клеточной адгезии позволяют клеткам узнавать друг друга и взаимодействовать.Например, белки, участвующие в иммунном ответе.
Рис. 2.33. Схематическое изображение трансмембранных белков. 1. одиночная трансмембранная α-спираль (битопический мембранный белок) 2. политопный трансмембранный α-спиральный белок 3. политопный трансмембранный β-листовой белок. Мембрана представлена светло-коричневым цветом.
Интегральные мембранные белки постоянно прикреплены к мембране. Такие белки можно отделить от биологических мембран только с использованием детергентов, неполярных растворителей или иногда денатурирующих агентов.Их можно классифицировать в зависимости от их отношения к бислою:
.- Интегральные политопные белки — это трансмембранные белки, которые проходят через мембрану более одного раза. Эти белки могут иметь различную трансмембранную топологию. Эти белки имеют одну из двух структурных архитектур:
- белков спирального пучка, которые присутствуют во всех типах биологических мембран;
- бета-цилиндрических белков, которые встречаются только во внешних мембранах грамотрицательных бактерий, а также в наружных мембранах митохондрий и хлоропластов.
- Битопические белки — это трансмембранные белки, которые проходят через мембрану только один раз. Трансмембранные спирали из этих белков имеют значительно отличающиеся распределения аминокислот от трансмембранных спиралей политопных белков.
- Интегральные монотопные белки представляют собой интегральные мембранные белки, которые прикреплены только к одной стороне мембраны и не охватывают весь путь.
Рисунок 2.34 Схематическое изображение различных типов взаимодействия между монотопными мембранными белками и клеточной мембраной. 1. взаимодействие амфипатической α-спирали, параллельной плоскости мембраны (плоская спираль мембраны) 2. взаимодействие гидрофобной петлей 3. взаимодействие ковалентно связанного липида мембраны ( липидирование ) 4. электростатическое или ионное взаимодействие с мембранные липиды.
Автор изображения : Foobar
Белки периферической мембраны временно присоединяются либо к липидному бислою, либо к интегральным белкам за счет комбинации гидрофобных, электростатических и других нековалентных взаимодействий.Периферические белки диссоциируют после обработки полярным реагентом, например раствором с повышенным pH или высокой концентрацией соли.
Интегральные и периферические белки могут быть посттрансляционно модифицированы с добавлением жирных кислот, диацилглицериновых или пренильных цепей или GPI (гликозилфосфатидилинозитол), которые могут быть закреплены в липидном бислое.
Неупорядоченные белкиВнутренне неупорядоченный белок ( IDP ) — это белок, не имеющий фиксированной или упорядоченной трехмерной структуры (Рисунок 2.35). IDP охватывают спектр состояний от полностью неструктурированного до частично структурированного и включают случайные клубки, (предварительно) расплавленные глобулы и большие многодоменные белки, соединенные гибкими линкерами. Они составляют один из основных типов белков (наряду с глобулярными, волокнистыми и мембранными белками).
Рис. 2.35. Конформационная гибкость белка SUMO-1 (PDB: 1a5r). Центральная часть показывает относительно упорядоченную структуру. Напротив, N- и C-концевые области (левая и правая соответственно) демонстрируют «внутреннее нарушение», хотя короткая спиральная область сохраняется в N-концевом хвосте.Были преобразованы десять альтернативных моделей ЯМР. Элементы вторичной структуры: α-спирали (красные), β-тяжи (синие стрелки).
Автор изображения: Лукаш Козловский
Открытие IDP бросило вызов традиционной парадигме структуры белка, согласно которой функция белка зависит от фиксированной трехмерной структуры. Эта догма была поставлена под сомнение в течение последних двадцати лет в результате все большего количества данных из различных областей структурной биологии, предполагающих, что динамика белков может иметь большое значение для таких систем.Несмотря на отсутствие стабильной структуры, IDP представляют собой очень большой и функционально важный класс белков. В некоторых случаях IDP могут принимать фиксированную трехмерную структуру после связывания с другими макромолекулами. В целом, IDP во многом отличаются от структурированных белков и, как правило, обладают различными свойствами с точки зрения функции, структуры, последовательности, взаимодействий, эволюции и регуляции.
В 1930-1950 годах первые структуры белка были решены с помощью кристаллографии белков.Эти ранние структуры предполагали, что фиксированная трехмерная структура может обычно требоваться для обеспечения биологических функций белков. Утверждая, что белки имеют только одну однозначно определенную конфигурацию, Мирски и Полинг не признали, что работа Фишера поддержала бы их тезис с его моделью «Замок и ключ» (1894). Эти публикации закрепили центральную догму молекулярной биологии в том, что последовательность определяет структуру, которая, в свою очередь, определяет функцию белков.В 1950 году Каруш написал о «конфигурационной адаптивности», что противоречит всем предположениям и исследованиям XIX века. Он был убежден, что белки имеют более одной конфигурации на одном уровне энергии и могут выбирать одну при связывании с другими субстратами. В 1960-х годах парадокс Левинталя предположил, что систематический конформационный поиск длинного полипептида вряд ли приведет к единственной свернутой структуре белка в биологически релевантных временных масштабах (то есть от секунд до минут). Любопытно, что для многих (небольших) белков или белковых доменов можно наблюдать относительно быструю и эффективную рефолдинг in vitro .Как указано в «Догме Анфинсена» 1973 года, фиксированная трехмерная структура этих белков уникально кодируется в их первичной структуре (аминокислотной последовательности), является кинетически доступной и стабильной в ряде (близких) физиологических условий и, следовательно, может рассматриваться как нативное состояние таких «упорядоченных» белков.
В последующие десятилетия, однако, многие крупные белковые области не могли быть отнесены к рентгеновским наборам данных, что указывает на то, что они занимают несколько позиций, которые усредняются на картах электронной плотности.Отсутствие фиксированных уникальных положений относительно кристаллической решетки предполагало, что эти области были «неупорядоченными». Спектроскопия ядерного магнитного резонанса белков также продемонстрировала наличие больших гибких линкеров и концов во многих решенных структурных ансамблях. Сейчас общепринято, что белки существуют как ансамбль подобных структур с некоторыми областями более ограниченными, чем другие. Внутренне неструктурированные белки (IUP) занимают крайний конец этого спектра гибкости, тогда как IDP также включают белки со значительной тенденцией к локальной структуре или гибкими многодоменными сборками.Эти высокодинамичные неупорядоченные области белков впоследствии были связаны с функционально важными явлениями, такими как аллостерическая регуляция и ферментативный катализ.
Многие неупорядоченные белки обладают аффинностью связывания со своими рецепторами, регулируемыми посттрансляционной модификацией, поэтому было высказано предположение, что гибкость неупорядоченных белков облегчает различные конформационные требования для связывания модифицирующих ферментов, а также их рецепторов. Внутреннее нарушение особенно обогащено белками, участвующими в передаче клеточных сигналов, транскрипции и ремоделировании хроматина.
Гибкие линкерыНеупорядоченные области часто встречаются в виде гибких линкеров или петель, соединяющих домены. Линкерные последовательности сильно различаются по длине, но обычно богаты полярными незаряженными аминокислотами. Гибкие линкеры позволяют соединяющим доменам свободно скручиваться и вращаться, чтобы рекрутировать своих связывающих партнеров через динамику белковых доменов. Они также позволяют своим партнерам по связыванию вызывать крупномасштабные конформационные изменения с помощью аллостерии на большие расстояния.
Линейные мотивыЛинейные мотивы — это короткие неупорядоченные сегменты белков, которые опосредуют функциональные взаимодействия с другими белками или другими биомолекулами (РНК, ДНК, сахарами и т. Д.).). Многие роли линейных мотивов связаны с клеточной регуляцией, например, с контролем формы клеток, субклеточной локализацией отдельных белков и регулируемым обменом белков. Часто посттрансляционные модификации, такие как фосфорилирование, настраивают сродство (не редко на несколько порядков величины) отдельных линейных мотивов для специфических взаимодействий. В отличие от глобулярных белков IDP не имеют пространственно расположенных активных карманов. Тем не менее, в 80% IDP (~ 3 дюжины), подвергнутых детальной структурной характеристике с помощью ЯМР, присутствуют линейные мотивы, называемые PreSMos (предварительно структурированные мотивы), которые являются временными вторичными структурными элементами, примированными для распознавания мишени.В нескольких случаях было продемонстрировано, что эти временные структуры становятся полными и стабильными вторичными структурами, например спиралями, после связывания мишени. Следовательно, PreSMos являются предполагаемыми активными сайтами IDP.
Фальцовка и переплет с сопряжениемМногие неструктурированные белки переходят в более упорядоченные состояния при связывании со своими мишенями. Спаренная укладка и связывание могут быть локальными и включать только несколько взаимодействующих остатков, или они могут включать весь домен белка.Недавно было показано, что спаренная укладка и связывание позволяют захоронить большую площадь поверхности, что было бы возможно только для полностью структурированных белков, если бы они были намного больше. Более того, определенные неупорядоченные области могут служить «молекулярными переключателями» в регуляции определенных биологических функций, переключаясь на упорядоченную конформацию при молекулярном распознавании, например, при связывании малых молекул, связывании ДНК / РНК, ионных взаимодействиях.
Нарушение связанного состояния (нечеткие комплексы)Внутренне неупорядоченные белки могут сохранять свою конформационную свободу, даже если они специфически связываются с другими белками.Структурный беспорядок в связанном состоянии может быть статическим или динамическим. В нечетких комплексах структурная множественность необходима для функционирования, и манипулирование связанной неупорядоченной областью изменяет активность. Конформационный ансамбль комплекса модулируется посредством посттрансляционных модификаций или белковых взаимодействий. Специфичность ДНК-связывающих белков часто зависит от длины нечетких областей, которая варьируется путем альтернативного сплайсинга. Внутренне неупорядоченные белки адаптируют множество различных структур in vivo в соответствии с условиями клетки, создавая структурный или конформационный ансамбль.
Следовательно, их структуры сильно зависят от функций. Однако только несколько белков полностью неупорядочены в своем нативном состоянии. Нарушение в основном обнаруживается в внутренне неупорядоченных областях (IDR) внутри хорошо структурированного белка. Термин «внутренне неупорядоченный белок» (IDP), следовательно, включает белки, которые содержат IDR, а также полностью неупорядоченные белки.
Наличие и вид белкового нарушения кодируется его аминокислотной последовательностью.В целом, IDP характеризуются низким содержанием объемных гидрофобных аминокислот и высокой долей полярных и заряженных аминокислот, обычно называемой низкой гидрофобностью. Это свойство приводит к хорошему взаимодействию с водой. Кроме того, высокие чистые заряды способствуют беспорядку из-за электростатического отталкивания, возникающего из-за одинаково заряженных остатков. Таким образом, неупорядоченные последовательности не могут в достаточной степени скрыть гидрофобное ядро, чтобы сложиться в стабильные глобулярные белки. В некоторых случаях гидрофобные кластеры в неупорядоченных последовательностях дают ключи для идентификации областей, которые подвергаются сопряженной укладке и связыванию (см. Биологические роли).
Многие неупорядоченные белки обнаруживают области без какой-либо регулярной вторичной структуры. Эти области можно назвать гибкими по сравнению со структурированными петлями. В то время как последние являются жесткими и содержат только один набор углов Рамачандрана, IDP включают несколько наборов углов. Термин гибкость также используется для хорошо структурированных белков, но описывает другое явление в контексте неупорядоченных белков. Гибкость структурированных белков связана с равновесным состоянием, в то время как у ВПЛ это не так.Многие неупорядоченные белки также обнаруживают последовательности низкой сложности, то есть последовательности с избыточным представлением нескольких остатков. В то время как последовательности низкой сложности являются сильным признаком нарушения, обратное не обязательно верно, то есть не все неупорядоченные белки имеют последовательности низкой сложности. Неупорядоченные белки имеют низкое содержание предсказанной вторичной структуры.
назад к началу2.6 Сворачивание, денатурация и гидролиз белков
Сворачивание белка — это физический процесс, посредством которого белковая цепь приобретает свою естественную трехмерную структуру, конформацию, которая обычно является биологически функциональной, быстрым и воспроизводимым образом (Рисунок 2.36). Это физический процесс, с помощью которого полипептид сворачивается в свою характерную и функциональную трехмерную структуру из случайного клубка. Каждый белок существует в виде развернутого полипептида или случайной спирали при трансляции из последовательности мРНК в линейную цепочку аминокислот. У этого полипептида отсутствует какая-либо стабильная (долговечная) трехмерная структура (левая часть первого рисунка). Поскольку полипептидная цепь синтезируется рибосомой, линейная цепь начинает складываться в свою трехмерную структуру.Сворачивание начинает происходить даже при трансляции полипептидной цепи. Аминокислоты взаимодействуют друг с другом, образуя четко определенную трехмерную структуру, свернутый белок (правая часть рисунка), известный как нативное состояние. Полученная трехмерная структура определяется аминокислотной последовательностью или первичной структурой (догма Анфинсена).
Рисунок 2.36 Белок до и после сворачивания
Автор изображения: DrKjaergaard
Правильная трехмерная структура важна для функционирования, хотя некоторые части функциональных белков могут оставаться развернутыми или, как в случае IDP, оставаться гибкими, поэтому важна динамика белков.Неспособность свернуться в нативную структуру обычно приводит к образованию неактивных белков, но в некоторых случаях неправильно свернутые белки имеют модифицированную или токсичную функциональность. Считается, что несколько нейродегенеративных и других заболеваний являются результатом накопления неправильно свернутых белков, таких как амилоидные фибриллы, обнаруженные у пациентов с болезнью Альцгеймера.
Сворачивание — это спонтанный процесс, который в основном управляется гидрофобными взаимодействиями, образованием внутримолекулярных водородных связей, силами Ван-дер-Ваальса, и ему противостоит конформационная энтропия.Процесс сворачивания часто начинается совместно с трансляцией, так что N-конец белка начинает сворачиваться, в то время как C-концевой участок белка все еще синтезируется рибосомой; однако молекула белка может самопроизвольно складываться во время или после биосинтеза. Хотя эти макромолекулы можно рассматривать как «сворачивающиеся сами по себе», процесс также зависит от растворителя (вода или липидный бислой), концентрации солей, pH, температуры, возможного присутствия кофакторов и молекулярных шаперонов.Белки будут иметь ограничения на их способность к складыванию из-за ограниченных углов изгиба или возможных конформаций, как описано в графике Рамачандрана.
Рисунок 2.37 Гидрофобный коллапс. В компактной складке (справа) гидрофобные аминокислоты (показаны черными сферами) схлопываются к центру, чтобы защитить себя от водной среды.
Автор изображения: Tomixdf
Сворачивание белка должно быть термодинамически благоприятным внутри клетки, чтобы реакция была спонтанной.Поскольку известно, что сворачивание белка является спонтанной реакцией, оно должно принимать отрицательное значение свободной энергии Гиббса. Свободная энергия Гиббса при сворачивании белка напрямую связана с энтальпией и энтропией. Для возникновения отрицательного значения ΔG и для того, чтобы сворачивание белка стало термодинамически благоприятным, тогда либо энтальпия, либо энтропия, либо оба условия должны быть благоприятными.
Сведение к минимуму количества гидрофобных боковых цепей, подверженных воздействию воды, является важной движущей силой процесса складывания. Гидрофобный эффект (рис. 2.37) — это явление, при котором гидрофобные цепи белка схлопываются в ядро белка (вдали от гидрофильной среды). В водной среде молекулы воды имеют тенденцию к агрегированию вокруг гидрофобных областей или боковых цепей белка, создавая водные оболочки из упорядоченных молекул воды. Упорядочение молекул воды вокруг гидрофобной области увеличивает порядок в системе и, следовательно, способствует отрицательному изменению энтропии (уменьшению энтропии в системе).Молекулы воды фиксируются в этих водных клетках, что приводит к гидрофобному коллапсу или сворачиванию внутрь гидрофобных групп (рис. 2.38).
Рис. 2.38. Образование клатрата воды. Хлороформ является гидрофобным соединением, поэтому, когда он растворяется в воде с образованием гидрата, гидрофобная гидратация сопровождается отрицательным изменением энтропии из-за повышенного порядка в окружающей воде и положительного изменения теплоемкости, часто вызывая положительное ΔG. Подобные водные клетки могут объединяться вокруг гидрофобных белковых остатков перед правильным сворачиванием.
Гидрофобный коллапс возвращает энтропию в систему за счет разрушения водяных клеток, что освобождает упорядоченные молекулы воды. Множество гидрофобных групп, взаимодействующих внутри ядра глобулярно свернутого белка, вносит значительный вклад в стабильность белка после сворачивания из-за сильно накопленных сил Ван-дер-Ваальса (особенно сил Лондонской дисперсии).Гидрофобный эффект существует как движущая сила в термодинамике только при наличии водной среды с амфифильной молекулой, содержащей большую гидрофобную область. Прочность водородных связей зависит от их окружения; таким образом, водородные связи, заключенные в гидрофобное ядро, вносят больший вклад, чем водородные связи, находящиеся в водной среде, для стабильности нативного состояния.
ШапероныМолекулярные шапероны представляют собой класс белков, которые помогают в правильном сворачивании других белков in vivo (Рисунок 2.39). Шапероны существуют во всех клеточных компартментах и взаимодействуют с полипептидной цепью, чтобы позволить сформироваться нативной трехмерной конформации белка; однако сами шапероны не включены в окончательную структуру белка, которому они помогают. Шапероны могут способствовать сворачиванию, даже когда возникающий полипептид синтезируется рибосомой. Молекулярные шапероны действуют путем связывания для стабилизации нестабильной в других отношениях структуры белка в его пути фолдинга, но шапероны не содержат необходимой информации, чтобы знать правильную нативную структуру белка, которому они помогают; скорее, шапероны работают, предотвращая неправильные складчатые конформации.
Рис. 2.39. Вид сверху комплекса бактериальных шаперонов GroES / GroEL, модель
Автор изображения: Википедия
Таким образом, шапероны на самом деле не увеличивают частоту отдельных шагов, участвующих в пути сворачивания к нативной структуре; вместо этого они работают, уменьшая возможные нежелательные агрегации полипептидной цепи, которые в противном случае могли бы замедлить поиск подходящего промежуточного соединения, и они обеспечивают более эффективный путь для полипептидной цепи, чтобы принять правильные конформации.Шапероны не следует путать с катализаторами сворачивания, которые на самом деле катализируют медленные в противном случае этапы пути сворачивания. Примерами катализаторов фолдинга являются протеин-дисульфидные изомеразы и пептидил-пролилизомеразы, которые могут участвовать в образовании дисульфидных связей или взаимном превращении между цис- и транс- стереоизомерами соответственно.
Показано, что шапероныимеют решающее значение в процессе сворачивания белка in vivo , потому что они обеспечивают белок с помощью, необходимой для принятия его надлежащих выравниваний и конформаций, достаточно эффективно, чтобы стать «биологически релевантными».Это означает, что полипептидная цепь теоретически может складываться в свою нативную структуру без помощи шаперонов, как продемонстрировали эксперименты по укладке белков, проведенные in vitro ; , однако, этот процесс оказывается слишком неэффективным или слишком медленным, чтобы существовать в биологических системах; следовательно, шапероны необходимы для сворачивания белка in vivo. Показано, что наряду со своей ролью в содействии формированию нативных структур, шапероны участвуют в различных ролях, таких как транспорт белков, деградация, и даже позволяют денатурированным белкам, подвергающимся воздействию определенных внешних денатурирующих факторов, возможность перекомпоноваться в их правильные нативные структуры.
Денатурация белкаПолностью денатурированный белок не имеет ни третичной, ни вторичной структуры, однако последовательность первичного белка остается нетронутой, и белок существует в виде случайной спирали (рис. 2.39). При определенных условиях некоторые белки могут складываться заново; однако во многих случаях денатурация необратима. Клетки иногда защищают свои белки от денатурирующего воздействия тепла с помощью ферментов, известных как белков теплового шока (тип шаперона), , которые помогают другим белкам как в сворачивании, так и в том, чтобы оставаться свернутыми (Рисунок 2.40). Белки теплового шока экспрессируются в ответ на повышенные температуры или другие стрессы. Некоторые белки вообще никогда не сворачиваются в клетках, кроме как с помощью шаперонов, которые либо изолируют отдельные белки, чтобы их сворачивание не прерывалось взаимодействиями с другими белками, либо помогают разворачивать неправильно свернутые белки, позволяя им повторно складываться в правильную нативную структуру. Эта функция имеет решающее значение для предотвращения риска осаждения в нерастворимые аморфные агрегаты.
Рисунок 2.40 Денатурация белка. На рисунке (1) изображен правильно свернутый интактный белок. На этапе (2) к системе подводится тепло, превышающее порог поддержания внутримолекулярных белковых взаимодействий. На этапе (3) показан развернутый или денатурированный белок. Цветные области денатурированного белка соответствуют окрашенным областям природного свернутого белка, показанного на (1).
Диаграмма предоставлена: Scurran15
К внешним факторам, участвующим в денатурации белка или нарушении нативного состояния, относятся температура, внешние поля (электрические, магнитные), скученность молекул и даже ограничение пространства, которые могут иметь большое влияние на сворачивание белков.Высокие концентрации растворенных веществ, экстремальные значения pH, механические силы и присутствие химических денатурирующих веществ также могут способствовать денатурации белка. Эти отдельные факторы вместе классифицируются как стрессы. Показано, что шапероны существуют в возрастающих концентрациях во время клеточного стресса и помогают правильному сворачиванию возникающих белков, а также денатурированных или неправильно свернутых.
При некоторых условиях белки не будут сворачиваться в свои биохимически функциональные формы.Температуры выше или ниже диапазона, в котором обычно живут клетки, вызывают разворачивание или денатурирование термически нестабильных белков (вот почему кипячение делает яичный белок непрозрачным). Однако термостабильность белков далеко не постоянна; например, были обнаружены гипертермофильные бактерии, которые растут при температурах до 122 ° C, что, конечно, требует, чтобы их полный набор жизненно важных белков и белковых ансамблей был стабильным при этой температуре или выше.
ГидолизГидролиз — это разрушение последовательности первичного белка путем добавления воды для преобразования отдельных мономерных звеньев аминокислот (Рисунок 2.41).
Рисунок 2.41 Гидролиз белков. В реакции гидролиза вода добавляется через амидную связь, включающую группу -ОН с карбонильным углеродом и реформируя карбоновую кислоту. Водород из воды преобразовывает амин.
Белки участвуют во многих клеточных функциях. Белки могут действовать как ферменты, которые увеличивают скорость химических реакций. Фактически, 99% ферментативных реакций внутри клетки опосредуются белками.Таким образом, они являются неотъемлемой частью процессов создания или разрушения клеточных компонентов. Белки также могут действовать как структурный каркас внутри клетки, помогая поддерживать клеточную форму. Белки также могут участвовать в клеточной передаче сигналов и коммуникации, а также в переносе молекул из одного места в другое. В экстремальных условиях, таких как голодание, белки также могут использоваться в качестве источника энергии внутри клетки.
назад к началу2.7 источников
OpenStax, Белки. OpenStax CNX. 30 сентября 2016 г. http://cnx.org/contents/bf17f4df-605c-4388-88c2-25b0f000b0ed@2.
Файл: Хиральность руками.jpg. (2017, 16 сентября). Wikimedia Commons, бесплатное хранилище мультимедиа . Получено 17:34, 10 июля 2019 г. с сайта https://commons.wikimedia.org/w/index.php?title=File:Chirality_with_hands.jpg&oldid=258750003.
участников Википедии. (2019, 6 июля). Цвиттерион. В Википедия, Бесплатная энциклопедия .Получено 21:48, 10 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Zwitterion&oldid=9721
.участников Википедии. (2019, 8 июля). Абсолютная конфигурация. В Википедия, Бесплатная энциклопедия . Получено в 15:28, 14 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Absolute_configuration&oldid=2423
.Структурная биохимия / фермент / активный сайт. (2019, 1 июля). Викиучебники, проект бесплатного учебника . Получено 16:55, 16 июля 2019 г., с сайта https: // en.wikibooks.org/w/index.php?title=Structural_Biochemistry/Enzyme/Active_Site&oldid=3555410.
Структурная биохимия / Белки. (2019, 24 марта). Викиучебники, проект бесплатного учебника . Получено в 19:16, 18 июля 2019 г., с сайта https://en.wikibooks.org/w/index.php?title=Structural_Biochemistry/Proteins&oldid=3529061.
Fujiwara, K., Toda, H., and Ikeguchi, M. (2012) Зависимость аминокислотной склонности α-спирали и β-складки от общего типа белковой складки. BMC Структурная биология 12:18.Доступно по адресу: https://bmcstructbiol.biomedcentral.com/track/pdf/10.1186/1472-6807-12-18
участников Википедии. (2019, 16 июля). Кератин. В Википедия, Бесплатная энциклопедия . Получено 17:50, 19 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Keratin&oldid=8340
.участников Википедии. (2019, 13 июля). Альфа-кератин. В Википедия, Бесплатная энциклопедия . Получено в 18:17, 19 июля 2019 г., с https://en.wikipedia.org/w/index.php? title = Альфа-кератин & oldid =7410
Инициатива открытого обучения. (2019) Покровные уровни организации. Университет Карнеги Меллон. В анатомии и физиологии. Доступно по адресу: https://oli.cmu.edu/jcourse/webui/syllabus/module.do?context=43480020ca6010f804da8baf7ba.
участников Википедии. (2019, 16 июля). Коллаген. В Википедия, Бесплатная энциклопедия . Получено в 03:42, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Collagen&oldid=9954
.участников Википедии.(2019, 2 июля). Россманн фолд. В Википедия, Бесплатная энциклопедия . Получено в 16:01, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Rossmann_fold&oldid=8788
.участников Википедии. (2019, 30 мая). Ствол ТИМ. В Википедия, Бесплатная энциклопедия . Получено в 16:46, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=TIM_barrel&oldid=899459569
.участников Википедии. (2019, 16 июля). Сворачивание белков. В Википедия, Бесплатная энциклопедия .Получено 18:30, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Protein_folding&oldid=4145
.участников Википедии. (2019, 11 июня). Глобулярный белок. В Википедия, Бесплатная энциклопедия . Получено в 18:49, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Globular_protein&oldid=0467
.участников Википедии. (2019, 11 июля). Внутренне неупорядоченные белки. В Википедия, Бесплатная энциклопедия . Получено 19:52, 20 июля 2019 г., с https: // en.wikipedia.org/w/index.php?title=Intrinsically_disordered_proteins&oldid=2287
.
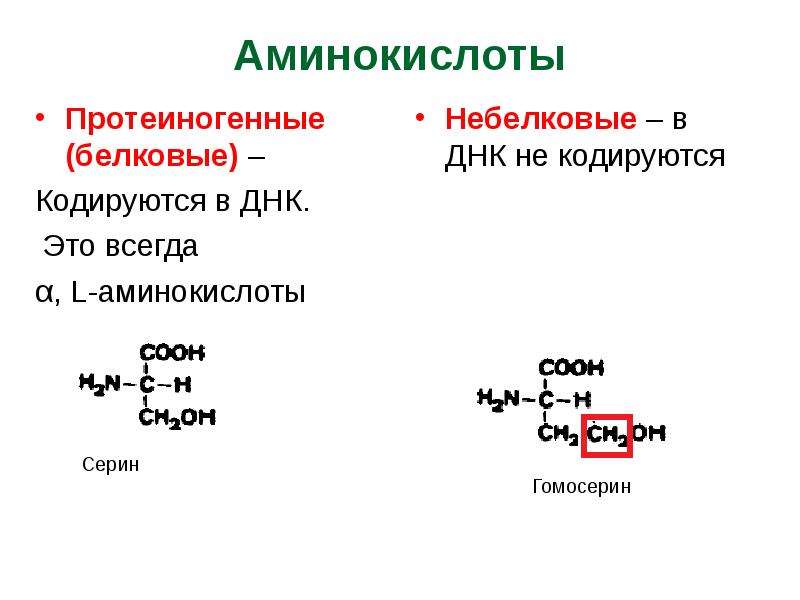
 PEG-PAL — это пегилированный инъекционный состав аммиаклиазы фенилаланина, который исследуется в клинических условиях на людях с фенилкетонурией. В данный момент PEG-PAL еще не утвержден как официальное терапевтическое средство.
PEG-PAL — это пегилированный инъекционный состав аммиаклиазы фенилаланина, который исследуется в клинических условиях на людях с фенилкетонурией. В данный момент PEG-PAL еще не утвержден как официальное терапевтическое средство.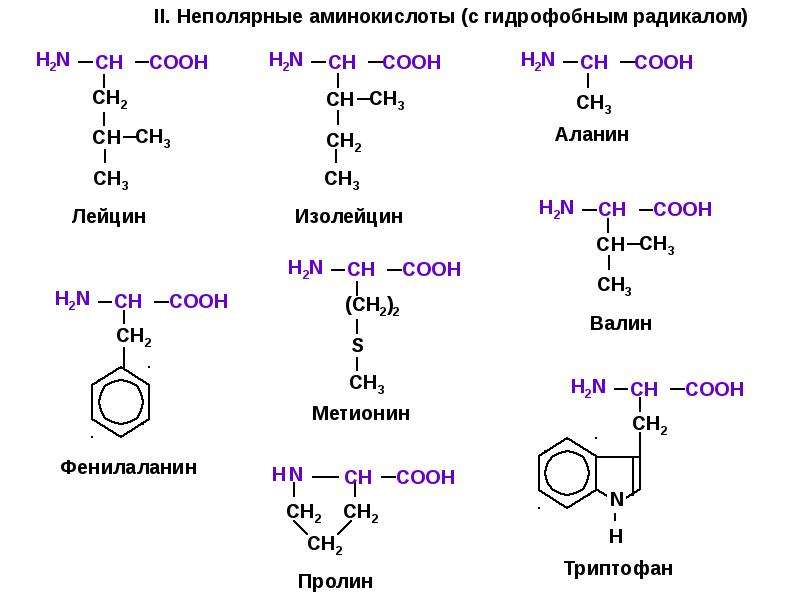 Люди, которые страдают фенилкетонурией и соблюдают диету с низким содержанием фенилаланина, не могут получать с пищей достаточное количество белков; для получения незаменимых аминокислот им могут потребоваться продукты лечебного питания
Люди, которые страдают фенилкетонурией и соблюдают диету с низким содержанием фенилаланина, не могут получать с пищей достаточное количество белков; для получения незаменимых аминокислот им могут потребоваться продукты лечебного питания Например, у пациентов с одной мутированной и одной нормальной копией фенилаланингидроксилазы (один из родителей является носителем мутации гена) не выражается клинический фенотип фенилкетонурии, характеризуемый гиперфенилаланинемией . Наследование двух мутированных копий (по одной от каждого родителя) в результате будет выражено фенотипом фенилкетонурии.
Например, у пациентов с одной мутированной и одной нормальной копией фенилаланингидроксилазы (один из родителей является носителем мутации гена) не выражается клинический фенотип фенилкетонурии, характеризуемый гиперфенилаланинемией . Наследование двух мутированных копий (по одной от каждого родителя) в результате будет выражено фенотипом фенилкетонурии.
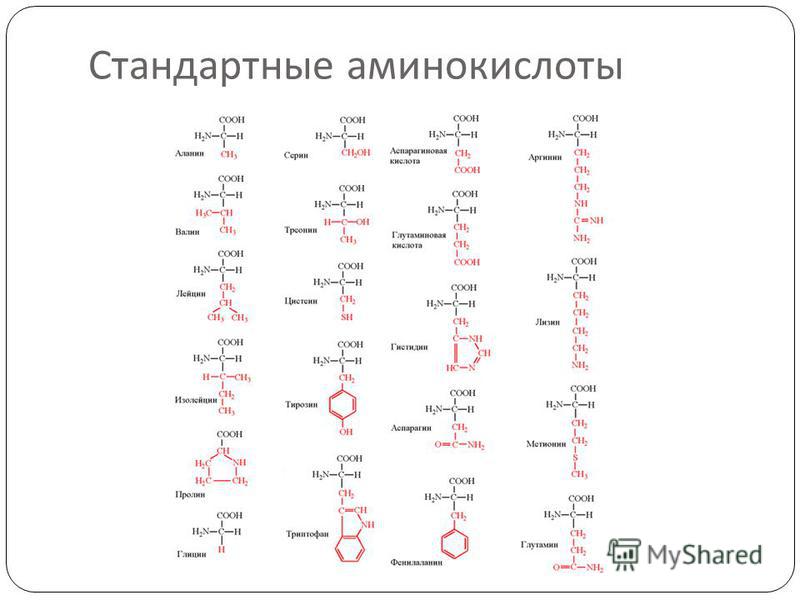
 Например, в экспериментальных исследованиях производится поиск метода генной терапии, который позволит создать рабочую копию фенилаланингидроксилазы для пациентов с фенилкетонурией, которые страдают от недостатка этого фермента . Однако, в настоящее время эти исследования являются теоретическими, а использование их результатов для лечения фенилкетонурии возможно лишь в далеком будущем.
Например, в экспериментальных исследованиях производится поиск метода генной терапии, который позволит создать рабочую копию фенилаланингидроксилазы для пациентов с фенилкетонурией, которые страдают от недостатка этого фермента . Однако, в настоящее время эти исследования являются теоретическими, а использование их результатов для лечения фенилкетонурии возможно лишь в далеком будущем. У пациентов с фенилкетонурии часто наблюдаются разные мутации в каждой копии гена фенилаланингидроксилазы .
У пациентов с фенилкетонурии часто наблюдаются разные мутации в каждой копии гена фенилаланингидроксилазы . При этом наблюдается слегка повышенный уровень фенилаланина в крови, который является недостаточным для диагностирования фенилкетонурии и, как правило, не требует лечения.
При этом наблюдается слегка повышенный уровень фенилаланина в крови, который является недостаточным для диагностирования фенилкетонурии и, как правило, не требует лечения.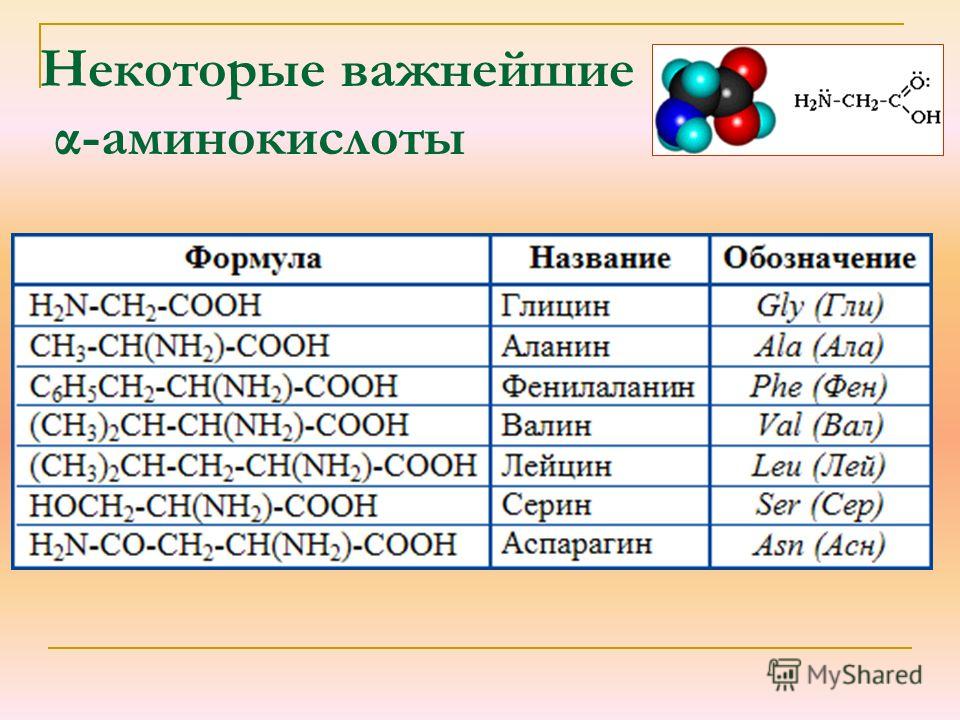 Измерение двигательных навыков иногда назначается в качестве нейропсихологических тестов , для того чтобы следить за развитием людей с фенилкетонурией.
Измерение двигательных навыков иногда назначается в качестве нейропсихологических тестов , для того чтобы следить за развитием людей с фенилкетонурией. Диарея может быть вызвана разными факторами: у больных фенилкетонурией причиной диареи может быть сохранение низких концентраций фенилаланина в крови в течение длительного времени. Более длительный период низких концентраций фенилаланина может привести к снижению скорости роста, атрофии кожи (которое можно ошибочно принять за экзему) и диарее, которая может свидетельствовать о слабой функции кишечника или неспособности кишечника синтезировать новые клетки. С другой стороны, диарея, так же как рвота или повышение температуры, может стать причиной катаболизма и последующего повышения концентрации фенилаланина в крови.
Диарея может быть вызвана разными факторами: у больных фенилкетонурией причиной диареи может быть сохранение низких концентраций фенилаланина в крови в течение длительного времени. Более длительный период низких концентраций фенилаланина может привести к снижению скорости роста, атрофии кожи (которое можно ошибочно принять за экзему) и диарее, которая может свидетельствовать о слабой функции кишечника или неспособности кишечника синтезировать новые клетки. С другой стороны, диарея, так же как рвота или повышение температуры, может стать причиной катаболизма и последующего повышения концентрации фенилаланина в крови.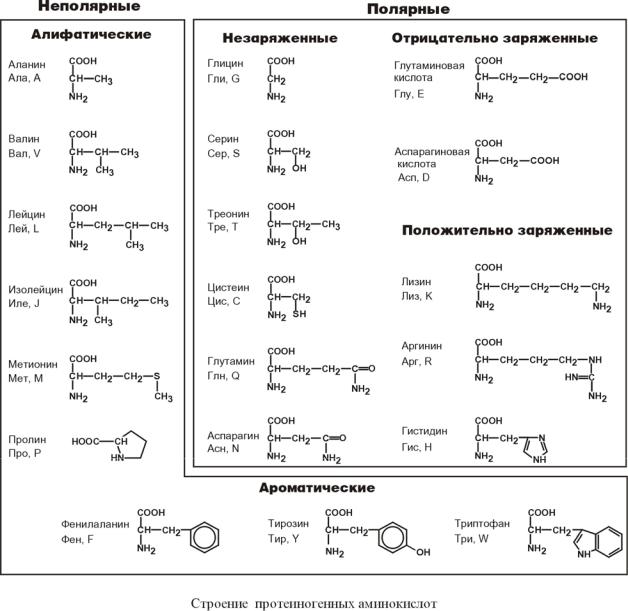

 К исполнительным функциям относятся воля, понимание, суждение, согласованное использование ресурсов (например, памяти) для достижения поставленных целей, планирование задач, разработка стратегий или создание комплекса действий для выполнения более объемной задачи, исправление ошибок, решение проблем, выработка соответствующего поведения с учетом полученной информации, реагирование на действия, которые еще не изучены, надлежащее поведение в ситуациях, в которых требуется преодолеть искушение или силу привычки. Исследования людей с фенилкетонурией выявили ухудшени исполнительной функции в сравнении с людьми, которые не страдают данным заболеванием.
К исполнительным функциям относятся воля, понимание, суждение, согласованное использование ресурсов (например, памяти) для достижения поставленных целей, планирование задач, разработка стратегий или создание комплекса действий для выполнения более объемной задачи, исправление ошибок, решение проблем, выработка соответствующего поведения с учетом полученной информации, реагирование на действия, которые еще не изучены, надлежащее поведение в ситуациях, в которых требуется преодолеть искушение или силу привычки. Исследования людей с фенилкетонурией выявили ухудшени исполнительной функции в сравнении с людьми, которые не страдают данным заболеванием. Вполне вероятно, что у таких пациентов будет развиваться тяжелая форма гиперфенилаланинемии (уровень фенилаланина в крови, как правило, выше 1200 μmol/л) и при этом будет необходима диета с низким содержанием фенилаланина . Для пациентов с классической фенрилкетонурией нехарактерна восприимчивость к лечению сапроптерином .
Вполне вероятно, что у таких пациентов будет развиваться тяжелая форма гиперфенилаланинемии (уровень фенилаланина в крови, как правило, выше 1200 μmol/л) и при этом будет необходима диета с низким содержанием фенилаланина . Для пациентов с классической фенрилкетонурией нехарактерна восприимчивость к лечению сапроптерином .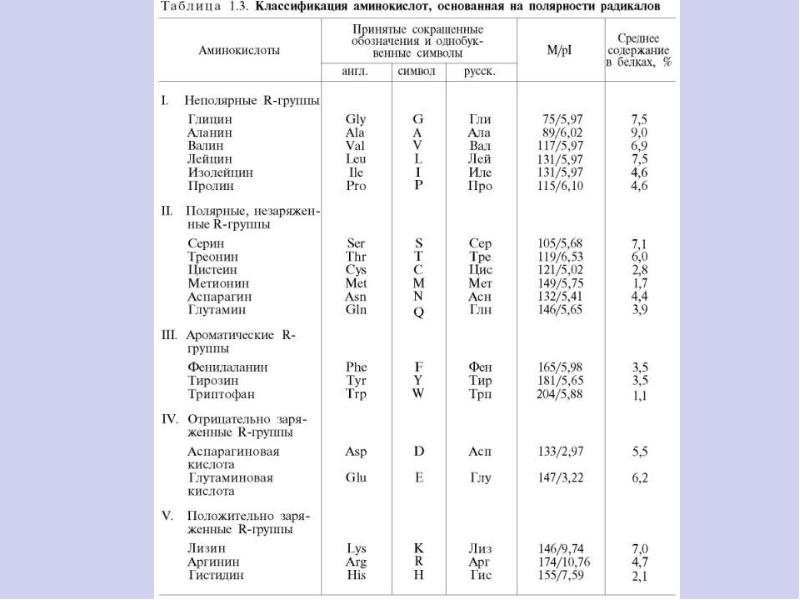

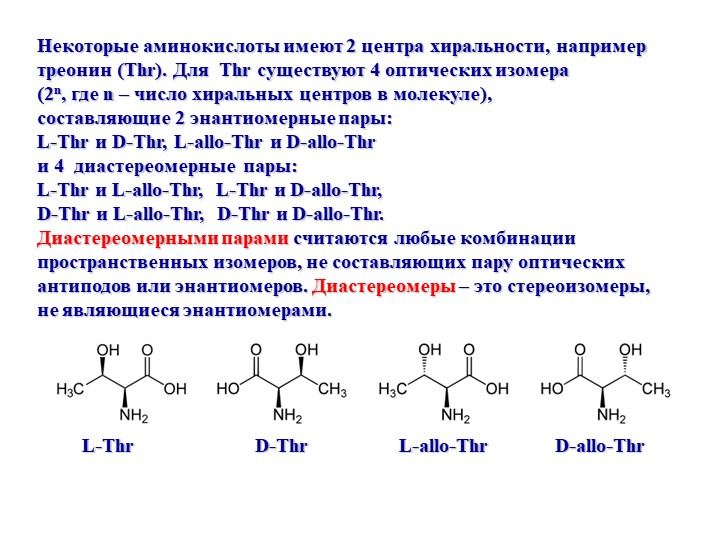 Недостаточная регуляция уровня фенилаланина в крови в течение длительного времени, как известно, может вызвать повреждение миелина в головном мозге. Однако, остается неясным, каким образом данное явление связано с подавлением исполнительных и когнитивных функций, что наблюдается у пациентов с фенилкетонурией.
Недостаточная регуляция уровня фенилаланина в крови в течение длительного времени, как известно, может вызвать повреждение миелина в головном мозге. Однако, остается неясным, каким образом данное явление связано с подавлением исполнительных и когнитивных функций, что наблюдается у пациентов с фенилкетонурией.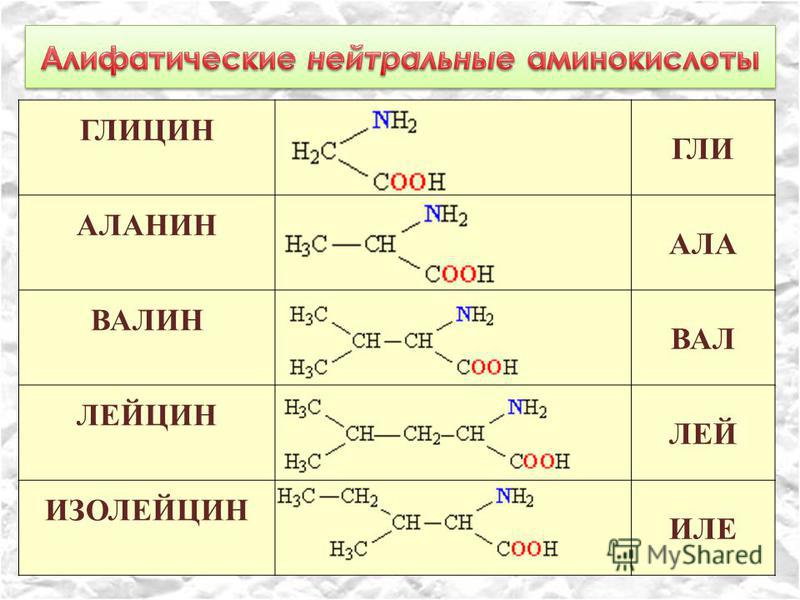 Данная молчащая мутация была описана применительно к фенилаланингидроксилазе .
Данная молчащая мутация была описана применительно к фенилаланингидроксилазе .

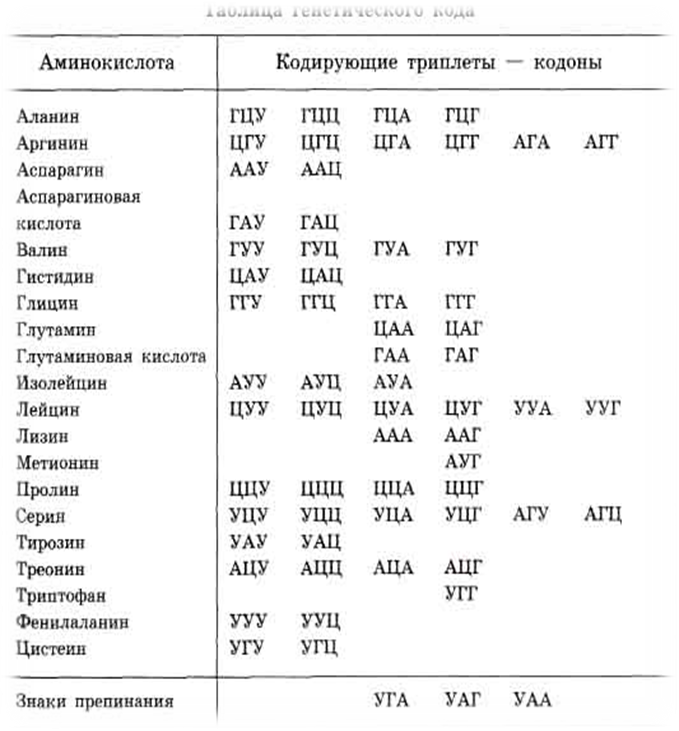
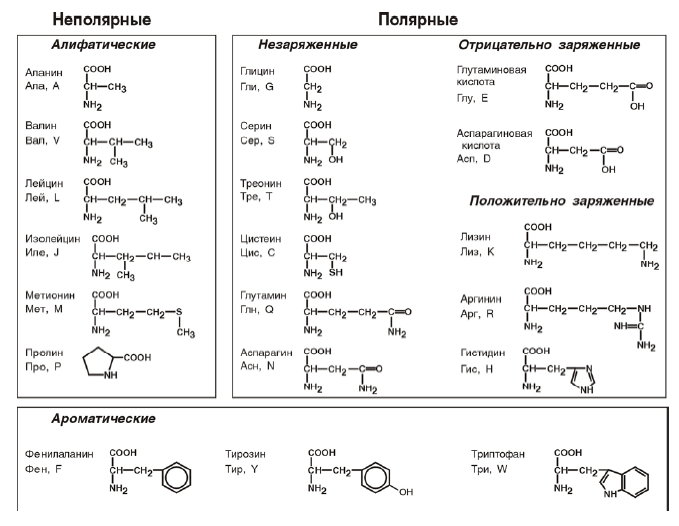 Люди с одной мутацией гена не страдают от фенилкетонурии, однако, они являются носителями мутации. Два носителя мутации гена фенилаланингидроксилазы (который подавляет активность фермента ) в результате получают: — В одном случае из четырех у них рождается ребенок с фенилкетонурией (две мутированные копии гена ),
— в одном случае из четырех у них рождается ребенок без мутаций , вызывающих фенилкетонурию (нет мутированных копий гена), и
— в одном случае из двух у них рождается ребенок-носитель первой или второй мутации .
Люди с одной мутацией гена не страдают от фенилкетонурии, однако, они являются носителями мутации. Два носителя мутации гена фенилаланингидроксилазы (который подавляет активность фермента ) в результате получают: — В одном случае из четырех у них рождается ребенок с фенилкетонурией (две мутированные копии гена ),
— в одном случае из четырех у них рождается ребенок без мутаций , вызывающих фенилкетонурию (нет мутированных копий гена), и
— в одном случае из двух у них рождается ребенок-носитель первой или второй мутации .
 , принимать прописанные лекарства в нужном количестве в нужное время), специальную диету (напр., прием рекомендуемых продуктов питания в правильных количествах и отказ от нежелательных продуктов, и т.д.). Это касается людей с фенилкетонурией, которые соблюдают диету с низким содержанием фенилаланина или проходят сапроптериновую терапию , к примеру. Термины «приверженность лечению» и « соблюдение указаний врача » являются взаимозаменяемыми.
, принимать прописанные лекарства в нужном количестве в нужное время), специальную диету (напр., прием рекомендуемых продуктов питания в правильных количествах и отказ от нежелательных продуктов, и т.д.). Это касается людей с фенилкетонурией, которые соблюдают диету с низким содержанием фенилаланина или проходят сапроптериновую терапию , к примеру. Термины «приверженность лечению» и « соблюдение указаний врача » являются взаимозаменяемыми. Повышение локальной концентрации фенилаланина (в крови младенца, больного гиперфенилаланинемией ) позволяет преодолеть подавление роста бактерий, и в течение одного дня вокруг положительного образца наблюдается рост кольца бактерий. По диаметру бактериальной колонии можно оценить степень концентрации фенилаланина в образце. Во многих странах проба Гатри заменена более новыми методами, например, тандемной масс-спектрометрией.
Повышение локальной концентрации фенилаланина (в крови младенца, больного гиперфенилаланинемией ) позволяет преодолеть подавление роста бактерий, и в течение одного дня вокруг положительного образца наблюдается рост кольца бактерий. По диаметру бактериальной колонии можно оценить степень концентрации фенилаланина в образце. Во многих странах проба Гатри заменена более новыми методами, например, тандемной масс-спектрометрией. При недостатке тетрагидробиоптерина у пациентов измеряются свойства птеринов в моче, для того чтобы определить, у какого из ферментов, участвующих в выработке тетрагидробиоптерина, нарушена функция. См. тж. дефицит тетрагидробиоптерина .
При недостатке тетрагидробиоптерина у пациентов измеряются свойства птеринов в моче, для того чтобы определить, у какого из ферментов, участвующих в выработке тетрагидробиоптерина, нарушена функция. См. тж. дефицит тетрагидробиоптерина . Уровень фенилаланина в крови обычно ниже, чем в случае классической фенилкетонурии, хотя диета с низким содержанием фенилаланинина в большинстве случаев все еще необходима. Люди с остаточной активностью фенилаланингидроксилазы в большей степени поддаются лечению с помощью сапроптерина, чем люди с классической формой фенилкетонурии.
Уровень фенилаланина в крови обычно ниже, чем в случае классической фенилкетонурии, хотя диета с низким содержанием фенилаланинина в большинстве случаев все еще необходима. Люди с остаточной активностью фенилаланингидроксилазы в большей степени поддаются лечению с помощью сапроптерина, чем люди с классической формой фенилкетонурии.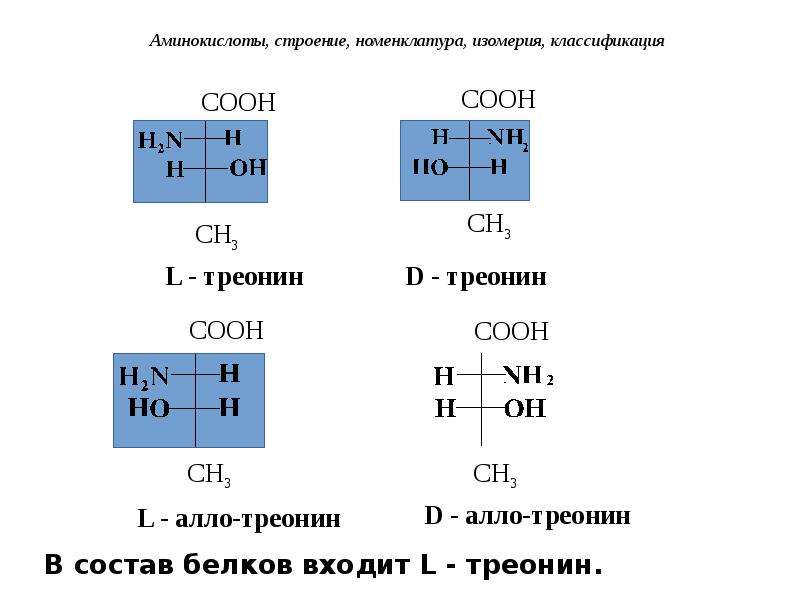 В группе пациентов с фенилкетонурией ( восприимчивый к тетрагидробиоптерину фенотип — обычно, но не обязательно — пациенты с более легкой формой фенилкетонурии), лечение сапроптерином повышает активность фенилаланингидроксилазы и обеспечивает регуляцию фенилаланина в крови.
В группе пациентов с фенилкетонурией ( восприимчивый к тетрагидробиоптерину фенотип — обычно, но не обязательно — пациенты с более легкой формой фенилкетонурии), лечение сапроптерином повышает активность фенилаланингидроксилазы и обеспечивает регуляцию фенилаланина в крови. Если количество пар оснований, которые вставляются или удаляются из ДНК, не кратно трем, то происходит мутация со сдвигом рамки. С этого момента происходит изменение рамки считывания. Например, рассмотрим следующую цепочку РНК, в которой основания показаны как рамка считывания шести нуклеотидов, которые завершаются стоп-кодоном. … UUA UAC AGU AAA GCC UAG Лейцин Тирозин Серин Лизин Аланин СТОП Теперь предположим, что вставляется дополнительное отдельное основание
( миссенс-мутация , выделена красным): … UUC AUA CAG UAA AGC CUA Фенилаланин Изолейцин Глутамин СТОП Не считан
Если количество пар оснований, которые вставляются или удаляются из ДНК, не кратно трем, то происходит мутация со сдвигом рамки. С этого момента происходит изменение рамки считывания. Например, рассмотрим следующую цепочку РНК, в которой основания показаны как рамка считывания шести нуклеотидов, которые завершаются стоп-кодоном. … UUA UAC AGU AAA GCC UAG Лейцин Тирозин Серин Лизин Аланин СТОП Теперь предположим, что вставляется дополнительное отдельное основание
( миссенс-мутация , выделена красным): … UUC AUA CAG UAA AGC CUA Фенилаланин Изолейцин Глутамин СТОП Не считан : Скрининг новорожденных
: Скрининг новорожденных Это имеет важное значение, в особенности для функции головного мозга, для обеспечения которой требуются и фенилаланин , и тирозин . Для некоторых людей, страдающих фенилкетонурией, достижение нормального соотношения между уровнями фенилаланина и тирозина может быть важнейшим аспектом их лечения с применением диеты с низким содержанием фенилаланина и, в некоторых случаях, продуктов лечебного питания с добавкой тирозина.
Это имеет важное значение, в особенности для функции головного мозга, для обеспечения которой требуются и фенилаланин , и тирозин . Для некоторых людей, страдающих фенилкетонурией, достижение нормального соотношения между уровнями фенилаланина и тирозина может быть важнейшим аспектом их лечения с применением диеты с низким содержанием фенилаланина и, в некоторых случаях, продуктов лечебного питания с добавкой тирозина.
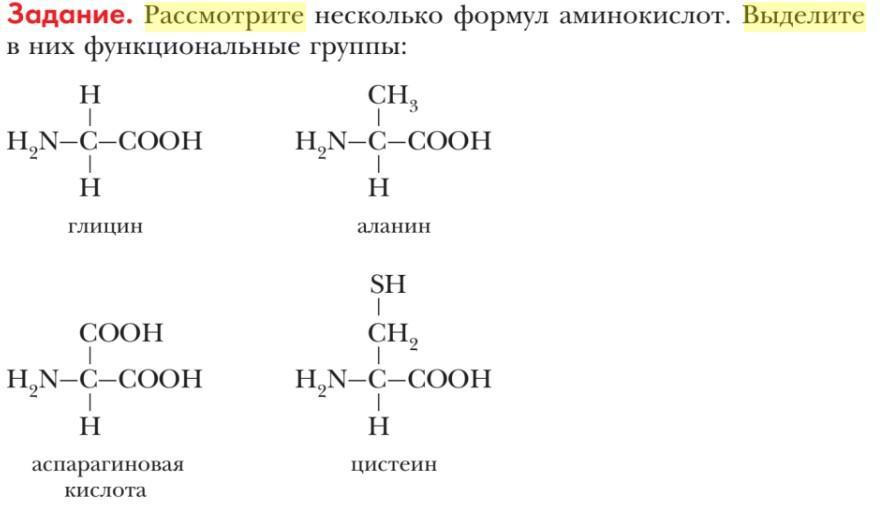
 Показатель уровня фенилаланина в крови используется для диагностики фенилкетонурии и в случае подтверждения — для назначения диеты с низким содержанием фенилаланина или другого лечения фенилкетонурии. Рекомендуемый уровень фенилаланина в крови может изменяться в зависимости от возраста.
Показатель уровня фенилаланина в крови используется для диагностики фенилкетонурии и в случае подтверждения — для назначения диеты с низким содержанием фенилаланина или другого лечения фенилкетонурии. Рекомендуемый уровень фенилаланина в крови может изменяться в зависимости от возраста.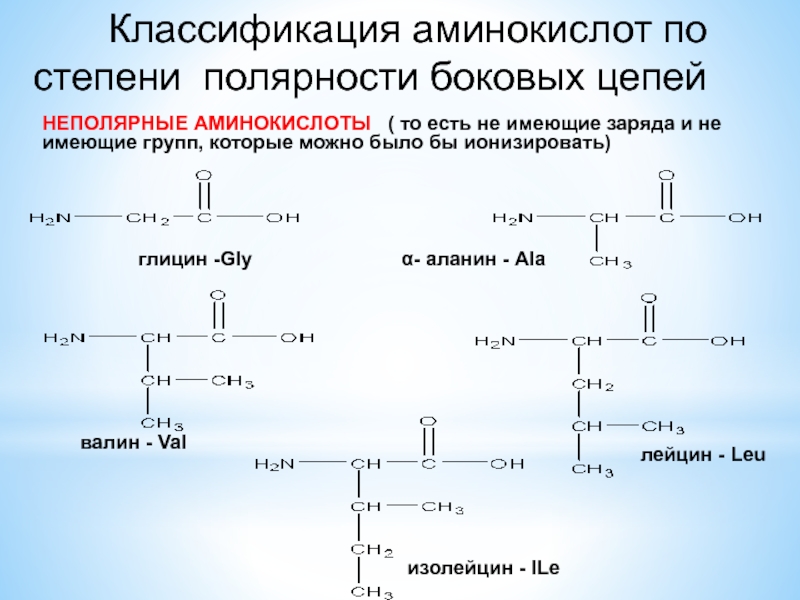 Возникающая вследствие этого концентрация фенилаланина в крови является токсичной для центральной нервной системы , если уровень фенилаланина не регулируется при помощи специальной диеты или другого метода лечения (см. Сапроптерин , Аминокислоты ).
Возникающая вследствие этого концентрация фенилаланина в крови является токсичной для центральной нервной системы , если уровень фенилаланина не регулируется при помощи специальной диеты или другого метода лечения (см. Сапроптерин , Аминокислоты ).