Обмен веществ клетки: Лекция №15 Обмен веществ в клетке — Студопедия
Лекция №15 Обмен веществ в клетке — Студопедия
Обмен веществ(метаболизм) – совокупность протекающих в живых организмах химических превращений, обеспечивающих их рост, жизнедеятельность, воспроизведение, постоянный контакт и обмен с окружающей средой. По субстрату, подлежащему обмену, различают белковый жировой , углеводный обмен, обмен воды и минеральных веществ.
В обмене веществ различают две стороны: ассимиляцию и диссимиляцию.
Ассимиляция – (пластический обмен, анаболизм) – эндотермический процесс уподобления веществ, поступающих в клетку, специфическим веществам самой клетки. Идет в цитоплазме клетки.
Диссимиляция – (энергетический обмен, катаболизм — экзотермический процесс распада веществ клетки до простых неспецифических соединений. Начинается в цитоплазме, заканчивается в митохондриях с образованием энергии.
Этапы энергетического обмена:
I. Подготовительный. Крупные полимеры (белки, жиры, углеводы) распадаются на мономеры (глицерин, высшие жирные кислоты, аминокислоты, глюкозу) в реакциях гидролиза.
II. Бескислородный — происходит гликолиз или молочно – кислое брожение – расщепление глюкозы в цитоплазме клеток до молочной кислоты. Освободившаяся энергия (30%) расходуется на синтез 2 молекул АТФ. У некоторых микроорганизмов , а так же иногда в клетках животных глюкоза может расщепляться до этанола. Остальная энергия рассеивается в виде тепла.
III. Кислородный – универсальный этап, он одинаков для распада аминокислот, глюкозы, высших жирных кислот. Расщепление всех типов органических веществ заканчивается образованием CO2 и H2O. В частности при расщепление 2 молекул молочной кислоты высвобождается энергия и синтезируется 36 молекул АТФ. Происходит в митохондриях, где есть ферменты и атомарный кислород. Весь процесс окисления органических соединений в присутствии О2
Происходит в митохондриях, где есть ферменты и атомарный кислород. Весь процесс окисления органических соединений в присутствии О2
Этапы пластического обмена.
I. Из простых веществ (CO2, H2O, NH3) и множества промежуточных соединений (молочная кислота, глицерин и др.) синтезируется необходимые для организма аминокислоты, высшие жирные кислоты, моносахара, азотные основания.
II. Происходит сборка из мономеров сложных высокомолекурных соединений. белков, жиров, углеводов, нуклеиновых кислот. Эти реакции протекают на мембранах ЭПС и комплекса Гольджи в рибосомах.
По типу ассимиляции выделяют 3 группы организмов:
1) автотрофы
2) гетеротрофы
3) миксотрофы
Условия, обеспечивающие более интенсивный обмен веществ.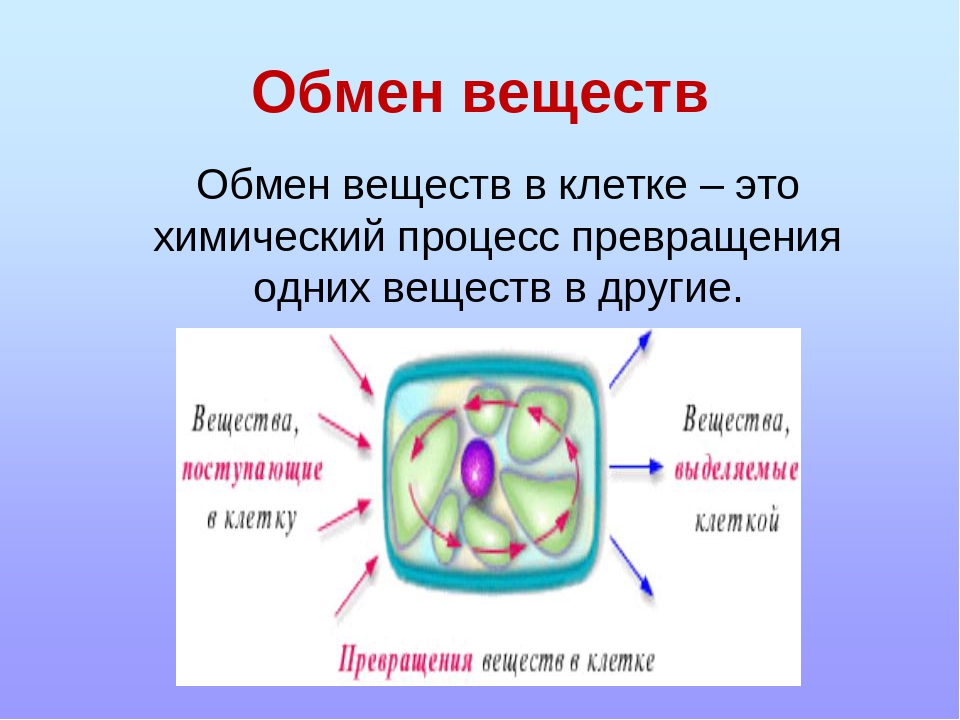
1.Каждая клетка сама синтезирует себе белки, липиды, полисахариды, нуклеиновые кислоты.
2.Каждая реакция, происходящая в клетке, катализируется отдельным ферментом.
3.Ферментные процессы возможны благодаря особому физическому состоянию цитоплазмы, которая представляет собой коллоидный раствор белков.
Ферменты, их группы. Fermentum – закваска (энзим). Известно около 2х тысяч ферментов.
Все химические реакции в клетке идут с участием биологических катализаторов – ферментов. Все ферменты – белки, но не все белки – ферменты. В структуре белков – ферментов выделяют активный центр. Это небольшой участок молекулы белка, на котором идет определенная химическая реакция. Ферменты специфичны. Они катализируют определенные химические реакции и преобразуют строго определенные химические вещества в клетке.
Выделяют несколько групп ферментов: липазы, амилазы, нуклеазы, протеазы, трансферазы, оксидоредуктазы и др. (действуют соответственно на жиры, углеводы, нуклеиновые кислоты, белки;катализируют перенос химических групп с одной молекулы на другую; участвуют в окислении одного субстрата и восстановлении другого).
Условия для действия ферментов.
1.Водная среда.
2.Определенная температура (до 500С).
3.Определенная рН.
4. Оптимальная ионная сила.
5. Гидратная оболочка – поддерживает структуру фермента и его активного центра.
6.Наличие коферментов – веществ небелковой природы (ионы тяжелых металлов, аминокислоты, витамины), входящих в состав активного центра фермента, устойчивы к температуре. Коферменты усиливают активность фермента.
Ферменты действуют на:
1. одно вещество (лактаза только на лактозу)
2. химическую связь (липаза – на жиры)
Нуклеиновые кислоты
Нуклеиновые кислоты были открыты в 1870 году швейцарским биохимиком Ф.Мишером. Он выделил из ядра клетки вещество, содержащее азот и фосфор, и назвал его нуклеином (nucleus – ядро). Позже выявили в нём несколько видов нуклеиновых кислот.
Нуклеиновые кислоты – это природные высокомолекулярные соединения, обеспечивающие хранение, передачу и реализацию наследственной информации в живых организмах.
Виды нуклеиновых кислот:
I. ДНК — дезоксирибонуклеиновая кислота
II. РНК — рибонуклеиновая кислота
ДНК: 1) Двуспиральный полимер, состоящий из мономеров – нуклеотидов.
2) Строение нуклеотида:
а) одно из 4 –х азотистых оснований
пуриновые А – аденин
Г – гуанин
пиримидиновые Т – тимиин
Ц – цитозин
Нуклеотидный состав количественно проанализировал американский биохимик Эдвин Чаргафф (1902 г) и сделал вывод: «число пуриновых оснований всегда равно числу пиримидиновых; количество аденина равно количеству тимина, а гуанина – цитозину (правило Чаргаффа).
Комплиментарные пары азотистых оснований – А =Т, ГºЦ
б) углевод – дезоксирибоза
в) один остаток фосфорной кислоты
3). Локализация в клетке – в хромосомах органеллах цитоплазмы (митохондриях, пластидах, центросоме).
4. Функции: а) хранение наследственной информации
б) передача наследственной информации
в) реализация наследственной информации в ходе биосинтеза белка
РНК. 1. Одно-цепочный полимер, мономером является нуклеотид.
1. Одно-цепочный полимер, мономером является нуклеотид.
2. Строение нуклеотида:
а) одно из четырех азотистых оснований:
б) углевод – рибоза
в) один остаток фосфорной кислоты
3. Локализация в клетке — ядрышко, рибосомы,цитоплазма.
Виды РНК:
1. и-РНК (5% от всей РНК клетки) — содержит информацию о строении белка и состоит из 300 – 3000 нуклеотидов.
Существует в 2х формах:
а) незрелая и-РНК (и-РНК – предшественница, про-и-РНК). Синтезируется на молекуле ДНК. У эукариот включает в себя экзоны (кодирующие участки) и интроны (некодирующие участки). При переходе из ядра в цитоплазму претерпевает процессинг (созревание). У прокариот в процессе созревания происходит укорочение молекулы незрелой и-РНК за счёт «отрезания» её концевых участков. У эукариот созревание происходит за счёт вырезания интронов и «сшивания» оставшихся экзонов. Таким образом, в результате процессинга образуется вторая форма – б)

2. т-РНК (10% от всей РНК клетки) — транспортирует аминокислоты к рибосомам. Состоит из 70 – 100 нуклеотидов. Выделяют 61 вид. Синтезируется в ядрышке.
3.р-РНК (85% от всей РНК клетки) – является структурным компонентом рибосом, контролирует начало и окончание синтеза белковой молекулы. Синтезируется в ядрышке, содержит 3 – 5 тысяч нуклеотидов.
Генетический код
Генетический код – это схема расположения трех нуклеотидов, следующих друг за другом в молекуле ДНК и определяющих место аминокислот в молекуле белка. Начал расшифровку генетического кода Ниренберг.
Основные свойства генетического кода.
1.Генетический код триплетен. Каждую аминокислоту в молекуле белка кодируют три нуклеотида молекулы ДНК – триплет, кодон. Есть таблица всех кодонов.
2.Генетический код избыточен (вырожден). Это значит, что для кодирования 20-и аминокислот существует 64 комбинации триплетов (число сочетаний из 4-х по 3). Одну и ту же аминокислоту могут кодировать несколько триплетов (до 6-и). Они отличаются по последнему (3-му) азотистому основанию.
Одну и ту же аминокислоту могут кодировать несколько триплетов (до 6-и). Они отличаются по последнему (3-му) азотистому основанию.
3. Генетический код коллинеарен. Тип и последовательность триплетов нуклеотидов молекулы ДНК строго соответствует типу и последовательности аминокислот в молекуле белка.
4. Код «не имеет запятых» — непрерывен. Между триплетами нуклеотидов в ДНК нет никаких дополнительных знаков, разделяющих их. Если выпадает или вставляется одно азотистое основание, то считывание идет дальше, т.е. включается в кодон следующее азотистое основание.
5. Генетический код не перекрывается. Считывание информации в гене происходит последовательно триплет за триплетом. Одно и то же азотистое основание не может одновременно входить в два кодона.
6. Генетический код специфичен. Определенную аминокислоту кодируют строго определенные триплеты (кодоны). Реально кодируют аминокислоты 61 триплет. Существует 3 бессмысленных триплета (УАГ, УАА, УГА).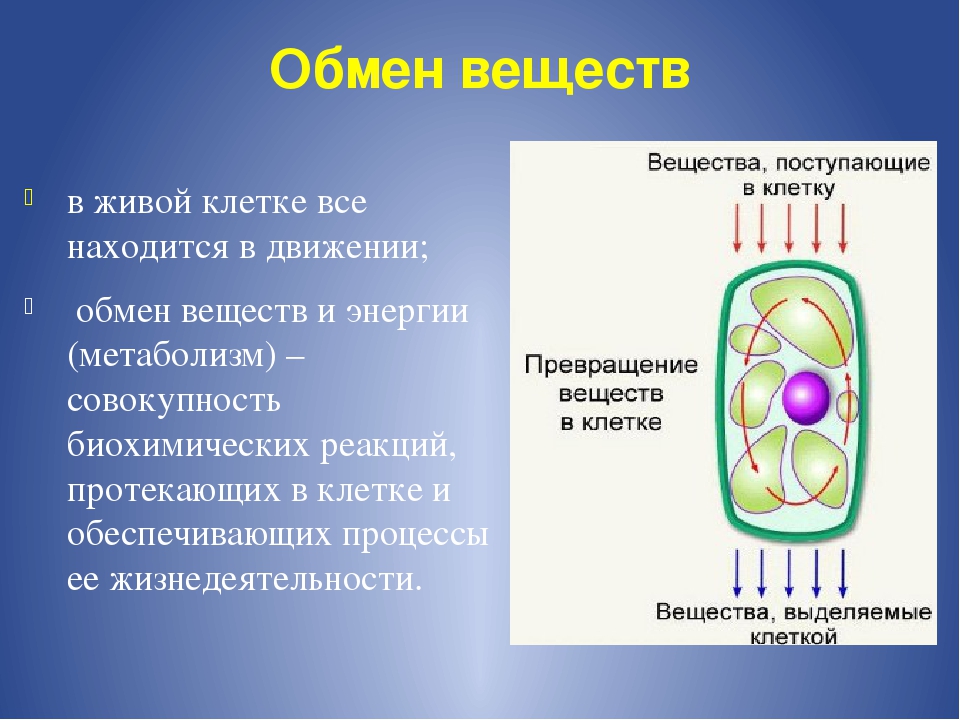 Они не кодируют аминокислоты, но смогут указывать на начало и конец гена, т.е. «точки» генетического кода.
Они не кодируют аминокислоты, но смогут указывать на начало и конец гена, т.е. «точки» генетического кода.
7. Генетический код универсален для всех видов живых организмов на Земле от вирусов и бактерий для человека. Один и тот же триплет нуклеотидов у организмов любого вида кодирует одну и ту же аминокислоту.
Поток информации – перенос информации с ДНК на белок.
Компоненты потока информации:
- Ядро (ДНК хромосом)
- Все виды РНК.
- Аппарат трансляции (рибосомы и полисомы, т-РНК, ферменты активации аминокислот)
- Генетический код.
Этапы биосинтеза белка.
I Транскрипция – переписывание генетической информации с ДНК на РНК. При этом образуются две формы и-РНК: про-и-РНК, незрелая и зрелая и-РНК.
II. Трансляция – расшифровка генетической информации и ее перевод с языка нуклеотидов ДНК и и-РНК на язык аминокислот молекулы белка
Поток энергии — у представителей разных групп организмов представлен внутриклеточными механизмами энергообеспечения – брожением, фото – и хемосинтезом, дыханием.
Поток веществ – метаболические пути расщепления и синтеза углеводов, белков, жиров, нуклеиновых кислот.
Лекция 5. Обмен веществ в клетке — Студопедия
Понятие об обмене веществ в клетке
Классификация организмов по источникам углерода и энергии
Обмен веществ в растительной клетке
Обмен веществ в клетках животного организма
Обмен веществ в клетках микроорганизмов. Хемосинтез и брожение
Понятие об обмене веществ в клетке
Органические, биоорганические и неорганические вещества, входящие в состав живых организмов, образуют устойчивую, обладающую постоянными свойствами открытую систему. Устойчивость этой системе придаетпостоянный поток вещества и энергии, поступающий из окружающей среды. Процесс потребления энергии и вещества называется питанием. В организме пища вовлекается в процесс метаболизма (гр. metabol – изменение) или обмена веществ– комплекс реакций, обеспечивающих живые организмы веществом и энергией. Выделяют энергетический (катаболизм) и пластический (анаболизм) обмены. Реакции распада молекул с выделением энергии, называются энергетическим обменом. Реакции синтеза новых молекул, идущие с поглощением энергии называются пластическим обменом.
metabol – изменение) или обмена веществ– комплекс реакций, обеспечивающих живые организмы веществом и энергией. Выделяют энергетический (катаболизм) и пластический (анаболизм) обмены. Реакции распада молекул с выделением энергии, называются энергетическим обменом. Реакции синтеза новых молекул, идущие с поглощением энергии называются пластическим обменом.
Основным результатом энергетического обмена является образование молекул АТФ из АДФ и фосфата. АТФ (аденозинтрифосфат) – нуклеотид, молекула которого состоит из аденина, рибозы и трёх фосфатных групп. Именно фосфатные связи позволяют запасти в молекуле АТФ столь большое количество энергии. Значение АТФ: а) универсальный аккумулятор солнечной и химической энергии; б) используется как источник энергии в реакциях биосинтеза; в) обеспечивает энергией все виды работ, совершающихся в клетках, тканях, органах.
Реакции пластического и энергетического обмена неразрывно связаны между собой. Все реакции синтеза протекают за счет энергии, которая образуется в ходе распада веществ. Распад веществ идет с помощью ферментов, которые образуются в процессе анаболизма.
Все реакции синтеза протекают за счет энергии, которая образуется в ходе распада веществ. Распад веществ идет с помощью ферментов, которые образуются в процессе анаболизма.
За счет обмена веществ осуществляется как жизнедеятельность организмов, так и круговорот веществ и поток энергии в биосфере.
Болезни и изменения клеточного метаболизма
Нейродегенеративные и онкологические болезни — самые распространенные возрастные патологии после болезней сердца и сосудов. Как показывают исследования, эти патологии тесным образом связаны с энергетическим обменом и митохондриальной дисфункцией. Детальное и масштабное изучение изменений клеточного метаболизма при развитии этих патологий способствует разработке более совершенных диагностических инструментов, позволяющих обнаруживать заболевание на самой ранней его стадии.
Спецпроект о клеточном энергетическом метаболизме, работе митохондрий и АТФ, а также о заболеваниях, связанных с нарушениями функций клеточных «батареек».
Спонсор спецпроекта — «БиоХимМак» — поставщик научного и медицинского оборудования в лаборатории России и стран СНГ.
Наверное, у каждого, кто начинает знакомиться с удивительной организацией наших клеток, возникает чувство восхищения невероятной сложностью внутриклеточного мира. Каждую секунду в миллиардах наших клеток протекают сложные и строго скоординированные процессы. И одним из таких очень важных процессов является производство в митохондриях главной энергетической молекулы — аденозинтрифосфата, или АТФ. Сегодня уже хорошо известно, что работа митохондрий очень тесно связана со здоровьем и продолжительностью жизни [1]. Митохондрии производят энергию для поддержания жизни, но при этом они же служат основными источниками активных форм кислорода, избыток которых для клеток губителен.
Энергетический обмен
Любой живой организм находится в постоянной связи с окружающей средой, непрерывно обмениваясь с ней веществом. В этом процессе можно выделить три этапа:
- поступление веществ;
- метаболизм;
- выделение конечных продуктов.

Внутриклеточный метаболизм, в свою очередь, включает в себя два типа реакций: катаболизм и анаболизм.
Катаболизм — это процесс расщепления и окисления органических молекул, приводящий к образованию тепла и энергетических молекул, АТФ. Именно за счет постоянного производства—расщепления последних съеденные нами калории направляются «по адресу»: гидролиз двух высокоэнергетических (макроэргических) связей в молекулах АТФ обеспечивает энергией всевозможные синтетические и транспортные процессы в клетках.
На первом этапе катаболизма под воздействием пищеварительных ферментов сложные органические соединения (белки, полисахариды, жиры) распадаются на более простые — аминокислоты, моносахариды, жирные кислоты и глицерин, — которые клетка использует для реакций анаболизма (пластического обмена) и получения энергии. Аминокислоты идут на синтез белков. Жирные кислоты выполняют энергетическую функцию, входят в состав клеточных мембран и служат субстратом для синтеза эйкозаноидов
На втором этапе происходит гликолиз — расщепление молекул глюкозы (рис. 1) до пировиноградной кислоты (ПВК). Дальнейший ход реакций зависит от присутствия или отсутствия кислорода в клетке. Если кислорода нет (анаэробный процесс), то ПВК у микроорганизмов и растений будет превращаться в этанол, а в организме животных — в молочную кислоту [2]. Каждый, кто подвергал себя тяжелым физическим нагрузкам, мог почувствовать конечный результат анаэробного метаболизма в виде боли и скованности в мышцах из-за скопившейся в них молочной кислоты.
1) до пировиноградной кислоты (ПВК). Дальнейший ход реакций зависит от присутствия или отсутствия кислорода в клетке. Если кислорода нет (анаэробный процесс), то ПВК у микроорганизмов и растений будет превращаться в этанол, а в организме животных — в молочную кислоту [2]. Каждый, кто подвергал себя тяжелым физическим нагрузкам, мог почувствовать конечный результат анаэробного метаболизма в виде боли и скованности в мышцах из-за скопившейся в них молочной кислоты.
Рисунок 1. Реакции гликолиза. На 10 этапах гликолиза (пяти подготовительных и пяти этапах синтеза АТФ) из шестиуглеродной молекулы глюкозы образуются две трехуглеродные молекулы пировиноградной кислоты. Полученная от расщепления глюкозы энергия запасается в «энергетической валюте» клетки — двух молекулах АТФ и двух молекулах НАДФ.
Если же кислород в клетке есть, ПВК будет расщепляться на углекислый газ и воду и тоже высвобождать заключенную в углеводной молекуле энергию. Этот процесс называется аэробным клеточным дыханием и проходит в специальных органеллах — митохондриях. Окисление в митохондриях дает гораздо больше энергии, чем гликолиз.
Окисление в митохондриях дает гораздо больше энергии, чем гликолиз.
Митохондрии и производство АТФ
Рисунок 2. Митохондрия под электронным микроскопом.
Митохондрии — настоящее биологическое чудо, сотворенное эволюцией. Несмотря на очень маленький размер (в одной клетке может быть более 1000 митохондрий), эти органеллы поражают чрезвычайно сложной организацией (рис. 2). Они представляют собой вытянутые «пузырьки», окруженные двумя мембранами. Считается, что митохондрии сформировались в результате поглощения археями-фагоцитами пурпурных фотосинтезирующих бактерий, которые, приспосабливаясь к избытку кислорода, освоили аэробное дыхание [3], [4]. Мембраны митохондрий состоят из липидов и гидрофобных, нерастворимых в воде белков. (Здесь мы так подробно описываем строение митохондрий не случайно, а для того чтобы потом было понятно, как их нормальная работа и дисфункция влияют на здоровье.)
Строение мембран очень важно для процесса дыхания. Внешняя мембрана митохондрий — гладкая, а внутренняя — многократно складчатая. Эти складки (или кристы) позволяют увеличить рабочую площадь мембраны, что необходимо для размещения там всего комплекса белков, осуществляющих дыхание. Вначале окисляются углеродные атомы углеводов, жирных кислот и аминокислот до СО2 (гликолиз, цикл Кребса и β-окисление жирных кислот), а полученные таким образом электроны используются для образования НАДФ. Далее НАДФ окисляется молекулярным кислородом с образованием воды. НАДФ-оксидазная реакция сопровождается выделением очень большого количества свободной энергии (около 1,1 эВ при переносе одного электрона с НАДФ на кислород), которая может запасаться дыхательной цепью в виде трансмембранной разности электрохимических потенциалов ионов H+ (протонов).
Эти складки (или кристы) позволяют увеличить рабочую площадь мембраны, что необходимо для размещения там всего комплекса белков, осуществляющих дыхание. Вначале окисляются углеродные атомы углеводов, жирных кислот и аминокислот до СО2 (гликолиз, цикл Кребса и β-окисление жирных кислот), а полученные таким образом электроны используются для образования НАДФ. Далее НАДФ окисляется молекулярным кислородом с образованием воды. НАДФ-оксидазная реакция сопровождается выделением очень большого количества свободной энергии (около 1,1 эВ при переносе одного электрона с НАДФ на кислород), которая может запасаться дыхательной цепью в виде трансмембранной разности электрохимических потенциалов ионов H+ (протонов).
Работа же дыхательных белков-ферментов похожа на работу насосов: передавая электроны друг другу, они перекачивают протоны в межмембранное пространство (см. видео 1). В результате внутренняя мембрана митохондрии заряжается подобно конденсатору. Создаются потенциалы: электрический (положительные заряды — снаружи митохондриальной мембраны, отрицательные — внутри органеллы) и химический (возникает разница концентраций протонов: внутри митохондрии их меньше, снаружи — больше). Известно, что электрический потенциал на мембране митохондрий, которая служит хорошим диэлектриком, достигает 200 мВ при толщине мембраны всего 10 нм [5]. Для сравнения: потенциал действия на мембранах нервных клеток при передаче сигнала достигает всего 30 мВ.
Известно, что электрический потенциал на мембране митохондрий, которая служит хорошим диэлектриком, достигает 200 мВ при толщине мембраны всего 10 нм [5]. Для сравнения: потенциал действия на мембранах нервных клеток при передаче сигнала достигает всего 30 мВ.
Видео 1. Как работает митохондрия
Накопившись в межмембранном пространстве, протоны, подобно электрическому току, устремляются назад, в митохондрию — туда, где их концентрация ниже. Однако они могут проходить только по специальным каналам АТФ-синтазы, встроенной во внутреннюю мембрану: протонный канал (ротор) этого фермента закреплен в мембране, а каталитический комплекс торчит внутрь митохондрии, в матрикс (рис. 3). Поток протонов раскручивает ротор, как река водяную мельницу. В результате ротор вращается с невероятной скоростью — 300 оборотов в секунду (см. видео 2)! И именно это вращение приводит к образованию высокоэнергетической молекулы — АТФ [6]. Подсчитано, что в сутки в организме взрослого человека синтезируется и расходуется около 40 кг АТФ, при этом жизнь каждой молекулы очень коротка.
Подсчитано, что в сутки в организме взрослого человека синтезируется и расходуется около 40 кг АТФ, при этом жизнь каждой молекулы очень коротка.
Рисунок 3. Схема дыхательной цепи митохондрий.
Видео 2. Работа АТФ-синтазы в мембране митохондрии
Всё вышесказанное имеет самое непосредственное отношение к старению. Дело в том, что в процессе дыхания ферменты работают не совсем «чисто», и в результате образуются побочные продукты — активные формы кислорода (АФК). Пока человек молод и здоров, образующиеся в митохондриях АФК не представляют для него ощутимой угрозы, так как легко нейтрализуются организмом. Но когда человек стареет, ведет нездоровый образ жизни или имеет генетическую предрасположенность к определенным болезням, его защитные системы дают сбой, рушась одна за другой.
Жирные кислоты и дисфункция митохондрий
То, что старение и возрастные патологии сопровождаются дисфункцией митохондрий, которые начинают производить меньше АТФ и хуже обновляться, уже ни у кого не вызывает сомнения. Выяснилось также, что дисфункция митохондрий и старение тесным образом связаны с повышением уровня свободных жирных кислот в крови [7], чему сильно способствуют малоподвижность и нерациональное питание. Жирные кислоты, попадая в клетку, способны напрямую снижать синтез АТФ, разобщая окисление и фосфорилирование. Этот связанный с терморегуляцией организма феномен был открыт еще шесть десятилетий назад академиком Скулачевым и его коллегами [8]. Снижение синтеза АТФ, в свою очередь, запускает сразу несколько негативных цепных реакций, связанных с возрастными болезнями и старением в целом.
Выяснилось также, что дисфункция митохондрий и старение тесным образом связаны с повышением уровня свободных жирных кислот в крови [7], чему сильно способствуют малоподвижность и нерациональное питание. Жирные кислоты, попадая в клетку, способны напрямую снижать синтез АТФ, разобщая окисление и фосфорилирование. Этот связанный с терморегуляцией организма феномен был открыт еще шесть десятилетий назад академиком Скулачевым и его коллегами [8]. Снижение синтеза АТФ, в свою очередь, запускает сразу несколько негативных цепных реакций, связанных с возрастными болезнями и старением в целом.
И вот что происходит. Повышение уровня свободных жирных кислот в организме приводит к резистентности к инсулину: инсулинзависимые клетки перестанут реагировать на этот гормон. В результате нарушается усвоение глюкозы и жирных кислот, ухудшается окисление последних. Дело в том, что характерный для состояния инсулинорезистентности высокий уровень инсулина активирует целый каскад реакций, который блокирует работу фермента карнитинпальмитоилтрансферазы I (СРT1), участвующего в переносе жирных кислот внутрь митохондрий [9]. Из-за этого ухудшается синтез АТФ, а жирные кислоты накапливаются в цитоплазме клеток, вызывая эффект липотоксичности. Кроме резистентности к инсулину, избыток жирных кислот в организме вызывает резистентность к еще одному «пищевому» гормону — лептину. А из-за этого страдает функция одного из главных участников биогенеза (обновления) митохондрий — коактиватора рецептора гамма, активируемого пролифераторами пероксисом (PGC-1α). В итоге митохондрии производят меньше АТФ, стареют, погибают и провоцируют гибель клеток путем апоптоза [10].
Из-за этого ухудшается синтез АТФ, а жирные кислоты накапливаются в цитоплазме клеток, вызывая эффект липотоксичности. Кроме резистентности к инсулину, избыток жирных кислот в организме вызывает резистентность к еще одному «пищевому» гормону — лептину. А из-за этого страдает функция одного из главных участников биогенеза (обновления) митохондрий — коактиватора рецептора гамма, активируемого пролифераторами пероксисом (PGC-1α). В итоге митохондрии производят меньше АТФ, стареют, погибают и провоцируют гибель клеток путем апоптоза [10].
Ну и наконец, избыток жирных кислот вызывает стресс эндоплазматического ретикулума (ЭПР) — внутриклеточного органоида, участвующего в синтезе белков и множестве других процессов. При стрессе ЭПР в цитоплазму высвобождаются ионы кальция, способные вызывать дисфункцию и гибель митохондрий [11]. Ионы кальция могут накапливаться в клетке и по другой причине — из-за ухудшения работы ионных насосов, откачивающих кальций из клетки. А причиной этому служит нарушение работы митохондрий, сопровождающееся снижением синтеза АТФ, без которого отказываются работать ионные насосы. В итоге формируется порочный круг: снижение выработки АТФ приводит к дисфункции митохондрий, что еще больше снижает выработку АТФ, и т.д.
А причиной этому служит нарушение работы митохондрий, сопровождающееся снижением синтеза АТФ, без которого отказываются работать ионные насосы. В итоге формируется порочный круг: снижение выработки АТФ приводит к дисфункции митохондрий, что еще больше снижает выработку АТФ, и т.д.
Жирные кислоты, церамиды и повреждения нейронов
Как выяснилось, избыток жирных кислот и дисфункция митохондрий напрямую связаны с возникновением возрастных нейродегенеративных патологий. Надо сказать, что клетки нервной системы — самые уязвимые для возрастного окислительного стресса и снижения синтеза АТФ. Такая исключительная чувствительность нейронов к дефициту энергии и повышению генерации АФК объясняется несколькими причинами.
Во-первых, нервная ткань в силу своей физиологии нуждается в наибольшем потреблении кислорода. Вследствие этого в митохондриях нейронов происходит интенсивный окислительный метаболизм, который и становится основной причиной повышенной генерации АФК.
Во-вторых, из-за того, что мембраны нейронов содержат много ненасыщенных жирных кислот, они легко подвергаются перекисному окислению липидов. Так как активность антиоксидантных систем в ткани головного мозга ниже, чем в других органах, а с возрастом сокращается и количество некоторых ферментов-антиоксидантов, становится понятным, почему клетки нервной системы наиболее чувствительны к окислительным повреждениям [12].
Так как активность антиоксидантных систем в ткани головного мозга ниже, чем в других органах, а с возрастом сокращается и количество некоторых ферментов-антиоксидантов, становится понятным, почему клетки нервной системы наиболее чувствительны к окислительным повреждениям [12].
В настоящее время известно несколько факторов, повреждающих нейроны. Среди них — белки, образующие внутри- и внеклеточные агрегаты (β-амилоидный белок и другие), а также церамиды и липофусцин. На их количество влияет прежде всего избыток жирных кислот в организме. Отягчающим обстоятельством в этом случае выступает чрезмерное содержание насыщенных кислот (пальмитиновой и стеариновой) в пищевом рационе. Всё это вместе служит мощным стимулом развития разнообразных нейродегенеративных заболеваний, таких как болезнь Альцгеймера [13], [14].
Но каким же образом пальмитиновая кислота может способствовать нейродегенерации? Установлено, что из-за избытка этой кислоты накапливаются церамиды, которые участвуют в регуляции терминальной дифференцировки, пролиферации и апоптоза нейронов. Посредством нескольких химических реакций они воздействуют на регуляторы клеточного цикла, повышая концентрацию ингибиторов киназ p21/SDI1 и p27/KIP1. Таким образом церамиды останавливают клеточный цикл, что, в свою очередь, активирует главного «стража генома» — белок р53 — и «насылает» на клетку апоптоз [15]. Кроме этого, при деградации церамида образуется вещество сфингозин, обладающее цитотоксическим действием и способное вызывать как апоптоз, так и некроз клеток. Но и это еще не всё. Обнаружено, что накопление насыщенных жирных кислот (пальмитиновой и стеариновой) стимулирует специальные клетки головного мозга (астроглию) на эндогенный (внутренний) синтез церамидов. Эти произведенные церамиды запускают цепную реакцию следующего вида: церамиды → повышение секреции провоспалительных цитокинов и оксида азота → увеличение производства АФК и окислительный стресс → активация стресс-регулируемых киназ (CDK5 и GSK-3) в нейронах → образование β-амилоидного белка и гиперфосфорилирование τ-белка [16].
Нейродегенеративные патологии и дисфункция митохондрий
Сегодня важнейшими и самыми распространенными нейродегенеративными патологиями считают болезни Альцгеймера, Паркинсона, Хантингтона, а также боковой амиотрофический склероз. Их возникновение связывают со структурными изменениями различных белков, приводящими к образованию внутриклеточных агрегатов. К таким белкам относятся:
Болезнь Альцгеймера (БА) — тяжелое нейродегенеративное заболевание, для которого характерны синаптическая дисфункция и гибель нейронов, что сопровождается снижением когнитивных способностей: ухудшением памяти и мышления, постепенной потерей социальных и моторных навыков [17]. В зоне риска развития болезни находятся в основном пожилые люди. Лишь 1–2% людей в возрасте до 65 лет страдают БА. Согласно одной из гипотез развития БА — амилоидной, — болезнь возникает из-за накопления в головном мозге агрегатов β-амилоида. Этот пептид состоит из 39–43 аминокислотных остатков и является фрагментом крупного трансмембранного белка под названием предшественник бета-амилоида (amyloid precursor protein, APP). Находясь в избытке, молекулы β-амилоида начинают «склеиваться» и образовывать нерастворимые бляшки (рис. 4). Именно в таком состоянии белок нарушает работу нервных клеток и вызывает симптомы БА. У страдающих БА в пораженных участках мозга находят большое количество амилоидных бляшек и нейрофибриллярных клубков [18].
Рисунок 4. Образование амилоидной бляшки у генно-инженерных мышей (показано длинной стрелкой). На 6-й день уже видна дистрофия нейрона (короткая стрелка). Синим цветом обозначены отложения амилоида, зеленым — нейроны. Длина масштабной линейки — 20 мкм; снимки сделаны с помощью мультифотонного микроскопа.
Однако амилоидная гипотеза — не единственная, объясняющая возникновение БА. В 1993 году Аллен Роузес, профессор Университета Дьюка, предложил еще одну гипотезу возникновения БА — генетическую, связанную с геном APOE, кодирующим аполипопротеин Е (ApoE). Выяснилось, что наследование одного из вариантов гена APOE — APOE4 — в несколько раз повышает шансы заболеть БА. Всё больше исследователей склоняются к мысли, что β-амилоид излишне «демонизирован» и не является первопричиной развития БА. Неудавшаяся терапия, направленная на очистку клеток от β-амилоида, подтверждает, что с этой болезнью не всё до конца ясно [19].
Болезнь Паркинсона (БП) — еще одно тяжелое и довольно распространенное возрастное нейродегенеративное заболевание. У больных БП в нейронах черной субстанции накапливается α-синуклеин, который образует особые гранулы — тельца Леви. Надо сказать, что существует так называемая деменция с тельцами Леви, для которой характерно скопление многочисленных телец Леви в кортикальных и субкортикальных нейронах и развитие прогрессирующего когнитивного расстройства уже в первый год заболевания. Но пока не совсем ясно, считать ли эту деменцию формой БП или же правильнее ее рассматривать как отдельное заболевание. В случае БП скопления телец Леви приводят к дисфункции нейронов и их гибели, при этом характерно поражение областей мозга из состава так называемого нигростриарного дофаминового пути. Этот путь регулирует двигательную активность, снижая напряжение в мышцах. Вот почему, когда гибнут дофаминовые нейроны, у больных возникают соответствующие симптомы: нарастающее повышение мышечного тонуса и дрожание рук. Кроме нарушения моторных функций для БП характерны и другие симптомы, связанные с нарушением сна, депрессией, тревогой, ухудшением зрения и замедлением мышления [20].
Болезнь Хантингтона (БХ) — тоже не слишком редкое нейродегенеративное заболевание [21]. Как и в случае болезни Альцгеймера, для патогенеза БХ характерно образование токсичных белковых агрегатов с участием мутантных форм белков, которые синтезируются в нервной ткани. Но если к основному «виновнику» БА, β-амилоиду, у ученых есть вопросы, в случае с БХ сомнений гораздо меньше. Установлено, что именно генетические особенности — полиморфизмы определенных участков ДНК — приводят к появлению патологических форм белка хантингтина. Такой хантингтин способен к ассоциации с другими белками нервной ткани, в результате чего образуются нерастворимые токсичные агрегаты, повреждающие кору и полосатое тело головного мозга. Для БХ типичны всплески непроизвольной двигательной активности, эмоциональные расстройства и потеря памяти. В то же время нормальная физиологическая функция белка хантингтина в организме остается под вопросом. Предполагают, что он играет какую-то роль в эмбриогенезе [22].
Все три упомянутые патологии самым тесным образом связаны с дисфункцией митохондрий. Прежде всего, надо отметить, что ее развитие под действием дефектных белков, специфичных для нейропатологий, было установлено несколькими способами: in vitro (на клеточных линиях и внеклеточных системах) и in vivo (на трансгенных животных). Обнаружили и обратную связь: оказалось, что дисфункция митохондрий может стимулировать появление дефектных белков. Так, нарушение активности дыхательного комплекса I ведет к накоплению в нервных клетках гиперфосфорилированного τ-белка и α-синуклеина [23].
Со скоплением дефектных белков связали и уже упоминавшийся стресс эндоплазматического ретикулума. Один из таких белков, α-синуклеин, может снижать активность протеасом, что заканчивается стрессом ЭПР, увеличением производства АФК и инициацией апоптозных процессов. Это происходит потому, что из митохондрий высвобождается апоптозный фактор, цитохром С, который активирует «клеточных убийц» — каспазу-9 и каспазу-3 [24]. Как полагают, на начальных этапах нейродегенерации при БА накопление β-амилоида и гиперфосфорилирование τ-белка могут быть физиологическими механизмами защиты клетки от окислительного стресса, вызванного прогрессирующей митохондриальной дисфункцией. Однако при избыточном накоплении этих белков в клетке происходит сбой в работе митохондрий. Так, у пациентов с БА обнаружили, что β-амилоид накапливается в митохондриях и нарушает реакции гликолиза и цикла Кребса, активизирует продукцию АФК. Более того, β-амилоид способен напрямую подавлять синтез АТФ. Это возможно из-за структурного сходства белка с естественным ингибитором F(1)-субъединицы АТФ-синтазы митохондрий. Также β-амилоид может взаимодействовать с митохондриальной мембраной, формируя стабильные комплексы с двумя транслоказами, TOM40 и TIM23. Такие комплексы подавляют импорт в митохондрии белков, кодируемых ядерным геномом, — субъединиц IV и Vb цитохромоксидазы. На что органелла откликается увеличением производства агрессивного пероксида водорода.
Но и это еще не всё: белок — предшественник β-амилоида может формировать поры в мембранах митохондрий и других органелл, что нарушает ионный баланс в клетке и запускает ее апоптоз [25]. Также этот белок повышает активность фосфолипазы D, в результате изменяя фосфолипидный состав митохондриальных мембран, увеличивая концентрацию фосфатидилхолина, фосфатидилэтаноламина и фосфатидной кислоты и нарушая работу мембран. Известно, что β-амилоид может связывать гем, а это ведет к дефициту гема в клетке, из-за чего нарушается работа гем-содержащего IV комплекса электронтранспортной цепи митохондрий [26].
Но не только β-амилоид способен негативно влиять на митохондрии. В экспериментах с трансгенными грызунами, экспрессирующими ген хантингтина человека, обнаружили агрегацию этого белка в митохондриях с последующим развитием их дисфункции. Другой «зловредный» белок, α-синуклеин, накапливаясь во внутренней митохондриальной мембране, способен снижать активность дыхательного комплекса I. Как следствие, митохондрии увеличивают продукцию АФК [27]. Также обнаружено, что α-синуклеин, взаимодействуя с митохондриями, может стимулировать высвобождение из них цитохрома С, а значит, инициировать апоптоз.
В целом, можно сказать, что запуск апоптоза — характерный эффект белков, вызывающих нейродегенерацию. Они могут прямо или косвенно воздействовать на регуляторные белки, связанные с апоптозом: p53, Akt, Bad, Bax, Bcl-x(L) и кальцинейрин [28].
Также описано, что сверхсинтез белка — предшественника β-амилоида приводит к повреждению системы слияния—деления митохондрий. Негативно влияют на эту же систему и на утилизацию дефектных митохондрий аутофагосомами мутации гена паркина (PARK2), обнаруженные у больных БП. Дефектные формы τ-белка и хантингтина тоже мешают нормальной работе митохондрий, ухудшая тем самым энергообеспечение отростков нервных клеток и синаптическую передачу, вызывая дегенерацию синапсов [29].
Таким образом, белки, участвующие в развитии нейродегенеративных патологий, могут способствовать митохондриальной дисфункции посредством целого ряда механизмов. В свою очередь, уже возникшая дисфункция может усугублять патологические процессы, стимулируя появление дефектных белков и замыкая тем самым порочный круг развития болезни.
Эффект Варбурга
И напоследок стόит коснуться еще одного момента, связанного с патологиями и изменением клеточного метаболизма. В 1926 году немецкий биохимик Отто Варбург сравнил скорости образования молочной кислоты (лактата) в нормальных и опухолевых клетках. Оказалось, что опухолевые клетки потребляют очень много глюкозы, образуя при этом лактат. И делают это они гораздо быстрее, чем нормальные клетки: злокачественная ткань в эксперименте производила молочную кислоту в восемь раз активнее, чем это происходит в мышце, выполняющей физическую работу. Варбург установил, что раковые клетки используют гликолиз для получения энергии вне зависимости от доступности кислорода (рис. 5) [30]. В честь первооткрывателя этот феномен назвали эффектом Варбурга [2].
Рисунок 5. Энергообеспечение нормальной и раковой клеток. Синим квадратом обозначена поступающая в клетку глюкоза.
Обнаружив этот эффект, Варбург логично предположил, что его можно объяснить дисфункцией митохондрий в опухолевых клетках и нарушением окислительного фосфорилирования. Сегодня эта точка зрения ставится под сомнение, так как и в перерожденной ткани обнаруживают большое количество нормально работающих митохондрий. Около половины всей энергии опухолевые клетки получают из молекул АТФ, произведенных в митохондриях [31]. Эффект Варбурга проявляется в клетках уже в самом начале их трансформации в опухолевые. И это дает возможность проводить раннюю диагностику неопластических процессов: как только клетка начала расходовать глюкозу в повышенных масштабах, пора бить тревогу. Обнаружить эти процессы можно с помощью позитронно-эмиссионной томографии с использованием фторированного аналога глюкозы, 2-(18F)-2-дезокси-D-глюкозы.
Но зачем раковые клетки переходят на анаэробный гликолиз? Сейчас считается, что так они получают преимущество, заранее подготавливаясь к «тяжелым временам» — развитию гипоксии. А кроме этого, такой способ энергообеспечения дает клеткам возможность использовать промежуточные продукты гликолиза для анаболических реакций, усиления своей антиоксидантной защиты и отражения иммунной атаки организма [32].
Таким образом, изменения в метаболизме глюкозы и появление дефектных белков и внутриклеточных агрегатов могут говорить о начале развития патологии. Своевременное выявление подобных внутриклеточных процессов может сыграть решающую роль в предупреждении и терапии самых распространенных нейродегенеративных и онкологических заболеваний. А для того чтобы это было возможным, необходимо изучать фундаментальные аспекты патологий, связанные с работой митохондрий и энергетическим обменом. Сегодня уже разработаны системы, позволяющие заглянуть «вглубь» этих заболеваний и даже провести диагностику на самой ранней стадии их развития. Подробнее об этих системах, принципах их действия и исследованиях с их использованием расскажут следующие статьи спецпроекта.
Компания более 25 лет успешно занимается поставками научного и медицинского оборудования российских и зарубежных производителей: Beckman Coulter, Bio-Rad, Molecular Devices, Thermo Fisher Scientific, UVP, Seahorse Bioscience (part of Agilent), Immucor, MRC Holland и др. «БиоХимМак» обслуживает более 5000 научных и медико-диагностических лабораторий в России и странах СНГ.
Отдел молекулярной диагностики (Life Science MDx)
Молекулярная онкология, преимплантационный скрининг, цитогенетика, пренатальные и постнатальные исследования, диагностика инфекций, наследственных, мультифакторных заболеваний, детекция генномодифицированных источников и бактериального загрязнения в продуктах питания, криминалистические приложения — это лишь неполный перечень областей, которые входят в сферу интересов отдела.
Основные направления деятельности отдела:
- комплексная поставка ПЦР- и иного оборудования для всех этапов анализа — пробоподготовки, амплификации, различных вариантов детектирования и архивирования результатов;
- запуск оборудования и обучение персонала;
- поставка расходных материалов и реагентов для диагностики и научных исследований;
- поиск и поставка тест-систем для решения уникальных задач или использующих передовые технологии, не имеющие пока широкого распространения в диагностической практике.
Отдел работает как с инновационной продукцией (MLPA, PGS и NGS исследования, клеточная биоэнергетика Agilent Seahorse Bioscience), так и с зарекомендовавшими себя мировыми брендами — Beckman Coulter, Bio-Rad, Molecular Devices, UVP, Thermo Fisher Scientific.
Материал предоставлен партнёром — компанией «БиоХимМак»
- Вода студеная, вареная и кипящее молоко, или Еще раз об омоложении;
- Страшней клешней на свете нет…;
- Как появились митохондрии (рассказ, похожий на сказку);
- От сложного к простому: трудности симбиогенеза;
- Ржешевский А.В. (2016). Нанороботы внутри нас: как работают клетки. Популярная механика. 1, 31–34;
- Романовский Ю.М. и Тихонов А.Н. (2010). Молекулярные преобразователи энергии живой клетки. Протонная АТФ-синтаза — вращающийся молекулярный мотор. Успехи физических наук. 9, 931–956;
- Терёшина Е.В. (2007). Роль жирных кислот в развитии возрастного окислительного стресса. Успехи геронтологии. 20, 59–65;
- Скулачев В.П. (1998). Альтернативные функции клеточного дыхания. Соросовский образовательный журнал. 8, 2–7;
- Ржешевский А.В. (2014). Снижение синтеза АТР и дисфункция биологических мембран. Биохимия. 10, 1300–1315;
- Roger H. Unger. (2003). Minireview: Weapons of Lean Body Mass Destruction: The Role of Ectopic Lipids in the Metabolic Syndrome. Endocrinology. 144, 5159-5165;
- C. Xu. (2005). Endoplasmic reticulum stress: cell life and death decisions. Journal of Clinical Investigation. 115, 2656-2664;
- Иллариошкин С.Н. (2012). Нарушения клеточной энергетики при заболеваниях нервной системы. Нервные болезни. 1, 34–38;
- R. A Whitmer. (2005). Obesity in middle age and future risk of dementia: a 27 year longitudinal population based study. BMJ. 330, 1360-0;
- β-амилоид: невидимый враг или тайный защитник? Запутанная тропка болезни Альцгеймера;
- L. M. Obeid. (2003). Ceramide, Stress, and a «LAG» in Aging. Science of Aging Knowledge Environment. 2003, 27pe-27;
- Бабенко Н.А., Семенова Я.А., Харченко В.С. (2009). Влияние обогащенной жирами диеты на содержание сфинголипидов и когнитивные функции у старых крыс. Нейрофизиология. 41, 309–315;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Смерть после жизни, болезнь Альцгеймера и почему мы хотим перемен;
- Болезнь Альцгеймера: ген, от которого я без ума;
- C. A. Davie. (2008). A review of Parkinson’s disease. British Medical Bulletin. 86, 109-127;
- Как спасти Тринадцатую? (Перспективы лечения болезни Хантингтона);
- Francis O Walker. (2007). Huntington’s disease. The Lancet. 369, 218-228;
- Gunter U. Hoglinger, Annie Lannuzel, Myriam Escobar Khondiker, Patrick P. Michel, Charles Duyckaerts, et. al.. (2005). The mitochondrial complex I inhibitor rotenone triggers a cerebral tauopathy. J Neurochem. 95, 930-939;
- W. W. Smith. (2005). Endoplasmic reticulum stress and mitochondrial cell death pathways mediate A53T mutant alpha-synuclein-induced toxicity. Human Molecular Genetics. 14, 3801-3811;
- Судаков Н.П., Бывальцев В.А., Никифоров С.Б., Сороковиков В.А., Клименков И.В., Константинов Ю.М. (2010). Дисфункция митохондрий при нейродегенеративных заболеваниях. Журнал неврологии и психиатрии. 9, 87–91;
- H. Atamna, K. Boyle. (2006). Amyloid-beta peptide binds with heme to form a peroxidase: Relationship to the cytopathologies of Alzheimer’s disease. Proceedings of the National Academy of Sciences. 103, 3381-3386;
- L. Devi, V. Raghavendran, B. M. Prabhu, N. G. Avadhani, H. K. Anandatheerthavarada. (2008). Mitochondrial Import and Accumulation of -Synuclein Impair Complex I in Human Dopaminergic Neuronal Cultures and Parkinson Disease Brain. Journal of Biological Chemistry. 283, 9089-9100;
- Sandra M. Cardoso, Catarina R. Oliveira. (2005). The role of calcineurin in amyloid-β-peptides-mediated cell death. Brain Research. 1050, 1-7;
- Francis C. Chee, Amritpal Mudher, Matthew F. Cuttle, Tracey A. Newman, Daniel MacKay, et. al.. (2005). Over-expression of tau results in defective synaptic transmission in Drosophila neuromuscular junctions. Neurobiology of Disease. 20, 918-928;
- Robert A. Gatenby, Robert J. Gillies. (2004). Why do cancers have high aerobic glycolysis?. Nat Rev Cancer. 4, 891-899;
- Peter L. Pedersen. (2007). Warburg, me and Hexokinase 2: Multiple discoveries of key molecular events underlying one of cancers’ most common phenotypes, the “Warburg Effect”, i.e., elevated glycolysis in the presence of oxygen. J Bioenerg Biomembr. 39, 211-222;
- Куликов В.А. и Беляева Л.Е. (2013). Метаболическое перепрограммирование раковых клеток. Вестник Витебского государственного медицинского университета. 2, 6–18;
- Melanie Meyer-Luehmann, Tara L. Spires-Jones, Claudia Prada, Monica Garcia-Alloza, Alix de Calignon, et. al.. (2008). Rapid appearance and local toxicity of amyloid-β plaques in a mouse model of Alzheimer’s disease. Nature. 451, 720-724.
Метаболизм клетки
Шпаргалка на конкурс «био/мол/текст»: Одна из основных функций биологических объектов — превращение одних веществ в другие. То, из чего мы, живые организмы, состоим и что используем для получения энергии, — это совсем не те вещества, которые можно найти в окружающей среде. Большинство из них мы сделали сами. Поэтому такое превращение веществ — это специальный биологический процесс, называемый метаболизмом. Зацените, какую я нарисовал шпаргалку по метаболизму!
Обратите внимание!
Эта работа опубликована в номинации «Наглядно о ненаглядном» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
С учетом соблюдения биологических норм данную науку можно называть метаболикой [1] (ну, или просто биохимией). Две иллюстрации, приведенные ниже, предлагаю считать введением в эту науку.
Чтобы посмотреть рисунки в полном размере, просто нажмите на них (откроются в отдельной вкладке).
Рисунок 1. Основные метаболические пути и механизмы в животных, бактериальных и растительных клетках: пути синтеза и распада глюкозы, регуляция углеводного обмена, метаболизм гликогена, глюконеогенез, цикл Кребса, глиоксилатный цикл, биосинтез и деградация жирных кислот, цикл мочевины. Также имеются основные принципы устройства дыхательной цепи переноса электронов и митохондриальных переносчиков восстановительных эквивалентов, принцип работы карнитинового челнока и др.
Рисунок 2. Основные виды брожений у микроорганизмов: молочнокислое, пропионовокислое, бутандиоловое, гомоацетатное, масляноекислое (также «ABE fermentation», как вариант маслянокислого брожения), спиртовое, типы брожения по Нейбергу, спиртовое брожение бактерий рода Clostridium. Кроме того, приведены некоторые пути ассимиляции углерода: цикл Арнона, глиоксилатный цикл, путь Вуда-Льюнгдала. И, наконец, дана короткая информация о метаболизме серы и азота и карбонатном дыхании.
- Скулачев В.П., Богачев А.В., Каспаринский Ф.О. Мембранная биоэнергетика: Учебное пособие. М.: Издательство Московского университета, 2010. — 368 с..
Какие вещества участвуют в обмене веществ?
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте https://ru.siberianhealth.com/ru/blogs/ предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Какие вещества участвуют в обмене веществ?
Метаболизм – это сложный процесс, который зависит от множества факторов. Например, для его нормального протекания требуются определенные вещества. Какие?
Обмен веществ – это все реакции и процессы, которые в совокупности происходят в организме. Нет ни одного процесса в организме, который проходил бы без участия обмена веществ. Из каких веществ он складывается?
Функции обмена веществ
Обмен веществ выполняет в организме набор следующих функций:- Дает энергию для полноценного функционирования.
- Вырабатывает строительный материал для дальнейших процессов.
- Помогает организму восстанавливаться после тяжелых физических или эмоциональных нагрузок.
- Запасает тело питательными веществами на случай их непредвиденных расходов.
- Выводит ненужные вещества, токсины, соединения.
- Физические нагрузки. Например, плавание даже на короткие дистанции может усилить обменные процессы в несколько раз.
- Возраст. С годами скорость метаболизма постепенно снижается.
- Температура тела. Если она повышается, то скорость обменных процессов повышается.
- Поступление в организм питательных веществ вместе со съеденными продуктами.
- Реакция распада еды на полезные вещества, их частичное всасывание органами желудочно-кишечного тракта.
- Усвоение отдельных компонентов тканями.
- Выделение отходов жизнедеятельности – углекислый газ, моча, каловые массы.
- Витамины группы В. Эти вещества играют важную роль в энергетическом обмене. Дефицит какого-либо витамина из этой группы может отразиться на скорости метаболизма и среде организма в целом. То есть они всегда должны быть в рационе. Содержатся в постном мясе, морепродуктах, яйцах, цельном молоке, живых кисломолочных культурах, орехах, семечках, бананах, арбузах.
- Витамин Д. Если его не хватает в организме взрослого человека, то это может грозить ожирением. Для поддержания его уровня важно соблюдать здоровую диету, почаще бывать на свежем воздухе, контролировать уровень сахара в крови. Также вещество можно принимать дополнительно.
- Кальций. Важен для здорового метаболизма и поддержания уровня глюкозы в крови. Для этого нужно употреблять натуральные молочные продукты, злаки, листовые зеленые овощи, миндаль, свежевыжатый апельсиновый сок, семечки.
- Железо. Поддерживает здоровый рост клеток, помогает выработке необходимых гормонов. Если железа не хватает, то мышцы плохо обеспечиваются кислородом, процесс обмена энергии не происходит полноценно. Железо есть в орехах, соевых бобах, листовых овощах, мясе, гречневой крупе, фасоли.
- Магний. Производит энергию в организме, значительно ускоряет обмен веществ. Магний есть в шпинате, бананах, картофеле, жирной морской рыбе, цельнозерновых культурах.
- Витамин Е. Помогает переваривать пищу, нормализует работу желудочно-кишечного тракта. Он содержится в яйцах, рыбе и морепродуктах, печени.
- Хром. Необходим для худеющих, так как сжигает подкожный жир. Хром есть в бобовых культурах и простой ячневой крупе.
- Клетчатка. Увеличивает метаболизм за счет повышения активности желудка и очищения организма от вредных веществ. Клетчаткой богаты свежие овощи и фрукты.
- О Эльзевире
- О нас
- Elsevier Connect
- Карьера
- Продукты и решения
- Решения НИОКР
- Клинические решения
- Исследовательские платформы
- Исследовательский интеллект
- Образование
- Все решения
- Сервисы
- Авторы
- Редакторы
- Рецензенты
- Библиотекарей
- Магазин и Откройте для себя
- Книги и журналы
- Автор Интернет-магазин (Открывается в новом окне)
- Поиск
- Объяснять, что такое метаболические пути, и описывать два основных типа метаболических путей
- Обсудить, как химические реакции играют роль в передаче энергии
Что влияет на метаболизм?
На протекание процессов обмена веществ влияют следующие факторы:
Как проходит обмен веществ?
Процесс ассимиляции можно разделить на несколько этапов:
Какие вещества участвуют в метаболизме?
Чтобы организм работал нормально, а метаболизм проходил с нужной скоростью, требуются следующие вещества:
Внимание! Метаболизм – это сложная совокупность процессов, на которой отражается работа всего организма и жизнь человека. Для здорового обмена веществ требуются определенные витамины и минералы, химические вещества, поэтому важно включать их в свой рацион.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте https://ru.siberianhealth.com/ru/blogs/ предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Эксперт: Елагина Мария Business Profi компании Siberian Wellness и нутрициолог по косметике Рецензент: Дарья Киншт Специалист по клинической диетологии и нутрициологии, материнству, здоровью и правильному питанию, аспирант кафедры педиатрии НГМУ.Обмен веществ — Знаешь как
Характерным свойством всего живого является обмен веществ. И в одноклеточном, и в многоклеточном организме, вплоть до сложного организма высших животных и человека, обмен веществ представляет собой основу жизни. С прекращением обмена веществ прекращается жизнь — наступает смерть.
«Жизнь — это форма существования белковых тел, существенным моментом которой является постоянный обмен веществ с окружающей их внешней природой и которая прекращается вместе с прекращением этого обмена веществ, ведя за собой разложение белка»,— писал Ф. Энгельс.
В течение всей жизни в организме непрерывно происходят два взаимосвязанных процесса: ассимиляция и диссимиляция. Одновременно с разрушением и распадом сложных веществ, входящих в состав протоплазмы, происходит образование сложных соединений из поступающих в организм веществ. Эти два внешне противоположных процесса являются двумя сторонами единого процесса жизнедеятельности организма.
Процесс усвоения веществ, поступающих в организм из внешней среды, и создания элементов ткани — клеток и межклеточного вещества — называется ассимиляцией, а их распад—диссимиляцией. Оба процесса в живом организме тесно связаны друг с другом: не может быть ассимиляции без диссимиляции и, наоборот, диссимиляции без ассимиляции.
В процессе обмена веществ происходит освобождение энергии, необходимой для жизнедеятельности организма. При распаде сложных питательных веществ или их элементов на более простые выделяется энергия. Эта выделившаяся энергия используется организмом для совершения работы, поддержания деятельности отдельных систем органов, а также для ассими-ляторных процессов, т. е. для синтеза в организме более сложных веществ.
В детстве, когда идет усиленный рост, процесс усвоения, т. е. ассимиляция, преобладает над распадом — диссимиляцией. В старости же, наоборот, распад, т. е. диссимиляция, начинает преобладать над ассимиляцией.
В организме человека всегда идет беспрерывный процесс разрушения тканей. Так, например, постоянно отмирают клетки верхнего слоя слизистой оболочки кишечника. Место этих отмерших клеток занимают новые, полноценные клетки, постоянно развивающиеся в слизистой оболочке кишечника.
Непрерывному обновлению подвергается и наша кровь. Например, красные кровяные тельца (эритроциты) живут всего около 130 дней. В течение каждых 130 дней старые эритроциты разрушаются и замещаются новыми. В течение жизни человека кровь полностью обновляется много раз. Такому же непрерывному обновлению подвергается наша кожа, у которой верхние слои клеток беспрерывно подвергаются ороговению, отмирают, слущиваются, замещаясь новыми клетками.
Жизнь возможна, если из внешней спелы непрерывно поступают в организм кислород и питательные вещества и отдаются в окружающую среду продукты диссимиляции, образующиеся в процессе жизнедеятельности организма.
Статья на тему Обмен веществ
Получите персональный доступ к клеточному метаболизму
перейти к содержаниюМетаболизм клеток | Институт Слоана Кеттеринга
Члены Дональда Б.и Центр метаболизма рака Кэтрин К. Маррон
Ядро Cell Metabolism является частью Центра метаболизма рака Дональда Б. и Кэтрин К. Маррон и помогает исследователям охарактеризовать биологические системы путем прямого измерения низкомолекулярных компонентов. Наши основные направления — метаболизм раковых клеток и понимание взаимодействия микробиома хозяина и кишечника.Мы используем ряд дополнительных аналитических платформ ГХ-МС и ЖХ-МС и помогаем исследователям проводить исследования, начиная со стадии разработки эксперимента, путем сбора данных, анализа и интерпретации данных.Мы также предоставляем доступ к технологиям, не связанным с МС, для измерения потребления питательных веществ и кислорода.
Технологии
Потребление питательных веществ
Наш ферментный анализатор YSI 7000 измеряет уровни глюкозы, глутамина и лактата в средах для культивирования клеток и используется для определения скорости потребления клеточных питательных веществ.
Потребление кислорода
Seahorse XFe96 и XFp анализаторы внеклеточного потока доступны для измерения потребления кислорода и внеклеточного подкисления.
Рост и жизнеспособность клеток
ACEA xCELLigence MP обеспечивает измерение пролиферации и жизнеспособности клеток в реальном времени. Также доступна камера гипоксии для поддержания клеток с низким содержанием кислорода.
Подготовка образца
Доступны различные инструменты и протоколы для гомогенизации экстракции метаболитов и липидов из клеток, сред для культивирования клеток, тканей, сыворотки / плазмы, мочи и фекалий. Прибор Gerstel MPS используется для автоматизации химических производных.
Газовая хроматография – масс-спектрометрия — целевой
2 Системы ГХ-МС Agilent с масс-селективными детекторами 5975 используются для измерения дериватизированных органических кислот, аминокислот, метиловых эфиров жирных кислот и жирных кислот с короткой цепью путем относительного и абсолютного количественного определения, а также с использованием ионизации ЭУ и ХИ.
Жидкостная хроматография – масс-спектрометрия — целевое значение
В лаборатории используются приборы Agilent 6230 Time-of-Flight (TOF) и 6545 Q-TOF LC-MS для относительного количественного определения полярных метаболитов из клеток, плазмы и экстрактов тканей.Специальные хроматографические методы используются для различных химических классов метаболитов, включая методы с обращенной фазой, HILIC и методы ионных пар. Наш трехквадрупольный ЖХ-МС Thermo Vantage используется для целевого количественного определения метаболитов, включая определение профиля ацил-КоА, циклических нуклеотидов и модифицированных оснований ДНК.
Ненаправленное профилирование метаболитов
Наши приборы Agilent 6550 LC Q-TOF и Agilent 7200 GC Q-TOF используются для профилирования микробиома и липидомных метаболитов.Мы используем рабочие процессы рекурсивного поиска функций и многомерные статистические стратегии при анализе больших наборов данных метаболомики. Мы также интегрируем данные из других технологий «атомного масштаба», такие как данные об экспрессии генов и рибосомное профилирование 16S микробных сообществ, чтобы генерировать гипотезы и информировать будущие целевые эксперименты.
Изотопы и измерения потоков
Эксперименты по отслеживанию стабильных изотопов с использованием 13 C, 2 H и 15 N, отслеживание стабильных изотопов, расчеты локальных потоков и анализ IROA проводятся на совместной основе.
Аналитическая фармакология
Наш AB SCIEX API 4000 с ВЭЖХ Shimadzu, флуоресценцией и УФ-детекцией используется для целевого количественного определения низкомолекулярных фармацевтических препаратов. Мы генерируем подтверждающие данные для стадий I / II клинических испытаний, включая исследования DMPK, идентификацию метаболитов лекарств и исследования биодоступности.
Cell Metabolism: основные моменты клинической и трансляционной работы
Cell Metabolism приглашает исследователей, которые занимаются непосредственно работой, подавать статьи для нового типа статей журнала, Clinical and Translational Report.Первый набор этих захватывающих новых статей будет опубликован в номере журнала Cell Metabolism от 7 июля.
Какие виды бумаг попадают в эту новую категорию? Что ж, чтобы ответить на этот вопрос, вот предварительный просмотр:
Голодание, имитирующее диету, способствует регенерации и долголетию у мышей, испытано на людях
Было показано, что ограничение калорий благотворно влияет на здоровье организмов, от дрожжей до человека. Однако соблюдение режима экстремального голодания психологически сложно, а его преимущества для людей спорны.Чтобы преодолеть это, группа исследователей во главе с Вальтером Лонго из USC изучала, может ли диета с ограничением калорий, имитирующая голодание всего несколько дней в месяц, иметь аналогичные преимущества.
Когда мышей кормили низкокалорийной / низкобелковой диетой, имитирующей голодание (FMD), начиная с среднего возраста в течение всего 4 дней, два раза в месяц, количество стволовых клеток значительно увеличивалось, а различные типы клеток, такие как костные, мышечные, печень, мозг и иммунные клетки — регенерировались. Многие из этих регенеративных эффектов не были продемонстрированы в предыдущих исследованиях хронических или краткосрочных диетических ограничений.У животных также улучшилось здоровье и увеличилась продолжительность жизни, в том числе уменьшение воспалительных заболеваний и рака, улучшение обучения и памяти и замедленная потеря костной массы без снижения мышечной массы.
Учитывая эти многообещающие результаты на мышах, исследователи провели пилотное рандомизированное клиническое испытание с 19 людьми, которые придерживались ящура, и 18 контрольными, которые продолжали придерживаться своей обычной диеты. Ящур длился 5 дней каждый месяц в течение 3 месяцев и обеспечивал от 34% до 54% нормального потребления калорий с составом от 11% до 14% белков, от 42% до 43% углеводов и от 44% до 46% жира.К концу исследования у участников, получивших вмешательство ящура, снизились факторы риска, связанные со старением, диабетом, сердечными заболеваниями и раком, по сравнению с контрольной группой.
«Это, возможно, первое не хроническое, доклинически и клинически протестированное вмешательство против старения и улучшения здоровья, которое показало свою эффективность и очень осуществимо с точки зрения вмешательства врача или диетолога», — говорит Лонго, директор Институт долголетия USC. «Вмешательство по ящуру теперь будет проходить через строгий процесс, необходимый для утверждения FDA, который сначала потребует подтверждения и дополнительных тестов с участием 60–70 участников, а затем испытания с участием 500–1000 человек.«
Периодическая диета, имитирующая голодание, способствует многократной регенерации систем, улучшенным когнитивным функциям и продолжительности здоровья от Choi et al.
Препарат, одобренный для лечения остеопороза, перспективен в доклинических исследованиях диабета
Препарат, обычно используемый для лечения остеопороза у людей, также стимулирует выработку клеток, контролирующих баланс инсулина у мышей с диабетом. Хотя было показано, что другие соединения обладают таким эффектом, препарат (деносумаб) уже одобрен FDA и может быстрее перейти к клиническим испытаниям в качестве средства лечения диабета.
Основная цель борьбы с диабетом — найти способы увеличить количество функционирующих бета-клеток. Однако взрослые бета-клетки очень устойчивы к делению и росту. Решая эту проблему, ученые обнаружили связь между хорошо известным путем, связанным с костями, и разрастанием бета-клеток поджелудочной железы.
«Наше исследование определяет молекулярный тормоз, который подавляет репликацию бета-клеток как мыши, так и человека», — говорит старший автор Рупанги Васавада из Института диабета, ожирения и метаболизма Медицинской школы Икана на горе Синай в Нью-Йорке.«Это показывает, что два белка, включая одобренное FDA лекарство от остеопороза, могут преодолеть и ослабить этот тормоз, чтобы вызвать пролиферацию бета-клеток грызунов и человека».
Васавада, первый автор Нагеша Кондеговда, и его коллеги, сделали свои открытия, изучая эффекты лактогенных гормонов, которые вырабатываются гипофизом, стимулируют лактацию у женщин и, как известно, повышают выживаемость и рост бета-клеток поджелудочной железы. Когда они искали белки, которые регулируются лактогенами в бета-клетках, исследователи идентифицировали связанный с костями белок под названием остеопротегерин (OPG).Интересно, что поиск в медицинской литературе показал, что OPG экспрессируется на высоком уровне в различных условиях, таких как беременность и ожирение, которые способствуют размножению бета-клеток. Эти данные предполагают, что OPG может принимать непосредственное участие в росте бета-клеток.
Васавада далее исследует, как деносумаб и OPG модулируют рост и функцию бета-клеток. Она также заинтересована в проведении клинических испытаний на пациентах с диабетом, которые также лечатся от остеопороза деносумабом или другими препаратами.Исследование 2013 года с участием женщин в постменопаузе, принимавших деносумаб, не обнаружило влияния на метаболизм глюкозы у тех, кто принимал препарат, но необходимы дополнительные тесты, поскольку участники не были диабетиками.
Остеопротегерин и деносумаб стимулируют пролиферацию бета-клеток человека посредством ингибирования рецепторного активатора пути лиганда NF-κB, Kondegowda et al.
Введение в метаболизм | Клеточный метаболизм
К концу этого и нескольких следующих уроков вы должны уметь:
Жизнь и потребность в энергии
Колибри нужна энергия, чтобы поддерживать длительные периоды полета.Птица получает энергию от еды и преобразования питательных веществ в энергию. Это достигается с помощью ряда биохимических реакций. Летательные мышцы птиц чрезвычайно эффективны в производстве энергии. Изображение предоставлено: модификация работы Кори Занкера
Практически каждая задача, выполняемая живыми организмами, требует энергии. Нам нужна энергия для выполнения тяжелой работы и упражнений. Но люди также расходуют много энергии во время размышлений и даже во время сна. Фактически, живые клетки каждого организма постоянно используют энергию.Кроме того, питательные вещества и другие молекулы импортируются, метаболизируются (расщепляются) и, возможно, синтезируются в новые молекулы, при необходимости модифицируются, транспортируются по клетке и могут распространяться по всему организму.
Например, большие белки, из которых состоят мышцы, активно строятся из более мелких молекул. Сложные углеводы расщепляются на простые сахара, которые клетка использует для получения энергии. Подобно тому, как энергия требуется как для строительства, так и для сноса здания, энергия требуется как для синтеза, так и для разрушения молекул.Кроме того, между клетками переносятся сигнальные молекулы, такие как гормоны и нейротрансмиттеры.
Патогенные бактерии и вирусы попадают в организм и разрушаются клетками. Клетки также должны экспортировать отходы и токсины, чтобы оставаться здоровыми, и многие клетки должны плавать или перемещать окружающие материалы за счет биения клеточных придатков, таких как реснички и жгутики.
Что мы будем изучать в отношении метаболизма
Перечисленные выше клеточные процессы требуют постоянного снабжения энергией.Откуда и в какой форме приходит эта энергия? Как живые клетки получают энергию и как они ее используют? Следующие несколько уроков будут обсуждать различные формы энергии и физические законы, управляющие передачей энергии. Эти уроки также расскажут, как клетки используют энергию и восполняют ее, и как химические реакции в клетке протекают с большой эффективностью.
Энергия и метаболизм
Ученые используют термин биоэнергетика , чтобы обсудить концепцию потока энергии (см. Изображение ниже) через живые системы, такие как клетки.Клеточные процессы, такие как построение и разрушение сложных молекул, происходят через ступенчатые химические реакции. Некоторые из этих химических реакций являются спонтанными и высвобождают энергию, тогда как другие требуют энергии для протекания.
Большинство форм жизни на Земле получают энергию от Солнца. Растения используют фотосинтез для улавливания солнечного света, а травоядные животные поедают эти растения для получения энергии. Плотоядные животные поедают травоядных, а разлагатели переваривают вещества растений и животных. Изображение предоставлено: OpenStax Biology
Точно так же, как живые существа должны постоянно потреблять пищу, чтобы восполнить то, что было использовано, клетки должны постоянно производить больше энергии, чтобы восполнить то, что используется многими химическими реакциями, требующими энергии, которые постоянно происходят.Мы говорим обо всех химических реакциях, которые происходят внутри клеток, включая те, которые используют энергию и те, которые высвобождают энергию, — это метаболизм клетки .
Метаболизм глутамина влияет на передачу сигналов и функцию Т-клеток — ScienceDaily
Глютамин запускает метаболический сигнальный путь, который способствует функционированию некоторых Т-клеток иммунной системы и подавляет другие, обнаружили исследователи Вандербильта.
Они показывают, что лекарство, подавляющее метаболизм глютамина, которое в настоящее время проходит клинические испытания в качестве противоракового средства, также может быть полезно для лечения воспалительных и аутоиммунных заболеваний.В исследовании, опубликованном в Интернете на этой неделе в журнале Cell , также предлагаются стратегии использования препарата для усиления иммунотерапии рака.
Джеффри Ратмелл, доктор философии, профессор иммунобиологии Корнелиус Вандербильт, и его коллеги сосредоточились на попытке понять, как клетка объединяет свои питательные вещества и метаболизм со своими функциями. Ранее они продемонстрировали важность клеточного топлива глюкозы для активации и функции Т-лимфоцитов, которые вызывают воспаление и устраняют патогены.
В текущей работе они обратили внимание на другое важное топливо: глутамин, который в первую очередь изучался в контексте метаболизма раковых клеток. Несколько компаний разрабатывают препараты, подавляющие метаболизм глутамина, чтобы уменьшить рост и разрастание раковых клеток.
Исследователи ожидали, что ингибирование метаболизма глютамина — например, блокирование метаболизма глюкозы — предотвратит активацию и функционирование Т-клеток. Они использовали препарат, который подавляет первую ступень метаболизма глутамина, фермент под названием глутаминаза.Они также изучали мышей с целевой генетической делецией гена глутаминазы.
Исследователи были удивлены, обнаружив, что определенные Т-клетки — те, которые обеспечивают противовирусные и противораковые реакции — работают лучше в отсутствие активности глутаминазы. Другие Т-клетки, участвующие в воспалительных и аутоиммунных заболеваниях, работали хуже.
«Мы были заинтригованы тем, что одно метаболическое нарушение может по-разному влиять на функции подмножеств Т-клеток», — сказал Марк Джонсон, аспирант, который руководил исследованиями.
Результаты соответствуют исследованиям метаболизма глютамина в раковых клетках, сказал Ратмелл, который также является профессором патологии, микробиологии и иммунологии.
«Это соединение (которое ингибирует глутаминазу) работает в некоторых опухолях и не работает в других. Марк обнаружил, что то же самое и с Т-клетками: некоторым Т-клеткам нужен этот путь, а некоторым нет», — сказал Ратмелл. «Если мы заблокируем этот путь, аутоиммунные Т-клетки не будут так хорошо себя чувствовать, а противораковые Т-клетки — лучше».
Исследователи продемонстрировали на мышиных моделях аллергической астмы, воспалительного заболевания кишечника и хронической реакции «трансплантат против хозяина», что устранение активности глутаминазы защищает от воспаления и болезней.
«Ингибитор глутаминазы обладает замечательным профилем безопасности, и мы думаем, что он может быть повторно использован при потенциально множестве воспалительных и аутоиммунных заболеваний», — сказал Ратмелл.
Чтобы изучить влияние ингибирования глутаминазы на Т-клетки, которые опосредуют противоопухолевые реакции, исследователи использовали препарат на мышиной модели Т-клеточной терапии CAR (рецептор химерного антигена). CAR Т-клетки — это Т-клетки, убивающие рак, которые были генетически сконструированы для распознавания определенных раковых клеток.
На мышиной модели исследователи обнаружили, что лечение ингибитором глутаминазы улучшает функцию CAR Т-клеток, но со временем эта улучшенная функция теряется. Более короткое воздействие ингибитора улучшало функцию CAR Т-клеток, и Т-клетки сохранялись в течение более длительного периода времени.
«Одна из проблем терапии CAR Т-клетками — это выживание созданных клеток», — сказал Джонсон. «Мы думаем, что кратковременное лечение ингибитором глутаминазы может улучшить устойчивость CAR Т-клеток.«
Результаты имеют значение для текущих клинических испытаний ингибитора глутаминазы в сочетании с иммунотерапией, называемой ингибиторами контрольных точек, сказал Ратмелл.
«Наши данные показывают, что комбинация лекарств может работать лучше всего, если вы дадите ингибитор глутаминазы на короткий период времени, а затем удалите его».
Исследователи тестируют различные схемы дозирования на мышиных моделях рака.
Исследователи также исследовали механистические изменения, возникающие в результате ингибирования глутаминазы, и продемонстрировали, что метаболический путь глутамина — обычно считающийся единственным источником энергии — тесно интегрирован с передачей сигналов в клетках и экспрессией генов.
«Изменяя этот метаболический фермент, мы воздействуем на последующий метаболит, который напрямую изменяет хроматин, доступность и экспрессию генов», — сказал Ратмелл. «Как концепция, идея о том, что метаболические пути являются сигнальными путями, относительно нова».
Это исследование было поддержано грантами Национальных институтов здравоохранения (HL136664, DK105550, CA217987, CA193256, CA001423). Calithera Biosciences предоставила некоторые ингибиторы глутаминазы для исследований in vitro.
Введение в клеточный метаболизм
Клеточный метаболизм относится к жизненно важным метаболическим реакциям, происходящим внутри клетки. Когда большинство людей думают о «метаболизме», они ассоциируют его с «сжиганием» или расщеплением питательных веществ. Однако в клеточной биологии метаболизм включает в себя «катаболизм», который представляет собой расщепление молекул, и «анаболизм», который представляет собой синтез новых биологических соединений. Эти процессы обеспечивают клетки энергией и, соответственно, помогают строить их компоненты.
В этом видео мы углубимся в основные открытия, которые способствовали нашему пониманию клеточного метаболизма. Мы продолжим изучение ключевых вопросов в этой области и некоторых методов, используемых в настоящее время для изучения метаболических путей.
Давайте погрузимся в богатую историю клеточного метаболизма.
Между 1770 и 1805 годами четыре химика провели ключевые эксперименты, которые помогли объяснить, как растения производят «массу» для роста. Их работа привела к основной реакции фотосинтеза, которая установила, что при солнечном свете растения поглощают углекислый газ и воду и производят кислород и органические вещества.Позднее, в 1860-х годах, Юлиус фон Закс определил, что этот органический материал представляет собой крахмал, состоящий из сахара и глюкозы.
Итак, заводы производят сахар. Но мы потребляем это. Так что же происходит с сахаром в нашем организме? Возможный ответ пришел в 1930-х годах, когда Густав Эмбден, Отто Мейерхоф и Якоб Парнас описали гликолиз — путь, по которому глюкоза расщепляется на пируват. Теперь мы знаем, что гликолиз также производит аденозинтрифосфат или АТФ.
Структура АТФ была определена в 1935 году в лаборатории Мейерхофа Карлом Ломанном.Мейерхоф и Ломанн предположили, что АТФ может «хранить» энергию, что было подтверждено Фрицем Липманном в 1941 году, который идентифицировал богатые энергией связи в АТФ и представил теорию, согласно которой эти связи могут использоваться во время биосинтеза.
Параллельно Ганс Кребс обнаружил, что окисление глюкозы или пирувата может стимулироваться рядом кислот, все из которых являются частью циклических реакций, образующих цикл трикарбоновых кислот, сокращенно называемый циклом TCA. Его главный вклад заключался в том, что оксалоацетат и пируват можно превратить в цитрат, что дало этой серии окисления циклическую форму.
В 1946 году Липманн и Натан Каплан дополнительно выяснили реакцию превращения пирувата в цитрат, открыв кофермент А. Теперь мы знаем, что пируват взаимодействует с этим ферментом с образованием ацетил-кофермента А, который запускает цикл ТСА.
Позже, между 1950-ми и 1970-ми годами, исследователи определили, что электроны, высвобождаемые во время цикла TCA, могут «переноситься» в белковые комплексы, расположенные в митохондриях, по пути, называемому цепью переноса электронов. Важно отметить, что в 1961 году Питер Митчелл предположил, что перенос электронов между этими комплексами создает протонный «градиент», который может управлять производством большей части АТФ в клетке.
Взятые вместе, открытия фотосинтеза, гликолиза, цикла TCA и цепи переноса электронов сформировали основу, на которой сегодня основываются исследования клеточного метаболизма.
Хотя эти исторические открытия предоставили огромное представление о метаболических путях, они также породили несколько вопросов. Давайте рассмотрим некоторые из тех, на которые нет ответа.
Сегодня исследователи изучают, как на метаболические пути влияют стрессовые факторы окружающей среды, такие как токсины или радиация.В частности, представляет интерес то, как такие факторы приводят к аномальному образованию активных форм кислорода, таких как свободные радикалы, которые обладают неспаренными электронами на атомах кислорода, что делает их очень реактивными. Эти молекулы могут повредить другие клеточные компоненты и привести к окислительному стрессу.
Окислительный стресс участвует в клеточном старении и смерти, а также в возникновении и прогрессировании рака. Следовательно, клеточные биологи заинтересованы в определении того, как эти активные виды влияют на нормальные физиологические процессы клетки, такие как деление клетки.Обладая этой информацией, они могут сделать дальнейшие выводы о роли этих видов в патологических событиях.
Наконец, нескольких исследователей интересуют метаболические нарушения — состояния, при которых нарушаются определенные метаболические реакции. К ним относятся такие заболевания, как диабет, когда организм не может усваивать сахар. В настоящее время исследователи пытаются определить факторы, такие как гены или сигналы окружающей среды, которые способствуют возникновению таких заболеваний. В конечном итоге это поможет им разработать более эффективные методы лечения пациентов.
Теперь, когда вы услышали несколько неотложных вопросов в области клеточного метаболизма, давайте рассмотрим экспериментальные методы, которые ученые используют для их решения.
Конечной целью многих катаболических процессов в живых клетках является выработка АТФ, который является основной молекулой хранения энергии, используемой клетками. Следовательно, такие методы, как анализ биолюминесценции АТФ, который определяет количественно АТФ в образце с помощью реакции люминесценции, могут дать представление о метаболической активности клеток.
Другие методы нацелены на конкретные метаболические пути. Например, исследователи могут оценить метаболизм гликогена в его мономер глюкозу. Один из способов сделать это — переработать глюкозу, полученную из гликогена, в продукты, которые будут реагировать с детектирующими зондами и вызывать изменение цвета или флуоресценцию. Таким образом, исследователи могут подсчитать, сколько гликогена изначально присутствовало в их образцах.
Напротив, аномальный метаболизм может быть обнаружен путем измерения активных форм кислорода.Обычно исследователи используют зонд, который флуоресцирует после «нападения» представителя этих видов. Эти анализы напрямую определяют количество активных метаболитов кислорода и, следовательно, помогают в обнаружении окислительного стресса.
Наконец, исследователи анализируют метаболизм на уровне организма с помощью «Метаболического профилирования». С помощью передовых методов, таких как высокоэффективная жидкостная хроматография или ВЭЖХ, масс-спектрометрия или МС, ученые могут количественно определять метаболиты, присутствующие в биологических образцах, и определять, застопорились ли определенные метаболические пути или они чрезмерно активны.
Имея в своем распоряжении все эти инструменты, давайте посмотрим, как ученые применяют их в экспериментах.
Некоторые ученые применяют эти методы для разработки новых способов диагностики нарушений обмена веществ. Здесь был разработан протокол для выделения мононуклеарных клеток периферической крови или PBMC из образцов крови пациентов с целью оценки содержания в них гликогена. С помощью анализа окрашивания, специфичного для метаболизма гликогена, исследователи получили представление о количестве гликогена, присутствующего в этих образцах.В будущем этот метод может помочь диагностировать пациентов с заболеваниями, связанными с обменом гликогена.
Другие исследователи используют эти инструменты для изучения влияния стресса окружающей среды на метаболизм. В этом эксперименте ученые измерили активные формы кислорода в эмбрионах рыбок данио, обработанных химическим веществом, называемым ротеноном, или после повреждения их хвостов. Это было сделано с помощью зонда, который флуоресцирует красным при нацеливании на активные формы кислорода.

