Функции редких аминокислот: Карта сайта
Редкие аминокислоты и аналоги аминокислот
Редкие аминокислоты и аналоги аминокислот, встречающиеся в природных [c.439]Редкие аминокислоты и аналоги аминокислот 373 [c.373]
Адапторная гипотеза объясняет также два важных экспериментальных факта. С одной стороны, для любого полипептида, однозначно определяемого соответствующим геном, включение природных, но неподходящих для данного места аминокислот — крайне редкий факт. С другой стороны, многие аналоги аминокислот, например такие, как селенометионин (аналог метионина), тг-фторфенилаланин или тиенилаланин (аналоги фенилаланина), 5-окситриптофан или азатриптофан (аналоги триптофана) и ряд других, легко включаются в места, предназначенные для тех аминокислот, аналогами которых они являются. Таким образом, аминокислоты могут включаться в места, предназначенные для их природных аналогов, только в том случае, если им удастся обмануть активирующий фермент. [c.
Интересно отметить, что в белках наиболее распространены а-аминокислоты, и редко встречаются р-аминокислоты 3) многие аминокислоты содержат асимметрический атом углерода, т. е. имеют оптические изомеры. Это можно продемонстрировать на примере существующей в двух изомерных формах а-амннопропионовой кислоты, являющейся аналогом а-оксппроппоповой кислоты [c.409]
Цитозин, урацил и тимин содержатся в нуклеиновых кислотах в значительных количествах, а 5-метилцитозин и 5-оксиметилцитозин—в ничтожных и далеко не всегда. Поэтому они называются минорными (экзотическими) основаниями. По аналогии с редкими аминокислотами в составе белков их можно было бы назвать иногда встречающимися в составе нуклеиновьк кислот основаниями. В последние годы список минорных оснований пиримидинового ряда, обнаруженных в составе нуклеиновых кислот, пополнился (табл. 15).
Углеводные цепи П. , выделенных из разл. бактерий, отличаются незначительно. Так, аминогруппы остатков мурамовой к-ты в нек-рых П. могут быть свободны, ацилированы гликолевой к-той нли образуют амидную связь с соседней карбоксильной группой изредка встречается аналог мурамовой к-ты, имеющий О-.и гаю-конфигурацию. Аминогруппы остатков глюкозамина также иногда свободны отдельные гидроксильные группы полимера м. б. ацетилирова-иы илн фосфорилированы. Напротив, пептидные фрагменты П. характеризуются очень сильной изменчивостью известно ок. 100 разл. структур пептидных участков, общими чертами к-рых является обязательное наличие остатков аминокислот D-ряда и присутствие редких диаминокислот (L-гидроксили-
, выделенных из разл. бактерий, отличаются незначительно. Так, аминогруппы остатков мурамовой к-ты в нек-рых П. могут быть свободны, ацилированы гликолевой к-той нли образуют амидную связь с соседней карбоксильной группой изредка встречается аналог мурамовой к-ты, имеющий О-.и гаю-конфигурацию. Аминогруппы остатков глюкозамина также иногда свободны отдельные гидроксильные группы полимера м. б. ацетилирова-иы илн фосфорилированы. Напротив, пептидные фрагменты П. характеризуются очень сильной изменчивостью известно ок. 100 разл. структур пептидных участков, общими чертами к-рых является обязательное наличие остатков аминокислот D-ряда и присутствие редких диаминокислот (L-гидроксили-
Следует отметить, что фермент, катализирующий окислительное декарбоксилирование указанных а-кетокислот, высокоспецифичен (по аналогии с пируватдегидрогеназным и а-кетоглутаратдегидрогеназным комплексами) и также нуждается в присутствии всех пяти кофакторов (см. главу 10). Известно наследственное заболевание болезнь кленового сиропа , при которой нарушено декарбоксилирование указанных а-кетокислот (вследствие синтеза дефектного дегидрогеназного комплекса), что приводит не только к накоплению в крови аминокислот и а-кетокислот, но и к их экскреции с мочой, издающей запах кленового сиропа.
Гликопротеины имеют относительно короткие олигосахарид-ные цепи, содержащие от 4 до 15 углеводных остатков. В них найдены следующие углеводы п-галактоза, в-манноза, п-глюко-замин, п-глюкоза (редко), п-галактозамин (всегда в виде N-ацетильного производного), ь-фукоза и Ы-ацетилнейраминовая кислота. По аналогии с белками, первичные структуры которых строятся из 20 наиболее распространенных аминокислот, можно составить практически неограниченное число олигосахарндных структур с линейными или разветвленными цепями. [c.58]
Гипоталамус вьвделяеТ гонадолиберин, гормон, стимулирующий секрецию гипофизом ряда гормонов, участвующих в механизмах размножения.
Подобно своим 2- и 4-аналогам р-(пиримидил-5) аланины являются кристаллическими веществами с высокими и, как правило, нехарактерными температурами плавления. Они обладают амфотерными свойствами, не растворяются (за редкими исключениями) в низкополярных растворителях и интенсивно поглощают УФ-лучи. В отличие, однако, от пиримидил-2- и пиримидил-4-аминокислот р-(пиримидил-5) аланины дают с нингидрином сине-лиловое окращивание, характерное для большинства а-аминокислот. Эта особенность позволяет легко дифференцировать пиримидил-5-аминокислоты от пиримидил-С-а-аминокислот иных типов. В то же время идентификация пиримидил-5-аминокислот в смесях с обычными а-аминокислотами, как правило, требует дополнительных мер.
Карта сайта
Страница не найдена. Возможно, карта сайта Вам поможет.
- Главная
-
Университет
- Об университете
- Структура
- Нормативные документы и процедуры
- Лечебная деятельность
- Международное сотрудничество
-
Пресс-центр
- Новости
- Анонсы
- События
- Объявления и поздравления
- Online конференции
-
Фотоальбом
- Товарищеский турнир по мини-футболу
- Конференция «Современные проблемы радиационной и экологической медицины, лучевой диагностики и терапии»
- Посвящение в первокурсники-2021
-
Встреча заместителя министра здравоохранения Д.
 В. Чередниченко со студентами
В. Чередниченко со студентами
- Открытый диалог, приуроченный к 19-летию БРСМ
- Группа переподготовки по специальности «Организация здравоохранения»
- Собрания факультетов для первокурсников-2021
- День знаний — 2021
- Совет университета
- Студенты военной кафедры ГрГМУ приняли присягу
- День освобождения Гродно-2021
- Ремонтные и отделочные работы
- Итоговая практика по военной подготовке
- День Независимости-2021
- Студенты военной кафедры ГрГМУ: итоговая практика-2021
- Выпускной лечебного факультета-2021
- Выпускной медико-психологического и медико-диагностического факультетов-2021
- Выпускной педиатрического факультета-2021
- Выпускной факультета иностранных учащихся-2021
- Вручение дипломов выпускникам-2021
- Митинг-реквием, посвященный 80-й годовщине начала Великой Отечественной войны
- Акция «Память», приуроченная к 80-летию начала Великой Отечественной войны
- Республиканский легкоатлетический студенческий забег «На старт, молодежь!»
- Актуальные вопросы гигиены питания
- Торжественное мероприятие к Дню медицинских работников-2021
- Совет университета
- Выездное заседание Республиканского совета ректоров
- Церемония вручения медалей и аттестатов особого образца выпускникам 2021 года
- Предупреждение деструктивных проявлений в студенческой среде и влияния агрессивного информационного контента сети интернет
- Онлайн-выставка «Помнить, чтобы не повторить»
- Областная межвузовская конференция «Подвиг народа бессмертен»
- Финал первого Республиканского интеллектуального турнира ScienceQuiz
- Конференция «Актуальные вопросы коморбидности заболеваний в амбулаторной практике: от профилактики до лечения»
- День семьи-2021
- Диалоговая площадка с председателем Гродненского областного Совета депутатов
- Праздничные городские мероприятия к Дню Победы
- Областной этап конкурса «Королева студенчества-2021″
- Праздничный концерт к 9 мая 2021
- IV Республиканский гражданско-патриотический марафон «Вместе – за сильную и процветающую Беларусь!»
- Университетский кубок КВН-2021
- Музыкальная планета студенчества (завершение Дней ФИУ-2021)
- Молодёжный круглый стол «Мы разные, но мы вместе»
-
Дни ФИУ-2021.
 Интеллектуальная игра «Что?Где?Когда?»
Интеллектуальная игра «Что?Где?Когда?»
- Неделя донорства в ГрГМУ
- Творческая гостиная. Дни ФИУ-2021
- Открытие XVIII студенческого фестиваля национальных культур
- Передвижная мультимедийная выставка «Партизаны Беларуси»
- Республиканский субботник-2021
- Семинар «Человек внутри себя»
- Международный конкурс «Здоровый образ жизни глазами разных поколений»
- Вручение нагрудного знака «Жена пограничника»
- Встреча с представителями медуниверситета г. Люблина
- Королева Студенчества ГрГМУ — 2021
- День открытых дверей-2021
- Управление личными финансами (встреча с представителями «БПС-Сбербанк»)
- Весенний «Мелотрек»
- Праздничный концерт к 8 Марта
- Диалоговая площадка с председателем Гродненского облисполкома
- Расширенное заседание совета университета
- Гродно — Молодежная столица Республики Беларусь-2021
- Торжественное собрание, приуроченное к Дню защитника Отечества
- Вручение свидетельства действительного члена Белорусской торгово-промышленной палаты
- Новогодний ScienceQuiz
- Финал IV Турнира трех вузов ScienseQuiz
- Областной этап конкурса «Студент года-2020″
- Семинар дистанционного обучения для сотрудников университетов из Беларуси «Обеспечение качества медицинского образования и образования в области общественного здоровья и здравоохранения»
- Студент года — 2020
- День Знаний — 2020
- Церемония награждения лауреатов Премии Правительства в области качества
- Военная присяга
- Выпускной лечебного факультета-2020
- Выпускной медико-психологического факультета-2020
- Выпускной педиатрического факультета-2020
- Выпускной факультета иностранных учащихся-2020
- Распределение — 2020
- Стоп коронавирус!
- Навстречу весне — 2020
- Профориентация — 18-я Международная специализированная выставка «Образование и карьера»
- Спартакиада среди сотрудников «Здоровье-2020″
- Конференция «Актуальные проблемы медицины»
- Открытие общежития №4
- Встреча Президента Беларуси со студентами и преподавателями медвузов
- Новогодний утренник в ГрГМУ
-
XIX Республиканская студенческая конференция «Язык.
 Общество. Медицина»
Общество. Медицина»
- Alma mater – любовь с первого курса
- Актуальные вопросы коморбидности сердечно-сосудистых и костно-мышечных заболеваний в амбулаторной практике
- Областной этап «Студент года-2019″
- Финал Science Qiuz
- Конференция «Актуальные проблемы психологии личности и социального взаимодействия»
- Посвящение в студенты ФИУ
- День Матери
- День открытых дверей — 2019
- Визит в Азербайджанский медицинский университет
- Семинар-тренинг с международным участием «Современные аспекты сестринского образования»
- Осенний легкоатлетический кросс — 2019
- 40 лет педиатрическому факультету
- День Знаний — 2019
- Посвящение в первокурсники
- Акция к Всемирному дню предотвращения суицида
- Турслет-2019
- Договор о создании филиала кафедры общей хирургии на базе Брестской областной больницы
- День Независимости
- Конференция «Современные технологии диагностики, терапии и реабилитации в пульмонологии»
- Выпускной медико-диагностического, педиатрического факультетов и факультета иностранных учащихся — 2019
- Выпускной медико-психологического факультета — 2019
- Выпускной лечебного факультета — 2019
- В добрый путь, выпускники!
- Распределение по профилям субординатуры
- Государственные экзамены
- Интеллектуальная игра «Что? Где? Когда?»
- Мистер и Мисс факультета иностранных учащихся-2019
- День Победы
- IV Республиканская студенческая военно-научная конференция «Этих дней не смолкнет слава»
- Республиканский гражданско-патриотический марафон «Вместе — за сильную и процветающую Беларусь!»
- Литературно-художественный марафон «На хвалях спадчыны маёй»
- День открытых дверей-2019
- Их имена останутся в наших сердцах
- Областной этап конкурса «Королева Весна — 2019″
- Королева Весна ГрГМУ — 2019
-
Профориентация «Абитуриент – 2019» (г.
 Барановичи)
Барановичи)
- Мероприятие «Карьера начинается с образования!» (г. Лида)
- Итоговое распределение выпускников — 2019
- «Навстречу весне — 2019″
- Торжественная церемония, посвященная Дню защитника Отечества
- Торжественное собрание к Дню защитника Отечества — 2019
- Мистер ГрГМУ — 2019
- Предварительное распределение выпускников 2019 года
- Митинг-реквием у памятника воинам-интернационалистам
- Профориентация «Образование и карьера» (г.Минск)
- Итоговая коллегия главного управления здравоохранения Гродненского областного исполнительного комитета
- Спартакиада «Здоровье — 2019»
-
Итоговая научно-практическая конференция «Актуальные проблемы медицины».

- Расширенное заседание Совета университета.
- Научно-практическая конференция «Симуляционные технологии обучения в подготовке медицинских работников: актуальность, проблемные вопросы внедрения и перспективы»
- Конкурс первокурсников «Аlma mater – любовь с первого курса»
- XVI съезд хирургов Республики Беларусь
- Итоговая практика
- Конкурс «Студент года-2018»
- Совет университета
- 1-й съезд Евразийской Аритмологической Ассоциации (14.09.2018 г.)
- 1-й съезд Евразийской Аритмологической Ассоциации (13.09.2018 г.)
- День знаний
- День независимости Республики Беларусь
- Церемония награждения победителей конкурса на соискание Премии СНГ
- День герба и флага Республики Беларусь
- «Стань донором – подари возможность жить»
- VIII Международный межвузовский фестиваль современного танца «Сделай шаг вперед»
- Конкурс грации и артистического мастерства «Королева Весна ГрГМУ – 2018»
- Окончательное распределение выпускников 2018 года
- Митинг-реквием, приуроченный к 75-летию хатынской трагедии
- Областное совещание «Итоги работы терапевтической и кардиологической служб Гродненской области за 2017 год и задачи на 2018 год»
- Конкурсное шоу-представление «Мистер ГрГМУ-2018»
- Предварительное распределение выпускников 2018 года
- Итоговая научно-практическая конференция «Актуальные проблемы медицины»
- II Съезд учёных Республики Беларусь
- Круглый стол факультета иностранных учащихся
- «Молодежь мира: самобытность, солидарность, сотрудничество»
- Заседание выездной сессии Гродненского областного Совета депутатов
- Областной этап республиканского конкурса «Студент года-2017»
- Встреча с председателем РОО «Белая Русь» Александром Михайловичем Радьковым
-
Конференция «Актуальные вопросы инфекционной патологии», 27.
 10.2017
10.2017
- XIX Всемирный фестиваль студентов и молодежи
- Республиканская научно-практическая конференция «II Гродненские аритмологические чтения»
- Областная научно-практическая конференция «V Гродненские гастроэнтерологические чтения»
- Праздник, посвящённый 889-летию города Гродно
- Круглый стол на тему «Место и роль РОО «Белая Русь» в политической системе Республики Беларусь» (22.09.2017)
- ГрГМУ и Университет медицины и фармации (г.Тыргу-Муреш, Румыния) подписали Соглашение о сотрудничестве
- 1 сентября — День знаний
- Итоговая практика на кафедре военной и экстремальной медицины
- Квалификационный экзамен у врачей-интернов
- Встреча с Комиссией по присуждению Премии Правительства Республики Беларусь
- Научно-практическая конференция «Амбулаторная терапия и хирургия заболеваний ЛОР-органов и сопряженной патологии других органов и систем»
- День государственного флага и герба
- 9 мая
- Республиканская научно-практическая конференция с международным участием «V белорусско-польская дерматологическая конференция: дерматология без границ»
- «Стань донором – подари возможность жить»
- «Круглый стол» Постоянной комиссии Совета Республики Беларусь Национального собрания Республики Беларусь по образованию, науке, культуре и социальному развитию
- Весенний кубок КВН «Юмор–это наука»
- Мисс ГрГМУ-2017
- Распределение 2017 года
- Общегородской профориентационный день для учащихся гимназий, лицеев и школ
- Праздничный концерт, посвященный Дню 8 марта
- Конкурсное шоу-представление «Мистер ГрГМУ–2017»
- «Масленица-2017»
- Торжественное собрание и паздничный концерт, посвященный Дню защитника Отечества
-
Лекция профессора, д.
 м.н. О.О. Руммо
м.н. О.О. Руммо
- Итоговая научно-практическая конференция «Актуальные проблемы медицины»
- Меморандум о сотрудничестве между областной организацией Белорусского общества Красного Креста и региональной организацией Красного Креста китайской провинции Хэнань
- Визит делегации МГЭУ им. А.Д. Сахарова БГУ в ГрГМУ
- «Студент года-2016»
- Визит Чрезвычайного и Полномочного Посла Королевства Швеция в Республике Беларусь господина Мартина Оберга в ГрГМУ
- Конкурс первокурсников «Аlma mater – любовь с первого курса»
- День матери в ГрГМУ
- Итоговая практика-2016
- День знаний
- Визит китайской делегации в ГрГМУ
- Визит иностранной делегации из Вроцлавского медицинского университета (Республика Польша)
- Торжественное мероприятие, посвященное профессиональному празднику – Дню медицинского работника
- Визит ректора ГрГМУ Виктора Александровича Снежицкого в Индию
- Республиканская университетская суббота-2016
- Республиканская акция «Беларусь против табака»
- Встреча с поэтессой Яниной Бокий
- 9 мая — День Победы
- Митинг, посвященный Дню Государственного герба и Государственного флага Республики Беларусь
- Областная межвузовская студенческая научно-практическая конференция «1941 год: трагедия, героизм, память»
- «Цветы Великой Победы»
- Концерт народного ансамбля польской песни и танца «Хабры»
- Суботнiк ў Мураванцы
- «Мисс ГрГМУ-2016»
- Визит академика РАМН, профессора Разумова Александра Николаевича в УО «ГрГМУ»
- Визит иностранной делегации из Медицинского совета Мальдивской Республики
- «Кубок ректора Гродненского государственного медицинского университета по дзюдо»
- «Кубок Дружбы-2016» по мини-футболу среди мужских и женских команд медицинских учреждений образования Республики Беларусь
- Распределение выпускников 2016 года
- Визит Министра обороны Республики Беларусь на военную кафедру ГрГМУ
- Визит Первого секретаря Посольства Израиля Анны Кейнан и директора Израильского культурного центра при Посольстве Израиля Рей Кейнан
- Визит иностранной делегации из провинции Ганьсу Китайской Народной Республики в ГрГМУ
- Состоялось открытие фотовыставки «По следам Библии»
- «Кубок декана» медико-диагностического факультета по скалолазанию
- Мистер ГрГМУ-2016
- Приём Первого секретаря Посольства Израиля Анны Кейнан в ГрГМУ
- Спартакиада «Здоровье» УО «ГрГМУ» среди сотрудников 2015-2016 учебного года
- Визит Посла Республики Индия в УО «ГрГМУ»
- Торжественное собрание и концерт, посвященный Дню защитника Отечества
- Митинг-реквием, посвященный Дню памяти воинов-интернационалистов
- Итоговое заседание коллегии главного управления идеологической работы, культуры и по делам молодежи Гродненского облисполкома
- Итоговая научно-практическая конференция Гродненского государственного медицинского университета
- Новогодний концерт
- Открытие профессорского консультативного центра
- Концерт-акция «Молодёжь против СПИДа»
- «Студент года-2015»
- Открытые лекции профессора, академика НАН Беларуси Островского Юрия Петровича
- «Аlma mater – любовь с первого курса»
- Открытая лекция Регионального директора ВОЗ госпожи Жужанны Якаб
- «Открытый Кубок по велоориентированию РЦФВиС»
-
Совместное заседание Советов университетов г.
 Гродно
Гродно
- Встреча с Министром здравоохранения Республики Беларусь В.И. Жарко
- День города
- Дебаты «Врач — выбор жизни»
- День города
- Праздничный концерт «Для вас, первокурсники!»
- Акция «Наш год – наш выбор»
- День знаний
- Открытое зачисление абитуриентов в УО «Гродненский государственный медицинский университет»
- Принятие военной присяги студентами ГрГМУ
- День Независимости Республики Беларусь
- Вручение дипломов выпускникам 2015 года
- Республиканская олимпиада студентов по педиатрии
- Открытие памятного знака в честь погибших защитников
- 9 мая
- «Вторая белорусско-польская дерматологическая конференция: дерматология без границ»
- Мистер университет
- Мисс универитет
- КВН
- Гродненский государственный медицинский университет
- Чествование наших ветеранов
- 1 Мая
- Cовместный субботник
- Наши издания
- Медицинский календарь
- Университет в СМИ
- Видео-презентации
- Общественные объединения
- Комиссия по противодействию коррупции
- Образовательная деятельность
- Абитуриентам
- Студентам
- Выпускникам
- Слайдер
- Последние обновления
- Баннеры
- Иностранному гражданину
- Научная деятельность
- Поиск
Ученые провели искусственный отбор бактерий, синтезирующих белки с участием дополнительных аминокислот
Не без помощи достижений генетики бактерии научислись синтезировать белки с «неестественными» аминокислотами.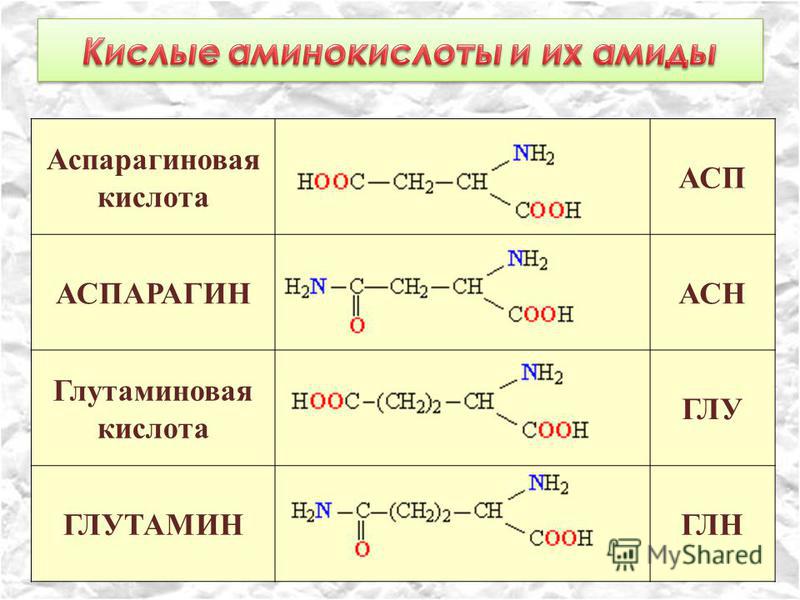 Отбор, которому их подвергли учёные, позволил синтезировать антитела к ВИЧ, даже более эффективные, чем те, что производит человеческий организм.
Отбор, которому их подвергли учёные, позволил синтезировать антитела к ВИЧ, даже более эффективные, чем те, что производит человеческий организм.
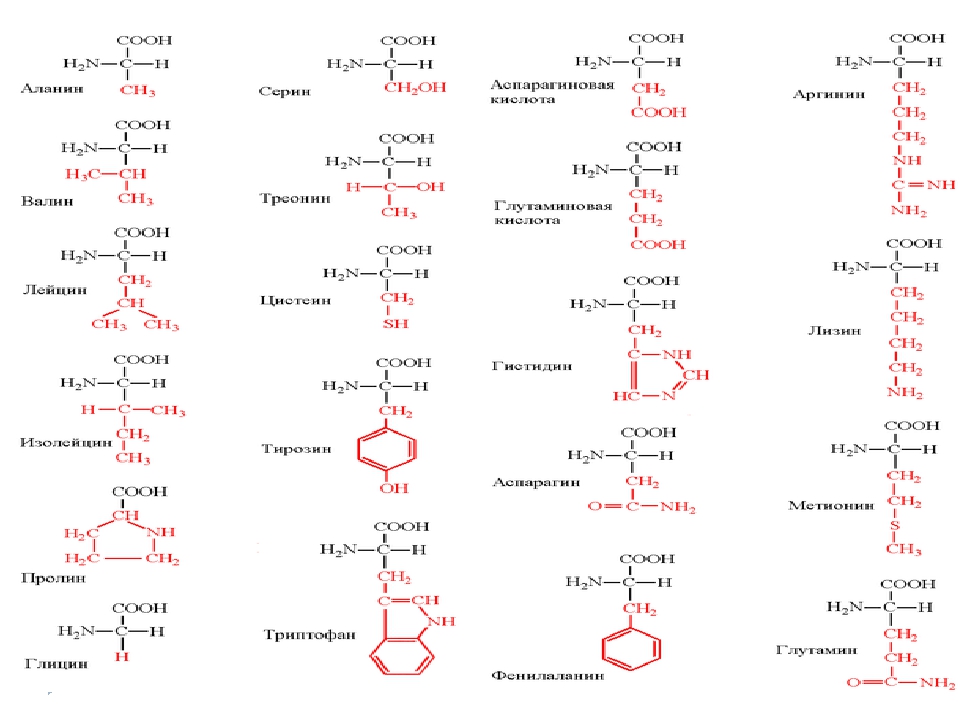
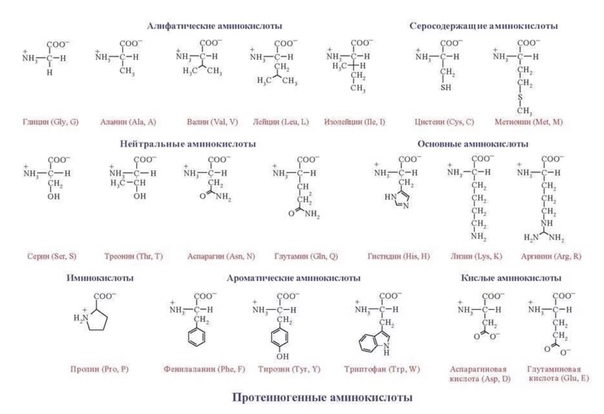
Все живые организмы за очень и очень редким исключением используют для построения своего организма двадцать основных, или канонических, как говорят биохимики, аминокислот. Этих двадцати кирпичиков хватило природе для создания необычайно разнообразных форм жизни, заселивших все уголки планеты.
Но достаточно ли двадцати аминокислот для полноценной эволюции? Отбросила ли природа лишнее, остановившись на этом наборе? И не будет ли эволюция живого более эффективной, если к двадцати каноническим аминокислотам добавить парочку «неканонических»?
Питер Шульц и Воун Шмайдер из Исследовательского института имени Скриппс в Калифорнии первыми решились перейти от подобных дискуссий к делу и поставить эксперимент, хоть отчасти способный ответить на этот фундаментальный вопрос. О том, насколько эволюция на основе 21 аминокислоты более эффективна, ученые рассказали в статье, опубликованной в журнале Proceedings of the National Academy of Sciences.
По всей строгости за такой эволюцией надо наблюдать в течение нескольких сотен тысячелетий, фиксируя скорость развития организмов, увеличение их разнообразия и собственно конкурентоспособности по отношению к «обычным». Но если учесть, что возможность управлять работой генома появилась у ученых только несколько десятилетий назад, то требовать от них подобного масштаба работы пока не приходится.
Это не помешало Шульцу и Шмайдеру провести скромный, но от этого не менее результативный эксперимент. Ученые решили отследить развитие одной функции у очень простых и быстро размножающихся организмов — бактерий.
Первая проблема, с которой столкнулись ученые, — вставить чужеродную аминокислоту в синтезируемый белок. В бактериальных, как и в наших, клетках сборка аминокислот в пептидную цепочку осуществляется по матрице — последовательности нуклеотидов в информационной РНК (иРНК), выстроенной, в свою очередь, по образу и подобию ДНК.
Кодон (кодирующий тринуклеотид)
единица генетического кода, тройка нуклеотидных остатков (триплет) в ДНК или РНК, кодирующих включение одной аминокислоты. Последовательность кодонов в гене определяет последовательность аминокислот в полипептидной цепи белка, кодируемого…
Последовательность кодонов в гене определяет последовательность аминокислот в полипептидной цепи белка, кодируемого…
Но отдельными буквами в этой последовательности стоит считать не нуклеотиды, а кодоны — тройки нуклеотидов, которым соответствует та или иная аминокислота. И, как в любом предложении, не обходится и без «знаков препинания», тоже состоящих из трех нуклеотидов. Причем роль этих знаков может варьировать от организма к организму.
То есть кодоны, ничего не кодирующие в одном живом существе, в другом могут соответствовать вполне определенной аминокислоте.
Это обеспечивается разницей в логистике. Аминокислоты доставляются к месту сборки пептидной цепи на транспортных РНК. И, опять же, каждой аминокислоте соответствует одна тРНК, имеющая форму «листа клевера». С одного конца у такой тРНК участок для адресного связывания с иРНК (на которой записана генетическая информация), а с другого — участок для контакта с аминокислотой. То есть многочисленные тРНК выступают в роли посредников, обеспечивающих своевременную доставку аминокислот к месту сборки пептидов и при этом точное воспроизведение последовательности, записанной в иРНК.
То есть многочисленные тРНК выступают в роли посредников, обеспечивающих своевременную доставку аминокислот к месту сборки пептидов и при этом точное воспроизведение последовательности, записанной в иРНК.
close
100%
У некоторых организмов ряд тРНК просто отсутствует, из-за чего определённые триплеты на иРНК по умолчанию получаются «некодирующими» — клетка не может сопоставить с ними ни одну аминокислоту просто из-за отсутствия посредников.
Шульц и Шмайдер выделили несколько «некодирующих» кодонов в геноме бактерий кишечной палочки E.coli, и подобрали в других организмах несколько тРНК, которые способны сопоставить с этими кодонами аминокислоты.
Осталось только заменить канонические аминокислоты на хвосте «небактериальных» тРНК на неканонические.
Чтобы присоединить неканонические аминокислоты
пришлось научить особые ферменты синтетазы, соединяющие транспортные т-РНК и аминокислоты перед отправкой к месту сборки белка, прицеплять к т-РНК не природные аминокислоты, а те, что ученые выбрали при подготовке эксперимента.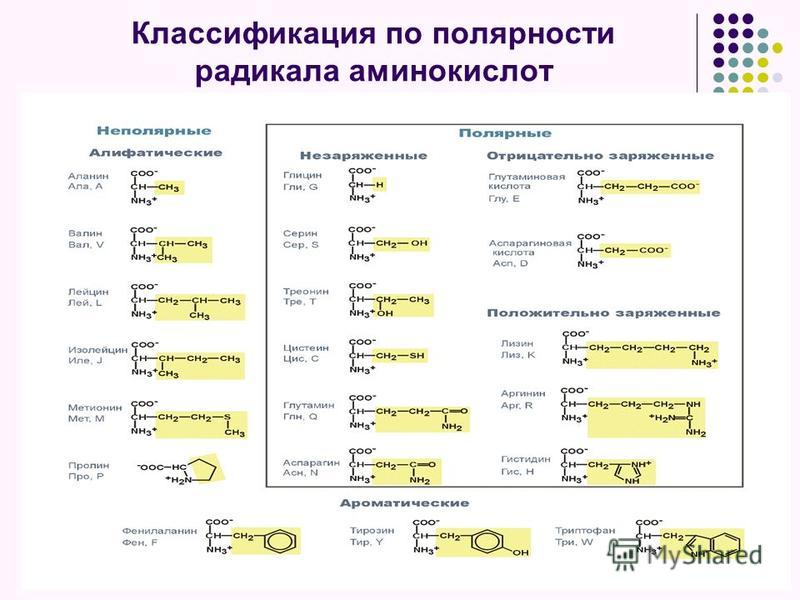 Пришлось…
Пришлось…
В результате специалисты вывели несколько штаммов кишечной палочки, способных наряду с каноническими двадцатью аминокислотами использовать при строительстве белков одну из четырех искусственных аминокислот: пара-ацетил-фенилаланин, бипиридил-аланин, сульфотирозин и 4-бороно-фенилаланин.
После чего генетики устроили своим подопечным «соревнования» — некое подобие естественного отбора, в котором бактериям по человеческой генетической матрице «предлагалось» синтезировать антитела к гликопротеину gp120, входящему в оболочку ВИЧ и давно ставшему важной мишенью при разработке лекарств и вакцин.
Штаммы, наделенные способностью синтезировать антитела с сульфотирозином, делали это не просто лучше своих товарищей, а даже эффективней, чем антитела к gp120, выделенные из плазмы крови человека. Так что если бы речь шла о вирусе, поражающем не человека, а бактерий, то прокариоты, умеющие использовать 21 аминокислоту, обладали бы явным преимуществом.
Конечно, в паре с продемонстрированными плюсами идут и недостатки: например, введение дополнительных тРНК может нарушить образование других белков, отвечающих за не менее важные жизненные функции.
Осторожные специалисты, комментируя свою работу, уделили больше внимания возможности введения искусственных аминокислот в состав природных белков, однако вывод о том, что их система показывает возможность использования «расширенного» генетического кода для создания преимуществ в направленной эволюции белков, Шульц и Шмайдер сделали. Для того чтобы узнать, скажется ли это на окружающем нас животном мире и на нас самих в будущем, осталось только подождать, хотя измененных E.coli генетики на свободу вроде бы не отпускали.
аминокислоты и симптомы белковой недостаточности у животных.
Белки – структурная и функциональная основа жизнедеятельности всех живых организмов.
Перечислим некоторые важные функции, которые выполняет белок в организме человека или животного:
— строительная – являются структурным компонентом клетки;
— регенеративная – используются для регенерации тканей;
— транспортная – транспортные белки переносят различные вещества;
— регуляторная – являются источником образования ферментов и гормонов;
— пищеварительная – в составе пищеварительных ферментов;
— каталитическая – увеличивают скорость биохимических реакций с помощью ферментов-катализаторов;
— двигательная – сократительные белки входят в состав мышечных клеток;
— поддерживают нормальное осмотическое давление в плазме;
— защитная – антитела (иммуноглобулины), барьерные белки – компоненты покровных тканей, лизоцим.
Несмотря на сложность строения и многообразие — все белки построены из сравнительно простых структурных элементов — аминокислот.
Аминокислоты бывают:
— заменимые – могут синтезироваться в организме в процессе обмена (из других аминокислот, поступающих в избытке) или поступать с пищей;
— незаменимые – могут поступать только с пищей, их синтез в организме невозможен.
Полный белок – пищевой источник белков, содержащий все незаменимые аминокислоты – мясо, рыба, яйца, птица и молоко.
Неполный белок – не содержит всех незаменимых аминокислот – овощи и злаки.
Недостаток поступления в организм аминокислот и нарушение их синтеза в организме приводит к прекращению образования белков, следствием будет количественная и качественная белковая недостаточность. Помните, любому живому организму требуется уход.
Помните, любому живому организму требуется уход.
Симптомы белковой недостаточности:
— заметная гипотония мышц и их дистрофия;
— появление отеков, которые маскируют падение массы тела;
— сухость и дряблость кожи, преждевременные морщины, гиперпигментация кожи;
— волосы становятся редкими, тонкими, неэластичными.
Нормы потребления белков зависят от разных факторов, назовем некоторые:
возраст, физические нагрузки, общее состояние организма…
— яичный белок – весьма ценный по составу и усвояемости в организме белок, который признан наукой эталонным. Куриный белок почти на 100% состоит из альбумина (овоальбумина), а желток содержит 7 различных белков;
— соевый белок – хорошо сбалансирован по незаменимым аминокислотам, снижает холестерин, но очень важна такая технология переработки соевых бобов, которая бы уменьшала количество ингибитора пищеварительного фермента трипсина;
— растительный белок усваивается плохо, так как, например, бобовые:
— содержат ингибиторы пищеварительных ферментов;
— трудно расщепляются до аминокислот;
— толстые оболочки клеток, не поддаются действию пищеварительных соков;
— белок молочной сыворотки – имеет наивысшую скорость расщепления среди цельных белков. Аминокислотный состав сывороточных белков наиболее близок к аминокислотному составу мышечной ткани человека.
Аминокислотный состав сывороточных белков наиболее близок к аминокислотному составу мышечной ткани человека.
Дмитрий Тамошкин – главный ветврач ветклиники «Ветус»
введение для айтишников / Хабр
Приятно видеть, что хабравчане регулярно интересуется другими предметными областями – например, биологией (более конкретно – структурой и функцией биологических макромолекул). Однако некоторые посты (например,
этот), вызывают у специалиста просто физическую боль из-за обилия совершенно диких фактологических ошибок. В этом посте мне хочется рассказать о структуре и функции белка. О том, что мы знаем и о том, чего не знаем, а так же об имеющихся в этой области вычислительных задачах, требующих решения и интересных IT-специалистам. Постараюсь рассказывать сжато и тезисно, чтобы информации было больше, а воды – меньше. Всех, интересующихся структурой белков, прошу под кат, там очень много букв.
1. Почему белки важны?
Как сказал Фридрих Энгельс, “Жизнь есть способ существования белковых тел”. В 19 веке еще не знали о роли ДНК в наследовании генетической информации, но утверждение дяди Фридриха в значительной мере справедливо до сих пор – основную работу в наших клетках совершают именно белки. Это и поддержание структуры (формы клеток), и химический катализ, и моторная функция (сокращение мышц, например), и транспорт (скажем, белок гемоглобин переносит кислород из легких в ткани и углекислый газ в обратном направлении) и сложные регуляторные функции по поддержанию постоянства внутренней среды (скажем, белковые гормоны и всякие внутриклеточные регуляторные системы) и многие другие. Словом, если в нашем организме что-то происходит, в это обязательно вовлечены белки (хотя и не только они).
В 19 веке еще не знали о роли ДНК в наследовании генетической информации, но утверждение дяди Фридриха в значительной мере справедливо до сих пор – основную работу в наших клетках совершают именно белки. Это и поддержание структуры (формы клеток), и химический катализ, и моторная функция (сокращение мышц, например), и транспорт (скажем, белок гемоглобин переносит кислород из легких в ткани и углекислый газ в обратном направлении) и сложные регуляторные функции по поддержанию постоянства внутренней среды (скажем, белковые гормоны и всякие внутриклеточные регуляторные системы) и многие другие. Словом, если в нашем организме что-то происходит, в это обязательно вовлечены белки (хотя и не только они).
2. Что такое белок?
С химической точки зрения белок – это линейный (неветвящийся) полимер, состоящий из монотонно повторяющихся одинаковых блоков «основной цепи», к которым приделаны различные «боковые группы». Так как блоки основной цепи несимметричны, вся полипептидная цепь белка имеет направление, различают N- и C-конец полипептидной цепи.
Длина цепи – от 70 до более чем 1000 мономеров (аминокислотных остатков), средняя длина для высших организмов – примерно 500-600 аминокислотных остатков, для бактерий эта величина будет меньше, скорее 300-400 остатков. Всего в природе существует 20 стандартных аминокислот, одинаковых и для бактерии и для человека, то есть из основной цепи могут торчать 20 разных боковых групп.
(Тут возможна поправка – некоторые химические группы могут быть модифицированны после синтеза белка, например, фосфорилированы. Однако это не рассматривается как другая аминокислота, а рассматривается как продукт модификации исходной. Так же у высших организмов возможно встраивание двух неканонических аминокислот, но это редкое событие. То есть, строго говоря, разных аминокислот 22, из них 20 основных и 2 редкие, плюс некоторые боковые группы могут быть изредка химически модифицированы).
Из поколения в поколение генетическая информация передается в виде ДНК, в ней есть так называемые «белок-кодирующие области». В этих местах ДНК однозначным образом (для ботанов – с точностью до альтернативного сплайсинга и редактирования РНК) закодирована информация о линейной последовательности аминокислот для синтеза данного белка, плюс в клетке есть соответствующие машины, способные синтезировать белок по информации, изначально закодированной в ДНК.
В этих местах ДНК однозначным образом (для ботанов – с точностью до альтернативного сплайсинга и редактирования РНК) закодирована информация о линейной последовательности аминокислот для синтеза данного белка, плюс в клетке есть соответствующие машины, способные синтезировать белок по информации, изначально закодированной в ДНК.
Так как белок – линейный полимер, собранный из 20 стандартных мономеров, его так называемую «первичную структуру» легко представить в виде строки, например так:
>small ubiquitin-related modifier 3 precursor [Homo sapiens] MSEEKPKEGVKTENDHINLKVAGQDGSVVQFKIKRHTPLSKLMKAYCERQG LSMRQIRFRFDGQPINETDTPAQLEMEDEDTIDVFQQQTGGVPESSLAGHSF
Это аминокислотная последовательность маленького человеческого белка в формате FASTA, первая строчка, начинающаяся с «>», описывает его название, после чего следует последовательность аминокислот в соответствии со стандартной кодировкой (например, М –метиони, S – серин и тд, всего 20 букв стандартного однобуквенного кода), слева – N-конец белка, справа – его С-конец. Для разных белков длина строки будет очевидно разной, так как белки имеют разную длину. Последовательности всех известных белков можно найти в открытом доступе здесь: www.ncbi.nlm.nih.gov
Для разных белков длина строки будет очевидно разной, так как белки имеют разную длину. Последовательности всех известных белков можно найти в открытом доступе здесь: www.ncbi.nlm.nih.gov
3. Структура белка
Хорошо, с первичной структурой разобрались, но разве белок работает в развернутом линейном виде? Конечно нет. Тут надо заметить, что со структурной точки зрения есть разные классы белков: глобулярные, мембранные и фибриллярные. Мембранные белки, как следует из названия, живут только в клеточных мембранах, для стабилизации их структуры нужно особое окружение мембраны, мы не будем их рассматривать в этом обзоре. Фибриллярные белки имеют простое регулярное строение, похожи на вытянутые волокна, они не растворимы в воде и выполняют структурные функции (например, из кератина состоят волосы, к фибриллярным белкам относится белок из натурального шёлка). Недавно стали выделять класс разупорядоченных белков – белков, не обладающих постоянной трехмерной структурой, либо приобретающих ее только на короткое время при взаимодействии с другими белками. Наиболее интересный с практической точки зрения класс белков, который мы и будем рассматривать – глобулярные водорастворимые белки, к этому классу относится большинство белков.
Наиболее интересный с практической точки зрения класс белков, который мы и будем рассматривать – глобулярные водорастворимые белки, к этому классу относится большинство белков.
Линейная полипептидная цепь в воде способна самопроизвольно сворачиваться в сложную трехмерную структуру (глобулу) и только в таком свернутом виде белки могут выполнять химический катализ и прочую интересную работу. Поэтому нам принципиально важно знать именно трехмерную укладку белка, так как только на этом уровне становится понятно, как белок работает.
Вопрос: сколько трехмерных структур соответствует конкретному белку?
Ответ: Одна, с точностью до небольшой подвижности маленьких «разупорядоченных» петель. Известно ровно одно исключение, когда одной последовательности соответствуют 2 достаточно разные структуры, это прионы.
Вопрос: Почему у белка только одна трехмерная структура?
Ответ: для химического катализа нам нужно расположить соответствующие химические группы строго определенным образом в пространстве.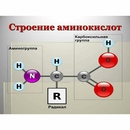 Для этого нужна жесткая структура. То есть весь белок должен быть жестким, чтобы поддерживать химические группы аминокислот активного центра в нужных местах (в реальности многие белки состоят из двух и более жестких частей, которые могут двигаться друг относительно друга, это нужно для регуляции активности белка (аллостерическая регуляция), чтобы некий сигнал мог включать и выключать химическую активность белка-фермента). Чтобы структура была жесткой и стабильной, природа позаботилась о том, чтобы структура каждого белка соответствовала энергетическому минимуму данной системы атомов и этот минимум был настолько глубоким, чтобы белок из него не «выпрыгнул». Все другие, паразитные структуры, обладают большей энергией и белок все равно сваливается в энергетический минимум, соответствующий нативной структуре.
Для этого нужна жесткая структура. То есть весь белок должен быть жестким, чтобы поддерживать химические группы аминокислот активного центра в нужных местах (в реальности многие белки состоят из двух и более жестких частей, которые могут двигаться друг относительно друга, это нужно для регуляции активности белка (аллостерическая регуляция), чтобы некий сигнал мог включать и выключать химическую активность белка-фермента). Чтобы структура была жесткой и стабильной, природа позаботилась о том, чтобы структура каждого белка соответствовала энергетическому минимуму данной системы атомов и этот минимум был настолько глубоким, чтобы белок из него не «выпрыгнул». Все другие, паразитные структуры, обладают большей энергией и белок все равно сваливается в энергетический минимум, соответствующий нативной структуре.
Вопрос: на чем держится трехмерная структура белка?
Ответ: если коротко, то в основном на большом количестве нековалентных взаимодействий. В принципе, химические группы белка могут образовывать: (1) водородную связь, эти группы есть и в основной цепи и у некоторых боковых групп, (2) ионную связь – электростатическое взаимодействие между разноименно заряженными боковыми группами, (3) Ван-дер-Ваальсово взаимодействие и (4) гидрофобный эффект, на котором держится общая структура белка. Суть в том, что в белке всегда есть гидрофобные ароматические остатки, им энергетически невыгодно контактировать с полярными молекулами воды, а выгодно «слипнуться» друг с другом. Таким образом, при сворачивании белка гидрофобные группы выталкиваются из водного окружения, «слипаясь» друг с другом и формируя «гидрофобное ядро», а полярные и заряженные группы, наоборот, стремятся в водное окружение, формируя поверхность белковой глобулы. Так же (5) боковые группы двух остатков цистеина могут образовать между собой дисульфидный мостик – полноценную ковалентную связь, жестко фиксирующую белок.
Суть в том, что в белке всегда есть гидрофобные ароматические остатки, им энергетически невыгодно контактировать с полярными молекулами воды, а выгодно «слипнуться» друг с другом. Таким образом, при сворачивании белка гидрофобные группы выталкиваются из водного окружения, «слипаясь» друг с другом и формируя «гидрофобное ядро», а полярные и заряженные группы, наоборот, стремятся в водное окружение, формируя поверхность белковой глобулы. Так же (5) боковые группы двух остатков цистеина могут образовать между собой дисульфидный мостик – полноценную ковалентную связь, жестко фиксирующую белок.
Соответственно, все аминокислоты делятся на гидрофобные, полярные (гидрофильные), положительно и отрицательно заряженные. Плюс цистеины, способные образовывать ковалентную связь между собой. Особыми свойствами обладают глицин – у него отсутствует боковая группа, сильно ограничивающая конформационную подвижность других остатков, поэтому он может очень сильно «гнуться» и находится в местах, где белковую цепь надо развернуть. У пролина же, наоборот, боковая группа образует кольцо, ковалентно связанное с основной цепью, жестко фиксируя ее конформацию. Пролины встречаются там, где надо сделать белковую цепь жесткой и негнущейся. Многие заболевания связаны с мутацией пролина на глицин, из-за чего структура белка слегка «плывет».
У пролина же, наоборот, боковая группа образует кольцо, ковалентно связанное с основной цепью, жестко фиксируя ее конформацию. Пролины встречаются там, где надо сделать белковую цепь жесткой и негнущейся. Многие заболевания связаны с мутацией пролина на глицин, из-за чего структура белка слегка «плывет».
Вопрос: откуда вообще мы знаем о трехмерных структурах белка?
Ответ: из эксперимента, это абсолютно надежные данные.
Сейчас есть 3 метода для экспериментального определения структуры белка: ядерно-магнитный резонанс (ЯМР), cryo-EM (электронная микроскопия) и рентгеноструктурный анализ кристаллов белка.
ЯМР позволяет определить структуру белка в растворе, но он работает только для очень маленьких белков (для больших невозможно сделать деконволюцию).
Этот метод был важен для общего доказательства того, что у белка только одна трехмерная структура и что структура белка в кристалле идентична структуре в растворе. Это очень дорогой метод, так как требуется получить белок с изотопными метками.
Cryo-EM заключается в простой заморозке раствора белка и микроскопии. Минус метода – низкое разрешение (видна лишь общая форма молекулы, но не видно, как она устроена внутри), плюс плотность белка близка к плотности воды/растворителя, поэтому сигнал тонет в высоком уровне шума. В этом методе активно применяются компьютерные технологии работы с картинками и статистика для вытягивания сигнала из шума.
Отбираются миллионы картинок молекул белка, проводится разделение на классы в зависимости от ориентации молекулы относительно подложки, усреднение по классам, генерация eigenimages, новый раунд усреднения и так пока не сойдется. Потом из информации из разных классов можно восстановить трехмерный вид молекулы с низким разрешением. Если же есть внутренняя симметрия частиц (например, при cryo-EM анализе вирусов), то можно еще каждую частицу поусреднять в соответствии с операторами симметрии – тогда разрешение будет еще лучше, но хуже, чем в случае рентгеноструктурного анализа.
Рентгеноструктурный анализ – основной способ определения структур белка. Главный плюс – потенциально можно получить кристаллы даже очень больших комплексов из многих десятков белков (например, именно так была определена структура рибосомы – Нобелевская премия 2009 года). Минус метода – вначале нужно получить кристалл белка, но далеко не каждый белок хочет кристаллизоваться.
Зато после того, как кристалл получен, по дифракции рентгеновского излучения можно однозначно определить положения всех (упорядоченных) атомов в молекуле белка, этот метод дает самое высокое разрешение и позволяет в лучших случаях видеть позиции отдельных атомов. Было доказано, что структура белка в кристалле однозначно соответствует структуре в растворе.
Сейчас действует конвенция – если ты определил структуру белка любым из экспериментальных физических методов, структура должна быть помещена в открытый доступ в банк данных белковых структур (Protein Data Bank – PDB, www.pdb.org ), в настоящее время там находится более 90 000 структур (впрочем, многие из них повторяющиеся, например, комплексы одного и того же белка с разными малыми молекулами, такими, как лекарственные средства). В PDB все структуры лежат в стандартном формате, называющемся, внезапно, pdb. Это текстовый формат, в котором каждому атому структуры соответствует одна строчка, в которой указан номер атома в структуре, название атома (углерод, азот и тд), название аминокислоты, в которую входит атом, название цепи белка (A, B, C и тд, если это кристалл комплекса из нескольких белков), номер аминокислоты в цепи и трехмерные координаты атома в ангстремах относительно ориджина, плюс так называемые температурный фактор и заселённость (это сугубо кристаллографические параметры).
В PDB все структуры лежат в стандартном формате, называющемся, внезапно, pdb. Это текстовый формат, в котором каждому атому структуры соответствует одна строчка, в которой указан номер атома в структуре, название атома (углерод, азот и тд), название аминокислоты, в которую входит атом, название цепи белка (A, B, C и тд, если это кристалл комплекса из нескольких белков), номер аминокислоты в цепи и трехмерные координаты атома в ангстремах относительно ориджина, плюс так называемые температурный фактор и заселённость (это сугубо кристаллографические параметры).
ATOM 1 N HIS A 17 -12.690 8.753 5.446 1.00 29.32 N ATOM 2 CA HIS A 17 -11.570 8.953 6.350 1.00 21.61 C ATOM 3 C HIS A 17 -10.274 8.970 5.544 1.00 22.01 C ATOM 4 O HIS A 17 -10.193 8.315 4.491 1.00 29.95 O ATOM 5 CB HIS A 17 -11.462 7.820 7.380 1.00 23.64 C ATOM 6 CG HIS A 17 -12.551 7.811 8.421 1.00 21.18 C ATOM 7 ND1 HIS A 17 -13.731 7.137 8.194 1.00 28.94 N ATOM 8 CD2 HIS A 17 -12.634 8.384 9.644 1.00 21.69 C ATOM 9 CE1 HIS A 17 -14.492 7.301 9.267 1.00 27.01 C ATOM 10 NE2 HIS A 17 -13.869 8.058 10.168 1.00 22.66 N ATOM 11 N ILE A 18 -9.269 9.660 6.089 1.00 19.45 N ATOM 12 CA ILE A 18 -7.910 9.377 5.605 1.00 18.67 C ATOM 13 C ILE A 18 -7.122 8.759 6.749 1.00 16.24 C ATOM 14 O ILE A 18 -7.425 8.919 7.929 1.00 18.80 O ATOM 15 CB ILE A 18 -7.228 10.640 5.088 1.00 20.22 C ATOM 16 CG1 ILE A 18 -7.062 11.686 6.183 1.00 18.52 C ATOM 17 CG2 ILE A 18 -7.981 11.176 3.889 1.00 24.61 C ATOM 18 CD1 ILE A 18 -6.161 12.824 5.749 1.00 28.
21 C ATOM 19 N ASN A 19 -6.121 8.023 6.349 1.00 15.46 N ATOM 20 CA ASN A 19 -5.239 7.306 7.243 1.00 14.34 C ATOM 21 C ASN A 19 -4.012 8.178 7.507 1.00 14.83 C ATOM 22 O ASN A 19 -3.431 8.715 6.575 1.00 18.03 O ATOM 23 CB ASN A 19 -4.825 6.003 6.573 1.00 17.71 C ATOM 24 CG ASN A 19 -6.062 5.099 6.413 1.00 21.26 C ATOM 25 OD1 ASN A 19 -6.606 4.651 7.400 1.00 26.18 O ATOM 26 ND2 ASN A 19 -6.320 4.899 5.151 1.00 31.73 N
Далее есть специальные программы, которые по данным из этого текстового файла могут графически отображать красивую трехмерную структуру молекулы белка, которую можно покрутить на экране монитора и, как говорил Гай Додсон, «дотронуться мышкой до молекулы» (например, PyMol, CCP4mg, старый RasMol). То есть смотреть на структуры белка просто – ставишь программу, загружаешь нужную структуру из PDB и наслаждаешься красотой природы.
4. Анализируем структуру
Итак, мы поняли основную идею: белок — линейный полимер, сворачивающийся в водном растворе под действием множества слабых взаимодействий в стабильную и единственную для данного белка трехмерную структуру, и способный в таком виде выполнять свою функцию. Различают несколько уровней организации белковых структур. Выше мы уже познакомились с первичной структурой – линейной последовательностью аминокислот, которую можно выписать в строчку.
Вторичная структура белка определяется взаимодействием атомов основной цепи белка. Как уже было сказано выше, в состав основной цепи белка входят доноры и акцепторы водородной связи, таким образом, основная цепь может приобретать некоторую структуру. Точнее, несколько разных структур (детали все-таки зависят от различающихся боковых групп), так как возможно образование разных альтернативных водородных связей между группами основной цепи. Структуры бывают такие: альфа-спираль, бета-листы (состоящие из нескольких бета-тяжей), которые бывают параллельными и анти-параллельными, бета-поворот. Плюс часть цепи может и не иметь выраженной структуры, например в районе поворота петли белка. Эти типы структур имеют свои устоявшиеся схематичные обозначения – альфа-спираль в виде спирали или цилиндра, бета-тяжи в виде широких стрелок. Вторичную структуру удается достаточно достоверно предсказывать по первичной (стандартом является JPred), альфа-спирали предсказываются наиболее точно, с бета-тяжами бывают накладки.
Плюс часть цепи может и не иметь выраженной структуры, например в районе поворота петли белка. Эти типы структур имеют свои устоявшиеся схематичные обозначения – альфа-спираль в виде спирали или цилиндра, бета-тяжи в виде широких стрелок. Вторичную структуру удается достаточно достоверно предсказывать по первичной (стандартом является JPred), альфа-спирали предсказываются наиболее точно, с бета-тяжами бывают накладки.
Третичная структура белка определяется взаимодействием боковых групп аминокислотных остатков, это и есть трехмерная структура белка. Можно представить себе, что вторичная структура сформирована и теперь эти спирали и бета-тяжи хотят уложиться все вместе в компактную трехмерную структуру, чтобы все гидрофобные боковые группы спокойно «слиплись» вместе в глубине белковой глобулы, сформировав гидрофобное ядро, а полярные и заряженные остатки торчали наружу в воду, формируя поверхность белка и стабилизируя контакты между элементами вторичной структуры. Третичную структуру изображают схематически несколькими способами. Если просто отрисовать все атомы, то получится каша (хотя когда мы анализируем активный центр белка, то мы хотим смотреть как раз на все атомы активных остатков).
Если просто отрисовать все атомы, то получится каша (хотя когда мы анализируем активный центр белка, то мы хотим смотреть как раз на все атомы активных остатков).
Если мы хотим посмотреть, как устроен весь белок в общем, можно отобразить только некоторые атомы основной цепи, чтобы увидеть ее ход. Как вариант, можно нарисовать красивую схему, где поверх реального расположения атомов схематично нарисованы элементы вторичной структуры – так с первого взгляда видна укладка белка. После изучения всей структуры в общем, схематичном виде, можно отобразить химические группы активного центра и уже сосредоточиться на них. Задача предсказания третичной структуры белка – нетривиальная и в общем случае не решается, хотя может быть решена в частных случаях. Подробнее – ниже.
Четвертичная структура белка – да, есть и такая, правда не у всех белков. Многие белки работают сами по себе (мономеры, в данном случае под мономером имеется в виду одиночная свернутая полипептидная цепь, то есть белок целиком), тогда их четвертичная структура равна третичной. Однако достаточно много белков работает только в комплексе, состоящем из нескольких полипептидных цепей (субъединиц или мономеров — димеры, тримеры, тетрамеры, мультимеры), тогда вот такая сборка из нескольких отдельных цепей и называется четвертичной структурой. Самый банальный пример – состоящий из 4 субъединиц гемоглобин, самый красивый на мой взгляд пример – состоящий из 11 одинаковых субъединиц бактериальный белок TRAP.
Однако достаточно много белков работает только в комплексе, состоящем из нескольких полипептидных цепей (субъединиц или мономеров — димеры, тримеры, тетрамеры, мультимеры), тогда вот такая сборка из нескольких отдельных цепей и называется четвертичной структурой. Самый банальный пример – состоящий из 4 субъединиц гемоглобин, самый красивый на мой взгляд пример – состоящий из 11 одинаковых субъединиц бактериальный белок TRAP.
5. Вычислительные задачи
Белок – сложная система из тысяч атомов, поэтому без использования компьютеров в структуре белка не разобраться. Задач, как решенных на приемлемом уровне, так и совсем не решенных, множество. Перечислю наиболее актуальные:
На уровне первичной структуры – поиск белков с похожей аминокислотной последовательностью, построение по ним эволюционных деревьев и тд – классические задачи биоинформатики. Главным хабом является NCBI — The National Center for Biotechnology Information, www.ncbi.nlm.nih.gov. Для поиска белков со сходной последовательностью стандартно используется BLAST: blast. ncbi.nlm.nih.gov/Blast.cgi
ncbi.nlm.nih.gov/Blast.cgi
Предсказание растворимости белка. Речь идет о том, что если мы прочитаем геном какого-нибудь животного, определим по нему последовательности белков, переклонируем эти гены в кишечную палочку или baculovirus expression system, то окажется, что при экспрессии в этих системах примерно треть белков не будет сворачиваться в правильную структуру, и, как следствие, будет нерастворима. Тут выясняется, что большие белки на самом деле состоят из отдельных «доменов», каждый из которых представляет автономную, функциональную часть белка (несущую одну из его функций) и часто «вырезав» из гена отдельный домен, можно получить растворимый белок, определить его структуру и провести с ним опыты. Люди пытаются использовать машинное обучение (нейронные сети, SVM и прочие классификаторы), чтобы предсказывать растворимость белка, однако работает оно достаточно плохо (Гугл много чего покажет по запросу “protein solubility prediction” – есть много серверов, но по моему опыту все они работают отвратительно на моих белках). В идеале я хотел бы видеть сервис, который надежно сказал бы, где в белке находятся те самые растворимые домены, чтобы их можно было вырезать и работать с ними – такого сервиса нет.
В идеале я хотел бы видеть сервис, который надежно сказал бы, где в белке находятся те самые растворимые домены, чтобы их можно было вырезать и работать с ними – такого сервиса нет.
На уровне вторичной структуры – предсказание той самой вторичной структуры по первичной (JPred)
На уровне третичной структуры – поиск белков со сходными трехмерными структурами (DALI, en.wikipedia.org/wiki/Structural_alignment ),
Поиск структур по заданной суб-структуре. Например, у меня есть расположение трех аминокислот активного центра в пространстве. Хочу найти структуры, которые содержать такие же три аминокислоты в таком же относительном расположении, либо найти структуры белков, мутирование которых даст возможность расположить нужные аминокислоты нужным образом. (гуглить «protein substructure search»)
Предсказание потенциальной подвижности трехмерной структуры, возможных конформационных изменений – normal mode analysis, ElNemo.
На уровне четвертичной структуры – предположим, известны структуры двух белков. Известно, что они образуют комплекс. Предсказать структуру комплекса (определить, как эти два белка будут взаимодействовать посредством shape matching, например). Гуглить «protein-protein docking»
Известно, что они образуют комплекс. Предсказать структуру комплекса (определить, как эти два белка будут взаимодействовать посредством shape matching, например). Гуглить «protein-protein docking»
6. Предсказание структуры белка
Выделил эту вычислительную задачу в отдельный раздел, ибо велика она, фундаментальна и не решается в общем случае.
Экспериментально мы знаем, что если взять белок, полностью развернуть его и бросить в воду, то он свернется обратно в исходное состояние за время от миллисекунд до секунд (это утверждение справедливо по крайней мере для небольших глобулярных белков без всяких патологий). Это значит, что вся информация, необходимая для определения трехмерной структуры белка, в неявном виде содержится в его первичной последовательности, поэтому так хочется научиться предсказывать трехмерную структуру белка по последовательности аминокислот in silico! Однако эта задача в общем случае не решена до сих пор. В чем же дело? Дело в том, что в первичной последовательности отсутствует в явном виде информация, необходимая для построения структуры. Во-первых, нет информации о конформации основной цепи – а она обладает значительной подвижностью, хотя и несколько ограниченной по стерическим причинам. Плюс каждая боковая цепь каждой аминокислоты может находиться в разных конформациях, для длинных боковых групп типа аргинина, это может быть больше десятка конформаций.
Во-первых, нет информации о конформации основной цепи – а она обладает значительной подвижностью, хотя и несколько ограниченной по стерическим причинам. Плюс каждая боковая цепь каждой аминокислоты может находиться в разных конформациях, для длинных боковых групп типа аргинина, это может быть больше десятка конформаций.
Что же делать? Есть достаточно известный хабравчанам самый общий подход, называемый «молекулярная динамика» и подходящий для любых молекул и систем. Берем развернутый белок, приписываем всем атомам случайные значения скоростей, считаем взаимодействия между атомами, повторяем до тех пор, пока система не придет в стабильное состояние, соответствующее свернутому белку. Почему это не работает? Потому что современные вычислительные мощности позволяют за месяцы работы кластера считать десятки наносекунд для системы из тысяч атомов, какой является белок, помещенный в воду. Время же сворачивания белка – миллисекунды и больше, то есть вычислительных мощностей не хватает, разрыв – в несколько порядков. Впрочем, пару лет назад американцы совершили некоторый прорыв. Они использовали специальное железо, оптимизированное для векторных вычислений и после оптимизации на аппаратном уровне у них за месяцы работы машины получилось посчитать молдинамику до миллисекунд для очень маленького белка и белок свернулся, структура соответствовала экспериментально определенной ( http://en.wikipedia.org/wiki/Anton_(computer) )! Однако праздновать победу еще рано. Они взяли очень маленький (его размер раз в 5-10 меньше среднего белка) и один из самых быстросворачивающихся белков, классический модельный белок, на котором изучалось сворачивание. Для больших белков время расчетов увеличивается нелинейно и потребуются уже годы, то есть еще есть над чем работать.
Впрочем, пару лет назад американцы совершили некоторый прорыв. Они использовали специальное железо, оптимизированное для векторных вычислений и после оптимизации на аппаратном уровне у них за месяцы работы машины получилось посчитать молдинамику до миллисекунд для очень маленького белка и белок свернулся, структура соответствовала экспериментально определенной ( http://en.wikipedia.org/wiki/Anton_(computer) )! Однако праздновать победу еще рано. Они взяли очень маленький (его размер раз в 5-10 меньше среднего белка) и один из самых быстросворачивающихся белков, классический модельный белок, на котором изучалось сворачивание. Для больших белков время расчетов увеличивается нелинейно и потребуются уже годы, то есть еще есть над чем работать.
Другой подход реализован в Rosetta. Они разбивают последовательность белка на очень короткие (3-9 остатков) фрагменты и смотрят, какие конформации для этих фрагментов присутствуют в PDB, после чего запускают Монте-Карло по всем вариантам и смотрят, что получится. Иногда получается что-то годное, но в моих случаях через несколько дней работы кластера получаешь такой бублик, что возникает немой вопрос: «Кто писал их оценочную функцию, ставящую какую-то хорошую оценку вот этой загогулине?».
Иногда получается что-то годное, но в моих случаях через несколько дней работы кластера получаешь такой бублик, что возникает немой вопрос: «Кто писал их оценочную функцию, ставящую какую-то хорошую оценку вот этой загогулине?».
Есть инструменты и для моделирования вручную – можно предсказать вторичную структуру и попробовать вручную крутить ее, находя лучшую укладку. Некие гениальные люди даже выпустили игрушку FoldIt, представляющую белок схематично и позволяющую укладывать его, как-бы собирая головоломку (для интересующихся структурой – рекомендую!). Есть абсолютно официальное соревнование для предсказателей белковых структур, называемое CASP. Суть в том, что когда экспериментаторы определяют новую структуру белка, не имеющую аналогов в PDB, они могут не выкладывать ее сразу в PDB, а выставить последовательность этого белка на конкурс предсказаний CASP. Через некоторое время, когда все закончат свои предсказательные модели, экспериментаторы выкладывают свою экспериментально определенную структуру белка и смотрят, насколько хорошо сработали предсказатели. Самое интересное, что игроки FoldIt, не будучи учеными, как-то выиграли CASP у профессионалов моделирования белковых структур и предсказали структуру белка точнее. Однако даже эти успехи не позволяют утверждать, что проблема предсказания структуры белка решается – очень часто модель очень далека от реальной структуры.
Самое интересное, что игроки FoldIt, не будучи учеными, как-то выиграли CASP у профессионалов моделирования белковых структур и предсказали структуру белка точнее. Однако даже эти успехи не позволяют утверждать, что проблема предсказания структуры белка решается – очень часто модель очень далека от реальной структуры.
Все это относилось к моделированию белков ab initio, когда нет никакой априорной информации о структуре. Однако очень часто бывают ситуации, когда для некоторого белка в PDB присутствует его отдаленный родственник с уже известной структурой. Под родственником подразумевается белок с похожей первичной последовательностью. Считается, что для белков со сходством по первичной последовательности больше 30% одинаковая укладка основной цепи (хотя одинаковая укладка наблюдалась и для белков, не проявляющих никакого статистически достоверного сходства по первичной последовательности). В случае наличия гомолога (похожего белка) с известной структурой, можно сделать «гомологичное моделирование», то есть попросту «натянуть» последовательность твоего белка на известную структуру гомолога, а потом погонять минимизацию энергии, чтобы как-то все это дело утрясти. Такое моделирование показывает хорошие результаты при наличие очень близких гомологов, чем дальше гомолог – тем больше ошибка. Инструменты для гомологичного моделирования – Modeller, SwissModel.
Такое моделирование показывает хорошие результаты при наличие очень близких гомологов, чем дальше гомолог – тем больше ошибка. Инструменты для гомологичного моделирования – Modeller, SwissModel.
Можно решать и другие задачи, например, пытаться моделировать, что произойдет, если внести в белок ту или иную мутацию. Например, если заменить гидрофильную аминокислоту на поверхности белка на другую гидрофильную, то скорее всего структура белка не изменится вообще. Если заменить аминокислоту из гидрофобного ядра на другую гидрофобную, но другого размера, то скорее всего укладка белка останется той же, но слегка «съедет» на доли ангстрема. Если же заменить аминокислоту из гидрофобного ядра на заряженную, то скорее всего белок просто «взорвется» и не сможет свернуться.
Может показаться, что все не так уж и плохо и мы достаточно хорошо пониманием сворачивание белка. Да, мы понимаем кое-что, например до некоторой степени мы понимаем общие физические принципы, лежащие в основе сворачивания полипептидной цепи – они рассматриваются в замечательном учебнике Птицына и Финкельштейна «Физика белка». Однако это общее понимание не позволяет нам ответить на вопросы «Свернется ли данный белок или не свернется?», «Какая структура будет у этого белка?», «Как сделать белок с желаемой структурой?».
Однако это общее понимание не позволяет нам ответить на вопросы «Свернется ли данный белок или не свернется?», «Какая структура будет у этого белка?», «Как сделать белок с желаемой структурой?».
Вот одна из иллюстраций: мы хотим локализовать один из доменов большого белка, это стандартная задача. У нас есть фрагмент, который сворачивается и растворим, то есть это живой и здоровый белок. Мы же хотим найти его минимальную часть и начинаем методами генетической инженерии с обоих концов удалять по 2-3 аминокислоты, экспрессировать такой обрезанный белок в бактерии и смотреть его сворачиваемость экспериментально. Мы делаем десятки конструкций с такими маленькими делециями и видим такую картину – полностью растворимый и живой белок отличается от полностью мертвого и несворачивающегося на 3 аминокислоты. Повторюсь, это объективный экспериментальный результат. Проблема в том, что сейчас не существует вычислительного метода, который предсказал бы сворачиваемость белка хотя бы на уровне «да/нет» и сказал мне, где проходит граница между сворачивающимся и несворачивающимся белком, потому мы вынуждены клонировать и экспериментально проверять десятки вариантов. Это лишь одна из иллюстраций того, что наше понимание структуры белка весьма далеко от совершенства. Как говорил Ричард Фейнман, «Чего не могу воссоздать, того не понимаю».
Это лишь одна из иллюстраций того, что наше понимание структуры белка весьма далеко от совершенства. Как говорил Ричард Фейнман, «Чего не могу воссоздать, того не понимаю».
Так что, господа программисты, физики и математики, нам еще есть над чем работать.
На этой оптимистичной ноте разрешите откланяться, благодарю всех, кто осилил сей опус.
Для глубоко знакомства с предметной областью рекомендую следующий минимум:
1) «Физика белка» Птицын и Финкельштейн. Большую часть материала Алексей Витальевич Финкельштейн выложил в онлайн, чем и рекомендую с благодарностью воспользоваться: phys.protres.ru/lectures/protein_physics/index.html (а я утащил оттуда несколько картинок)
2) Патрушев, «Искусственные генетические системы», особенно часть II «Белковая инженерия». Есть на торрентах в формате Djvu
3) Для информации, опубликованной в биологических научных журналах, есть официальный поисковик PubMed ( www.pubmed.org ) — у него стоит попросить почитать про «protein engineering» и тому подобное.
Эпилепсия
Эпилепсия – не одно состояние, а разнообразное семейство расстройств, общей чертой которых является аномально высокая предрасположенность к эпилептическим приступам. Некоторые авторы предпочитают говорить и писать не об эпилепсии, а об «эпилепсиях».Раньше считалось, что диагноз эпилепсии можно поставить, если у ребенка есть два спонтанных (ничем не провоцируемых) приступа. Сейчас врач имеет право поставить эпилепсию, если у ребенка один эпилептический приступ, но существует высокая вероятность его повторов. Как правило, вероятность повторов врач оценивает исходя из данных электроэнцефалограммы и конкретной клинической ситуации (наличия у ребенка неврологической болезни, внешнего вида приступов и т.д.). Кроме того, стало ясно, что приступ не всегда может быть спонтанным. Так, при нескольких эпилепсиях развивающихся в юношеском возрасте приступ может провоцироваться недосыпанием в сочетании со стрессом.
Эпилептический приступ — это событие, вызванное тем, что нервные клетки в определенной части мозга становятся перевозбужденными и работают в особом неправильном ритме. Деятельность головного мозга нарушается, и у человека развиваются расстройства движений, поведения, восприятия, иногда с нарушением сознания и падением. Приступ длится недолго – от секунд до нескольких минут, хотя есть и исключения их правила (очень длительные приступы). В целом приступ не всегда выглядит так устрашающе, как показывают в кино. Иногда приступы бывают мало заметными.
Эпилептический приступ не всегда является симптомом эпилепсии. Значительно чаще, чем эпилепсия, встречаются так называемые фебрильные судороги (которые провоцируются температурой). Как правило, они не наносят вреда мозгу ребенка, очень редко переходят в эпилепсию, исчезают по мере его взросления (после 6 лет) и не нуждаются в постоянном лечении. По-сути, они только выглядят страшно, но являются вполне доброкачественным состоянием с хорошим прогнозом. Также у части новорожденных детей бывают эпилептические приступы, которые могут потом никогда не повториться, поэтому есть особый термин «неонатальные судороги» (судороги новорожденного), так и формулируется диагноз. Есть еще один вариант, когда при нейроинфекции (например, при менингите) или при черепно-мозговой травме развивается эпилептический приступ. Он далеко не всегда переходит в эпилепсию, то есть, далеко не всегда развиваются повторные приступы.
Эпилепсия представляет собой самое распространенное тяжелое заболевание нервной системы, встречающееся во всем мире независимо от расы с частотой 0,5-1%.
Причины эпилепсии
В зависимости от причины развития эпилепсии выделяют три группы эпилепсий:
Идиопатические эпилепсии – те, при которых эпилепсия является единственным проявлением, не связанным со структурным повреждением головного мозга, другие неврологические симптомы отсутствуют. Предполагается, что эти синдромы имеют генетическую природу и обычно возраст – зависимы (возникают и, иногда, проходят в определенном возрасте). Международная Лига по борьбе с эпилепсией (ILAE) в настоящее время предпочитает термин «генетические» эпилепсии. Концепция генетической эпилепсии заключается в том, что эпилепсия является прямым результатом известного или предполагаемого генетического(их) дефекта(ов), и эпилептические приступы являются стержневым симптомом заболевания
Симптоматические эпилепсии – те, при которых эпилептические приступы являются результатом одного или более идентифицируемых структурных повреждения мозга. Международная Лига по борьбе с эпилепсией (ILAE) в настоящее время предпочитает термин «структурные/метаболические» эпилепсии. Концепция заключается в том, что у пациента с эпилептическими приступами существует другое структурное повреждение головного мозга или метаболическое состояние/заболевание, которое ассоциировано с весомым риском развития эпилепсии.
Криптогенные эпилепсии (предположительно симптоматические) — те, которые, как предполагается, являются симптоматическими, однако идентифицировать этиологию невозможно. Международная Лига по борьбе с эпилепсией (ILAE) в настоящее время предпочитает термин «эпилепсии с неизвестной причиной», то есть, причина неизвестна к моменту установления диагноза (она может быть и генетической, и связанной с какой-то пока не установленной болезнью)
Следует сказать, что эпилепсия у детей отличается чрезвычайным разнообразием. Встречаются самые разные синдромы – от доброкачественных до злокачественных.
Смысл термина «доброкачественная эпилепсия» претерпел определенную эволюцию. Ранее доброкачественным считался тот эпилептический синдром, который не вызывал нарушений интеллектуальных функций и легко поддавался лечению. В настоящее время доброкачественным считается тот эпилептический синдром, для которого характерны эпилептические приступы, легко поддающиеся лечению, или не требующие лечения, и проходящие без последствий. В отдельных ситуациях его только условно можно назвать эпилепсией, так как у ребенка может быть всего один эпилептический приступ, и тогда правильнее определять это как эпилептические приступы, а не эпилепсию. В сообщении Комиссии по Классификации и Терминологии Международной противоэпилептической лиги (2010) также говорится о том, что термин «доброкачественный» может создавать «фальшивый оптимизм» и нереалистичные ожидания, как у врача, так и у родителей ребенка. Известно, что познавательные и поведенческие нарушения, психиатрические расстройства, мигрень и даже синдром внезапной смерти могут встречаться практически при любой форме эпилепсии.
В другом конце спектра эпилепсий находятся эпилептические энцефалопатии. Это тяжело текущие эпилепсии, как правило, с частыми приступами, задержкой или даже регрессом психического развития, которые с трудом поддаются медикаментозному лечению. Эти эпилептические синдромы часто называют катастрофическими, так как их исходом (даже при правильном лечении) чаще всего бывает умственная отсталость, инвалидизация и, иногда, даже смерть. Эпилептические энцефалопатии могут наблюдаться в любом возрасте, начиная с периода новорожденности. Концепция развития эпилептических энцефалопатий основана на признании того факта, что эпилептическая активность сама по себе (даже не сопровождаясь приступами) может оказывать негативное влияние на развивающийся головной мозг, вызывая тем самым интеллектуальные и поведенческие нарушения. По сути дела развивающийся мозг ребенка все время находится в ситуации эпилептического статуса, хотя этот статус характеризуется не столько приступами, сколько разрядами.
Еще одну особую группу эпилепсий составляют идиопатические генерализованные эпилепсии. Эти эпилепсии высоко чувствительны к медикаментозной терапии, и большинство пациентов, получая адекватный препарат, не испытывают приступов. Но отмена препарата без рецидивов возможна только при детской абсансной эпилепсии. При идиопатических генерализованных эпилепсиях, стартующих в подростковом возрасте (юношеской миоклонической и юношеской абсансной), отмена антиэпилептического препарата даже при длительной ремиссии возможна далеко не всегда, так как при этом наблюдается высокий риск рецидивов приступов.
Промежуточное положение между двумя концами спектра эпилепсий (доброкачественными эпилепсиями детства и эпилептическими энцефалопатиями) занимают симптоматические и криптогенные фокальные эпилепсии детства, которые могут течь как легко, так и тяжело в зависимости от конкретного клинического случая. Прогноз течения зависит от совокупности множества обстоятельств: наличия изменений в мозге по данным МРТ, двигательных и интеллектуальных нарушений, степени выраженности разрядов на энцефалограмме, своевременности и адекватности антиэпилептической терапии и целого ряда других факторов.
Диагностика эпилепсии
В диагностике эпилепсии наибольшее значение имеют опрос пациента, электроэнцефалографическое исследование, проведение магнитно-резонансной томографии головного мозга
Опрос пациента или его родителей. Каждый тип эпилептического приступа имеет свои клинические и энцефалографические черты. Во время опроса пациента или его родителей врач уточняет все, что касается различных характеристик приступов:
- Возраст, в котором приступ развился. Существуют возраст-зависимые формы эпилепсии с характерным возрастом начала приступов
- Связь приступа с циклом сон/бодрствование – существуют эпилептические синдромы, при которых приступы наблюдаются преимущественно во время сна или при пробуждении
- Наличие провоцирующих факторов – недосыпания, просмотра телепрограмм, работа на компьютере и др.
- Продолжительность приступа в секундах и минутах является чрезвычайно важной его характеристикой
- Подробно описание течения приступов с первых симптомов и до последних: предчувствовал ли пациент приступ, какие субъективные ощущения у него наблюдались, терял ли он сознание (полностью или частично), отмечалось ли напряжение в конечностях и теле (в каких именно конечностях), и в мимической мускулатуре, подводились ли глаза (и куда – вверх, в какую сторону), были ли подергивания и если да, то в каких частях тела. Важно, как пациент выходил из приступа, помнит ли свои ощущения во время приступа, имеются ли у него/нее речевые и двигательные нарушения, оглушенность после приступа или сон.
- Частота приступов в сутки, в месяц, в год
- Иногда у пациента бывает два — три типа приступов, и тогда каждый из них описывается подробно
- Если лечение уже проводилось, то уточняется, как оно влияло на частоту и другие характеристики приступов
Из расспроса у врача, как правило, уже складывается впечатление о том, эпилептический ли это приступ или нет, о типе эпилептического приступа, и иногда, формируется предположение о конкретном эпилептическом синдроме. Существует не очень корректное, но достаточно точно отражающее суть проблемы врачебное высказывание: «Насколько точно Вы расскажете о приступах, настолько точно Вам и поставят диагноз». Врач сам достаточно редко видит приступ. Процент ошибок в описании неспециалистами достаточно высок. Поэтому лучше приходить даже на первую консультацию с т.н. «домашним видео» (видеозаписью приступа, сделанной видеокамерой, фотоаппаратом или мобильным телефоном). Простой просмотр видеозаписи позволит квалифицированному специалисту определить эпилептический ли это приступ и, иногда, его тип.
Электроэнцефалографическое исследование (ЭЭГ) является главным методом, подтверждающим эпилептический характер приступа. Скрининговым методом при эпилепсии является рутинная ЭЭГ, которая записывается в состоянии расслабленного бодрствования. Как правило, рутинная ЭЭГ короткая и проводится в течение 20 минут. В протокол рутинной ЭЭГ обязательно включаются проба на открытие/закрытие глаз, ритмическая фотостимуляция и проба с гипервентиляцией (пациент часто и глубоко дышит). Все эти пробы направлены на провокацию эпилептиформной активности, если она не очевидна. Иногда используется запись рутинной ЭЭГ в утренние часы после депривации сна (короткая продолжительность сна), что при определенных эпилептических синдромах повышает информативность ЭЭГ. Далеко не всегда за время записи короткой рутинной ЭЭГ удается записать приступ или получить достоверные эпилептиформные изменения между приступами. В то же время хорошо известно, что доказательством эпилептической природы приступа является наличие эпилептических разрядов в момент его возникновения или предшествующих его клиническим проявлениям.
Более информативным, но и трудоемким методом исследования является видеоЭЭГ мониторинг: длительная запись ЭЭГ и видеоизображения во время бодрствования и сна, иногда с моделированием реальных жизненных ситуаций (например, просмотр телевизора фотосенситивным пациентом с целью подбора метода немедикаментозной защиты). Продолжительность видеоЭЭГмониторинга может быть различной – от нескольких часов до дней. Достаточно часто в мониторинг включается не только бодрствование, но и сон пациента (дневной или ночной). Большая длительность записи с большей долей вероятности позволяет зафиксировать клинические проявления приступа, увидеть эпилептические изменения на ЭЭГ в этот момент, понять, в каких отделах мозга генерируется эпилептическое возбуждение. Необходимость проведения видеоЭЭГмониторинга, его продолжительность, необходимость включения в мониторинг сна пациента определяет врач, исходя из конкретной клинической ситуации. Особую роль длительный видеоЭЭГ мониторинг играет при предхирургической подготовке, когда для провокации приступов с целью локализации их источника иногда проводится временная отмена противоэпилептической терапии.
Как правило, данные опроса и электроэнцефалографического обследования позволяют установить тип приступа, после чего врач задумывается о том, какой именно эпилептический синдром имеется у пациента. В диагностике отдельных эпилептических синдромов играет роль возраст начала эпилепсии, тип приступа (приступов), неврологический статус пациента (наличие у него двигательных, речевых и интеллектуальных нарушений — поэтому при первой консультации врач должен провести неврологический осмотр пациента), данные межприступной и/или приступной ЭЭГ и магнитно-резонансной томографии головного мозга.
МРТ головного мозга широко используется для уточнения диагноза эпилепсии. При идиопатических (генетических) фокальных и генерализованных эпилепсиях не должно быть патологических изменений на МРТ. Поэтому врач, если он уверен в наличии идиопатической эпилепсии, может не направлять пациента на это исследование. Лучше использовать МРТ высокого разрешения. При фармакорезистентной эпилепсии (которая плохо поддается лечению антиэпилептическими препаратами) при проведении МРТ стараются использовать специальный эпилептологический режим (делают более частые срезы при исследовании). При предоперационной подготовке для уточнения локализации эпилептического очага используется позитронно-эмиссионная томография и томография с эмиссией единичного фотона.
Дополнительные исследования необходимы, если врач подозревает, что эпилепсия – только симптом какого-то другого, как правило, тяжелого заболевания. У детей с эпилепсией и задержкой психоречевого развития может понадобиться исследование кариотипа, определение спектра аминокислот крови и мочи, органических кислот мочи, молекулярно-генетическое исследования и др.
Весь спектр исследований проводится с одной целью – как можно точнее установить причину эпилепсии и определиться с прогнозом ее течения.
Лечение эпилепсии.
Кардинальной задачей антиэпилептической терапии является полный контроль над приступами при отсутствии нежелательных побочных реакций и негативного влияния на качество жизни больного. Эта цель достижима у двух третей всех пациентов. Медикаментозное лечение эпилепсии мало эффективно примерно у 20 — 30% пациентов с эпилепсией. Такая эпилепсия называется резистентной, цель лечения при резистентной эпилепсии будет другой — достижение минимально возможной частоты эпилептических приступов (а не полное избавление от них).
Не назначается хроническое лечение при фебрильных приступах (на фоне температуры), при изолированных неонатальных приступах (в первые 30 дней жизни), при острых симптоматических приступах (приступы, ассоциированные с острым системным заболеванием, интоксикацией, злоупотреблением алкоголем или наркотическими веществами или их отменой, или острой стадией мозгового повреждения), а также при единственным неспровоцированном приступе. Можно не лечить редкие ночные приступы при доброкачественной фокальной эпилепсии детства с центро-темпоральными спайками (роландической).
Решение о начале лечения у пациентов, страдающих эпилепсией, должно приниматься индивидуально. В целом, лечение необходимо начинать быстро, если существует вероятность того, что задержка лечения нанесет вред больному. Оценка вероятности вреда от задержки лечения зависит от эпилептического синдрома и от особенностей окружения пациента. Она также должна включать и риск внезапной смерти при эпилепсии, который потенциально существует в любом возрасте.
Препараты, применяемые в лечении эпилепсии, носят название антиэпилептических – сокр. АЭП (синонимы: антиконвульсанты, противоэпилептические препараты, противосудорожные препараты). В мире насчитывается более 20 АЭП, не все из них, к сожалению, зарегистрированы в России. Врач, занимающийся диагностикой и лечением эпилепсии, как правило, хорошо знает антиэпилептические препараты, механизмы их действия, дозы, показания и противопоказания, взаимодействия различных препаратов, острые и хронические побочные эффекты.
Врач выбирает один АЭП (такая тактика носит название монотерапии), руководствуясь типом приступов и конкретным эпилептическим синдром пациента. Выбранный АЭП должен обладать наибольшей эффективностью при данном типе приступов и эпилептическом синдроме. Как правило, при выборе препарата врач учитывает наличие сопутствующих заболеваний и конкретную финансовую ситуацию (наличие препарата в льготных списках и возможность его бесплатного получения, вероятность того, что пациент сам сможет покупать препарат и др.), а также доступность препарата в аптечной сети.
Доза всех АЭП наращивается постепенно. Считается, что постепенное увеличение дозы улучшает переносимость терапии. Есть препараты с достаточно быстрым наращиванием дозы (например, терапевтической дозы вальпроата можно достигнуть в течение 1-2-х недель), со средним темпом наращивания дозы (например, карбамазепин) и с медленным темпом (ламотриджин, топирамат). При медленном наращивании дозы терапевтическая доза достигается через несколько недель.
Кратность применения зависит от лекарственной формы препарата. Один и тот же АЭП может выпускаться для удобства применения в разных лекарственных формах. Так существуют специальные лекарственные формы для детей (они не любят глотать таблетки) – капли, сиропы, растворы для внутреннего применения, микрогранулы для посыпания пищи. Тот же самый препарат может выпускаться и в таблетках с разным содержанием активного вещества. Активное вещество может быстро высвобождаться из таблетки, а может высвобождаться постепенно. Если высвобождение активного вещества постепенное, то такая лекарственная форма называется пролонгированной. Общепризнанным является тот факт, что пролонгированные формы более эффективны и лучше переносимы. Кратность приема определяет врач в каждом конкретном случае. Как правило, 2 раза в день применяются пролонгированные формы АЭП, а также препараты с длительным периодом полураспада. Остальные лекарственные формы, как правило, применяются три раза в день. Нет никакого смысла делить суточную дозу АЭП на 4 и более раз.
При определении эффективности АЭП необходимо следить за числом приступов и за переносимостью препарата. Число приступов отмечается в дневнике приступов. Там же указывается и их характер, так как клинические проявления приступов могут меняться на фоне лечения. При введении препарата терапевтическая концентрация в крови создается не сразу, а через несколько дней после увеличения дозы. Поэтому мы не ожидаем существенного улучшения на невысоких дозах препарата и сразу после увеличения дозы. Необходимо подождать хотя бы несколько дней, чтобы препарат распределился в органах и тканях, и создалась стойкая терапевтическая концентрация в крови. Переносимость препарата оценивается по наличию побочных эффектов. Все побочные эффекты делятся на две большие группы – реакции непереносимости и дозозависимые побочные эффекты. Реакции непереносимости возникают на ранних этапах лечения и требуют отмены препарата. Как пример, можно привести развитие тяжелой аллергической реакции в виде отека Квинке или сыпи (такая реакция возможна на введение любого медикамента). Дозо-зависимые побочные эффекты появляются постепенно по мере нарастания дозы и проходят при ее снижении. Как правило, врач при назначении конкретного АЭП рассказывает пациенту или его родственникам, какие нежелательные эффекты наиболее часты и как с ними бороться.
Прием препарата должен быть непрерывным. Если препарат не принимается вовремя, то его концентрация в крови падает, и это чревато рецидивом эпилептического приступа. Считается, что вероятность развития приступа при пропуске приема препарата составляет около 30%. Поэтому врач всегда подчеркивает и иногда пишет в заключении, что лечение должно быть длительным и непрерывным. Если пациент забыл принять препарат, то он должен сделать это сразу, как только вспомнит о пропуске.
После того, как пациент определенное время принимает препарат, его направляют на контрольное энцефалографическое исследование. Оно может быть неоднократным по мере течения болезни, сроки проведения ЭЭГ определяет врач. Полезным и информативным также является определение концентрации препарата в крови, оно может назначаться от одного до нескольких раз в год. Врач следит за вероятными побочными эффектами АЭП по жалобам пациента и по лабораторным тестам (анализы крови – клинический и биохимический, ЭКГ, УЗИ внутренних органов и др.). Какой именно анализ назначается, зависит от конкретного АЭП. Например, если препарат иногда дает анемию, то это будет клинический анализ крови. Если препарат вызывает снижение числа тромбоцитов, то именно этот показатель и будет мониторироваться.
Если один препарат не эффективен, то врач будет применять альтернативный препарат. Как правило, поступают следующим способом – вводят второй препарат в терапевтической дозе, не уменьшая дозы первого, и смотрят, каков результат. Если достигнуто исчезновение приступов, то дозы первого препарата можно уменьшить и, возможно, в дальнейшем его отменить. Тем не менее, существуют пациенты, которые годами вынуждены принимать 2 (редко – 3) препарата.
Пациент является активным участником процесса лечения. В последние годы меняется модель взаимоотношений пациента и врача. От авторитарной модели взаимоотношений (когда врач жестко диктовал условия лечения пациенту) сейчас постепенно весь мир переходит к так называемой «партнерской» («коллегиальной») модели, при которой врачи и пациенты – равноправные участники процесса лечения. Врач сообщает пациенту или его родственникам правдивую информацию, обеспечивает ее понимание, создает условия для принятия пациентом адекватного решения. Если решение принято совместно (пациентом или его родителями и врачом), то эффективность его выполнения существенно увеличивается. Тогда пациент и его родственники мотивированы на четкое выполнение всех этапов обследования и лечения. Для них процесс лечения очень нелегкий, так как он иногда продолжается годами. Чем длительнее течение эпилепсии, тем труднее соблюдать все предписания. Многие пациенты (считается, что около 30% от общего числа) не следуют советам врача: меняют кратность приема препарата, его дозу, допускают пропуски приема препарата. Некоторые переходят на режим самолечения. Чаще всего это происходит из-за недостатка информированности в области эпилепсии. Отсутствие «приверженности к терапии» может сыграть неблагоприятную роль в эффективности лечения, а также привести к жизнеугрожающей ситуации (эпилептический статус), а, иногда, и к летальному исходу. С другой стороны врач также должен прислушиваться к пожеланиям и жалобам пациента, особенно в том, что касается переносимости АЭП. Партнерская (коллегиальная) модель взаимоотношений врача и пациента требует от обеих сторон доверия и высокой ответственности.
Продолжительность лечения зависит от конкретной клинической ситуации и определяется в основном тем, каким эпилептическим синдромом страдает пациент. Есть эпилептические синдромы (юношеская миоклоническая эпилепсия, юношеская абсансная эпилепсия, миоклония век с абсансами и др.), при которых мы не можем вылечить эпилепсию, а только ее «контролируем». Пациент принимает препарат и приступы у него отсутствуют, но отмена препарата приводит к рецидиву приступов в 80-90 % всех случаев. При таких эпилептических синдромах лечение носит длительный (годами и десятилетиями) характер. Наоборот короткая продолжительность лечения принята при так называемых доброкачественных эпилепсиях детства – роландической и затылочной с ранним началом (лечат, как правило, не более 2-х лет). Продолжительность лечения – один из самых сложных вопросов в эпилептологии. Существуют международные рекомендации о том, что вопрос об отмене препарата должен рассматриваться не ранее, чем через 2 года ремиссии (полного отсутствия эпилептических приступов). В то же время у целого ряда пациентов, в основном с симптоматическими эпилепсиями, два года – слишком короткий срок, чтобы добиться излечения от эпилепсии
Решение об отмене препарата принимается врачом совместно с пациентом или его родителями/опекунами. Решение принимается на основании оценки риска рецидива эпилептических приступов. Риск рецидива зависит от многих факторов. Такие факторы как нормальный интеллект, отсутствие двигательных нарушений, изменений на МРТ головного мозга и эпилептиформных разрядов на ЭЭГ, а также большая длительность ремиссии уменьшают риск рецидива. Считается, что медленная отмена препарата уменьшает риск рецидива. Насколько медленно отменять препарат, вопрос не очень ясный. В международной литературе существует рекомендация, что отмена АЭП не должна проводится быстрее, чем за 6-8 недель. Из этого правила существуют исключения – очень медленно отменяются фенобарбитал и бензодиазепины. В отечественной практике АЭП отменяются медленнее, чем в международной – отмена занимает не недели, а месяцы. При большинстве эпилептических синдромов (за исключением доброкачественных эпилепсий детства) отмену АЭП лучше проводить под контролем ЭЭГ. Снижается доза препарата, через какое-то время после этого делается ЭЭГ. Если на ЭЭГ появляются эпилептиформные разряды, то целесообразно вернуться к той дозе, на которой их не было и не отменять препарат. Проведение ЭЭГ также показано после полной отмены препарата. Наиболее опасен в отношении рецидива приступов первый год после полной отмены препарата
Образ жизни больного с эпилепсией
Все пациенты с эпилепсией, их родственники, лица, их опекающие, и врачи должны стремиться к максимально возможному сохранению нормального образа жизни, свойственного здоровым людям. Конечно, это не всегда возможно, особенно при тяжелых эпилепсиях, протекающих с частыми приступами и нарушениями интеллектуального развития. Тем не менее, всегда нужно стремиться к тому, чтобы не было ненужных и лишних ограничений. Эпилепсия может оказывать негативное влияние на образ жизни пациента, но разумный оптимизм позволяет уменьшить степень этого негативного влияния. Баланс между стремлением к нормальному образу жизни и минимизацией возможных рисков иногда достигается с трудом.
Диета. Пациенты с эпилепсией должны получать полноценное питание с достаточным количеством свежих овощей и фруктов. Существует специальная диета, которая носит название кетогенной, и которая может уменьшить число приступов у пациентов с резистентной эпилепсией. Она достаточная сложна в применении и не может проводиться самостоятельно в связи с возможными осложнениями.
Физические нагрузки. Общие физические нагрузки, как правило, не вызывают провокации приступов (хотя это и чрезвычайно редко возможно у отдельных пациентов). Занятия спортом показаны пациентам с эпилепсией, они благотворно влияют на настроение и уменьшают степень изолированности пациента от общества. Упражнения позволяют избежать избыточной массы тела, что иногда является последствием приема препаратов. Кроме того, физические нагрузки позволяют укрепить костную ткань (ее плотность также может снижаться при приеме отдельных антиэпилептических препаратов). Есть несколько исследований, результаты которых не показывают связи между физической активностью пациента и частотой его приступов. Тем не менее, в каждом конкретном случае вопрос решается индивидуально. Большое значение имеет тип приступов – если пациент во время приступа теряет сознание, то могут вводиться определенные ограничения. Всегда учитывается риск возможной травматизации в момент приступа, поэтому исключаются альпинизм, ныряние с аквалангом, бокс и прыжки на батуте. Как правило, пациенту с текущими приступами не показано и плавание. Судороги в воде приводят к утоплению. В каких-то отдельных ситуациях при отсутствии приступов или при редких приступах без нарушений сознания врач может разрешить пациенту плавать, но только в присутствии ответственных лиц, способных оказать неотложную помощь, если она понадобиться. Ездить на велосипеде можно, если приступы отсутствуют, лучше при этом надевать защитный шлем. То же самое касается катания на лошадях.
Работа. В некоторых случаях эпилепсия может вызывать приступы, которые могут мешать определенной работе. В целом у работодателей существует определенное предубеждение против работников, страдающих эпилепсией, и оно далеко не всегда справедливо. Необходимо определенное законодательство, которое предотвратило бы дискриминационные ограничения в приеме на работу. Тем не менее, наличие эпилепсии может ограничить выбор работы или специальности – страдая эпилепсией, невозможно стать пилотом, водителем, профессиональным военным, полицейским, пожарным. Потенциальную опасность для пациента с сохраняющимися приступами может представлять работа с движущимися механизмами и химикатами. Для пациента, у которого приступы провоцируются недостатком сна, неприемлема работа в ночное время суток
Секс. Многие пациенты, страдающие эпилепсией, ведут полноценную сексуальную жизнь и не предъявляют никаких жалоб. В то же время определенные варианты эпилепсии сами по себе, а также отдельные антиэпилептические препараты могут снижать либидо. Если это происходит, необходимо сказать об этом врачу.
Путешествия. Для любого путешествия принципиально важно запастись достаточным количеством антиэпилептического препарата. Целесообразно захватить с собой и рецепт на препарат с указанием его международного названия, выписанный врачом. Еще лучше наряду с рецептом иметь короткую выписку (письмо лечащего врача) с рекомендациями. Препарат необходимо держать при себе (в ручной клади) на тот случай, если багаж будет потерян. Оформление страховки на время путешествия за границу обязательно.
Эмоциональная и психологическая поддержка чрезвычайно важна для пациентов. Это касается и семьи, в которой живет пациент, и школы/колледжа/института, в котором он учится, и места работы. Все окружающие должны относиться к пациентам с эпилепсией (взрослым и детям) как к совершенно нормальным людям, пусть и имеющим определенные проблемы. Пациенты и их родственники также могут обратиться за поддержкой в специальные общественные организации (ассоциации), которых сейчас довольно много. Некоторым пациентам и их семьям нужна помощь психолога и психотерапевта.
Алкоголь. Большинство пациентов с эпилепсией могут время от времени выпить бокал вина (100 мл) или пива (285-300 мл) или крепкий спиртной напиток (30 мл). Ограничения в приеме алкоголя связаны с тем, что большие его количества снижают эффективность антиэпилептического лечения (возможен рецидив приступов). Злоупотребление алкоголем может приводить к потере контроля над приступами также из-за недосыпания, пропусков приема препарата или снижения его концентрации в крови.
Вождение автомобиля. В нашей стране законодательство очень строгое – если человек страдает эпилепсией, он не может водить автомобиль.
Телевидение и компьютерные игры – определенные ограничения существуют только для так называемых фоточувствительных пациентов. Всем им рекомендуется избегать провоцирующих факторов. С этой целью рекомендуется ношение солнцезащитных или поляризующих очков. Эффективность такой защиты можно протестировать при проведении ЭЭГ. Нет необходимости запрещать пациентам с эпилепсией смотреть телевизор, тем более, что рефлекторной «телевизионной» эпилепсии не существует (практически всегда есть и спонтанные приступы).
При просмотре телевизора рекомендуется соблюдать следующие меры предосторожности:
- небольшой экран с хорошим качеством изображения и частотой развертки 100 Гц более безопасен, чем с частотой 50 Гц;
- расстояние до телеэкрана должно быть не менее 2 м;
- использование пульта дистанционного управления;
- просмотр телевизора в освещенной комнате для уменьшения контраста;
- избегание просмотра телевизора под тупым углом;
- при возникновении необходимости подойти близко и смотреть на экран на близком расстоянии даже короткое время, необходимо закрыть один глаз рукой (просто зажмуривание глаза недостаточно).
Determining the Likelihood of Variant Pathogenicity Using Amino Acid-level Signal-to-Noise Analysis of Genetic Variation
Представитель результат аминокислоты уровень сигнала анализ шума для KCNQ1 изображен на рисунке 6. В этом примере, редких вариантов, определенных в GnomAD когорты (когорта управления), кстати выявлены варианты Уэс (экспериментальная когорты #1) и LQTS дело связанных вариантов считается что вероятно связанных заболеваний (экспериментальная когорты #2) изображены. Кроме того анализ сигнал шум, сравнивая Уэс и LQTS когорты вариант частоты нормированный против GnomAD изображен вариант частоты. LQTS-связанные варианты продемонстрировал высокое соотношение сигнал шум в доменах с поровых каналов, избирательность фильтра и KCNE1-связывающий домен. В сравнении кстати выявленных вариантов в когорте Уэс не демонстрируют ясно конкретных регионов высокогорные сигнал шум, предполагая, что эти варианты отражают фон генетической вариации. В этом примере не использовать вариант ТБР, как указано выше; Однако он демонстрирует все те же принципы, как описано.
Рисунок 1 : Пример управления вариант базы данных с расчетом ТБР. Столбец A, напрямую импортированных GnomAD редких вариантов управления. Столбец B, удаление левосторонней, не связанных с позиции текста от варианта номенклатуры, с помощью примера формулы для удаления символов (то есть: для B2» = правый (A2, LEN (А2) -5», смотрите Таблицу материалы). Столбец C, удаление правосторонняя, не связанных с позиции текста от варианта номенклатуры, с использованием соответствующих формулы (то есть: C2» = LEFT(B2,LEN(B2)-3″). Столбец D, результирующая несортированные аминокислоты позиции. Колонка E, аминокислоты позиции отсортированы по возрастанию моды для идентификации повторяющихся позиций. Колонке F, связанные ТБР для каждого варианта, как импортированные из GnomAD. Столбец, G и H, комбинированные ТБР для данной аминокислоты позиции (сумма каждого варианта MAF на определенной позиции). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 2 : Пример экспериментальный вариант базы данных с расчетом ТБР. Столбец A, список макет связанных LQTS мутации в KCNQ1 представляющих связанные заболевания мутация экспериментальной базы данных. Столбец B, мутация положении для каждого варианта. Столбец C, количество мутаций позитивных людей в макет исследование 1. Предполагается, что каждый гетерозиготных мутации перевозчиков. Общее количество лиц, генотипируемого в исследовании расположен в нижней части листа. Столбец D, количество мутации позитивные лица в макет 2 исследования. Колонка E, количество мутации позитивные лица в макет исследование 3. Колонке F, всего мутации-инфицированных хостинг наблюдаемых мутаций во всех исследованиях. Обратите внимание, что различные мутации, связанные с одной и той же позиции аминокислоты должны быть объединены. Колонка G, ТБР положение каждого мутации и аминокислоты, с помощью примера формулы (то есть: G2 «=2/(176*2)», см. Таблицу материалы). Обратите внимание, что поскольку предполагается, что все люди являются гетерозиготной и каждый человек, как предполагается, нести 2 аллелей локуса KCNQ1, общая лиц следует умножить на 2 для частоты аллеля. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 3 : Пример прокатки расчета среднего для управления и экспериментальные варианты. Столбец A и B, вариант позиции GnomAD элемента управления и соответствующих ТБР. Столбец C, все аминокислоты позиции KCNQ1 из аминокислоты позиции в финал. Столбец D, GnomAD вариант ТБР для всех позиций с ТБР 0 вместо должности без вариант. Это автоматически вычисляется с помощью функции ВПР (т.е. для D2, «= IFERROR(VLOOKUP(C2,A:B,2,),0), смотрите Таблицу материалы). Колонка E, скользящее среднее из позиции ТБР, с помощью примера формулы (т.е. для E2, «= SUM(D2:D7)/6» и E7, «= SUM(D2:D12)/11″). Столбец, G и H, LQTS экспериментальный вариант позиции с соответствующими ТБР. Колонке я, все аминокислоты позиции KCNQ1. Колонка J, LQTS вариант ТБР для всех позиций. Колонка K, Роллинг LQTS MAF. Серая заливка ячейки являются примерами где ТБР значения из столбца B и H расширяются в столбец D и J, соответственно, которые коррелируют с соответствующих позиций в колонке C/I. Обратите внимание, что очень важно, что все ячейки форматируются как «Номера» для надлежащей формулы функционирование. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 4 : Пример анализа сигнала к шуму и изображая диаграммой. Слева, пример базы данных и вычисления. Столбец A, все аминокислоты позиции KCNQ1. Столбец B, LQTS экспериментальной ТБР скользящее среднее для каждой позиции. Столбец C, GnomAD контроль ТБР скользящего среднего для каждой позиции. D: сигнал шум коэффициент (т.е. для D2, «= B2/C2»). Справа, пример графа соотношения сигнал шум (ось y) против позиции аминокислоты (ось x). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 5 : Пример белков и вариант позиции сопоставления. A, пример базы данных и вычисления. Столбец A, все аминокислоты позиции KCNQ1. Столбец B, KCNQ1 позиций, которые имеют вариант редкий управления определены в GnomAD. Столбец C, столбце сопоставления домена, где ячейки, содержащие значения соответствуют N или C-терминал аспект определенных доменов протеина KCNQ1 или функции. Как большинство N-концевой домен домен S1 имеет границы N-терминала на аминокислоты 122, значения не указаны здесь. Столбец D, вариант отображения столбца, где клетки, содержащие 1 соответствуют KCNQ1 позиции, которая локализовать редкие варианты. Серый заполнить клетки являются двумя примерами где вариант позиции в колонке B расширяются в столбец D которых коррелируют с соответствующих позиций в колонке A. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 6 : Пример аминокислоты уровня сигнала к шуму анализа KCNQ1-кодировке KCNQ1 (Kv7.1). Топ, вариант позиции демонстрируются с вертикальными линиями, включая редкие варианты когорты GnomAD (черный), кстати выявлены варианты в WES рефералов (синий) и варианты, указанные в LQTS cases(green). Отмечены функциональные домены. Относительная частота LQTS случае вариантов нормированы GnomAD варианты (зеленая линия) изображен по сравнению с Уэс (синяя линия). S1-S6 трансмембранных доменов; SF, Ион избирательность фильтра; KCNE1 и AKAP9, соответствующих белков связывания доменов. Изменение и Перепечатано с разрешения от предыдущей работы14. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Subscription Required. Please recommend JoVE to your librarian.
частей определенных белков и их роль
1
Biomolecule Reports — Международный электронный бюллетень BR / 05/18/20
Необычные аминокислоты: части определенных белков и их роль
Четан Кумар Нагар * 1 Сапреш Кумари2 и Kumar2
1Ph.D., MBB, Индийский институт сельскохозяйственных исследований, Нью-Дели, 110012
2SRF, Национальный исследовательский центр биотехнологии растений, Нью-Дели, 110012
* Почта для корреспондента автора: chetankrnagar @ gmail.com
Abstract
Во всех типах клеток и их части белки являются наиболее распространенными биологическими макромолекулами
, которые построены из вездесущего набора из 20 аминокислот, ковалентно связанных между собой в характерные линейные последовательности. Поскольку каждая из этих аминокислот имеет боковую цепь
с отличительными химическими свойствами, которые определяют функциональные свойства этих аминокислот.
Помимо этого универсального набора аминокислот есть некоторые необычные аминокислоты, также
, обнаруженные в определенных белках и играющие важную роль в функции белков.В отличие от обычных
аминокислот, эти необычные аминокислоты образуются из обычных аминокислот как часть посттрансляционной модификации
. В этой статье мы указываем на некоторые необычные аминокислоты
, обнаруженные в определенных белках, с их функциональной активностью.
Введение
Белок — это конечный продукт экспрессии гена, который опосредует практически каждый
процесс, происходящий в клетке, демонстрируя почти бесконечное разнообразие функций.Белок
, также известный как строительный блок клетки, представляет собой наиболее распространенные биологические макромолекулы
, обнаруженные в клетке и ее части. Белки сконструированы из повсеместного набора из 20 аминокислот
, ковалентно связанных в характерные линейные последовательности. Это наиболее замечательный феномен
клеток, который может продуцировать белок с совершенно разными свойствами и активностями
путем соединения одного и того же повсеместного набора из 20 аминокислот во многих различных комбинациях и последовательностей
.Из этих строительных блоков различные организмы могут производить
таких самых разнообразных продуктов, как гормоны, переносчики, ферменты, антитела, мышечные волокна и перья птиц,
паутины, молочные белки, белки шелка и многое другое. Среди этих белковых продуктов наиболее разнообразны ферменты
, которые играют роль биологического катализатора во всех клеточных биологических реакциях
. В дополнение к этому универсальному набору из 20 аминокислот некоторые белки могут содержать
необычных остатков, образованных модификацией обычных аминокислотных остатков, которые
уже включены в полипептид.
Отчеты о биомолекулах ISSN: 2456-8759
Популярная статья
CK Nagar et al, BR / 05/18/20
Какие две редкие аминокислоты? »Science ABC
Селеноцистеин (Sec) и пирролизин (Pyl) — редкие аминокислоты, которые не так широко распространены, как 20 канонических аминокислот.
Большинство людей хорошо знают, что есть 20 аминокислот, из которых состоят наши белки, но что, если бы я сказал вам, что это на самом деле неправда, и на самом деле есть несколько дополнительных аминокислот, о которых мы редко говорим?
Общие аминокислоты (Фото: Cristian Victor Rete / Shutterstock)
Всего в нашей ДНК было определено 22 аминокислоты .Селеноцистеин (Sec) и пирролизин (Pyl) являются 21-й и 22-й аминокислотами соответственно. Их называют редкими аминокислотами, поскольку они не так распространены в природе, как остальные аминокислоты.
Почему это открытие было таким шокирующим?Четыре нуклеотидных основания, обозначаемые буквами A, G, T и C, составляют всю нашу ДНК. Когда в 1960-х годах был обнаружен генетический код, ученые обнаружили, что он читается по 3 буквы за раз. Эти три буквы вместе известны как кодоны и присутствуют на информационной РНК (мРНК).
Считалось, что каждый кодон выполняет единственную функцию: либо обозначает одну из 20 аминокислот, либо обозначает начало (через стартовый кодон) или конечную точку (через стоп-кодон) аппарата трансляции, генерирующего белок.
Кодоны на мРНК, определяющие аминокислоту и заканчивающиеся стоп-кодоном (Фото: Thomas Splettstoesser / Wikimedia Commons)
Хотя эти 20 аминокислот составляют основу каждого белка, некоторые белки имеют разные или нетрадиционные аминокислоты.Ученые обнаружили, что большинство этих аминокислот произошли от исходных 20 аминокислот, структура которых изменилась после того, как в конце трансляции образовалась полипептидная цепь. Эти изменения известны как посттрансляционные модификации , и они необходимы для придания белку его необходимой функции.
Хотя эти аминокислоты встречаются редко, они все же выполняют важные функции. Например, 4-гидроксилизин и 5-гидроксипролин являются производными лизина и пролина, соответственно, и обнаруживаются в коллагене (белок, содержащийся в соединительной ткани).
Посттрансляционные модификации (Фото предоставлено Kep17 / Wikimedia Commons)
Таким образом, когда в белках были впервые обнаружены селеноцистеин (Sec) и пирролизин (Pyl), они считались результатом таких посттрансляционных модификаций цистеина и лизин соответственно. Однако в 1986 году два важных открытия показали, что селеноцистеин на самом деле кодируется стоп-кодоном UGA. 16 лет спустя было установлено, что пирролизин кодируется стоп-кодоном UAG!
К середине 1960-х годов было хорошо известно, что стартовый кодон (AUG) кодирует аминокислоту метионин, но считалось, что стоп-кодоны (UAG, UAA и UGA) не кодируют какие-либо белки, а просто прерывают трансляцию. .Фактически, их даже называют бессмысленными кодонами, поскольку они не образуют аминокислот.
Таким образом, это открытие было революционным, поскольку оно приписывало новую роль стоп-кодонам. Кроме того, два открытия были сделаны отдельно на двух разных организмах — E. coli , и мышах, что указывает на то, что такие необычные аминокислоты присутствовали у самых разных видов.
Обычный механизм стоп-кодона (Фото предоставлено Аленом Галлиеном / Wikimedia Commons)
16 лет спустя пирролизин был идентифицирован как кодируемый стоп-кодоном UAG!
Почему они редки? Несмотря на то, что селеноцистеин (Sec) и пирролизин (Pyl) закодированы в ДНК, в отличие от стандартных аминокислот, они требуют особого механизма для включения в белок.Фактически, они требуют двух механизмов, потому что, хотя обе эти две редкие аминокислоты кодируются стоп-кодонами, они делают это, используя совершенно разные механизмы.
Присутствие пирролизина ограничено крошечной долей белков у очень ограниченного числа организмов. На данный момент только 11 организмов из примерно 1000 организмов, по которым имеются полные геномные данные, кодируют пирролизин.
С другой стороны, селеноцистеин присутствует во множестве организмов во всех трех областях жизни (археи, бактерии, эукарии).Считается, что он синтезируется почти четвертью секвенированных бактерий. Однако, что интересно, было обнаружено, что всего 17 белков млекопитающих синтезируют селеноцистеин.
Важны ли они?Ученые уже знали, что даже несмотря на то, что многие нестандартные аминокислоты не могут быть включены в белки, они по-прежнему являются важными промежуточными звеньями во многих метаболических процессах. Поскольку селеноцистеин и пирролизин фактически кодируются ДНК, они, скорее всего, были важны.Однако из-за их редкости важность этих двух аминокислот до недавнего времени игнорировалась.
Селеноцистеин структурно похож на цистеин и содержит важный питательный микроэлемент — селен — вместо атома серы, обнаруженного в цистеине. Это важная аминокислота, которая содержится в селенопротеинах и связана с рядом метаболических и клеточных процессов. Было обнаружено, что дефицит селена в головном мозге вызывает неврологические нарушения, такие как судороги. Это было связано с рядом других заболеваний, помимо нейродегенеративных расстройств.Однако исследователям еще предстоит определить его точную роль в механизме заболевания.
Структура селеноцистеина (Фото: Шмитт Мария / Shutterstock)
Пирролизин был идентифицирован в метаногене, Methanosarcina barkeri , который содержится в желудке коров! До недавнего времени белки, содержащие пирролизин, были обнаружены только в метаногенах, что означает, что он играет роль в производстве метана (метаногенез). Он структурно похож на лизин и помогает ферменту метилтрансферазе во время метаногенеза.Необходимы дальнейшие исследования, чтобы определить, играет ли пирролизин роль в каких-либо других процессах.
Структура пирролизина (Фото: Bacsica / Shutterstock)
ЗаключениеСтатьи по теме
Статьи по теме
Почему и когда в процессе эволюции жизни эти две аминокислоты были добавлены в геномы нескольких организмов, остается загадкой. Хотя в настоящее время они классифицируются как редкие, дальнейшие исследования могут доказать, что мы ошибаемся.В конце концов, по словам Альберта Эйнштейна, «мы до сих пор не знаем и одной тысячной процента того, что нам открыла природа».
2.2: Структура и функции — аминокислоты
Источник: BiochemFFA_2_1.pdf. Весь учебник доступен бесплатно у авторов по адресу http://biochem.science.oregonstate.edu/content/biochemistry-free-and-easy
.Все белки на Земле состоят из одних и тех же 20 аминокислот. Связанные вместе в длинные цепи, называемые полипептидами, аминокислоты являются строительными блоками для огромного ассортимента белков, обнаруженных во всех живых клетках.
«Это одно из наиболее поразительных обобщений биохимии … что двадцать аминокислот и четыре основания, с небольшими оговорками, одинаковы во всей Природе». — Фрэнсис Крик
Все аминокислоты имеют одинаковую основную структуру, показанную на рисунке 2.1. В «центре» каждой аминокислоты находится углерод, называемый α-углеродом, и к нему присоединены четыре группы — водород, α-карбоксильная группа, α-аминогруппа и R-группа, иногда называемая боковая цепь.Α-углеродная, карбоксильная и аминогруппы являются общими для всех аминокислот, поэтому R-группа является единственной уникальной особенностью каждой аминокислоты. (Незначительным исключением из этой структуры является пролин, в котором конец R-группы присоединен к α-амину.) За исключением глицина, у которого есть R-группа, состоящая из атома водорода, все из аминокислоты в белках имеют четыре разные группы, присоединенные к ним, и, следовательно, могут существовать в двух зеркальных формах, L и D. За очень небольшими исключениями каждая аминокислота, обнаруженная в клетках и в белках, находится в L-конфигурации.
Рисунок 2.1 — Общая структура аминокислотВ белках содержатся 22 аминокислоты, из которых только 20 определены универсальным генетическим кодом. Другие, селеноцистеин и пирролизин, используют тРНК, которые способны образовывать пары оснований со стоп-кодонами в мРНК во время трансляции. Когда это происходит, эти необычные аминокислоты могут быть включены в белки. Ферменты, содержащие селеноцистеин, например, включают глутатионпероксидазы, тетрайодтиронин-5′-дейодиназы, тиоредоксинредуктазы, формиатдегидрогеназы, глицинредуктазы и селенфосфатсинтетазу.Белки, содержащие пирролизин, встречаются гораздо реже и в основном встречаются в архее.
Существенное и несущественное
Диетологи делят аминокислоты на две группы — незаменимые аминокислоты (должны присутствовать в рационе, потому что клетки не могут их синтезировать) и заменимые аминокислоты (могут производиться клетками). Эта классификация аминокислот имеет мало общего со структурой аминокислот. Незаменимые аминокислоты значительно различаются от одного организма к другому и даже различаются у людей, в зависимости от того, взрослые они или дети.Таблица 2.1 показывает незаменимые и заменимые аминокислоты в организме человека.
Некоторые аминокислоты, которые обычно не являются незаменимыми, в определенных случаях может потребоваться получить с пищей. Людям, которые не синтезируют достаточное количество аргинина, цистеина, глутамина, пролина, селеноцистеина, серина и тирозина, например, из-за болезни, могут потребоваться пищевые добавки, содержащие эти аминокислоты.
Таблица 2.1 — Незаменимые и заменимые аминокислоты
Небелковые аминокислоты
Есть также α-аминокислоты, обнаруженные в клетках, которые не включены в белки.Общие включают орнитин и цитруллин. Оба эти соединения являются промежуточными продуктами цикла мочевины. Орнитин является метаболическим предшественником аргинина, а цитруллин может вырабатываться при расщеплении аргинина. Последняя реакция производит оксид азота, важную сигнальную молекулу. Цитруллин — это побочный продукт метаболизма. Иногда его используют в качестве пищевой добавки для снижения мышечной усталости.
Химия группы R
Таблица 2.2 — Категории аминокислот (на основе свойств R-группы)
Мы разделяем аминокислоты на категории на основе химического состава их R-групп.Если вы сравните группы аминокислот в разных учебниках, вы увидите разные названия категорий и (иногда) одну и ту же аминокислоту по-разному классифицируют разные авторы. Действительно, мы относим тирозин как к ароматической аминокислоте, так и к гидроксиламинокислоте. Полезно классифицировать аминокислоты на основе их R-групп, потому что именно эти боковые цепи придают каждой аминокислоте ее характерные свойства. Таким образом, можно ожидать, что аминокислоты с (химически) подобными боковыми группами будут функционировать аналогичным образом, например, во время сворачивания белка.
Неполярные аминокислоты
- Аланин (Ala / A) — одна из самых распространенных аминокислот, обнаруживаемых в белках, по распространенности уступающая только лейцину. D-форма аминокислоты также содержится в стенках бактериальных клеток. Аланин несущественен, легко синтезируется из пирувата. Он кодируется GCU, GCC, GCA и GCG.
- Глицин (Gly / G) — это аминокислота с самой короткой боковой цепью, имеющая R-группу, соответствующую только одному водороду. В результате глицин — единственная нехиральная аминокислота.Его небольшая боковая цепь позволяет ему легко вписываться как в гидрофобную, так и в гидрофильную среду.
- Глицин определяется в генетическом коде посредством GGU, GGC, GGA и GGG. Для людей это несущественно.
- Изолейцин (Ile / I) — незаменимая аминокислота, кодируемая AUU, AUC и AUA. У него гидрофобная боковая цепь, а также хиральная боковая цепь.
- Лейцин (Leu / L) представляет собой аминокислоту с разветвленной цепью, которая является гидрофобной и незаменимой.Лейцин является единственной диетической аминокислотой, которая, как сообщается, напрямую стимулирует синтез белка в мышцах, но следует соблюдать осторожность, поскольку 1) существуют противоречивые исследования и 2) токсичность лейцина опасна, что приводит к «четырем D»: диарее, дерматиту, деменции. и смерть. Лейцин кодируется шестью кодонами: UUA, UUG, CUU, CUC, CUA, CUG.
- Метионин (Met / M) — незаменимая аминокислота, которая является одной из двух серосодержащих аминокислот, цистеин — другой. Метионин неполярен и кодируется исключительно кодоном AUG.Это «инициатор» аминокислоты в синтезе белка, поскольку она первая включается в белковые цепи. В прокариотических клетках первый метионин в белке формилируется.
- Пролин (Pro / P) — единственная аминокислота, обнаруженная в белках с R-группой, которая соединяется со своей собственной α-аминогруппой, образуя вторичный амин и кольцо. Пролин является незаменимой аминокислотой и кодируется CCU, CCC, CCA и CCG. Это наименее гибкая из аминокислот белка и, таким образом, придает конформационную жесткость, когда присутствует в белке.Присутствие пролина в белке влияет на его вторичную структуру. Это разрушитель α-спиралей и β-цепей. Пролин часто гидроксилирован в коллагене (для реакции требуется витамин С — аскорбат), что увеличивает конформационную стабильность белка. Гидроксилирование пролином фактора, индуцируемого гипоксией (HIF), служит датчиком уровня кислорода и нацелено на разрушение HIF при избытке кислорода.
- Валин (Val / V) — незаменимая неполярная аминокислота, синтезируемая в растениях.Это примечательно в отношении гемоглобина, поскольку, когда он заменяет глутаминовую кислоту в позиции номер шесть, он вызывает аномальную агрегацию гемоглобина в условиях низкого содержания кислорода, что приводит к серповидно-клеточной анемии. Валин закодирован в генетическом коде GUU, GUC, GUA и GUG.
Карбоксиламинокислоты
- Аспарагиновая кислота (Asp / D) — это заменимая аминокислота с карбоксильной группой в ее R-группе. Он легко образуется при переаминировании оксалоацетата. При pKa 3,9 боковая цепь аспарагиновой кислоты отрицательно заряжена при физиологическом pH.Аспарагиновая кислота указана в генетическом коде кодонами GAU и GAC.
- Глутаминовая кислота (Glu / E), кодируемая GAA и GAG, представляет собой заменимую аминокислоту, легко получаемую путем трансаминирования α-кетоглутарата. Он является нейротрансмиттером и имеет R-группу с карбоксильной группой, которая легко ионизируется (pKa = 4,1) при физиологическом pH.
Аминокислоты
- Аргинин (Arg / R) — это аминокислота, которая в некоторых случаях является незаменимой, а в других — несущественной.Недоношенные дети не могут синтезировать аргинин. Кроме того, хирургическая травма, сепсис и ожоги увеличивают потребность в аргинине. Однако большинству людей добавки аргинина не нужны. Боковая цепь аргинина содержит сложную гуанидиниевую группу с pKa более 12, что делает ее положительно заряженной при клеточном pH. Он кодируется шестью кодонами — CGU, CGC, CGA, CGG, AGA и AGG.
- Гистидин (His / H) — единственная из белковых аминокислот, которая содержит имидазольную функциональную группу. Это незаменимая аминокислота для человека и других млекопитающих.С pKa боковой цепи, равным 6, его заряд может легко измениться при небольшом изменении pH. Протонирование кольца приводит к двум структурам NH, которые можно представить как две одинаково важные резонансные структуры.
- Лизин (Lys / K) является незаменимой аминокислотой, кодируемой AAA и AAG. Он имеет группу R, которая может легко ионизироваться с зарядом +1 при физиологическом pH и может быть посттрансляционно модифицирована с образованием ацетиллизина, гидроксилизина и метиллизина.Он также может быть убиквитинирован, сумоилирован, неддилирован, биотинилирован, карбоксилирован и пупилирован, и. О-гликозилирование гидроксилизина используется для маркировки белков для экспорта из клетки. Лизин часто добавляют в корм для животных, поскольку он является ограничивающей аминокислотой и необходим для оптимизации роста свиней и цыплят.
Ароматические аминокислоты
Рисунок 2.6 — Ароматические аминокислоты- Фенилаланин (Phe / F) — неполярная незаменимая аминокислота, кодируемая UUU и UUC.Это метаболический предшественник тирозина. Неспособность метаболизировать фенилаланин возникает из-за генетического нарушения, известного как фенилкетонурия. Фенилаланин входит в состав искусственного подсластителя аспартама.
- Триптофан (Trp / W) — незаменимая аминокислота, содержащая индольную функциональную группу. Это метаболический предшественник серотонина, ниацина и (в растениях) фитогормона ауксина. Хотя считается, что он используется в качестве снотворного, четких результатов исследований, подтверждающих это, нет.
- Тирозин (Tyr / Y) — это незаменимая аминокислота, кодируемая UAC и UAU.Он является мишенью для фосфорилирования белков тирозиновыми протеинкиназами и играет роль в процессах передачи сигналов. В дофаминергических клетках мозга тирозингидроксилаза превращает тирозин в l-допа, непосредственный предшественник дофамина. Дофамин, в свою очередь, является предшественником норадреналина и адреналина. Тирозин также является предшественником гормонов щитовидной железы и меланина.
Гидроксиламинокислоты
- Серин (Ser / S) — одна из трех аминокислот, имеющих R-группу с гидроксилом в ней (другие — треонин и тирозин).Он кодируется UCU, UCC, UCA, UGC, AGU и AGC. Обладая водородной связью с водой, он классифицируется как полярная аминокислота. Для человека это несущественно. Серин является предшественником многих важных клеточных соединений, в том числе пуринов, пиримидинов, сфинголипидов, фолиевой кислоты и аминокислот глицина, цистеина и триптофана. Гидроксильная группа серина в белках является мишенью для фосфорилирования некоторыми протеинкиназами. Серин также является частью каталитической триады сериновых протеаз.
- Треонин (Thr / T) — незаменимая полярная аминокислота. Это одна из трех аминокислот, несущих гидроксильную группу (серин и тирозин — другие), и, как таковая, она является мишенью для фосфорилирования белков. Он также является мишенью для гликозилирования белков. Треониновые протеазы используют гидроксильную группу аминокислоты в своем катализе, и она является предшественником одного пути биосинтеза для производства глицина. В некоторых случаях он используется в качестве пролекарства для повышения уровня глицина в мозге.Треонин кодируется в генетическом коде ACU, ACC, ACA и ACG.
Тирозин — см. ЗДЕСЬ.
Рисунок 2.8 — Свойства аминокислот ВикипедияДругие аминокислоты
- Аспарагин (Asn / N) — это незаменимая аминокислота, кодируемая AAU и AAC. Его карбоксиамид в R-группе придает ему полярность. Аспарагин участвует в образовании акриламида в продуктах, приготовленных при высоких температурах (жарка во фритюре), когда он реагирует с карбонильными группами. Аспарагин может быть произведен в организме из аспартата путем реакции амидирования амином из глутамина.При распаде аспарагина образуется малат, который может окисляться в цикле лимонной кислоты.
- Цистеин (Cys / C) — единственная аминокислота с сульфгидрильной группой в боковой цепи. Для большинства людей это несущественно, но может быть необходимо для младенцев, пожилых людей и людей, страдающих определенными метаболическими заболеваниями. Сульфгидрильная группа цистеина легко окисляется до дисульфида при взаимодействии с другой группой. Цистеин не только содержится в белках, но и входит в состав трипептида, глутатиона.Цистеин определяется кодонами UGU и UGC.
- Глютамин (Gln / Q) — это аминокислота, которая обычно не является незаменимой для людей, но может быть у людей, проходящих интенсивные спортивные тренировки или страдающих желудочно-кишечными расстройствами. Он имеет карбоксиамидную боковую цепь, которая обычно не ионизируется при физиологических значениях pH, но придает полярность боковой цепи. Глутамин кодируется CAA и CAG и легко образуется путем амидирования глутамата.Глютамин — самая распространенная аминокислота в циркулирующей крови и одна из немногих аминокислот, способных преодолевать гематоэнцефалический барьер.
- Селеноцистеин (Sec / U) — компонент селенопротеинов, обнаруженных во всех сферах жизни. Он является компонентом нескольких ферментов, включая глутатионпероксидазы и тиоредоксинредуктазы. Селеноцистеин включается в белки по необычной схеме, включающей стоп-кодон UGA. Клетки, выращенные в отсутствие селена, прекращают синтез белка на UGA.Однако, когда присутствует селен, некоторые мРНК, которые содержат последовательность вставки селеноцистеина (SECIS), вставляют селеноцистеин при обнаружении UGA. Элемент SECIS имеет характерные нуклеотидные последовательности и паттерны спаривания оснований вторичной структуры. Двадцать пять белков человека содержат селеноцистеин.
- Пирролизин (Pyl / O) — двадцать вторая аминокислота, но редко встречается в белках. Как и селеноцистеин, он не закодирован в генетическом коде и должен быть включен необычными способами.Это происходит по стоп-кодонам UAG. Пирролизин содержится в метаногенных архейских организмах и, по крайней мере, в одной метан-продуцирующей бактерии. Пирролизин входит в состав ферментов, производящих метан.
Ионизирующие группы
ЗначенияpKa для боковых цепей аминокислот очень зависят от химической среды, в которой они присутствуют. Например, карбоксил R-группы, обнаруженный в аспарагиновой кислоте, имеет значение pKa 3,9 в свободном состоянии в растворе, но может достигать 14 в определенных средах внутри белков, хотя это необычно и экстремально.Каждая аминокислота имеет по крайней мере одну ионизируемую аминогруппу (α-амин) и одну ионизируемую карбоксильную группу (α-карбоксил). Когда они связаны пептидной связью, они больше не ионизируются. Некоторые, но не все аминокислоты имеют R-группы, которые могут ионизировать. Заряд белка тогда возникает из-за зарядов α-аминогруппы, α-карбоксильной группы. и сумма зарядов ионизированных R-групп. Титрование / ионизация аспарагиновой кислоты показано на рисунке 2.10. Ионизация (или деионизация) в структуре белка может иметь значительное влияние на общую конформацию белка и, поскольку структура связана с функцией, большое влияние на активность белка.
Рисунок 2.10 — Кривая титрования аспарагиновой кислоты Изображение Пенелопы ИрвингБольшинство белков имеют относительно узкие диапазоны оптимальной активности, которые обычно соответствуют окружающей среде, в которой они находятся (Рисунок 2.11). Стоит отметить, что образование пептидных связей между аминокислотами удаляет ионизируемые водороды как из α-аминных, так и из α-карбоксильных групп аминокислот. Таким образом, ионизация / деионизация в белке происходит только от 1) аминоконца; 2) карбоксильный конец; 3) R-группы; или 4) другие функциональные группы (такие как сульфаты или фосфаты), добавленные к аминокислотам посттрансляционно — см. ниже.
Карнитин
Не все аминокислоты в клетке находятся в белках. Наиболее распространенные примеры включают орнитин (метаболизм аргинина), цитруллин (цикл мочевины) и карнитин (рис. 2.12). Когда жирные кислоты, предназначенные для окисления, перемещаются в митохондрии с этой целью, они перемещаются через внутреннюю мембрану, прикрепленную к карнитину. Из двух стереоизомерных форм L-форма является активной. Молекула синтезируется в печени из лизина и метионина.
Фигура 2.12 — L-карнитинИз экзогенных источников жирные кислоты должны активироваться при входе в цитоплазму путем присоединения к коферменту A. Часть молекулы CoA заменяется карнитином в межмембранном пространстве митохондрии в реакции, катализируемой карнитином. ацилтрансфераза I. Полученная в результате молекула ацилкарнитина переносится через внутреннюю митохондриальную мембрану с помощью карнитинацилкарнитинтранслоказы, а затем в матриксе митохондрии карнитинацилтрансфераза II заменяет карнитин коферментом A (Рисунок 6.88).
Рисунок 2.11 — Активность фермента изменяется при изменении pH Изображение Aleia KimКатаболизм аминокислот
Мы классифицируем аминокислоты как незаменимые и несущественные в зависимости от того, может ли организм их синтезировать. Однако все аминокислоты могут расщепляться всеми организмами. Фактически, они являются источником энергии для клеток, особенно во время голодания или для людей, соблюдающих диету с очень низким содержанием углеводов. С точки зрения распада (катаболизма) аминокислоты классифицируются как глюкогенные, если они производят промежуточные соединения, которые могут быть превращены в глюкозу, или кетогенные, если их промежуточные соединения превращаются в ацетил-КоА.На рис. 2.13 показана метаболическая судьба катаболизма каждой из аминокислот. Обратите внимание, что некоторые аминокислоты являются как глюкогенными, так и кетогенными.
Рисунок 2.13 — Катаболизм аминокислот. У некоторых есть более одного пути. Изображение Пера ЯкобсонаПост-трансляционные модификации
После того, как белок синтезирован, боковые цепи аминокислот в нем могут быть химически модифицированы, что приведет к большему разнообразию структуры и функций (рис. 2.14). Общие изменения включают фосфорилирование гидроксильных групп серина, треонина или тирозина.Лизин, пролин и гистидин могут иметь гидроксильные группы, добавленные к аминам в их R-группах. Другие модификации аминокислот в белках включают добавление жирных кислот (миристиновой кислоты или пальмитиновой кислоты), изопреноидных групп, ацетильных групп, метильных групп, йода, карбоксильных групп или сульфатов. Они могут иметь эффекты ионизации (добавление фосфатов / сульфатов), деионизации (добавление ацетильной группы к амину R-группы лизина) или вообще не влиять на заряд. Кроме того, N-связанные и O-связанные гликопротеины содержат углеводы, ковалентно присоединенные к боковым цепям аспарагина и треонина или серина соответственно.
Некоторые аминокислоты являются предшественниками важных соединений в организме. Примеры включают адреналин, гормоны щитовидной железы, Ldopa и дофамин (все из тирозина), серотонин (из триптофана) и гистамин (из гистидина).
Рисунок 2.14 — Посттрансляционно модифицированные аминокислоты. Изменения показаны зеленым цветом. Изображение Пенелопы Ирвинг Рисунок 2.15 — Фосфорилированные аминокислотыСтроительные полипептиды
Хотя аминокислоты выполняют в клетках и другие функции, их наиболее важная роль заключается в том, что они являются составными частями белков.Белки, как мы уже отмечали ранее, представляют собой полимеры аминокислот.
Аминокислоты связаны друг с другом пептидными связями, в которых карбоксильная группа одной аминокислоты соединяется с аминогруппой следующей с потерей молекулы воды. Дополнительные аминокислоты добавляются таким же образом путем образования пептидных связей между свободным карбоксилом на конце растущей цепи и аминогруппой следующей аминокислоты в последовательности. Цепь, состоящая всего из нескольких связанных вместе аминокислот, называется олигопептидом (олиго = несколько), а типичный белок, состоящий из множества аминокислот, называется полипептидом (поли = много).Конец пептида, который имеет свободную аминогруппу, называется N-концом (для Nh3), а конец со свободным карбоксилом называется C-концом (для карбоксила).
Рис. 2.16. Формирование пептидной связиКак мы уже отмечали ранее, функция зависит от структуры, и цепочка аминокислот должна складываться в определенную трехмерную форму или конформацию, чтобы образовался функциональный белок. Сворачивание полипептидов в их функциональные формы — тема следующего раздела.
Высокое содержание белков, содержащих 21-ю и 22-ю аминокислоты, селеноцистеин и пирролизин, в симбиотической дельтапротеобактерии кишечного червя Olavius algarvensis
Nucleic Acids Res.2007 Aug; 35 (15): 4952–4963.
Департамент биохимии, Университет Небраски, Линкольн, NE 68588-0664, США
* Кому следует направлять корреспонденцию. + 1 402 472 4948, факс: +1 402 472 7842, ude.lnu@1vehsydalgvПолучено в мае 2007 г. 24; Пересмотрено 14 июня 2007 г .; Принято 14 июня 2007 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями некоммерческой лицензии Creative Commons Attribution (http://creativecommons.org/licenses/by-nc/2.0/uk/), которая разрешает неограниченное неограниченное использование коммерческое использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.Эта статья цитировалась в других статьях в PMC.Abstract
Селеноцистеин (Sec) и пирролизин (Pyl) — редкие аминокислоты, котрансляционно вставленные в белки и известные как 21-я и 22-я аминокислоты в генетическом коде. Sec и Pyl кодируются кодонами UGA и UAG соответственно, которые обычно служат стоп-сигналами. Здесь мы сообщаем о необычно больших селенопротеомах и пирропротеомах в наборе метагеномных данных симбионтов морского кишечного червя, Olavius algarvensis .Мы идентифицировали 99 генов селенопротеинов, которые объединились в 30 семейств, в том числе 17 новых генов селенопротеинов, принадлежащих шести семействам. Кроме того, в этом наборе данных было идентифицировано несколько Pyl-содержащих белков. Большинство селенопротеинов и Pyl-содержащих белков присутствовали в одной дельтапротеобактерии, δ1-симбионте, который содержал наибольшее количество как селенопротеинов, так и Pyl-содержащих белков среди всех организмов, о которых сообщалось на сегодняшний день. Наши данные контрастируют с предыдущими наблюдениями о том, что симбионты и ассоциированные с хозяином бактерии либо теряют утилизацию Sec, либо обладают ограниченным количеством селенопротеинов, и предполагают, что окружающая среда в кишечном черве способствует утилизации Sec и Pyl.Анаэробные условия и постоянное поступление селена могут быть факторами, поддерживающими использование аминокислот, расширяющих генетический код.
ВВЕДЕНИЕ
Селен (Se) является важным микронутриентом из-за его потребности в биосинтезе и функции 21-й аминокислоты, селеноцистеина (Sec). Эта аминокислота обычно находится в активных центрах небольшого числа селенопротеинов во всех трех сферах жизни: архей, бактерий и эукариот (1–4). Биосинтез Sec и его котрансляционная вставка в полипептиды требуют сложного молекулярного аппарата, который перекодирует внутрикадровые кодоны UGA, которые обычно функционируют как стоп-сигналы, чтобы они служили кодонами Sec (5–9).Хотя распространение селенопротеиновых генов ограничено, кодон Sec UGA стал первым дополнением к универсальному генетическому коду с момента его расшифровки 40 лет назад (10).
Механизм вставки Sec различается в трех сферах жизни. У бактерий этот процесс наиболее подробно изучен на примере Escherichia coli (1,2,6). Трансляция бактериальной мРНК селенопротеина требует как элемента последовательности вставки селеноцистеина (SECIS), который представляет собой структуру стержень-петля, непосредственно ниже кодирующего Sec кодона UGA (5,11,12), так и факторов, действующих на trans , предназначенных для включения Sec. (8).У архей и эукариот элементы SECIS расположены в 3′-UTRs, и некоторые факторы, участвующие в биосинтезе и встраивании Sec, различны. Недавняя идентификация Sec-синтазы, SecS, у эукариот, которая отличается от бактериальной Sec-синтазы, SelA, дала важную информацию о биосинтезе Sec в этих организмах (13).
Недавно была идентифицирована еще одна редкая аминокислота пирролизин (Pyl), которая расширила канонический генетический код до 22 аминокислот (14,15). Pyl вставляется в ответ на кодон UAG в несколько метаногенных архей (14).Хотя механизм биосинтеза Pyl и встраивания в белок до конца не изучен, присутствие гена тРНК pyl ( pylT ) с антикодоном CUA и гена аминоацил-тРНК синтетазы класса II ( pylS ) является аргументом в пользу котрансляционной трансляции. включение Pyl (15). В Desulfitobacterium hafniense , единственной бактерии, у которой был обнаружен Pyl-содержащий белок, PylS состоит из двух белков: PylSn и PylSc (15).
В последние годы крупномасштабные проекты по секвенированию генома, включая как специфические для организма, так и экологические метагеномные проекты, предоставили большой объем информации о последовательностях генов и белков.Однако гены селенопротеинов почти всегда неправильно аннотируются в этих наборах данных, потому что UGA выполняет двойную функцию кодирования Sec и завершения трансляции, и только последняя функция распознается текущими программами аннотации. Для решения этой проблемы было разработано несколько инструментов биоинформатики, которые могут использоваться для идентификации генов селенопротеинов (16–22). Эти программы успешно идентифицировали много новых селенопротеинов как в геномах прокариот, так и в геномах эукариот, а также в образцах окружающей среды Саргассова моря (23).
Сложные симбиотические отношения между бактериями и многоклеточными эукариотами развивались в нескольких средах, но наука традиционно фокусировалась на патогенных взаимодействиях (24). В последнее время возросло понимание симбиотических взаимодействий, которые приносят пользу как микроорганизму, так и хозяину (25). Недавний метагеномный анализ симбиотического микробного консорциума морских олигохет Olavius algarvensis , червя без рта, кишечника и нефридий, выявил четыре основных сосуществующих симбионта, которые принадлежат к Deltaproteobacteria (δ1 и δ4) и Gamrotemapobacteria. (γ1 и γ3), а также один второстепенный вид Spirochaete .Поскольку около Deltaproteobacteria являются организмами, богатыми селенопротеинами (27), мы проанализировали селенопротеомы этих симбионтов, чтобы изучить возможную связь между селеном и симбиозом.
Чтобы охарактеризовать селенопротеом у этих симбионтов, мы применили подход поиска на основе гомологии Sec / cysteine (Cys), который успешно использовался для характеристики селенопротеомов обоих прокариот (22) и в одном из крупнейших проектов секвенирования прокариот, Sargasso Проект по секвенированию морских микробов (23).Мы обнаружили известные селенопротеины, присутствующие в этом наборе метагеномных данных, и идентифицировали несколько новых селенопротеинов. Интересно, что одна дельтапротеобактерия, симбионт δ1, содержит по меньшей мере 57 селенопротеинов, что на сегодняшний день является наибольшим количеством селенопротеинов в любом организме. Кроме того, было идентифицировано несколько Pyl-содержащих белков, и большинство из них также были обнаружены в одном и том же симбионте δ1. Наши результаты позволяют по-новому взглянуть на эволюцию и функцию этих редких аминокислот.
МАТЕРИАЛЫ И МЕТОДЫ
Идентификация пар Cys / TGA в гомологичных последовательностях и минимальных ORF
Каждую последовательность Cys-содержащего белка в базе данных NR первоначально искали в метагеномной базе данных Olavius симбионтов на предмет возможных TGA / TAG / TAA -содержание гомологов с использованием TBLASTN с параметрами по умолчанию.Для дальнейшего анализа были отобраны только локальные сопоставления, в которых Cys в запрашиваемом белке был выровнен с кодоном TGA в нуклеотидной последовательности из метагеномной базы данных симбионтов Olavius . Для каждой TGA-содержащей нуклеотидной последовательности, идентифицированной в метагеномной базе данных, были проанализированы области выше и ниже предполагаемого кодона TGA в рамке считывания для определения минимальной ORF. Если стоп-кодон был обнаружен между кодоном TGA в рамке считывания и кодоном инициации (ATG или GTG), такая последовательность, содержащая TGA, отбрасывалась.
Анализ TGA-фланкирующих областей и кластеризацию последовательностей
Мы проанализировали консервативность TGA-фланкирующих областей во всех шести рамках считывания с помощью BLASTX. Если лучший результат, который покрывает кодон TGA с перекрытием по крайней мере 10 нуклеотидов, находился в другой рамке считывания, чем кодон TGA, соответствующая последовательность отфильтровывалась. Затем RPS-BLAST был использован для поиска в базе данных консервативных доменов (CDD). Если лучший результат, который перекрывал кодон TGA с перекрытием по меньшей мере из пяти остатков, был в другой рамке считывания или в консервативном домене в той же рамке появлялись дополнительные стоп-кодоны, последовательность удалялась.
Мы использовали BL2SEQ для кластеризации оставшихся белковых последовательностей в разные группы. Если локальное выравнивание двух белков имело значение E ниже 10 -4 и было длиной не менее 20 аминокислот, а также предсказанные остатки Sec были расположены в одном положении или очень близко (не более трех остатков друг от друга ) в выравнивании два белка были отнесены к одному кластеру.
Консервация цистеина и классификация селенопротеинов
Поиск всех кластеров проводился автоматически по NCBI NR и микробным базам данных с использованием BLASTX и TBLASTX.Каждую предсказанную ORF, содержащую TGA в рамке считывания, дополнительно рассматривали только в том случае, если были обнаружены по меньшей мере два соответствующих Cys-содержащих гомолога и доля пар TGA / Cys в наборе гомологов была> 50%.
Остальные кластеры анализировали на наличие бактериальных элементов SECIS, расположенных непосредственно ниже кодонов TGA в рамке считывания, с помощью программы bSECISearch (19). Окончательные кластеры были проанализированы вручную и разделены на три группы: известные селенопротеины, новые селенопротеины (кластеры, содержащие по крайней мере две разные последовательности с консервативными кодонами TGA в рамке считывания) и селенопротеины-кандидаты (кластеры, содержащие только одну последовательность).Следует отметить, что ошибки секвенирования, которые генерируют кодоны UGA в кадре, не могут быть исключены для кандидатов в селенопротеины.
Идентификация белков оперона Pyl и известных Pyl-содержащих белков
Последовательности PylT и PylS из Methanosarcina barkeri (номер доступа {«type»: «entrez-нуклеотид», «attrs»: {«text»: «AY064401» , «term_id»: «21322022», «term_text»: «AY064401»}} AY064401) использовались для поиска возможных гомологов в наборе метагеномных данных. Кандидатная тРНК Pyl была дополнительно проанализирована для выявления структурных особенностей, связанных с известной тРНК Pyl , включая акцепторный стержень из шести пар оснований и основание между D и акцепторным стержнем (15).Другие гены в опероне Pyl ( pylB , pylC , pylD ) также анализировали сравнительным анализом последовательностей.
Для поиска известных Pyl-содержащих метиламинметилтрансфераз использовалась программа TBLASTN с параметрами по умолчанию. Открытые рамки считывания (ORF) и консервацию областей, фланкирующих UAG, исследовали вручную. Множественные выравнивания были произведены с помощью ClustalW (29).
РЕЗУЛЬТАТЫ
Чтобы идентифицировать селенопротеиновые гены в наборе метагеномных данных симбионтов Olavius , мы использовали алгоритм, который мы ранее использовали для идентификации селенопротеинов в наборе микробных данных Саргассова моря (23).Этот метод использует тот факт, что почти все селенопротеины имеют Cys-содержащие гомологи в разных организмах. Промежуточные результаты для каждого шага в процессе поиска показаны в. Кроме того, был проведен независимый поиск гомологии BLAST для Sec-содержащих гомологов всех известных семейств селенопротеинов.
Принципиальная схема алгоритма поиска. Подробная информация о процессе поиска представлена в разделе «Материалы и методы».
Идентификация известных селенопротеинов в метагеноме
Olavius симбионтовВсего было идентифицировано 82 гена селенопротеинов, которые принадлежат 24 ранее описанным семействам селенопротеинов ().Учитывая, что только четыре основных симбионта были идентифицированы в наборе метагеномных данных симбионтов Olavius , каждый селенопротеин можно было сопоставить с конкретным организмом, из которого была получена последовательность. Было обнаружено, что практически все селенопротеины картируются с симбионтами δ1 и δ4. Первый организм содержал 44 гомолога известных селенопротеинов, что уже является наибольшим числом селенопротеинов, о которых сообщалось на сегодняшний день в любом организме [предыдущим рекордсменом также является дельтапротеобактерия, Syntrophobacter fumaroxidans , которая имеет 31 ген селенопротеинов, см. (27)].Кроме того, несколько селенопротеинов были обнаружены в последовательностях, не сопоставленных ни с одним из четырех симбионтов (обозначенных как неназначенные последовательности). Напротив, селенопротеиновые гены не могут быть идентифицированы у симбионтов γ1 и γ3. Все идентифицированные гены селенопротеинов были неправильно аннотированы в исходном наборе данных. Несколько семейств селенопротеинов, обнаруженных в наборе данных, были представлены 2–12 генами селенопротеинов, тогда как шесть семейств: DsbG-подобные, пероксиредоксин (Prx), тиоредоксин (Trx), глутаредоксин (Grx), NADH-оксидаза и UGSC-содержащий белок [неопубликованные данные; это селенопротеин неизвестной функции, который также встречается в Hyphomonas neptunium (30) и обнаружен в проекте экологического секвенирования микробных сообществ в субтропическом круговороте северной части Тихого океана (31)], были представлены отдельными последовательностями.Ошибки секвенирования, которые генерируют внутрикадровые кодоны TGA в этих последовательностях, не могут быть исключены; однако тот факт, что они соответствуют известным селенопротеинам и обладают сильными предсказанными элементами SECIS, доказывает, что они являются истинными селенопротеинами. Многие из обнаруженных семейств селенопротеинов также имели Cys-содержащие гомологи в метагеномной базе данных ().
Таблица 1.
Известные семейства селенопротеинов, идентифицированные в симбионтах Olavius algarvensis
| Семейство белков | Всего селенопротеинов | Olavius 9045 9044 9044 9044 гомологов | Cys 9044||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| δ1 | δ4 | γ1 | γ3 | Неназначенный | ||||||||||
| 86 9048 9048 9048 9048 9048 9048 | ||||||||||||||
| F420-восстанавливающая гидрогеназа, дельта-субъединица (FrhD) | 12 | 5 | 2 | 0 | 0 | 5 | 6 | -редукт. | 10 | 4 | 4 9 0489 | 0 | 0 | 2 | 3 |
| Роданезийская серотрансфераза | 8 | 4 | 2 | 0 | 0 | 2 | 7 | 5 | 1 | 0 | 0 | 1 | 4 | |
| Prx-подобный тиол: дисульфид оксидоредуктаза * | 9048 0 | 1 | 4 | |||||||||||
| Пролинредуктаза (PR) * | 5 | 5 | 0 | 0 | 0 | 0 | 04 | 2 | 1 | 0 | 0 | 1 | > 10 | |
| Сульфуртрансфераза COG2897 | 3 | 1 | 2 | 0 | 0 | 0 | 4 | |||||||
| DSRE-подобный * | 3 | 2 | 1 | 0 | 0489 | 0 DsbA-подобный * | 2 | 2 | 0 | 0 | 0 | 0 | 0 | |
| F420-восстановительная гидрогеназа, альфа-субъединица (FrhA6 1 | 0 | 0 | 0 | 3 | ||||||||||
| Селенофосфатсинтетаза (SelD) | 2 | 1 | 1 | 0 | 0 | 0489 9048 1 | 2 | 1 | 0 | 0 | 0 | 1 | 0 | |
| Fe-S оксидоредуктаза (GlpC) | 2 | 1 | 1 | 0486 00 | 10 | |||||||||
| Отдаленный гомолог AhpD * | 2 | 2 | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 1 | > 10 | ||
| Метионсульфоксидредуктаза A (MsrA) * | 2 | 1 | 0 | 6 | ||||||||||
| Метилированная ДНК-протеин-цистеинметилтрансфераза | 2 | 0 | 0 | 0 | 0 | 2 | 8 | |||||||
| -как 0 | 0 | 0 | 0 | 1 | 0 | |||||||||
| Пероксиредоксин (Prx) * | 1 | 1 | 0 904 89 | 0 | 0 | 0 | 4 | |||||||
| Тиоредоксин (Trx) * | 1 | 1 | 0 | 0 | 0 | 0 оксидаза | 1 | 1 | 0 | 0 | 0 | 0 | 1 | |
| Глутаредоксин * | 1 | 0 | 9048 9048 9048 1 2 | |||||||||||
| UGSC-содержащий белок * | 1 | 1 | 0 | 0 | 0 | 0 | 0 | |||||||
| семейств 9048 Селенопротеинов не обнаружено 48 | ||||||||||||||
| SelW-like * | 0 | 0 | 0 | 9 0486 00 | 0 | 0 | ||||||||
| Глутатионпероксидаза (GPx) * | 0 | 0 | 0 | 0 | 0 | 9048 из 9048 N-концевой домен AhpF * | 0 | 0 | 0 | 0 | 0 | 0 | 3 | |
| Тиол: дисульфидный обменный белок * | 0 | 0 | 0 | 8 | ||||||||||
| Глицинредуктаза селенопротеин А (GrdA) | 0 | 0 | 0 | 0 | 0 | селенопротеин B (GrdB)0 | 0 | 0 | 0 | 0 | 0 | 0 | ||
| Арсенат редуктаза * 9 0489 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | |||||||
| Биосинтез молибдоптерина MoeB белок | 0 | 0 | 0 | 0 | ||||||||||
| Глутатион-S-трансфераза (GST) * | 0 | 0 | 0 | 0 | 0 | 0 | 1 | |||||||
| как 9048-9048-деиодиназа 0 | 0 | 0 | 0 | 0 | 0 | |||||||||
| Тиолдисульфид-изомеразоподобный белок * | 0 | 0 | 0 | 9048 5 | ||||||||||
| Гипотетический белок 1 * | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |||||||
| OsmC-подобный протеин * | 0 | 0 | 0 | 0 | 0 | 0 | 3 | |||||||
| NADH: убихинон оксидоредуктаза | 0486 0489 | 0489 | 048 0 | 0 | 9 | |||||||||
| Радикальный белок домена SAM | 0 | 0 | 0 | 0 | 0 | 0 | 1 | |||||||
| 0 | 0 | 0 | 0 | 0 | ||||||||||
| Катион-транспортная ATPase, семейство E1-E2 | 0 | 0 | 0 | 0 | ||||||||||
| Всего | 82 | 44 | 20 | 0 | 0 904 89 | 18 | ||||||||
Несколько семейств селенопротеинов имели особенно высокое представительство в наборе данных симбионтов Olavius .Наиболее многочисленным семейством была дельта-субъединица F420-восстанавливающей гидрогеназы (FrhD), которая включала 12 генов селенопротеинов. показывает множественное мировоззрение этого семейства. Это семейство селенопротеинов ранее было обнаружено как у метаногенных архей, так и у бактерий. У архей его Sec-содержащие формы содержат два остатка Sec. Напротив, только один из двух остатков Sec был обнаружен в различных гомологах, содержащих Sec, у бактерий, включая все метагеномные последовательности в текущем исследовании. Такая гибкость при замене функционально важного Cys на Sec ранее не описывалась.
Множественное выравнивание последовательностей семейства FrhD. Консервированные остатки выделены. Sec (U) и соответствующие остатки Cys (C) показаны красным и синим цветом соответственно.
Субъединица А гетеродисульфидредуктазы (HdrA) была вторым по численности семейством селенопротеинов, которое было представлено 10 генами селенопротеинов. Интересно, что было обнаружено, что большинство последовательностей HdrA кластеризуется с последовательностями FrhD. Это открытие согласуется с нашей предыдущей гипотезой о том, что кластер hdrA-frhD-frhG-frhA может латерально передаваться между Sec-декодирующими археями и Deltaproteobacteria (27).Роданезная серотрансфераза [8 генов, (19)], AhpD-подобная (7 генов), Prx-подобная тиол: дисульфид оксидоредуктаза (6 генов) и пролинредуктаза (PR, 5 генов) были следующими наиболее распространенными семействами селенопротеинов. На эти шесть семейств приходится 58,5% известных последовательностей селенопротеинов, что свидетельствует о важности их функций в симбиозе с участием Deltaproteobacteria и червя-хозяина. Другие обнаруженные семейства селенопротеинов включали альфа-субъединицу формиатдегидрогеназы (FdhA), альфа-субъединицу F420-восстанавливающей гидрогеназы (FrhA), селенфосфатсинтетазу (SelD), HesB-подобную, Fe-S-оксидоредуктазу (GlpC), метионинсульфоксидредуктазу A (MsrA). другие семейства селенопротеинов.
Большинство этих селенопротеинов были окислительно-восстановительными белками, которые использовали Sec либо для координации окислительно-восстановительных металлов, либо для окислительно-восстановительного катализа на основе тиолов / дисульфидов. Более того, среди 24 семейств селенопротеинов, обнаруженных в наборе метагеномных данных симбионтов, по крайней мере 17 (67 последовательностей, 81,7%) были гомологами известных тиолоксидоредуктаз или обладали Trx-подобной складкой (). Многие из этих селенопротеинов содержат консервативный редокс-мотив UxxC / UxxS / CxxU / TxxU.
В двух известных генах селенопротеинов были идентифицированы новые позиции Sec.Интересно, что в семействе роданезных серотрансфераз была обнаружена новая форма белка, в которой вторая Sec эволюционировала в белке, что привело к мотиву UxU (A). Кроме того, новый Sec был обнаружен в FrhA, что привело к мотиву CxxU по сравнению с ранее известным мотивом UxxC (B).
Множественное выравнивание последовательностей нескольких известных семейств селенопротеинов, содержащих новые особенности. Новые позиции Sec показаны розовым цветом. Контиги, содержащие эти новые функции, также выделены зеленым фоном.( A ) Роданская серотрансфераза; ( B ) F420-восстанавливающая гидрогеназа, альфа-субъединица.
Новые селенопротеины, идентифицированные в метагеноме
Olavius симбионтовВ дополнение к гомологам ранее описанных селенопротеинов мы идентифицировали шесть новых семейств селенопротеинов, которые были представлены по крайней мере двумя отдельными открытыми рамками считывания, содержащих TGA (всего 17 генов,) . Большинство этих новых семейств не соответствовали доменам с известной функцией и не были гомологичны семействам белков с известными функциями.Множественные выравнивания этих новых селенопротеинов и их Cys-содержащих гомологов () подчеркивают консервативность последовательностей пар Sec / Cys и их фланкирующих областей. Все новые селенопротеины содержали стабильные структуры «стебель-петля» ниже кодирующих Sec кодонов TGA, которые напоминали бактериальные элементы SECIS. Предсказанные репрезентативные элементы SECIS, обнаруженные в этих новых семействах селенопротеинов, показаны в.
Множественное выравнивание последовательностей новых селенопротеинов и их гомологов Cys. Выравнивания показывают Sec-фланкирующие области в обнаруженных белках.Показаны как последовательности селенопротеинов, обнаруженные в наборе данных метагенома Olavius симбионтов, так и их Sec / Cys-содержащие гомологи, присутствующие в указанных организмах. Консервированные остатки выделены. Предсказанные остатки Sec (U) и соответствующие остатки Cys (C) в других гомологах показаны красным и синим цветом соответственно.
Предсказанные бактериальные элементы SECIS в репрезентативных последовательностях новых семейств селенопротеинов. Показаны только последовательности, расположенные ниже кодонов UGA в кадре. Кодоны UGA в рамке считывания и консервативные гуанозины в апикальной петле показаны красным.( A ) Белок домена YHS, {«type»: «entrez-нуклеотид», «attrs»: {«text»: «AASZ01000529», «term_id»: «115510438», «term_text»: «AASZ01000529»}} AASZ01000529; ( B ) Предполагаемый окислительно-восстановительный белок, {«type»: «entrez-нуклеотид», «attrs»: {«text»: «AASZ01002486», «term_id»: «115508481», «term_text»: «AASZ01002486»}} AASZ01002486; ( C ) OS_HP1, {«type»: «entrez-нуклеотид», «attrs»: {«text»: «AASZ01000351», «term_id»: «115510616», «term_text»: «AASZ01000351»}} AASZ01000351; ( D ) Консервативный белок (COG1810), {«type»: «entrez-нуклеотид», «attrs»: {«text»: «AASZ01000538», «term_id»: «115510429», «term_text»: «AASZ01000538» }} AASZ01000538; ( E ) OS_HP3, {«type»: «entrez-нуклеотид», «attrs»: {«text»: «AASZ01001720», «term_id»: «115509247», «term_text»: «AASZ01001720»}} AASZ01001720.
Таблица 2.
Новые селенопротеины, идентифицированные у симбионтов Olavius algarvensis
| Семейство белков | Всего селенопротеинов | Olavius симбионтов | 9044 9044 9044 9044 гомологов 9044 9044 9044|||||
|---|---|---|---|---|---|---|---|
| δ1 | δ4 | γ1 | γ3 | Неназначенный | |||
| YHS домен | 9048 | 9048 1 | 2 | ||||
| Предполагаемый окислительно-восстановительный белок | 3 | 3 | 0 | 0 | 0 | 0 | 2 |
| OS_HP1 9048 3 9048 9048 3 9048 9048 9048 | 0 | 0 | 0 | 2 | |||
| 2 | 1 | 1 | 0 | 0 | 0 | 0 | |
| OS_HP2 | 2 | 1 | 0486 0489 | 0486 0489 | 0489 | 0489 0 | |
| OS_HP3 | 2 | 1 | 1 | 0 | 0 | 0 | 0 |
| Всего | 9048 | 0 | 0 | 1 | 6 | ||
Мы также обнаружили по крайней мере 15 дополнительных TGA-содержащих последовательностей, которые не показали сходства ни с известными и новыми селенопротеинами, ни друг с другом.В отношении этих последовательностей нельзя сделать окончательный вывод из-за возможности ошибок секвенирования. Однако некоторые из них содержали кандидаты в элементы SECIS. Более того, было идентифицировано небольшое количество TGA-содержащих гомологов селенопротеинов-кандидатов, которые не имеют консервативных гомологов Cys, но были ранее предсказаны в секвенированных бактериальных геномах с помощью bSECISearch (19). Для этих кандидатов в селенопротеины необходима будущая экспериментальная проверка.
Pyl-содержащие белки, обнаруженные в наборе данных
Olavius симбионтовPyl был идентифицирован в активных центрах нескольких семейств метиламинметилтрансфераз, включая монометиламинметилтрансферазу (MtmB), диметиламинметилтрансферазу (MtbB) и триметиламинметилтрансферазу (MttB). у нескольких метаногенных архей (14,15).Однако была обнаружена только одна грамположительная бактерия, D. hafniense , которая обладает единственным Pyl-содержащим гомологом MttB. Недавно семейство транспозаз было идентифицировано как новое семейство Pyl-содержащих белков (32). Помимо pylT и pylS , для использования Pyl был предложен оперон гена pylB-pylC-pylD (особенно pylD ) (32). Мы исследовали наличие как Pyl-содержащих белков, так и генов оперона Pyl. К нашему удивлению, в общей сложности было идентифицировано 10 Pyl-содержащих последовательностей метиламинметилтрансферазы (принадлежащих семействам MtbB и MttB), и восемь были обнаружены в эндосимбионте δ1, который также имел pylT , pylSn , pylSc и pylB- гены pylC-pylD ().Несколько генов были сгруппированы или присутствовали в одном опероне (). Выравнивание этих последовательностей и их гомологов показано на.
Встречаемость генов Pyl-содержащих белков и белков оперона Pyl в метагеномных последовательностях симбионтов Olavius . Гены mtbB и mttB и другие гены оперона Pyl показаны указанной цветовой схемой в контигах, содержащих эти гены.
Множественные выравнивания фланкирующих Pyl областей в семействах метиламинметилтрансфераз (MtbB и MttB).Pyl обозначен X, а его расположение в выравнивании выделено красным.
Таблица 3.
Известные Pyl-содержащие белки и белки Pyl-оперона, идентифицированные у симбионтов Olavius algarvensis
| Семейство белков | Всего последовательностей | Симбионты | Другие гомологи Olavius | | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| δ1 | δ4 | γ1 | γ3 | Не назначенный | 0 | 0 | 0 | 0 | 0 | 2 | ||||||||
| MtbB | 7 | 6 | 0 | 0 | 3 | 2 | 0 | 0 | 0 | 1 | > 10 | |||||||
| Компоненты биосинтеза и вставки Pyl | ||||||||||||||||||
| PylSn | 1 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | ||||||||
| PylB | 1 | 1 | 0 | 0 | 0 | 90481 | 0 | 0 | 0 | 0 | ||||||||
| PylD | 1 | 1 | 0 | 0 | 0 | 90481 | 0 | 0 | 0 | 0 | ||||||||
Было предложено, чтобы Pyl вставлялся Кодоны UAG с помощью предполагаемого элемента последовательности вставки пирролизина (PYLIS), который, как было предсказано, расположен ниже Pyl-кодирующего кодона UAG в мРНК Pyl-содержащего белка (33).Хотя наличие такого элемента у архей сомнительно, разумно, что должен существовать определенный цис -элемент, чтобы отличить Pyl-кодирующий кодон UAG от стоп-кодона у бактерий (32). Для поиска кандидатов в элементы PYLIS в бактериях, последовательности ниже кодонов UAG в рамке считывания и в предполагаемых 5′- и 3′-UTR мРНК метиламинметилтрансферазы как в D. hafniense , так и в симбионте δ1 были проанализированы вручную на предмет возможных консервативных структур. и особенности последовательности в этих структурах.Наш анализ не выявил очевидной общей структуры, разделяемой всеми членами этих семейств метиламинметилтрансфераз.
Взаимосвязь между различными симбиотическими условиями и использованием Sec
Хотя эндосимбионты δ1 и δ4 принадлежат к богатой селенопротеинами филуму Deltaproteobacteria , они являются организмами, ассоциированными с хозяином. Напротив, большинство идентифицированных ранее богатых селенопротеинами организмов являются свободноживущими организмами (27). Чтобы исследовать взаимосвязь между средами обитания, размером генома / протеома и использованием Sec у бактерий, мы провели исчерпывающий поиск гомологии всех известных семейств селенопротеинов против 450 секвенированных бактериальных геномов.Всего было обнаружено 116 организмов-утилизаторов сек. Характеристики селенопротеомов, размер генома, размер протеома и среды обитания для этих организмов показаны в таблице S1 и иллюстрируют корреляции между этими свойствами. Для организмов, содержащих Sec, независимо от среды обитания, размер протеома был пропорционален размеру генома (A). Очевидной корреляции между размером селенопротеома и размером протеома не наблюдалось. Однако можно увидеть тенденцию, при которой организмы, ассоциированные с хозяином, обладают наименьшими селенопротеомами по сравнению со свободноживущими организмами (B).
Взаимосвязь между средами обитания, размером генома, размером протеома и селенопротеомами. Организмы, содержащие сек, были разделены на четыре группы в зависимости от среды обитания: водные, связанные с хозяином, множественные и наземные. ( A ) Корреляция между размером генома и размером протеома. ( B ) Корреляция между размером протеома и селенопротеомами. Симбионты δ1 и δ4 указаны на рисунке.
Мы обнаружили, что симбионты δ1 и δ4 сильно отличаются по размеру селенопротеома, особенно по сравнению с другими бактериями, ассоциированными с хозяином (B).показывает полный список секвенированных селенопротеин-содержащих бактерий, связанных с хозяином, и условий их жизни. В отличие от богатых селенопротеинами симбионтов δ1 и δ4, у большинства этих организмов единственными селенопротеинами были FdhA и / или SelD. Одна из возможностей состоит в том, что симбионты δ1 и δ4 расположены ниже кутикулы червя, где практически отсутствует кислород, тогда как другие паразиты, большинство из которых являются факультативными анаэробными, микроаэробными и аэробными, расположены во рту, дыхательных путях или желудочно-кишечном тракте, которые являются подвергается хотя бы небольшому воздействию кислорода (34).Ранее мы обнаружили, что уменьшение концентрации кислорода коррелирует с увеличением использования сек (27). Olavius algarvensis — первый идентифицированный на сегодняшний день морской хозяин, который живет в облигатных и видоспецифичных ассоциациях с Sec-содержащими бактериальными симбионтами. Предположительно, эти дельтапротеобактериальные симбионты пользуются относительно постоянным запасом селена в морской воде и увеличивают свою потребность в этом микроэлементе.
Таблица 4.
Селенопротеины в секвенированных симбиотических / ассоциированных с хозяином бактериях
| Тип | Организм | Общее количество белков | Количество селенопротеинов | Среда обитания | 9048 Кислород | Collinsella aerofaciens | 2367 | 2 | Кишечник человека | Анаэробный | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Mycobacterium smegmatis | Amegmatis человека avium5120 | 1 | Легкое | Аэробные | |||||||
| Бетапротеобактерии / Burkholderiaceae | Burkholderia mallei | 5025 | Mambero 489 9 | Burkholderia multivorans | 6604 | 1 | Человеческое легкое | Аэробное | |||
| Burkholderia phymatum | 7845 | 7845 | бобовое | Lawsonia intracellularis | 1185 | 1 | Слизистая оболочка нижних отделов кишечного тракта у животных | Факультативно | |||
| ? Под кутикулой червя Olavius algarvensis | Анаэробный | ||||||||||
| δ4 симбионт | 3012 | 23 | кутикула garvensis | Анаэробный | |||||||
| Epsilonproteobacteria | Campylobacter concisus | 2039 | 6 | Человеческая полость рта и желудочно-кишечный тракт | 4 | Человеческая ротовая полость и желудочно-кишечный тракт | Микроаэрофильный | ||||
| Campylobacter fetus | 1719 | 4 | Человеческая кровь | Helobacter 9048 | Helobacter 9048 | Microaero6 9048 | 1 | Слизистая оболочка желудочно-кишечного тракта | Микроаэрофильный | ||
| Wolinella succinogenes | 2043 | 1 | Желудочно-кишечный тракт | аэрофильный||||||||
| Gammaproteobacteria / Enterobacteriales | Escherichia coli | 4243 | 3 | Нижний отдел кишечника | Факультативный | ||||||
| нематода | Факультативный | ||||||||||
| Salmonella enterica | 4427 | 3 | Желудочно-кишечный тракт у животных | Факультативный | |||||||
| животные | Факультативно | ||||||||||
| Shigella boydii | 4136 | 3 | Желудочно-кишечный тракт у животных | Факультативно | |||||||
| Shigella 9048 d. teriae | 4274 | 2 | Желудочно-кишечный тракт у животных | Факультативно | |||||||
| Shigella flexneri 2a | 4182 | 3 | Shigella sonnei | 4223 | 3 | Желудочно-кишечный тракт у животных | Факультативный | ||||
| Gammaproteobacteria / Pasteurellaceae | Actinobacillus pleuropneumoniae 9048 2+ 9048 9482| Actinobacillus succinogenes | 1883 | 2 | Рубец крупного рогатого скота | Анаэробный | | |||||
| Haemophilus ducreyi 6 | Животное s мембраныАнаэробные | ||||||||||
| Haemophilus influenzae | 1791 | 2 | Слизистые оболочки животных | Факультативные | |||||||
| 2 Факультативные | Анаэробный | ||||||||||
| Pasteurella multocida | 2015 | 1 | Слизистые оболочки кишечной, генитальной и респираторной тканей | Факультативно | |||||||
| Полость рта | Анаэробный |
ОБСУЖДЕНИЕ
Проекты по полному геному и метагеномному секвенированию предоставили новый мощный инструмент в изучении организации сообщества и метаболизма в естественных микробных сообществах (35–37).В последнее время такие методы были расширены для анализа симбиотических отношений. Один проект включал анализ микробов из морских олигохет O. algarvensis , у которых отсутствует ротовая полость, кишечник, анус или нефридиальная выделительная система, а также содержится несколько бактериальных эндосимбионтов, расположенных непосредственно под кутикулой червя (26). Эти эндосимбионты включают две окисляющие серу гаммапротеобактерии (γ1 и γ3) и две сульфатредуцирующие дельтапротеобактерии (δ1 и δ4). Идентификация генов селенопротеинов в такой необычной симбиотической системе может помочь понять роль селена и других питательных микроэлементов в сложных взаимодействиях, которые образуют такой сложный адаптивный консорциум.
В настоящем исследовании мы использовали процедуру, которая анализирует пары Sec / Cys в гомологичных последовательностях, чтобы охарактеризовать селенопротеомы симбиотических микроорганизмов в кишечном черве. Было идентифицировано 82 гена, принадлежащих к 24 ранее описанным семействам прокариотических селенопротеинов, и 17 последовательностей, принадлежащих к шести новым семействам селенопротеинов. Было обнаружено, что большинство селенопротеинов встречается в симбионте δ1, который содержит 44 известных селенопротеина (21 семейство) и 13 новых селенопротеинов (6 семей).Хотя размер генома δ1-симбионта составляет ~ 13,5 Мб, что больше, чем у большинства других дельтапротеобактерий, его реконструкция выявила один вид (26). Если это так, то наше исследование идентифицировало организм, который имеет самый большой селенопротеом, зарегистрированный на сегодняшний день (57 селенопротеидов), среди всех организмов, включая эукариот и архей.
Большинство обнаруженных селенопротеинов были гомологами окислительно-восстановительных ферментов на основе тиолов и содержали консервативные окислительно-восстановительные мотивы. Напротив, такие известные окислительно-восстановительные мотивы в значительной степени отсутствовали в новых селенопротеинах, идентифицированных в наборе метагеномных данных.Кроме того, анализ вторичных структур показал, что эти новые селенопротеины не содержат тиоредоксин-подобную складку, которая является доминирующей складкой селенопротеинов, идентифицированных в нескольких проектах по секвенированию морской среды (23,38). Возможно, у этих симбионтов протекают дополнительные окислительно-восстановительные реакции, которые осуществляются новыми селенопротеинами.
Помимо необычно большого количества селенопротеинов, в наборе метагеномных данных было идентифицировано 10 Pyl-содержащих белков. δ1 содержал восемь из этих последовательностей, принадлежащих семействам MtbB и MttB.Таким образом, δ1-симбионт также является организмом, который имеет наибольшее количество Pyl-содержащих белков в бактериях. Ранее было известно, что только один бактериальный белок из D. hafniense обладает Pyl. Таким образом, идентификация такого количества пирропротеинов в одной и той же бактерии действительно примечательна.
Мы ранее предположили, что UAG может быть неоднозначным кодоном у некоторых архей, где он может служить либо Pyl-кодоном, либо стоп-сигналом. Однако в D. hafniense UAG часто используется в качестве стоп-сигнала, что указывает на неизвестный механизм, который позволяет рибосомам распознавать функцию определенных кодонов UAG.По аналогии с Sec, который вставляется с помощью элементов SECIS, элементы PYLIS могут присутствовать в генах бактериальных пирропротеинов. Однако наш анализ генов, кодирующих Pyl-содержащие белки, не выявил общих структур РНК. В будущем необходимо провести дополнительные поиски структуры РНК. Текущий набор Pyl-содержащих белков представляет собой отличный набор данных для дальнейшего исследования.
Учитывая, что большинство симбиотических и связанных с хозяином бактерий утратили способность использовать Sec или обладают только ограниченным количеством селенопротеинов, резкое изобилие селенопротеинов в двух эндосимбиотических дельтапротеобактериях, особенно δ1, которое также содержит много Pyl-содержащих белков, составляет замечательно, что поднимает ряд вопросов относительно эволюции и функции этих белков, а также их роли в симбиозе.Было высказано предположение, что большинство селенопротеинов, произошедших от их Cys-содержащих гомологов, и анаэробная среда могут поддерживать использование Sec (27). По сравнению с большинством других симбионтов и организмов, связанных с хозяином, которые, кажется, живут в аэробных или микроаэробных условиях, облигатная анаэробная среда двух симбионтов может быть одной из причин эволюции новых селенопротеинов. Кроме того, по сравнению со средой, в которой живут другие хозяева, морская вода может обеспечивать постоянный запас селена для биосинтеза Sec у этих симбионтов.Альтернативная гипотеза состоит в том, что червь-хозяин нуждается в более эффективном метаболизме и утилизации отходов, которые обеспечивают его симбионты из-за отсутствия пищеварительной и выделительной систем. Эти особые потребности могли привести к селективному преимуществу укрытия нескольких симбионтов, которые используют аминокислоты, которые обеспечивают каталитические преимущества для различных метаболических систем, таких как Sec во многих окислительно-восстановительных белках и Pyl в метилтрансферазах метиламина.
Симбиотические дельтапротеобактерии у кишечного червя эволюционировали как организмы, которые поддерживают самое широкое использование генетического кода, используя 63 из 64 кодонов для кодирования 22 аминокислот.Было бы интересно изучить, обеспечивают ли эта и другие симбиотические системы селективное преимущество для дальнейшего расширения генетического кода, используя либо третий стоп-сигнал, UAA, либо некоторые кодоны для вставки нескольких неканонических или общих аминокислот.
ВЫВОДЫ
В этом исследовании мы сообщаем о всестороннем анализе использования Sec и Pyl в метагеномной базе данных симбионтов Olavius путем идентификации селенопротеинов и Pyl-содержащих белков. Был идентифицирован организм, симбионт δ1, который содержит наибольшее количество как селенопротеинов, так и пирропротеидов в любом организме.Этот набор данных предоставляет возможности для решения критических вопросов, касающихся эволюционных факторов, влияющих на использование Sec и Pyl, дальнейшего расширения генетического кода и понимания молекулярных механизмов перекодирования.
ДОПОЛНИТЕЛЬНЫЕ ДАННЫЕ
Дополнительные данные доступны в NAR онлайн.
ССЫЛКИ
1. Бёк А., Форчхаммер К., Хайдер Дж., Лейнфельдер В., Саверс Г., Вепрек Б., Зинони Ф. Селеноцистеин: 21-я аминокислота. Мол. Microbiol. 1991; 5: 515–520.[PubMed] [Google Scholar] 3. Гладышев В.Н., Хэтфилд ДЛ. Селеноцистеин-содержащие белки у млекопитающих. J. Biomed. Sci. 1999; 6: 151–160. [PubMed] [Google Scholar] 5. Низкий S, Берри MJ. Когда не стоит останавливаться: включение селеноцистеина в эукариотах. Trends Biochem. Sci. 1996; 21: 203–208. [PubMed] [Google Scholar] 6. Бёк А. Биосинтез селенопротеинов — обзор. Биофакторы. 2000; 11: 77–78. [PubMed] [Google Scholar] 7. Ротер М., Реш А., Уилтинг Р., Бёк А. Синтез селенопротеинов в архее. Биофакторы.2001. 14: 75–83. [PubMed] [Google Scholar] 8. Дрисколл DM, Copeland PR. Механизм и регуляция синтеза селенопротеидов. Анну. Rev. Nutr. 2003; 23: 17–40. [PubMed] [Google Scholar] 9. Коупленд ПР, Степаник В.А., Дрисколл Д.М. Понимание вставки селеноцистеина млекопитающих: структура домена и свойства связывания с рибосомами белка, связывающего последовательность вставки Sec 2. Mol. Клетка. Биол. 2001; 21: 1491–1498. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Ниренберг М., Каски Т., Маршалл Р., Бримакомб Р., Келлог Д., доктор Б. П., Хэтфилд Д., Левин Дж., Ротман Ф. и др.Код РНК в синтезе белка. Харб Холодного источника. Symp. Quant. Биол. 1966; 31: 11–24. [PubMed] [Google Scholar] 11. Танбихлер М., Бёк А. Функция SECIS РНК в трансляционном контроле экспрессии генов в Escherichia coli . EMBO J. 2002; 21: 6925–6934. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Лю З., Речес М., Гройсман И., Энгельберг-Кулька Х. Природа минимальной «последовательности вставки селеноцистеина» (SECIS) в Escherichia coli . Nucleic Acids Res. 1998; 26: 896–902.[Бесплатная статья PMC] [PubMed] [Google Scholar] 13. Сюй XM, Карлсон Б.А., Микс Х., Чжан Ю., Сайра К., Гласс Р.С., Берри М.Дж., Гладышев В.Н., Хэтфилд Д.Л. Биосинтез селеноцистеина на его тРНК у эукариот. PLoS Biol. 2006; 5: e4. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Хао Б., Гонг В., Фергюсон Т.К., Джеймс К.М., Кшицкий Ю.А., Чан М.К. Новый кодируемый UAG остаток в структуре метаногенметилтрансферазы. Наука. 2002; 296: 1462–1466. [PubMed] [Google Scholar] 15. Srinivasan G, Джеймс CM, Krzycki JA. Пирролизин, кодируемый UAG в архее: зарядка специализированной тРНК, декодирующей UAG.Наука. 2002; 296: 1459–1462. [PubMed] [Google Scholar] 16. Крюков Г.В., Крюков В.М., Гладышев В.Н. Новые белки, содержащие селеноцистеин млекопитающих, идентифицированные с помощью алгоритма, который ищет элементы последовательности вставки селеноцистеина. J. Biol. Chem. 1999; 274: 33888–33897. [PubMed] [Google Scholar] 17. Lescure A, Gautheret D, Carbon P, Krol A. Новые селенопротеины, идентифицированные in silico и in vivo с использованием консервативного структурного мотива РНК. J. Biol. Chem. 1999; 274: 38147–38154. [PubMed] [Google Scholar] 18.Кастеллано С., Морозова Н., Мори М., Берри М.Дж., Серрас Ф., Короминас М., Гиго Р. Идентификация In silico новых селенопротеинов в геноме Drosophila melanogaster . EMBO Rep. 2001; 2: 697–702. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Чжан Ы, Гладышев В.Н. Алгоритм идентификации бактериальных элементов последовательности инсерции селеноцистеина и генов селенопротеинов. Биоинформатика. 2005; 21: 2580–2589. [PubMed] [Google Scholar] 20. Крюков Г.В., Кастеллано С., Новоселов С.В., Лобанов А.В., Зехтаб О, Гуйго Р., Гладышев В.Н.Характеристика селенопротеомов млекопитающих. Наука. 2003; 300: 1439–1443. [PubMed] [Google Scholar] 21. Кастеллано С., Новоселов С.В., Крюков Г.В., Лескюр А., Бланко Э., Крол А., Гладышев В.Н., Гиго Р. Пересмотр эволюции селенопротеинов эукариот: новое семейство немлекопитающих с разбросанным филогенетическим распределением. EMBO Rep. 2004; 5: 71–77. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Уокер А., Кроссман LC. Это место достаточно большое для нас обоих. Nat. Rev. Microbiol. 2007; 5: 90–92. [PubMed] [Google Scholar] 25.Руби Э. Г., Хендерсон Б., Макфолл-Нгаи М. Мы справляемся с небольшой помощью наших (маленьких) друзей. Наука. 2004. 303: 1305–1307. [PubMed] [Google Scholar] 26. Войк Т., Тилинг Х., Иванова Н.Н., Хантеманн М., Рихтер М., Глекнер Ф.О., Боффелли Д., Андерсон И.Дж., Барри К.В. и др. Понимание симбиоза посредством метагеномного анализа микробного консорциума. Природа. 2006; 443: 950–955. [PubMed] [Google Scholar] 27. Zhang Y, Romero H, Salinas G, Gladyshev VN. Динамическая эволюция использования селеноцистеина в бактериях: баланс между потерей селенопротеина и выделением селеноцистеина из окислительно-восстановительных остатков цистеина.Genome Biol. 2006; 7: R94. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Альтшул С.Ф., Гиш В., Миллер В., Майерс Е. В., Липман Д. Д.. Базовый инструмент поиска локального выравнивания. J. Mol. Биол. 1990; 215: 403–410. [PubMed] [Google Scholar] 29. Томпсон Дж. Д., Хиггинс Д. Г., Гибсон Т. Дж.. CLUSTAL W: повышение чувствительности прогрессивного множественного выравнивания последовательностей за счет взвешивания последовательностей, штрафов за пропуски в зависимости от позиции и выбора матрицы весов. Nucleic Acids Res. 1994; 22: 4673–4680. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30.Badger JH, Hoover TR, Brun YV, Weiner RM, Laub MT, Alexandre G, Mrazek J, Ren Q, Paulsen IT, et al. Сравнительные геномные доказательства тесной связи между диморфными простекатными бактериями Hyphomonas neptunium и Caulobacter crescentus . J. Bacteriol. 2006; 188: 6841–6850. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Делонг Э.Ф., Престон С.М., Минсер Т., Рич В., Халлам С.Дж., Фригаард Н.Ю., Мартинес А., Салливан МБ, Эдвардс Р. и др. Геномика сообщества среди стратифицированных микробных сообществ в глубинах океана.Наука. 2006; 311: 496–503. [PubMed] [Google Scholar] 32. Чжан Ы, Баранов П.В., Аткинс Дж.Ф., Гладышев В.Н. Пирролизин и селеноцистеин используют разные стратегии декодирования. J. Biol. Chem. 2005; 280: 20740–20751. [PubMed] [Google Scholar] 33. Longstaff DG, Blight SK, Zhang L, Green-Church KB, Krzycki JA. In vivo контекстные требования для перевода UAG как пирролизина. Мол. Microbiol. 2007. 63: 229–241. [PubMed] [Google Scholar] 35. Халлам С.Дж., Патнэм Н., Престон С.М., Деттер Дж. К., Рохсар Д., Ричардсон П.М., Делонг Е.Ф.Обратный метаногенез: проверка гипотезы с помощью экологической геномики. Наука. 2004. 305: 1457–1462. [PubMed] [Google Scholar] 36. Триндж С.Г., фон Меринг Ч., Кобаяши А., Саламов А.А., Чен К., Чанг Х.В., Подар М., Шорт Дж. М., Матур Э. Дж. И др. Сравнительная метагеномика микробных сообществ. Наука. 2005; 308: 554–557. [PubMed] [Google Scholar] 37. Gill SR, Pop M, Deboy RT, Eckburg PB, Turnbaugh PJ, Samuel BS, Gordon JI, Relman DA, Fraser-Liggett CM, et al. Метагеномный анализ микробиома дистального отдела кишечника человека.Наука. 2006; 312: 1355–1359. [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Фоменко Д.Е., Син З., Адаир Б.М., Томас Д.Д., Гладышев В.Н. Высокопроизводительная идентификация каталитических окислительно-восстановительных остатков цистеина. Наука. 2007; 315: 387–389. [PubMed] [Google Scholar]Аминокислотные расстройства
Ann Transl Med. 2018 Dec; 6 (24): 471.
, 1 , 2 и 1Эрмал Алиу
1 Детская больница Питтсбурга, Медицинская школа Университета Питтсбурга, Питтсбург, Пенсильвания, США;
Шибани Канунго
2 Университет Западного Мичигана Медицинский факультет Гомера Страйкера, Каламазу, Мичиган, США
Джорджинн Л.Арнольд
1 Детская больница Питтсбурга, Медицинская школа Университета Питтсбурга, Питтсбург, Пенсильвания, США;
1 Детская больница Питтсбурга, Медицинская школа Университета Питтсбурга, Питтсбург, Пенсильвания, США;
2 Университет Западного Мичигана Медицинский факультет Гомера Страйкера, Каламазу, Мичиган, США
Автор, ответственный за переписку.Вклады: (I) Концепция и дизайн: S Kanungo, GL Arnold; (II) Административная поддержка: С. Канунго; (III) Предоставление учебных материалов или пациентов: нет; (IV) Сбор и сбор данных: Э. Алиу, Г.Л. Арнольд; (V) Анализ и интерпретация данных: нет; (VI) Написание рукописи: Все авторы; (VII) Окончательное утверждение рукописи: Все авторы.
Для корреспонденции: Georgianne L. Arnold, MD. Детская больница UPMC в Питтсбурге, 4401 Penn Avenue, Suite 1200, Pittsburgh, PA 15224, США. Электронная почта: [email protected].Поступило 07.12.2018; Принято 7 декабря 2018 г.
Copyright 2018 Annals of Translational Medicine. Все права защищены.Эта статья цитировалась в других статьях в PMC.Abstract
Аминокислоты служат ключевыми строительными блоками и источником энергии для восстановления, выживания, регенерации и роста клеток.Каждая аминокислота имеет аминогруппу, карбоновую кислоту и уникальную углеродную структуру. Человек использует 21 различную аминокислоту; большинство из них может синтезироваться эндогенно, но 9 из них являются «необходимыми», так как они должны поступать в организм с пищей. В дополнение к их роли в качестве строительных блоков белка, аминокислоты являются ключевым источником энергии (кетогенным, глюкогенным или и тем, и другим), являются строительными блоками промежуточных продуктов цикла Креба (также известного как TCA) и других метаболитов, и при необходимости рециркулируются. Метаболический дефект в метаболизме тирозина (дефицит оксидазы гомогентизиновой кислоты) исторически определил Арчибальда Гаррода как ключевого архитектора в соединении биохимии, генетики и медицины и создании термина «врожденная ошибка метаболизма» (IEM).Ключевая концепция дефекта одного гена, ведущего к дисфункции одного фермента, ведущего к «интоксикации» предшественником метаболического пути, была жизненно важна для связи генетики и метаболических нарушений и разработки подходов к скринингу и лечению, как описано в других главах этого выпуска. Аминокислотные расстройства также привели к развитию области метаболического питания и нарушили формулы и продукты с ограничением аминокислот. В этом обзоре будут обсуждаться наиболее распространенные нарушения, вызванные врожденными ошибками метаболизма аминокислот.
Ключевые слова: Фенилкетонурия (PKU), аминокислоты, интоксикация, метаболическая формула, диетический белок
Введение
Аминокислоты являются строительными блоками белков, включая структурные белки и ферменты. Они также образуют основу критических соединений на основе азота, таких как цитохромы, гем, гормоны, меланин, нейротрансмиттеры, нуклеотиды / нуклеиновые кислоты и другие. Аминокислоты эффективно используются организмом с помощью множества механизмов, таких как переработка, трансаминирование или выработка энергии.У здоровых людей, соблюдающих обычную диету, только небольшое количество потребляемого белка выводится с мочой или калом. Белки не только служат структурными или рабочими соединениями, они также могут метаболизироваться для создания энергии. При необходимости углеродные скелеты можно использовать для производства глюкозы или ее производных (таких как гликоген или жирные кислоты) для поддержания уровня глюкозы в плазме или обеспечения энергии во время голодания.
Пищевые белки являются ключевыми источниками незаменимых аминокислот для млекопитающих и людей, тогда как заменимые аминокислоты могут синтезироваться эндогенно.Люди используют 21 различную аминокислоту, из которых 21 st аминокислота — селеноцистеин, уникальность которой заключается в том, что она не следует каноническим путям синтеза других 20 протеиногенных аминокислот, но играет важную роль в различных клеточных процессах, таких как окислительный стресс, сигнальные пути, метаболизм гормонов щитовидной железы, сворачивание белков и гомеостаз селена (1).
Девять аминокислот (гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан, валин) считаются «незаменимыми», т.е.е., незаменимы в диете, поскольку люди не могут синтезировать их эндогенно.
Большинство заменимых аминокислот, таких как аланин, аргинин, аспарагин, аспартат, глутамат, глутамин, глицин, пролин и серин, синтезируются из глюкозы; в то время как тирозин синтезируется в результате метаболизма фенилаланина, а цистеин — в результате метаболизма метионина (2).
Алкаптонурия, врожденная ошибка метаболизма аминокислот, считается первым описанным метаболическим нарушением.Сэр Арчибальд Гаррод исследовал, почему моча некоторых людей становится черной, выясняя дефект метаболизма тирозина в оксидазе гомогентизиновой кислоты. Так родилась новая область медицины «Врожденные ошибки метаболизма» (ВЭМ) и концепция фермента «один ген — один» (3,4). Впоследствии выявление дефекта метаболизма фенилаланина, фенилкетонурии (ФКУ) привело к эволюции скрининга новорожденных (NBS) и его успеху, о чем говорилось в другой теме « Скрининг новорожденных и меняющееся лицо врожденных нарушений метаболизма в Соединенных Штатах». этого выпуска.Благодаря развитию исследований фенилкетонурии концепция диетического ограничения вредной аминокислоты в качестве стратегии лечения привела к последующей эволюции области «Метаболическое питание» (5). В этом обзоре будут дополнительно обсуждаться общие врожденные ошибки метаболизма аминокислот, их клиническая картина, диагностическая оценка, лечение и подходы к управлению.
Нарушения фенилаланина и тирозина
Фенилаланин — незаменимая аминокислота, а тирозин — полузаменимая аминокислота.У человека тирозин синтезируется из фенилаланина через фенилаланингидроксилазу, которая добавляет гидроксильную группу к ароматическому кольцу. Тирозин катаболизируется в несколько этапов с образованием ацетоацетата (кетогенного) и фумарата (глюкогенного) в качестве конечных продуктов. Гиперфениаланинемии и гипертирозинемии подробно рассматриваются в онлайн-издании «Метаболические и молекулярные основы наследственных заболеваний» (OMMBID) (6,7). Биохимический путь метаболизма фенилаланина и тирозина проиллюстрирован на рисунке.
Обзор метаболизма фенилаланина и тирозина.Недостатки ферментов показаны красными звездочками. Зеленая линия представляет митохондриальную мембрану. SUAC, сукцинилацетон; Bh5, тетрагидробиоптерин; HPA, гиперфенилаланинемия, PKU, фенилкетонурия; TYR, тирозинемия.
PKU (OMIM № 261600) является одним из наиболее ранних выявленных врожденных нарушений метаболизма и имеет хорошо описанную историю. Его назвали «воплощением биохимической генетики человека». По этому заболеванию опубликован ряд исторических обзоров (8,9). Фенилкетонурия впервые был идентифицирован в 1934 году Асбьёрном Фёллингом, когда он обнаружил повышенное содержание фенилкетонов в моче двух братьев и сестер с умственной отсталостью и необычным запахом.Механизм токсичности фенилаланина до конца не изучен. Лечение диетой с ограничением фенилаланина было впервые описано Хорстом Бикелем в 1953 году, и раннее и непрерывное лечение, по-видимому, предотвращает умственную отсталость. Большинство случаев вызвано дефицитом фермента фенилаланингидроксилазы , с несколькими процентами случаев недостаточностью синтеза или рециклинга кофактора биоптерин . ФКУ передается по аутосомно-рецессивному типу.Если не лечить в младенчестве и детстве, ФКУ вызывает умственную отсталость, судороги, «мышечный запах», светлые волосы / кожу, экзему и другие симптомы. Заболеваемость варьируется в зависимости от населения, с самым высоким уровнем заболеваемости среди населения Турции (приблизительно 1: 2600) и до 1:10 000 среди населения Северной Европы и Восточной Азии) (10).
Классическая ФКУ изначально определялась как уровни фенилаланина выше 1200 мкмоль / л (20 мг / дл), однако это различие в настоящее время несколько устарело, поскольку гораздо более низкие уровни фенилаланина все еще связаны с неоптимальными когнитивными и неврологическими исходами.Текущие рекомендации по лечению рекомендуют поддерживать уровень фенилаланина в пределах 120–360 мкмоль / л (2–6 мг / дл) на протяжении всей жизни (9). В настоящее время основным методом лечения является ограничение фенилаланина в рационе с добавлением тирозина. Однако диета очень строгая, и немногие из них могут сохранять ее в подростковом и взрослом возрасте, что приводит к дефициту управляющих функций, которые ухудшают образование, занятость и межличностные отношения. Новые методы лечения теперь полезны для некоторой части пациентов.Пациентам с остаточной ферментативной активностью может быть полезно добавление кофактора биоптерина сапроптерина (в настоящее время одобрено для детей в возрасте от четырех лет и старше), который может снизить уровень фенилаланина у некоторых. Пегвалайз — это инъекционная форма фенилаланинаммонийлиазы, недавно одобренная для взрослых с ФКУ, которая во многих случаях может нормализовать уровень фенилаланина в крови. Экспериментальные методы лечения включают генную терапию или трансплантацию гепатоцитов.
ФКУ также отличается тем, что является первоначальным скрининговым заболеванием новорожденных.Признание того, что ранняя и универсальная диагностика может предотвратить умственную отсталость, привело Роберта Гатри к разработке в 1963 году метода бактериального ингибирования, который позволил широко проводить скрининг новорожденных. Следует помнить, что уровни фенилаланина ниже в первые дни жизни, так как младенец еще не получал протеиновый корм, поэтому умеренное повышение фенилаланина на скрининге новорожденных часто бывает выше при последующем обследовании. В программах скрининга новорожденных обычно используется соотношение фенилаланина к определенным аминокислотам для выявления гиперфенилаланинемии уже через 24 часа жизни, например, с диагностической точки зрения полезно соотношение фенилаланина и тирозина> 3.Новорожденные с положительным результатом скрининга также должны пройти обследование на наличие дефектов синтеза или рециркуляции биоптерина, поскольку они также могут привести к повышению уровня фенилаланина.
Материнская ФКУ
Во время беременности самки с ФКУ должны поддерживать уровень фенилаланина <360 мкмоль / л (6 мг / дл), поскольку более высокие уровни связаны с тератогенными эффектами, такими как микроцефалия, врожденные пороки сердца, ЗВРП, умственная отсталость и другие плохие качества. исходы (11).
Дефекты биоптерина
Небольшая часть гиперфенилаланинемии возникает из-за дефектов синтеза или рециркуляции кофактора биоптерина для фермента фенилаланингидроксилазы.Поскольку этот кофактор является общим с тирозингидроксилазой и триптофангидроксилазой, пораженные пациенты обычно также имеют нарушение выработки дофамина и серотонина и демонстрируют неврологические нарушения даже при ограничении фенилаланина (12).
Тирозинемия типа II (OMIM # 276600) (также известная как синдром Ричнера-Ханхарта) — это нарушение первой стадии расщепления тирозина фермента тирозинаминотрансферазы. Тирозин и его метаболиты (4-гидроксифенилпируват, 4-гидроксифениллактат, 4-гидроксифенилацетат) повышены в крови, спинномозговой жидкости и моче (7).Заболевание передается по аутосомно-рецессивному типу.
Обычно без лечения уровни тирозина в плазме> 1200 мкмоль / л. В нелеченых случаях у пациентов в течение первых одного-двух лет жизни появляются глазные симптомы, и чаще всего развиваются кожные и неврологические симптомы. Отложение кристаллов тирозина в эпителиальных клетках роговицы приводит к светобоязни, чрезмерному слезотечению и ощущению жжения. Кожные аномалии развиваются в основном в области давления, такой как ладони и подошвы, начиная с волдырей или эрозий, переходя в незудящие, гиперкератотические папулы и бляшки.Неврологический исход варьируется от нормального развития до умственной отсталости (от легкой до тяжелой), в некоторых случаях с судорогами, тремором и атаксией. Причина неврологических осложнений остается невыясненной. Это заболевание встречается редко, с частотой менее 1 / 250,000.
Окончательный диагноз может быть установлен с помощью генного анализа. Диетическое ограничение тирозина и фенилаланина рекомендуется для поддержания уровней тирозина в плазме в диапазоне 200–500 мкмоль / л при сохранении адекватных уровней фенилаланина.Во время беременности более строгий контроль может быть полезным для дальнейшего снижения рисков для плода, связанных с гипертирозинемией.
Заболевание выявляется при обследовании новорожденных. Повышение уровня тирозина при скрининге новорожденных из-за тирозинемии типа II необходимо дифференцировать от тирозинемии типа I или типа III (см. Ниже), болезни печени (которое обычно также проявляется повышением уровня метионина и другими признаками дисфункции печени), и преходящая тирозинемия новорожденного , которая обычно купируется самостоятельно, но иногда может сохраняться в течение нескольких месяцев после рождения (13). Преходящая тирозинемия новорожденного. — частая биохимическая находка у новорожденных, особенно недоношенных. Предполагается, что причиной является незрелость 4-гидроксифенилпируватдиоксигеназы, возможно, в присутствии высокого потребления белка и / или относительной недостаточности аскорбата. Хотя обычно считается доброкачественным, есть сообщения о связи с неонатальной летаргией и некоторой легкой умственной отсталостью. Когда уровни тирозина в плазме остаются повышенными и другие причины повышенного тирозина исключены, лечение преходящей тирозинемии новорожденных, включая ограничение белка до 2 г / кг / день и добавление аскорбиновой кислоты 50-200 мг / день в течение 1-2 недель, может быть назначено. полезный.
Тирозинемия типа III (OMIM # 276710) — редкое аутосомно-рецессивное заболевание, вызываемое патогенными вариантами фермента 4-гидроксифенилпируватдиоксигеназы (ген HPD). Тирозин и его метаболиты (4-гидроксифенилпируват, 4-гидроксифениллактат, 4-гидроксифенилацетат) повышены в крови и моче. Наиболее частым наблюдаемым осложнением является умственная отсталость, которая может варьироваться от легкой до тяжелой. Другие находки включают задержку психомоторного развития, перемежающуюся атаксию или сонливость.Это очень редко, с неизвестной распространенностью. Причина неврологических осложнений неизвестна, но, возможно, связана с повышенным уровнем тирозина. Генетическое тестирование может помочь подтвердить диагноз. Лечение включает ограничение тирозина для поддержания уровня тирозина в плазме в диапазоне 200–500 мкмоль / л. Это редкая причина повышенного тирозина при обследовании новорожденных (14).
Хокинсинурия (OMIM # 140350) также возникает из-за дефицита фермента 4-гидроксифенилпируватдиоксигеназы, но в этом случае объясняется доминантно наследуемыми более мягкими изменениями в гене HPD.Хокинсин (4-дигидроксициклогексилуксусная кислота) образуется из предшественников метаболита тирозина с минимальным повышением уровня тирозина или без него. В первые годы жизни у пораженных пациентов может наблюдаться задержка развития и метаболический ацидоз, но в более позднем возрасте это заболевание, по-видимому, протекает бессимптомно. Это редко с неизвестной распространенностью. Описаны всего несколько случаев. Присутствие хавкинсина в аминокислотном анализе мочи является диагностическим и может быть подтверждено генетическим тестированием. Когда диагноз ставится в младенчестве, восстановление грудного вскармливания ассоциируется с клиническим улучшением, а в некоторых случаях помогает ограничение тирозина в диете и добавки витамина С (7).
Алкаптонурия (OMIM # 203500) — рецессивное заболевание, вызванное патогенными изменениями в гене HGD, кодирующем гомогентизатдиоксигеназу. Исторически это примечательно как первая врожденная ошибка метаболизма, описанная Гарродом. У пациентов накапливается гомогентизиновая кислота, и к третьему десятилетию жизни наблюдается пигментация соединительной ткани (особенно заметная в склерах или ушном хряще), артрит суставов и позвоночника, поражение сердечного клапана, камни в почках и простате.У детей это может быть диагностировано по потемнению мочи при контакте с воздухом. Артрит имитирует остеоартрит с поражением крупных суставов и позвоночника. Операции по замене суставов и поражение сердечного клапана обычно наблюдаются у половины пациентов к 6 -му десятилетию. В Соединенных Штатах распространенность оценивается в 1: 250 000–1 000 000 живорождений, чаще в Доминиканской Республике и на северо-западе Словакии. Повышенный уровень гомогентизата при количественном анализе в моче или биаллельных патогенных вариантах в HGD может подтвердить диагноз.В прошлом были опробованы несколько методов лечения (диетическое ограничение тирозина и фенилаланина, высокие дозы витамина С или пероральный бисфосфонат), но не было доказано, что они замедляют / обращают вспять прогрессирование заболевания. Недавно в качестве потенциального терапевтического средства был предложен нитисинон; он приводит к биохимическому улучшению, но демонстрирует неоднозначные результаты у пациентов с уже имеющимися симптомами (15,16).
Тирозинемия типа I (OMIM # 276700) представляет собой опасное для жизни нарушение метаболизма тирозина, вызванное патогенными вариантами гена FAH, который кодирует фумарилацетоацетазу (последний этап пути деградации тирозина).Дефект фермента вызывает накопление предшественников малейлацетоацетата и фумарилацетоацетата, а их побочные продукты (сукцинилацетон и сукцинилацетоацетат) токсичны для клеток, особенно для печени и почек. Сукцинилацетон также является мощным ингибитором дегидратазы 5-аминолевулиновой кислоты, приводящим к накоплению 5-ALA, которая является нейротоксичной и считается причиной острых (порфирийоподобных) неврологических кризисов. Он наследуется по аутосомно-рецессивному типу. Самая тяжелая форма проявляется рано, часто в первые шесть месяцев жизни, когда заболевание печени прогрессирует до печеночной недостаточности при отсутствии лечения.Более поздние проявления включают дисфункцию печени и почечный канальцевый ацидоз, задержку роста, гипофосфатемический рахит и симптомы, подобные порфирии. Для тех, кто выжил в младенчестве, естественным течением, если его не лечить, является прогрессирующее заболевание, в конечном итоге приводящее к циррозу и / или гепатоцеллюлярной карциноме.
Сукцинилацетон (SUAC) в крови или моче является патогномоничным, но не всегда обнаруживается при анализе органических кислот в моче, поэтому его следует запрашивать отдельно, если рассматривается этот диагноз.Повышение уровня тирозина в плазме может быть минимальным; таким образом, только аминокислоты плазмы могут не дать диагноза. Заболеваемость составляет примерно 1: 100 000–120 000 рождений. В регионе Сагеней-Лак-Сен-Жан в Квебеке распространенность составляет 1: 1846 живорождений из-за эффекта основателя (c.1062 + 5G> A наблюдается в 87% патогенных вариантов). Скрининг новорожденных путем измерения сукцинилацетона доступен во многих, но не во всех программах скрининга новорожденных. Поскольку повышение уровня тирозина в плазме может быть минимальным, это заболевание можно пропустить при скрининге новорожденных, если программа также не обнаружит сукцинилацетон.
Лечение выбора — 2- (2-нитро-4-трифторметилбензол) 1,3-циклогександион (NTBC), также известный как нитисинон, и его следует начинать сразу после подтверждения диагноза. Он ингибирует более проксимальную стадию пути деградации тирозина (фермент диоксигеназа 4-гидроксифенилпировиноградной кислоты), тем самым предотвращая образование токсичных метаболитов. Поскольку нититинон приведет к повышению уровня тирозина в плазме, необходимо ограничить потребление тирозина и фенилаланина с пищей для поддержания уровней в желаемом диапазоне (уровни тирозина в сыворотке 200–400 мкмоль / л при сохранении адекватных уровней фенилаланина.Лечение нитисиноном снижает риск гепатоцеллюлярного рака, но пациенты требуют постоянного наблюдения. Пациентам, диагностированным до того, как был разработан нититинон, потребовалась ортотопическая трансплантация печени (ОТП) (7,17,18).
Нарушения аминокислот с разветвленной цепью
Аминокислоты с разветвленной цепью (лейцин, изолейцин, валин) являются незаменимыми аминокислотами для человека, на их долю приходится 20% аминокислот в мышечных белках и они играют важную роль в синтезе и обмене белков. .
Болезнь мочи кленового сиропа (MSUD) (OMIM # 248600) — нарушение катаболизма аминокислот с разветвленной цепью (BCAA) (см.). Это аутосомно-рецессивная врожденная ошибка метаболизма, вызванная патологическими вариантами в субъединицах ферментного комплекса, участвующего во второй общей стадии метаболизма кетокислот с разветвленной цепью [ BCKDHA (OMIM # 608348), BCKDHB (OMIM # 248611). ), DBT (OMIM # 248610) или DLD (OMIM # 238331)] (см.). Описано пять фенотипов — классический, промежуточный, прерывистый, чувствительный к тиамину и дефицитный по дигидролипоилдегидрогеназе (E3).При классическом MSUD у новорожденных признаки заболевания проявляются в течение первых дней или месяцев жизни. Повышенный уровень лейцина вызывает отек мозга и интоксикацию, сначала с неспецифическими симптомами, такими как плохое питание / раздражительность, затем прогрессирует до летаргии, прерывистого апноэ, отека мозга, комы и смерти. Более поздние или более легкие формы могут проявляться энцефалопатией во время эпизодической декомпенсации метаболизма, особенно во время перемежающихся заболеваний. Распространенность составляет 1: 185 000 среди населения в целом, но в некоторых общинах меннонитов она, как сообщается, составляет 1: 380 из-за эффекта основателя (19, 20).
Обзор катаболизма аминокислот с разветвленной цепью. Названия ферментов выделены курсивом, а соответствующие дефициты внутримитохондриальных ферментов показаны красными звездочками. Зеленая линия представляет митохондриальную мембрану. MSUD, болезнь мочи кленового сиропа.
Аминокислота в плазме выявляет значительное повышение валина, лейцина и изолейцина, а также l-аллоизолейцина (патогномоничный маркер MSUD). Диагноз можно подтвердить молекулярным тестированием. Запах «кленового сиропа» (из-за накопления 2-гидроксиизолейцина) во многих случаях достоверно не очевиден (и часто лучше всего проявляется в серной сере).
Лечение острого криза может потребовать гемодиализа для быстрого снижения уровня лейцина в плазме. Другие важные элементы лечения включают в себя обратный катаболизм (краткосрочное ограничение белка, обеспечивающее не менее 1,25 дневной потребности в энергии, с 40–50% жира), с последующим добавлением валина и изолейцина и постепенным добавлением лейцина для выполнения минимальных требований для этого. незаменимая аминокислота. Из-за риска отека мозга следует избегать приема гипотонических жидкостей. Диетическое ограничение лейцина (цель — поддержание уровней в сыворотке крови между 150–300 мкмоль / л) с добавлением валина и изолейцина является основным направлением хронической терапии (21).
OLT устраняет диетические ограничения и постоянную озабоченность по поводу острых метаболических кризисов и становится все более популярным среди пациентов с MSUD (22). Поскольку примерно половина метаболизма BCAA происходит в скелетных мышцах, эксплантированная печень пациентов с MSUD использовалась в «трансплантатах домино» в качестве доноров печени.
MSUD обнаруживается при скрининге новорожденных, но младенец может заболеть до того, как будут завершены результаты скрининга. Ложноположительное повышение аминокислот с разветвленной цепью может быть связано с перееданием, катаболизмом или другими факторами, но обследование новорожденного с подозрением на MSUD должно рассматриваться как нарушение метаболизма, пока не будет исключен дифференциальный диагноз.
Гипервалинемия (OMIM 277100) и гиперлейцин-изолейцинемия (OMIM 238340) — это биохимические результаты неопределенного значения, вызванные BCT1 (OMIM 113520) и BCT2 (OMIM 113530). Сообщалось об одном пациенте, у которого были как гипервалинемия, так и гиперлейцин-изолейцинемия с аномалиями белого вещества головного мозга, у которого улучшилось состояние после приема витамина B6.
Нарушения сульфатированных аминокислот (метионина и цистеина)
Метионин является незаменимой аминокислотой и обеспечивает наиболее распространенный исходный кодон для трансляции белка.Дифференциальный диагноз повышенного содержания метионина в плазме включает тирозинемию I типа (из-за заболевания печени), дефицит цитрина (см. Нарушения цикла мочевины), гомоцистинурию и нарушения синтеза гомоцистеина. Метионин превращается в гомоцистеин через промежуточные соединения s-аденозилметионин (SAM) и s-аденозилгомоцистеин (SAH). Уровни гомоцистеина жестко регулируются либо путем возврата гомоцистеина к метионину через метионинсинтазу с использованием пути метилентетрагидрофолатредуктазы (MTHFR) (путь реметилирования), либо путем дальнейшего метаболизма до цистатионина с помощью фермента цистатионин-бета-синтаза, а затем до цистатионин-бета-синтазы. и, наконец, сульфат.иллюстрирует различные IEM, идентифицированные на нескольких ферментативных стадиях этого пути (23).
Обзор метаболизма сульфатированных аминокислот. Названия ферментов выделены курсивом, а соответствующие дефициты внутримитохондриальных ферментов показаны красными звездочками. Зеленая линия представляет митохондриальную мембрану. B12, витамин B12; CBS, цистатионин-бета-синтаза; HCY, гомоцистинурия; MeCbl, метилкобаламин; MAT, метионин-S-аденозилтрансфераза; SAM, S-аденозилметионин; SAH, S-аденозилгомоцистеин; SAHH, S-аденозилгомоцистеингидролаза; MTHFR, метилентетрагидрофолатредуктаза; ТГФ, тетрагидрофолат; SUOX, сульфитоксидаза.
Изолированная гиперметионинемия возникает из-за дефектов пути превращения метионина в гомоцистеин. Это преобразование требует трех этапов: преобразование метионина в s-аденозилметионин [метионин-аденозилтрансферазой (MAT)], преобразование s-аденозилметионина в s-аденозилгомоцистеин с помощью глицинметилтрансферазы и преобразование S-аденозилгомоцистеина в гомоцистеин (гомоцистеин). САХХ). Врожденные ошибки сообщаются на всех трех этапах пути.
Дефицит MAT I / III (OMIM 250850) связан с дефектами превращения метионина в s-аденозилметионин из-за патогенных вариантов в гене MATA1A (OMIM # 250850). Это наиболее распространенное из трех расстройств этого пути. Описаны как доминантные, так и рецессивные формы. У большинства пациентов это доброкачественный биохимический фенотип. Однако в рецессивной форме, когда уровень метионина в плазме превышает 800 мкмоль / л, это может быть связано с неврологическим дефицитом / демиелинизацией.Диагноз ставится путем установления гиперметионинемии (по аминокислотному анализу плазмы) в отсутствие гипергомоцистеинемии (требуется окончательное тестирование, поскольку гомоцистеин нестабилен при стандартном аминокислотном анализе плазмы). Нестабильность гомоцистеина при аминокислотном анализе плазмы требует отдельного окончательного анализа на гомоцистеин плазмы. Лечение не требуется, если уровень метионина в плазме не очень высок, и в этом случае может потребоваться ограничение метионина. Это заболевание выявляется случайно при обследовании новорожденных, поскольку на нем измеряется уровень метионина (не гомоцистеина) из-за нестабильности гомоцистеина в плазме.При наличии неврологических аномалий или заболевания печени может потребоваться рассмотреть два других нарушения этого пути (см. Ниже).
Дефицит глицин-N-метилтрансферазы (OMIM № 606664) связан с дефектом превращения s-аденозилметионина в s-аденозилгомоцистеин. Это очень редкое аутосомно-рецессивное заболевание, вызванное дефицитом GNMT, о котором сообщалось лишь о нескольких случаях. Результаты включают стойкое умеренное повышение уровня трансаминаз печени в сыворотке крови и легкую гепатомегалию.Биохимические данные включают повышенный уровень метионина и S-аденозилметионина (SAM) (24).
Дефицит S-аденозилгомоцистеингидролазы (OMIM 613752) дважды сообщался с повышенным уровнем метионина и s-аденозилметионина в плазме без значительной гомоцистинурии (HCY). Клинические признаки включали заболевание печени, неврологические аномалии, аномалии белого вещества и повышенный уровень КК. В одном случае было проведено молекулярное тестирование гена ACHY и были биаллельные патогенные варианты. Он показал некоторое улучшение при ограничении в рационе метионина и добавлении фосфатидилхолина и креатина (25).
Гомоцистинурия (классическая гомоцистинурия, OMIM # 236200) — аутосомно-рецессивное заболевание, вызванное патологическими вариантами гена CBS, кодирующего бета-синтазу цистатионина. Классическая гомоцистинурия (а также более тяжелые расстройства реметилирования, связанные с гипергомоцистеинемией) характеризуются поражением глаза (эктопия lentis, связанная с аномальным сшиванием коллагена в поясулах, прогрессирующая миопия), скелетной системы (марфаноидный габитус — высокий, стройный, с увеличенным верхом / меньшее соотношение конечностей, сколиоз, грудная клетка, ригидность суставов), сосудистой системы (тромбоэмболия) и ЦНС (задержка развития / умственная отсталость).Пациенты имеют повышенный риск ишемической болезни сердца. Беременность увеличивает послеродовой риск тромбоэмболии. Распространенность классической гомоцистинурии в США оценивается от 1: 200 000 до 1: 335 000, но в некоторых регионах мира она намного выше (например, Катар 1: 1800, Норвегия 1: 6400).
Уровни метионина в плазме повышены при аминокислотном анализе. Уровни гомоцистеина в плазме повышены, но не могут быть оценены при анализе аминокислот в плазме, если кровь не депротеинизирована немедленно, поэтому при подозрении на это заболевание показан специфический анализ гомоцистеина в плазме.Диагноз подтверждается биохимически или наличием биаллельных патогенных вариантов в гене цистатионин-бета-синтазы (CBS).
Пациенты с классической гомоцистинурией со специфическими мутациями могут реагировать на добавку кофактора пиридоксина (витамин B6). При постановке диагноза пациенты должны пройти провокацию пиридоксином. Стандартное лечение включает диетическое ограничение метионина и добавление цистеина для поддержания уровня гомоцистеина в плазме ниже 50 мкмоль / л.Бетаин увеличивает реметилирование гомоцистеина до метионина и может быть полезным. Гомоцистинурия у матери не является тератогенной, но увеличивает повышенный риск тромбоэмболии у матери, поэтому следует рассмотреть возможность назначения низкомолекулярного гепарина в последнем триместре и через 6 недель после родов.
Скрининг новорожденных на гомоцистинурию проводится путем измерения уровней метионина у новорожденных, поскольку гомоцистеин в плазме не является стабильным для этого анализа. Повышение уровня метионина при скрининге новорожденных должно сопровождаться конкретным определением уровня гомоцистеина в плазме, а также уровней B12 и фолиевой кислоты (26,27).
Гомоцистинурия также может быть вызвана неспособностью реметилировать гомоцистеин обратно до метионина. Как отмечалось ранее, уровни гомоцистеина строго регулируются. Помимо преобразования гомоцистеина в бета-цистатионин, гомоцистеин также активно реметилируется обратно в метионин. В этом процессе участвуют витамин B12, метионинсинтаза и MTHFR.
Дефекты метаболизма витамина B12 связаны с модификацией кобаламина с образованием метилкобаламина (MeCbl). Этот процесс включает в себя несколько шагов, с врожденными ошибками на различных этапах, на которые ссылается их дополнительная группа.Дефекты в группах комплементации C, D, F, J и X также приводят к снижению образования аденозила B12 и некоторых форм метилмалоновой ацидемии. Дефицит витамина B12 в питании также может привести к небольшому повышению уровня гомоцистеина, но не до такой степени, как при патологических метаболических дефектах (28).
Дефекты в MTHFR (OMIM # 236250): фермент MTHFR участвует в метаболизме фолиевой кислоты и реметилировании гомоцистеина до метионина. Серьезные генетические дефекты приводят к появлению признаков и симптомов, характерных для классической гомоцистинурии.Часто встречаются неврологические нарушения, включая судороги, микроцефалию, тяжелую умственную отсталость и психические расстройства.
Общие полиморфизмы в MTHFR (C677T и A1298C) приводят к некоторому снижению экспрессии фермента, но не являются врожденными ошибками метаболизма. Они могут проявляться легкой гипергомоцистинемией, но не до такой степени, что вызывает гомоцистинурию.
В случае дефектов реметилирования уровень метионина в плазме от низкого до низкого-нормального, в то время как уровни гомоцистеина в плазме значительно повышены.Пациенты с дефектами реметилирования могут реагировать на большие дозы кобаламина (1 мг / день или более инъекций гидроксокобаламина) и на бетаин. Поскольку гомоцистинурия, вызванная дефектом реметилирования, не связана с гиперметионинемией, она НЕ выявляется при обычном скрининге новорожденных, если не сопровождается другими дефектами комплементации кобаламина, то есть метилмалоновой ацидемией).
Детоксикация сульфита до нетоксичного сульфата является заключительным этапом катаболизма сульфатированных аминокислот.Ответственный за это фермент — сульфитоксидаза. В настоящее время описаны две врожденные ошибки активности сульфитоксидазы: изолированный дефицит самого фермента сульфитоксидазы и дефицит его кофактора, кофактора молибдена (29).
Дефицит кофактора молибдена (OMIM № 252150 и 252160) — аутосомно-рецессивное заболевание, влияющее на биосинтез кофактора молибдена, который необходим для ферментов — сульфитоксидазы, альдегидоксидазы и ксантиндегидрогеназы.Потеря активности сульфитоксидазы, вызванная дефицитом кофактора, по-видимому, является наиболее клинически значимым из трех катализируемых ферментов. Классическое проявление — трудноизлечимые неонатальные судороги с аномалиями ЭЭГ (часто с паттерном подавления вспышек, часто сопровождающимся структурными аномалиями ЦНС, с более поздней умственной отсталостью и (через год) эктопией лентиса. Сообщается также о более позднем начале или более легких проявлениях. Расстройство встречается редко.
Хотя классический метаболит s-сульфоцистеин может быть обнаружен в некоторых анализах аминокислот, его часто не распознают, учитывая его положение на хроматограмме и недостаточную осведомленность о заболевании.Таким образом, для s-сульфоцистеина показано специальное тестирование. Щуп свежей мочи на сульфит также может быть полезен в диагностике. Уровень мочевой кислоты в сыворотке также обычно низкий (вторичный по отношению к дефициту ксантиндегидрогеназы). Генетическое тестирование может подтвердить диагноз. Лечение монофосфатом пираноптерина внутривенно приводит к значительному улучшению результатов у некоторых, но не у всех пациентов с дефицитом типа А (30).
Изолированная недостаточность сульфитоксидазы (OMIM # 272300) — это рецессивное заболевание, вызванное дефектами гена SUOX.Это поразительно похоже на дефицит кофактора молибдена по проявлениям, с неонатальными судорогами, умственной отсталостью и более поздней эктопией lentis, но в этом случае мочевая кислота в сыворотке нормальна. Лечение добавками метионина и цистеина может привести к минимальному улучшению, но существенного лечения не существует (31). В настоящее время при обследовании новорожденных ни одно из заболеваний не выявляется.
Нарушения метаболизма глицина
Глициновая энцефалопатия (также известная как некетотическая гиперглицинемия) (OMIM # 605899) — это нарушение системы расщепления глицина.Глицин накапливается в спинномозговой жидкости и других тканях организма. Большинство пораженных пациентов поступают в период новорожденности с трудноизлечимыми приступами, обычно с паттерном подавления вспышек на ЭЭГ, а выжившие имеют глубокую умственную отсталость. Неонатальный вариант формы проявляется прогрессирующей летаргией и апноэ. Около 15% присутствуют в более позднем возрасте от младенчества до взрослого возраста. Иногда исход развития более мягкий. Заболевание передается по аутосомно-рецессивному типу. Это важная причина судорог у новорожденных.Заболеваемость достигает 1:55 000 в популяциях Северной Европы, но, вероятно, заболевание недостаточно диагностировано, поскольку его нельзя оценить без определения уровней глицина (на аминокислотном анализе) в спинномозговой жидкости.
Подозрение на диагноз основано на повышенном соотношении глицина в спинномозговой жидкости и плазме. Глицин в плазме не всегда повышен. Подтверждение может включать генетическое тестирование (по крайней мере) 3 белков, составляющих ферментный комплекс расщепления глицина. Возможен ферментный анализ ткани печени.В настоящее время не существует высокоэффективного лечения. Бензоат натрия (который образует комплекс с глицином с образованием гиппуровой кислоты) может усиливать экскрецию глицина, а декстрометорфан может оказывать противосудорожное действие, предположительно за счет ослабления перевозбуждения рецептора NMDA в ЦНС. Однако в тяжелых случаях новорожденных эффективность этих методов лечения минимальна.
Предлагается скрининг новорожденных на это заболевание, основанный на повышении уровня глицина в плазме. Однако чувствительность неясна, поскольку при этом заболевании уровень глицина в плазме повышен неравномерно (32,33).
Другие редкие аминокислотные нарушения, включая гистидинемию, болезнь Хартнупа, гиперлизинемию, дефицит форминотрансферазы, 2-аминоадипиновый полуальдегиддегидрогеназа (дефицит антихина), дефицит пролидазы, пролиноксидазы, дефицит, дефицит 5-оксопролиназы и т. Д., Не будут рассматриваться в этой статье и могут можно найти на www.omim.org.
Сноски
Конфликт интересов: Авторы не заявляют о конфликте интересов.
Список литературы
3.Гаррод А. Заболеваемость алькаптонурией: исследование химической индивидуальности. Ланцет 1902; 160: 1616-20. 10.1016 / S0140-6736 (01) 41972-6 [CrossRef] [Google Scholar] 5. Бикель Х, Джеррард Дж, Хикманс Э.М. Влияние приема фенилаланина на фенилкетонурию. Lancet (Лондон, Англия) 1953; 265: 812-3. 10.1016 / S0140-6736 (53)-5 [PubMed] [CrossRef] [Google Scholar] 6. Донлон Дж., Саркисян К., Леви Х. и др. Гиперфенилаланинемия: дефицит фенилаланингидроксилазы. В: Beaudet AL, Vogelstein B, Gibson KM, et al.редакторы. Интернет-метаболические и молекулярные основы наследственных заболеваний. Нью-Йорк, штат Нью-Йорк: McGraw-Hill Companies, Inc., 2014. [Google Scholar] 7. Митчелл Г.А., Громпе М., Ламберт М. и др. Гипертирозинемия. В: Beaudet AL, Vogelstein B, Kinzler KW, et al. редакторы. Интернет-метаболические и молекулярные основы наследственных заболеваний. Нью-Йорк, штат Нью-Йорк: McGraw-Hill Companies, Inc., 2014. [Google Scholar] 8. Camp KM, Parisi MA, Acosta PB, et al. Конференция по научному обзору фенилкетонурии: состояние науки и будущие потребности в исследованиях.Мол Генет Метаб 2014; 112: 87-122. 10.1016 / j.ymgme.2014.02.013 [PubMed] [CrossRef] [Google Scholar] 9. Vockley J, Andersson HC, Antshel KM и др. Дефицит фенилаланингидроксилазы: рекомендации по диагностике и лечению. Genet Med 2014; 16: 188-200. 10.1038 / gim.2013.157 [PubMed] [CrossRef] [Google Scholar] 10. Regier DS, Грин CL. Дефицит фенилаланингидроксилазы. GeneReviews®. Вашингтонский университет, Сиэтл, 1993. [Google Scholar] 11. Waisbren SE, Rohr F, Anastasoaie V и др. Материнская фенилкетонурия: отдаленные результаты у потомства и характеристики матери после беременности.Представитель JIMD 2015; 21: 23-33. 10.1007 / 8904_2014_365 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 12. Блау Н., Тёни Б., Хайланд К. и др. Нарушения тетрагидробиоптерина и родственных биогенных аминов. В: Beaudet AL, Vogelstein B, Gibson KM, et al. редакторы. Интернет-метаболические и молекулярные основы наследственных заболеваний. Нью-Йорк, штат Нью-Йорк: McGraw-Hill Companies, Inc., 2014. [Google Scholar] 13. Леви Х.Л., Ши В.Е., Мэдиган П.М. и др. Транзиторная тирозинемия у доношенных детей. JAMA 1969; 209: 249. 10.1001 / jama.1969.03160150035008 [PubMed] [CrossRef] [Google Scholar] 14. Эллавей CJ, Holme E, Standing S и др. Исход тирозинемии III типа. J Наследовать Metab Dis 2001; 24: 824-32. 10.1023 / A: 1013936107064 [PubMed] [CrossRef] [Google Scholar] 15. Интрон WJ, Gahl WA. Алькаптонурия. В: Adam MP, Ardinger HH, Pagon RA, et al. редакторы. SourceGeneReviews® [Интернет]. Сиэтл (Вашингтон): Вашингтонский университет, Сиэтл, 1993-2018. [Google Scholar] 16. Ранганат Л.Р., Хедр М., Милан А.М. и др. Нитисинон останавливает охроноз и снижает скорость прогрессирования алкаптонурии: оценка действия нититинона в Национальном центре алкаптонурии Соединенного Королевства.Мол Генет Метаб 2018; 125: 127-34. 10.1016 / j.ymgme.2018.07.011 [PubMed] [CrossRef] [Google Scholar]17. Снайдерман Кинг Л., Трамс К., Скотт К.Р. Тирозинемия типа I. GeneReviews® [Интернет]. Сиэтл (Вашингтон): Вашингтонский университет, Сиэтл, 1993-2018.
18. Чински Дж. М., Сингх Р., Фичичиоглу С. и др. Диагностика и лечение тирозинемии типа I: обзор и рекомендации консенсусной группы США и Канады. Genet Med 2017; 19 (12). 10.1038 / gim.2017.101 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 19.Чуанг Д.Т., Ши В.Е., Макс Винн Р. Болезнь мочи кленового сиропа (кетоацидурия с разветвленной цепью). В: Beaudet AL, Vogelstein B, Gibson KM, et al. редакторы. Интернет-метаболические и молекулярные основы наследственных заболеваний. Нью-Йорк, штат Нью-Йорк: McGraw-Hill Companies, Inc., 2014. [Google Scholar] 20. Штраус К.А., Паффенбергер Э.Г., Мортон Д.Х. Заболевание мочи кленовым сиропом [Интернет]. GeneReviews®. Вашингтонский университет, Сиэтл, 1993. [Google Scholar] 21. Frazier DM, Allgeier C, Homer C, et al. Руководство по питанию при болезни мочи кленовым сиропом: подход, основанный на доказательствах и консенсусе.Мол Генет Метаб 2014; 112: 210-7. 10.1016 / j.ymgme.2014.05.006 [PubMed] [CrossRef] [Google Scholar] 22. Мазариегос Г. В., Мортон Д. Х., Синди Р. и др. Трансплантация печени при классической болезни мочи кленового сиропа: долгосрочное наблюдение у 37 пациентов и сравнительный опыт United Network for Organ Sharing. J Педиатр 2012; 160: 116-21.e1. 10.1016 / j.jpeds.2011.06.033 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 23. Харви Мадд С., Леви Х.Л., Краус Дж. П. Нарушения транссульфурации. В: Beaudet AL, Vogelstein B, Kinzler KW, et al.редакторы. Онлайн-метаболические и молекулярные основы наследственных заболеваний [Интернет]. Нью-Йорк, штат Нью-Йорк: McGraw-Hill Companies, Inc., 2014. [Google Scholar] 24. Барич И., Эрдол С., Саглам Х. и др. Дефицит глицин-N-метилтрансферазы: участник дисметилирующих заболеваний печени? Представитель JIMD 2017; 31: 101-6. 10.1007 / 8904_2016_543 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 25. Барик I, Фумик К., Гленн Б. и др. Дефицит S-аденозилгомоцистеингидролазы у человека: генетическое нарушение метаболизма метионина.Proc Natl Acad Sci U S A 2004; 101: 4234-9. 10.1073 / pnas.0400658101 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 26. Сахаров С.Дж., Пикер Д.Д., Леви Х.Л. Гомоцистинурия, вызванная дефицитом цистатионин-бета-синтазы [Интернет]. GeneReviews®. Вашингтонский университет, Сиэтл, 1993. [Google Scholar] 27. Моррис А.А.М., Кожич В., Чакрапани А.Б. и др. Рекомендации по диагностике и лечению дефицита цистатионин-бета-синтазы. J Наследовать Metab Dis 2017; 40: 49-74. 10.1007 / s10545-016-9979-0 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 28.Sloan JL, Carrillo N, Venditti CP et al. Нарушения внутриклеточного обмена кобаламина [Интернет]. GeneReviews®. Вашингтонский университет, Сиэтл, 1993. [Google Scholar] 29. Джонсон Дж. Л., Дюран М. Дефицит кофактора молибдена и изолированный дефицит сульфитоксидазы. В: Beaudet AL, Vogelstein B, Gibson KM, et al. редакторы. Интернет-метаболические и молекулярные основы наследственных заболеваний. Нью-Йорк, штат Нью-Йорк: McGraw-Hill Companies, Inc., 2014. [Google Scholar] 30. Атвал П.С., Скалья Ф. Дефицит кофактора молибдена.Мол Генет Метаб 2016; 117: 1-4. 10.1016 / j.ymgme.2015.11.010 [PubMed] [CrossRef] [Google Scholar] 31. Бинду П.С., Нагаппа М., Тали А.Б. и др. Изолированный дефицит сульфитоксидазы [Интернет]. GeneReviews®. Вашингтонский университет, Сиэтл, 1993. [Google Scholar] 32. Хамош А., Джонстон М. В. Некетотическая гиперглицинемия. В: Beaudet AL, Vogelstein B, Gibson KM, et al. редакторы. Онлайн-метаболические и молекулярные основы наследственных заболеваний [Интернет]. Нью-Йорк, штат Нью-Йорк: McGraw-Hill Companies, Inc., 2014. [Google Scholar] 33.Ван Хов Дж., Кофлин С., Шарер Г. Глициновая энцефалопатия [Интернет]. GeneReviews®. Вашингтонский университет, Сиэтл, 1993. [Google Scholar]Редкая, но необходимая аминокислота селеноцистеин | by Research Features
Профессор Ульрих Швейцер из Боннского университета, Германия, возглавляет исследования по выявлению роли селенопротеинов в физиологии млекопитающих. Выясняя механизмы, лежащие в основе их функции, его работа позволяет по-новому взглянуть на широкий спектр человеческих заболеваний, влияющих на мозг и гормоны щитовидной железы.В основе исследований профессора доктора Швейцера лежит редкая селенсодержащая 21-я аминокислота селеноцистеин (Sec), определяющий компонент селенопротеинов.
Селеноцистеин (Sec) является незаменимым аминокислотным компонентом селенопротеинов, которые участвуют во множестве клеточных и метаболических процессов. Их дерегуляция все чаще ассоциируется с нейродегенеративными и другими заболеваниями, лежащие в основе которых механизмы остаются неясными. Однако, используя новые модели трансгенных мышей, профессор доктор Швейцер и его команда обнаружили массу информации о механизмах, лежащих в основе их функции.Обширное исследование его команды показало, что снижение экспрессии селенопротеинов в мозге млекопитающих ухудшает развитие мозга и его нормальное функционирование, что приводит к широкому спектру заболеваний, включая эпилепсию и нейродегенерацию.
Селенопротеины — это белки, внутри которых Sec включен в полипептидную цепь. До недавнего времени важность Sec не принималась во внимание — возможно, из-за его низкой распространенности и открытия после других 20 канонических аминокислот.В разделе Sec атом микроэлемента селена (Se) заменяет атом серы цистеина. Селен обладает аналогичными, но более реактивными свойствами, чем сера, и всегда находится в активном центре селеноферментов.
Исследование самой редкой аминокислоты
Sec ускользнул от ученых, получивших Нобелевскую премию, которые расшифровали генетический код, потому что Sec кодируется тем, что считалось исключительно терминирующим кодоном, UGA. Как клетка может отличить завершение от включения Sec? В последовательности мРНК есть особый элемент, который управляет перекодированием UGA, называемый последовательностью вставки селеноцистеина (SECIS).SECIS распознается SECIS-связывающим белком, который, в свою очередь, инструктирует рибосому не завершаться, а включать Sec — см. Рисунок на обороте.
Sec ускользнул от лауреатов Нобелевской премии
, которые расшифровали генетический код
Геном человека содержит 25 генов, кодирующих селенопротеины. У мышей те же гены селенопротеинов, что и у людей, но на один меньше. Из селенопротеинов, кодируемых геномами человека и грызунов, примерно половина их функций остается неизвестной.Доктор Швейцер и другие ученые поняли, что генетический анализ трансгенных мышей, у которых была нарушена или изменена конкретная функция гена, может пролить свет на роль отдельных селенопротеинов. Фактически, некоторые селенопротеины необходимы млекопитающим. С быстрым развитием генетики человека выявляется все больше и больше мутаций, нарушающих функцию селенопротеина.
Селен в основе важных активных центров ферментов
Белки, которые функционируют как ферменты, в которых Sec является ключевым компонентом, известны как селеноферменты.Они наиболее известны как антиоксидантные ферменты, которые борются со «свободными радикалами» внутри клеток и, следовательно, участвуют в старении и нарушениях обмена веществ. Кроме того, селен и селеноферменты, в которые он входит, имеют решающее значение для регуляции активности гормонов щитовидной железы. Это стало очевидным, когда у пациентов с мутациями в SECIS-связывающем белке была обнаружена задержка роста и притупленная реакция на гормоны щитовидной железы. И то, и другое можно объяснить присутствием Sec в дейодиназах. Дейодиназы представляют собой группу селеноферментов, которые отвечают за активацию и дезактивацию гормонов щитовидной железы на тканевом уровне.Гормоны щитовидной железы, как известно, играют центральную роль в развитии и играют ключевую роль в расходе энергии и метаболизме, а также, как недавно было обнаружено, играют решающую роль в стволовых клетках, регенерации и раке.
Как именно действуют дейодиназы, оставалось малоизученным, пока доктор Швейцер не объединился с кристаллографами белков, чтобы стать первой командой, решившей кристаллическую структуру одного из этих ферментов. Примечательно, что этот фермент напоминает древние ферменты, разлагающие перекись, и, должно быть, приобрел свою функцию, специфичную для позвоночных, после потери своей первоначальной функции.
Удивительный фенотип смещает акцент на развитие и дегенерацию нейронов
При защите докторской диссертации по другой теме доктор Швейцер обнаружил, что одна из созданных им мышей с нокаутом страдает эпилепсией, что дало ему понять, что селенопротеины могут иметь жизненно важное значение для работы мозга. . С тех пор доктор Швейцер и его исследователи приступили к проекту по исследованию роли селенопротеинов в функции нейронов, изучая, как они участвуют в неврологических заболеваниях.
По мере того, как функция селенопротеинов становится более понятной, вскоре будут обнаружены многие более редкие заболевания, вызванные дефицитом селенопротеинов.
До этого открытия лишь несколько более ранних отчетов подчеркивали потенциальную связь между эпилепсией и низким уровнем селена в крови. Тем не менее, в течение этого времени большинство функций селенопротеидов оставалось без категорий, и поэтому связь с селеноцистеином не проводилась. Профессор доктор Швейцер и его команда исследования с тех пор обнаружили, что селенопротеины необходимы для развития мозга, и им удалось разработать некоторые из конкретных механизмов, участвующих в этом процессе.Они идентифицировали специфический класс ГАМКергических интернейронов, дисфункция которых является фундаментальной для клинического проявления эпилепсии, обнаружив, что два селенопротеина неразрывно связаны с этим процессом.
Для этого профессор доктор Швейцер и его команда нарушили биосинтез нейронального селенопротеина на своих моделях мышей, удалив ген, кодирующий тРНК, необходимую для биосинтеза Sec. При специфической инактивации в нейронах исследователи обнаружили дефект развития, влияющий на определенную подгруппу тормозных интернейронов.Это обнаружило, что было не только сокращение интернейронов, но и мыши также страдали от судорог и атаксии, неспособности получить контроль над позой и неспособности координировать свои движения. Гистологический анализ ткани мозга мышей показал прогрессирующую нейродегенерацию, лежащую в основе этих фенотипов. Работа на других моделях мутантных мышей показала, что в этом процессе участвуют клеточная глутатионпероксидаза (GPX4) и цитозольная тиоредоксинредуктаза (TXRND1). Совсем недавно исследование доктора Швейцера показало, что мутации в гене TXNRD1 присутствуют у пациентов с генерализованной эпилепсией.
Более того, было обнаружено, что пациенты с врожденными мутациями в гене селеноцистеинсинтазы страдают сложным расстройством нервного развития и дегенеративным расстройством, которое включает широкий спектр признаков, включая микроцефалию, задержку интеллектуального и моторного развития, спастичность и эпилептические припадки. Недавно были идентифицированы пациенты, несущие очень легкие мутации в гене, объясняющие, почему они страдают только более низким IQ, но не страдают какой-либо нейродегенерацией.
Врожденные ошибки селенопротеинов связаны с широким спектром нарушений
Другие расстройства, помимо эпилепсии и нейродегенерации, также связаны с мутациями в генах селенопротеинов. Например, мутации в селенопротеине N (SEPN1) приводят к спектру мышечных расстройств, которые вместе известны как миопатия, связанная с SEPN1.
Вероятно, что по мере того, как функция селенопротеидов станет более понятной, вскоре будут раскрыты многие другие редкие заболевания, вызванные дефицитом селенопротеинов.Профессор доктор Швейцер и его команда надеются, что их исследования откроют новые возможности для диагностики и лечения нейродегенеративных заболеваний.
Аминокислотный дефицит — обзор
4.3.4 BNNT и аминокислоты
Аминокислоты являются биологически основными органическими соединениями. Глицин, например, необходим для создания белка в организме и для синтеза нуклеиновых кислот, желчных кислот и других важных биорелевантных веществ. Лизин необходим для роста и развития костей у детей, способствует усвоению кальция и поддерживает правильный баланс азота в организме.Кроме того, он необходим для выработки антител, гормонов, ферментов, образования коллагена, а также для восстановления тканей. Серин поддерживает функцию центральной нервной системы, а также общий метаболизм мозга. Эта важная аминокислота также способствует выработке иммуноглобулинов, что делает ее необходимой для функциональной иммунной системы. Глутаминовая кислота играет важную роль в метаболизме сахаров и жиров и помогает транспортировать калий в спинномозговую жидкость и через гематоэнцефалический барьер.Аминокислоты пролина, гидроксипролина и аргинина представляют собой единичные блоки длинных полипептидных цепей, которые самоорганизуются в многоступенчатом процессе с образованием коллагена, основного компонента соединительной ткани у животных и одного из наиболее распространенных белков у млекопитающих [89,90 ].
Дефицит аминокислот вызывает ряд болезненных состояний, дефицит питательных веществ, усталость, ускоренное старение и даже преждевременную смерть. Многие патологические состояния, такие как подавленная иммунная система, потеря веса, пролежни, диарея, депигментация волос и кожи и мышечная слабость, связаны с дефицитом аминокислот [91,92].Уникальная и важная роль аминокислот в организмах, а также важность патологий, связанных с дефицитом аминокислот, побудили провести значительные исследования систем доставки этих биомолекул, и BNNT представляют собой подходящего кандидата.
Фарманзаде и Газанфари [93] выполнили теоретическое исследование взаимодействия аминокислот коллагена с (5,5) и (9,0) BNNTs, при этом оба конца заканчиваются атомами водорода, используя вычисления методом DFT, реализованные в DMOL 3 программа.Было обнаружено, что функционализация BNNT глицином (Gly), пролином (Pro), гидроксипролином (Hyp) и аргинином (Arg) была энергетически выгодной как в газовой, так и в водной фазах. Аминокислотные комплексы BNNT / коллаген были термодинамически стабильными с энергиями взаимодействия в диапазоне от -0,49 до -1,89 эВ; Рис. 4.8 изображает все эти конфигурации. Следует отметить, что энергии сольватации ниже энергии функционализации указывают на стабилизацию комплексов аминокислот (5,5) / (9,0) BNNT / коллаген в воде.Более того, растворимость аминокислот коллагена увеличивалась в присутствии BNNT. Расчеты также показали, что растворимость аминокислотных комплексов (9,0) BNNT / коллаген выше, чем растворимость одного из аминокислотных комплексов (5,5) BNNT / коллаген. HLG для (5,5) / (9,0) BNNT и аминокислот коллагена указывает на то, что реакционная способность комплексов увеличивается с функционализацией. Эти результаты представляют собой важную отправную точку для определения потенциальных применений BNNT в качестве систем доставки лекарств.
Рисунок 4.8. Оптимизированная геометрия (a) Gly, (b) Pro, (c) Hyp, (d) Arg, (e) (5,5) BNNT, (f) (9,0) BNNT, (g) (5,5 ) Комплекс BNNT – Gly, (h) (9, 0) комплекс BNNT – Gly, (i) (5,5) комплекс BNNT – Pro, (j) (9,0) комплекс BNNT – Pro, (k) (5 , 5) комплекс BNNT – Hyp, (l) (9,0) комплекс BNNT – Hyp, (m) (5,5) комплекс BNNT – Arg, (n) (9,0) комплекс BNNT – Arg.
Печатается с разрешения [93]; авторское право (2014) Springer.В 2014 г. Фарманзаде и Газанфари [94] также исследовали взаимодействие между глутаминовой кислотой, лизином, глицином и серином разной полярности и (9,0) зигзагообразными БННТ разной длины в присутствии и в отсутствие внешнего электрического поля (EF ), в газовой фазе и в фазе растворителя, снова используя DFT.Они обнаружили, что энергии взаимодействия отрицательны в комплексе BNNT / аминокислоты в обеих фазах, что указывает на термодинамически стабильные комплексы. Полученные конфигурации взаимодействия изображены на рис. 4.9. Более того, эти авторы рассчитали значения энергии сольватации, и полученные результаты показали, что комплексы BNNT / аминокислота стабилизируются в присутствии растворителя и что растворимость глутаминовой кислоты, лизина, глицина и серина увеличивается в присутствии BNNT. .Подводя итог, можно сказать, что анализ функционализации BNNT рассматриваемыми аминокислотами может дать новое понимание развития BNNT как систем доставки лекарств для аминокислот в биологической среде.
Рисунок 4.9. Оптимизированная геометрия (a) Glu, (b) Lys, (c) Gly, (d) Ser, (e) BNNT 19 Å, (f) BNNT 22 Å, (g) BNNT 25 Å, (h) BNNT 19 Å — комплекс Glu, (i) BNNT 22 Å — комплекс Glu, (j) BNNT 25 Å — комплекс Glu, (k) BNNT 19 Å — комплекс Lys, (l) BNNT 22 Å — комплекс Lys, (м) BNNT 25 Å — Lys комплекс, (n) BNNT 19 Å — Gly комплекс, (o) BNNT 22 Å — Gly комплекс, (p) BNNT 25 Å — Gly комплекс, (q) BNNT 19 Å — Ser комплекс, (r) BNNT 22 Å — комплекс Ser, и (s) комплекс BNNT 25 Å — комплекс Ser.
Печатается с разрешения [94]; авторское право (2014) Elsevier.На следующем этапе те же исследователи исследовали процесс адсорбции в присутствии внешнего EF. Обнаружено, что разрыв ВЗМО-НСМО и потенциал ионизации комплексов BNNT / аминокислоты чувствительны к присутствию внешнего EF. Результаты показали, что рассматриваемые аминокислоты эффективно абсорбируются на поверхности BNNT, имеющих разную длину, а значения энергии взаимодействия в присутствии внешнего EF значительно увеличиваются, почти в 15 раз больше, чем в отсутствие EF.

 В. Чередниченко со студентами
В. Чередниченко со студентами
 Интеллектуальная игра «Что?Где?Когда?»
Интеллектуальная игра «Что?Где?Когда?»
 Общество. Медицина»
Общество. Медицина»
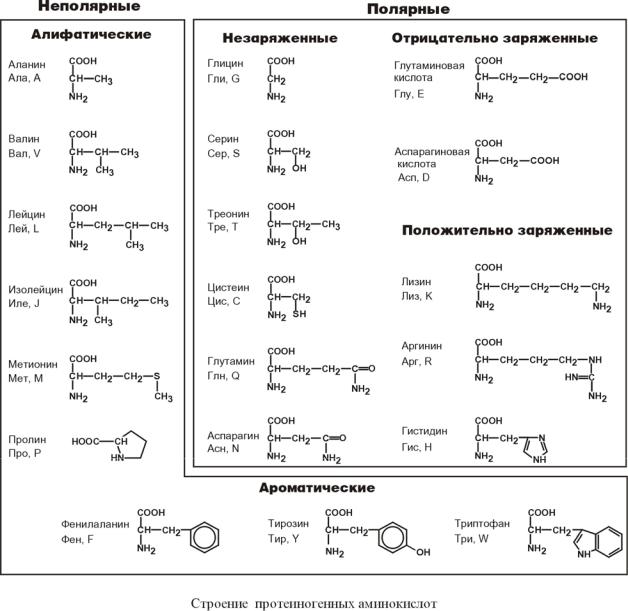 Барановичи)
Барановичи)
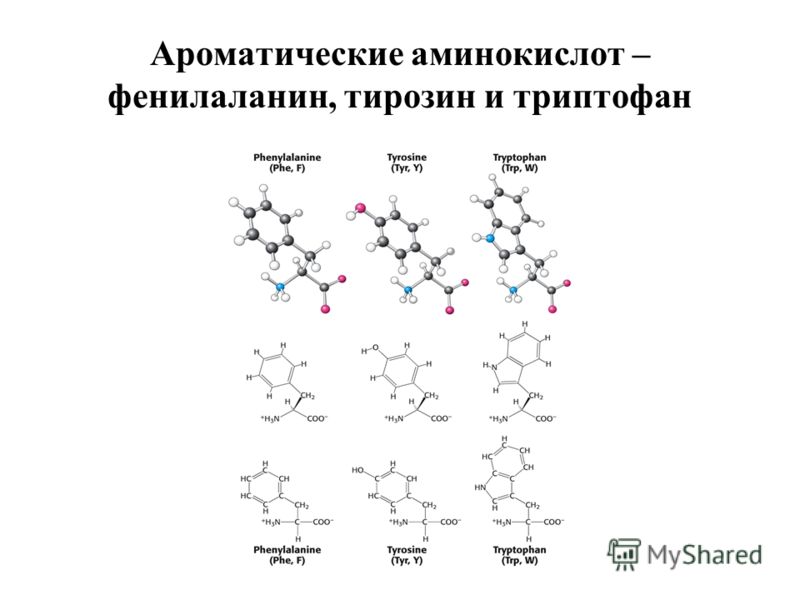
 10.2017
10.2017
 м.н. О.О. Руммо
м.н. О.О. Руммо
 Гродно
Гродно
 551 7.811 8.421 1.00 21.18 C
ATOM 7 ND1 HIS A 17 -13.731 7.137 8.194 1.00 28.94 N
ATOM 8 CD2 HIS A 17 -12.634 8.384 9.644 1.00 21.69 C
ATOM 9 CE1 HIS A 17 -14.492 7.301 9.267 1.00 27.01 C
ATOM 10 NE2 HIS A 17 -13.869 8.058 10.168 1.00 22.66 N
ATOM 11 N ILE A 18 -9.269 9.660 6.089 1.00 19.45 N
ATOM 12 CA ILE A 18 -7.910 9.377 5.605 1.00 18.67 C
ATOM 13 C ILE A 18 -7.122 8.759 6.749 1.00 16.24 C
ATOM 14 O ILE A 18 -7.425 8.919 7.929 1.00 18.80 O
ATOM 15 CB ILE A 18 -7.228 10.640 5.088 1.00 20.22 C
ATOM 16 CG1 ILE A 18 -7.062 11.686 6.183 1.00 18.52 C
ATOM 17 CG2 ILE A 18 -7.981 11.176 3.889 1.00 24.61 C
ATOM 18 CD1 ILE A 18 -6.161 12.824 5.749 1.00 28.
551 7.811 8.421 1.00 21.18 C
ATOM 7 ND1 HIS A 17 -13.731 7.137 8.194 1.00 28.94 N
ATOM 8 CD2 HIS A 17 -12.634 8.384 9.644 1.00 21.69 C
ATOM 9 CE1 HIS A 17 -14.492 7.301 9.267 1.00 27.01 C
ATOM 10 NE2 HIS A 17 -13.869 8.058 10.168 1.00 22.66 N
ATOM 11 N ILE A 18 -9.269 9.660 6.089 1.00 19.45 N
ATOM 12 CA ILE A 18 -7.910 9.377 5.605 1.00 18.67 C
ATOM 13 C ILE A 18 -7.122 8.759 6.749 1.00 16.24 C
ATOM 14 O ILE A 18 -7.425 8.919 7.929 1.00 18.80 O
ATOM 15 CB ILE A 18 -7.228 10.640 5.088 1.00 20.22 C
ATOM 16 CG1 ILE A 18 -7.062 11.686 6.183 1.00 18.52 C
ATOM 17 CG2 ILE A 18 -7.981 11.176 3.889 1.00 24.61 C
ATOM 18 CD1 ILE A 18 -6.161 12.824 5.749 1.00 28. 21 C
ATOM 19 N ASN A 19 -6.121 8.023 6.349 1.00 15.46 N
ATOM 20 CA ASN A 19 -5.239 7.306 7.243 1.00 14.34 C
ATOM 21 C ASN A 19 -4.012 8.178 7.507 1.00 14.83 C
ATOM 22 O ASN A 19 -3.431 8.715 6.575 1.00 18.03 O
ATOM 23 CB ASN A 19 -4.825 6.003 6.573 1.00 17.71 C
ATOM 24 CG ASN A 19 -6.062 5.099 6.413 1.00 21.26 C
ATOM 25 OD1 ASN A 19 -6.606 4.651 7.400 1.00 26.18 O
ATOM 26 ND2 ASN A 19 -6.320 4.899 5.151 1.00 31.73 N
21 C
ATOM 19 N ASN A 19 -6.121 8.023 6.349 1.00 15.46 N
ATOM 20 CA ASN A 19 -5.239 7.306 7.243 1.00 14.34 C
ATOM 21 C ASN A 19 -4.012 8.178 7.507 1.00 14.83 C
ATOM 22 O ASN A 19 -3.431 8.715 6.575 1.00 18.03 O
ATOM 23 CB ASN A 19 -4.825 6.003 6.573 1.00 17.71 C
ATOM 24 CG ASN A 19 -6.062 5.099 6.413 1.00 21.26 C
ATOM 25 OD1 ASN A 19 -6.606 4.651 7.400 1.00 26.18 O
ATOM 26 ND2 ASN A 19 -6.320 4.899 5.151 1.00 31.73 N