Аминокислоты основные: Продукция | Solgar
Незаменимые аминокислоты. Справка — РИА Новости, 28.02.2011
Валин необходим для метаболизма в мышцах, он активно участвует в процессах восстановления поврежденных тканей. Помимо этого, он может быть использован мышцами в качестве дополнительного источника энергии. Валином богаты зерновая пища, мясо, грибы, молочные продукты, а также арахис.
Лизин необходим для нормального формирования костей и роста детей, способствует усвоению кальция и поддержанию нормального обмена азота у взрослых. Лизин участвует в синтезе антител, гормонов, ферментов, формировании коллагена и восстановлении тканей. Пищевыми источниками лизина являются сыр, яйца, рыба, молоко, картофель, красное мясо, соевые и дрожжевые продукты.
Лейцин защищает мышечные ткани и может являться источником энергии. Его наличие способствует восстановлению костей, кожи, мышечной ткани. Снижает уровень холестерина. К пищевым источникам лейцина относятся бурый рис, бобовые, мясо, орехи.
Изолейцин необходим для синтеза гемоглобина, увеличивает выносливость и способствует восстановлению мышц. К пищевым источникам изолейцина относятся куриное мясо, кешью, яйца, рыба, чечевица, мясо, рожь, миндаль, нут (турецкий горох), печень, соя.
Треонин способствует поддержанию нормального белкового обмена в организме, помогая при этом работе печени. Необходим организму для правильной работы иммунной системы. Содержится в яйцах, молочных продуктах, бобах и орехах.
Метионин способствует нормальному пищеварению, сохранению здоровой печени, участвует в переработке жиров, защищает от воздействия радиации. Метионин содержится в бобовых, яйцах, чесноке, луке, йогурте мясе.
Фенилаланин является нейромедиатором для нервных клеток головного мозга. Эффективно помогает при депрессии, артрите, мигрени, ожирении. Не усваивается организмом, которому не хватает витамина С. Содержится в говядине, курином мясе, рыбе, соевых бобах, яйцах, твороге, молоке, а также является составной частью синтетического сахарозаменителя — аспартама.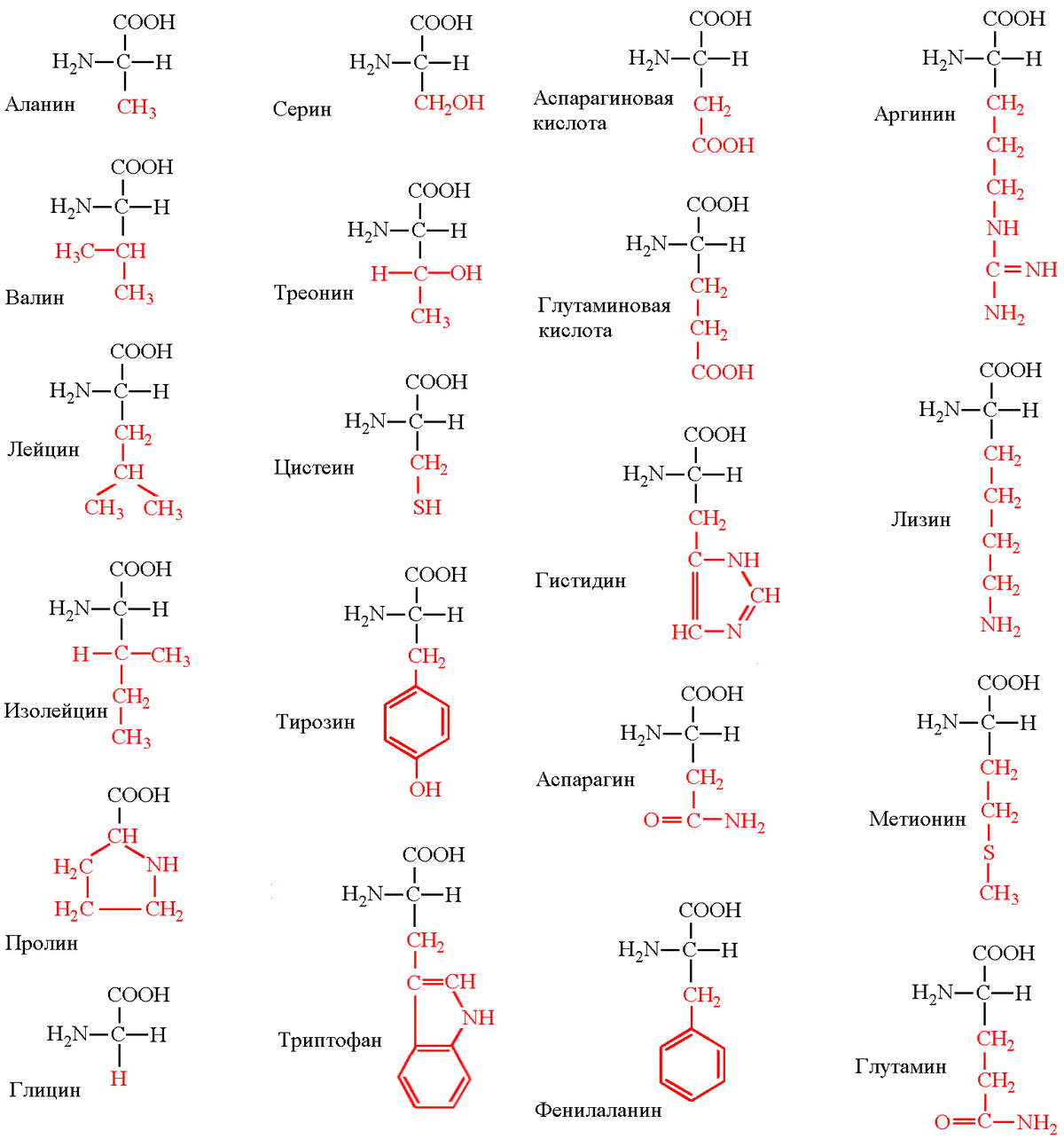
Триптофан используется организмом для синтеза в головном мозге серотонина, который в свою очередь является важнейшим нейромедиатором. Необходим при бессоннице, депрессии и для стабилизации настроения. Снижает вредное воздействие никотина. В пище эта аминокислота находится в буром рисе, деревенском сыре, мясе, бананах, йогурте, сушеных финиках, курице, кедровых орехах и арахисе.
Потребность человека в незаменимых аминокислотах составляет от 250 до 1100 миллиграммов в сутки. Существуют биологически активные добавки, содержащие необходимые дозы этих веществ. Особо внимание восполнению их в организме рекомендуется уделять вегетарианцам (поскольку некоторые незаменимые аминокислоты в необходимых количествах содержатся только в продуктах животного происхождения), беременным женщинам и спортсменам.
Материал подготовлен на основе информации открытых источников
Смотрите полный выпуск программы «Сытые и стройные» с Маргаритой Королевой: «Пища для мозга, или Что надо есть, чтобы ничего не забывать» >>
Классификация аминокислот | Химия онлайн
Аминокислоты классифицируют по следующим структурным признакам.
В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α- , b- , g- , d- , e- и т. д.
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы.
II. Классификация по строению бокового радикала (функциональным группам)Алифатические аминокислоты
Моноаминомонокарбоновые кислоты: глицин, аланин, валин, изолейцин, лейцин.
Оксимоноаминокарбоновые кислоты (содержат-ОН-группу): серин, треонин.
Моноаминодикарбоновые кислоты (содержат СООН-группу): аспартат, глутамат (за счёт второй карбоксильной группы несут в растворе отрицательный заряд).
Амиды моноаминодикарбоновых кислоты (содержат NH2СО-группу): аспарагин, глутамин.
Диаминомонокарбоновые кислоты (содержат NH2-группу): лизин, аргинин (за счёт второй аминогруппы несут в растворе положительный заряд).
Серусодержащие кислоты: цистеин, метионин.
Ароматические аминокислоты: фенилаланин, тирозин, триптофан.
Гетероциклические аминокислоты: триптофан, гистидин, пролин.
Иминокислоты: пролин.
Важнейшие α–аминокислоты
III. Классификация по полярности бокового радикала (по Ленинджеру)Выделяют четыре класса аминокислот, содержащих радикалы следующих типов.
Гидрофобные аминокислоты располагаются внутри молекулы белка, тогда как гидрофильные – на внешней поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка.
Благодаря этому свойству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток.
1. Неполярные (гидрофобные)
К неполярным (гидрофобным) относятся аминокислоты с неполярными R-группами и одна серусодержащая аминокислота:
— алифатические: аланин, валин, лейцин, изолейцин
— ароматические: фенилаланин, триптофан.
— серусодержащие: метионин
— иминокислота: пролин.
2. Полярные незаряженные
Полярные незаряженные аминокислоты по сравнению с неполярными лучше растворяются в воде, более гидрофильны, так как их функциональные группы образуют водородные связи с молекулами воды.
К ним относятся аминокислоты, содержащие:
— полярную ОН-группу (оксиаминокислоты): серин, треонин и тирозин
— HS-группу: цистеин
— амидную группу: глутамин, аспарагин
— и глицин (R-группа глицина, представленная одним атомом водорода, слишком мала, чтобы компенсировать сильную полярность a-аминогруппы и a-карбоксильной группы).
3.
Аспарагиновая и глутаминовая кислоты относятся к отрицательно заряженным аминокислотам.
Они содержат по две карбоксильные и по одной аминогруппе, поэтому в ионизированном состоянии их молекулы будут иметь суммарный отрицательный заряд:
4. Заряженные положительно при рН-7 (основные)
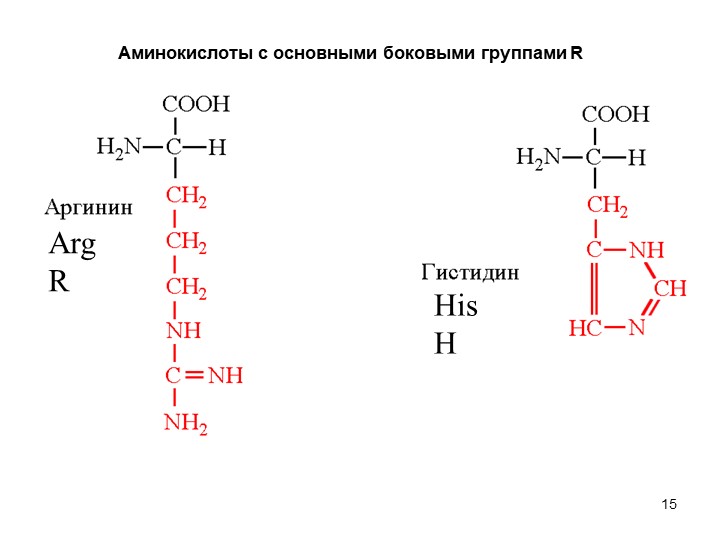
К положительно заряженным аминокислотам принадлежат лизин, гистидин и аргинин.
В ионизированном виде они имеют суммарный положительный заряд:
В зависимости от характера радикалов природные аминокислоты также подразделяются на
В зависимости от количества функциональных групп различают кислые, нейтральные и основные аминокислоты.
Основные
Аминокислоты, в которых число аминогрупп превышает число карбоксильных групп, называют основными аминокислотами: лизин, аргинин, гистидин:
Кислые
Если в аминокислотах имеется избыток кислотных групп, их называют кислыми аминокислотами: аспарагиновая и глутаминовая кислоты:
Все остальные аминокислоты относятся к нейтральным.
V. По числу функциональных группАминокислоты по числу функциональных групп можно разделить моноаминомонокарбоновые, моноаминодикарбоновые, диаминомонокарбоновые:
VI.Биологическая классификация (по способности синтезироваться в организме человека и животных)
Заменимые аминокислоты – десять из 20 аминокислот, входящих в состав белков, могут синтезироваться в организме человека. К ним относятся: глицин (гликокол), аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты, аспарагин, глутамин, пролин.
К ним относятся: глицин (гликокол), аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты, аспарагин, глутамин, пролин.
Незаменимые аминокислоты (8 аминокислот) – не могут синтезироваться в организме человека и животных и должны поступать в организм в составе белковой пищи.
Абсолютно незаменимых аминокислот восемь: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
Незаменимые аминокислоты входят часто в состав пищевых добавок, используются в качестве лекарственных препаратов.
Условно незаменимые (2 аминокислоты) — синтезируются в организме, но в недостаточном количестве, поэтому частично должны поступать с пищей. Такими аминокислотами являются
Для детей также незаменимыми являются гистидин и аргинин.
Для человека одинаково важны оба типа аминокислот: и заменимые, и незаменимые. Большая часть аминокислот идет на построение собственных белков организма, но без незаменимых аминокислот организм существовать не сможет.
При недостатке каких-либо аминокислот в организме человека в течение непродолжительного времени могут разрушаться белки соединительной ткани, крови, печени и мышц, а полученный из них «строительный материал» — аминокислоты идут на поддержание нормальной работы наиболее важных органов — сердца и мозга.
Дефицит аминокислот приводит к ухудшению аппетита, задержке роста и развития, жировой дистрофии печени и другим тяжелым нарушениям.
При этом наблюдается снижение аппетита, ухудшение состояния кожи, выпадение волос, мышечная слабость, быстрая утомляемость, снижение иммунитета, анемия.
Избыток аминокислот может вызвать развитие тяжелых заболеваний, особенно у детей и в юношеском возрасте. Наиболее токсичными являются метионин (провоцирует риск развития инфаркта и инсульта), тирозин (может спровоцировать развитие артериальной гипертонии, привести к нарушению работы щитовидной железы) и гистидин (может способствовать возникновению дефицита меди в организме и привести к заболеваниям суставов, ранней седине, тяжелым анемиям).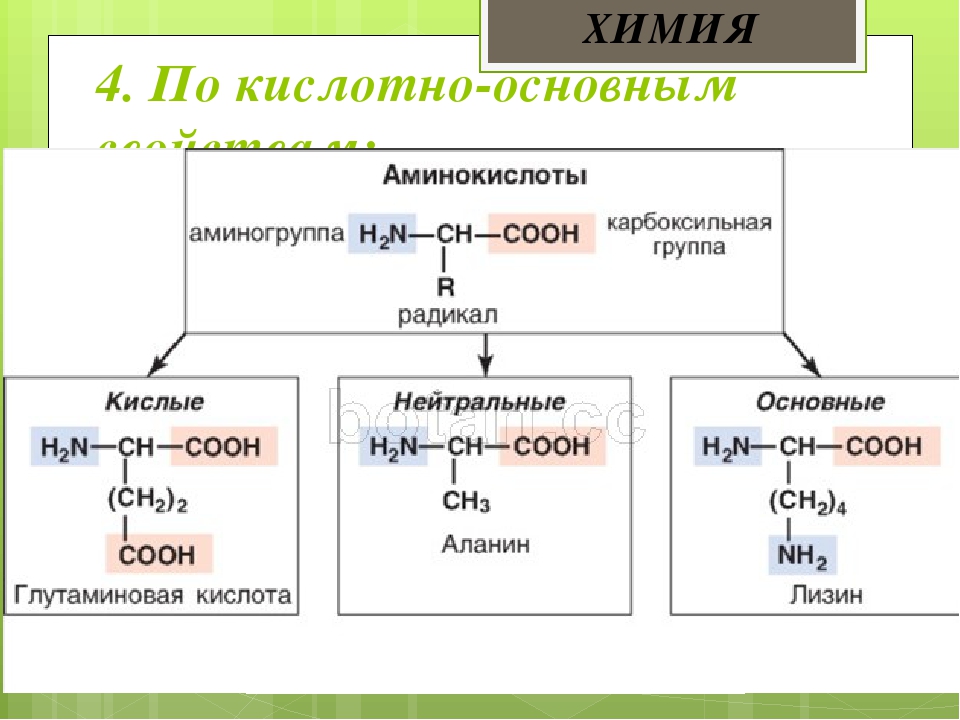
В условиях нормального функционирования организма, когда присутствует достаточное количество витаминов (В6, В12, фолиевой кислоты) и антиоксидантов (витамины А, Е, С и селен), избыток аминокислот не наносит вред организму.
Продукты с повышенным содержанием отдельных незаменимых аминокислот
Качество некоторых пищевых белков относительно белков женского молока
Аминокислоты
Aминокислоты — урок. Химия, 8–9 класс.
Аминокислоты — это органические вещества, в молекулах которых содержатся две функциональные группы: карбоксильная −COOH и аминогруппа −Nh3.
Состав аминокислот можно выразить формулой:
Примеры аминокислот
Аминокислоты — это производные карбоновых кислот, в молекулах которых вместо атома водорода содержится аминогруппа.
Самая простая аминокислота — аминоуксусная, или глицин .
Гомологом глицина является аланин.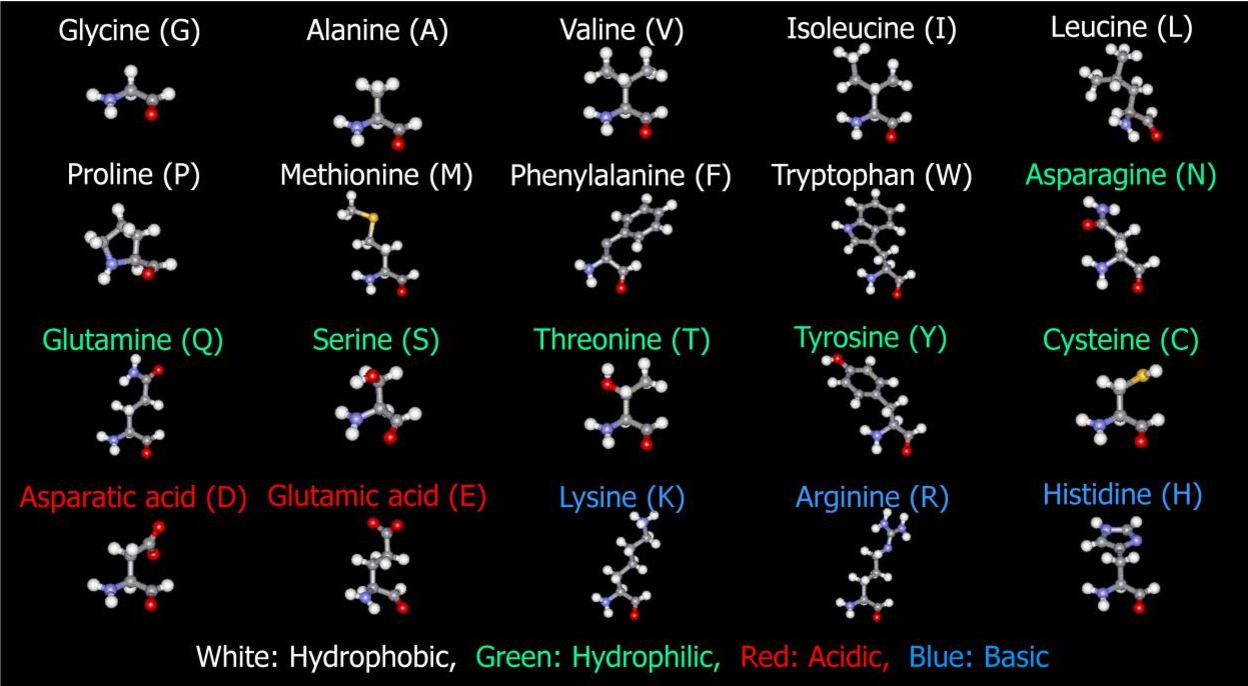 Его формулу можно записать следующим образом:
Его формулу можно записать следующим образом:
Аминокислоты могут содержать в радикале разные группы атомов. Так, в молекуле фенилаланина содержится бензольное кольцо. Его структурная формула:
В молекуле серина содержится гидроксильная группа:
В состав аминокислот могут также входить атомы некоторых элементов. Например, в молекуле цистеина содержится атом серы. Формула цистеина может быть представлена следующим образом:
Физические свойства
Аминокислоты — кристаллические вещества, хорошо растворимые в воде. Они могут быть сладкие, безвкусные и даже горькие. Температуры плавления всех аминокислот выше \(22\) °С.Химические свойства
Функциональные группы определяют химические свойства аминокислот: карбоксильная — кислотные, а аминогруппа — основные. Основность аминогруппы связана со способностью атома азота присоединять к себе протоны водорода за счёт свободной электронной пары:
−N. .h3+H+→−Nh4+.
.h3+H+→−Nh4+.
Аминокислоты способны реагировать как с кислотами, так и с основаниями с образованием солей:
Аминокислоты — амфотерные органические соединения, имеющие одновременно кислотные и основные свойства.
Благодаря наличию двух функциональных групп аминокислоты способны взаимодействовать друг с другом и соединяться в более сложные вещества — пептиды:
При взаимодействии аминокислот образуются молекулы полимера (полипептида) и воды.
Реакция образования полимера, сопровождающаяся выделением низкомолекулярного вещества, называется реакцией поликонденсации.
При взаимодействии молекул аминокислот между их остатками возникает связь, которая называется пептидной связью.Пептидная связь — связь, возникающая между остатком аминогруппы одной молекулы аминокислоты и остатком карбоксильной группы другой молекулы аминокислоты −NH−CO− в полипептидах.
Применение аминокислот
Аминокислоты используются как лекарства. В сельском хозяйстве их применяют для подкормки животных. Некоторые аминокислоты служат исходными веществами для синтеза полимеров (например, капрона).
В сельском хозяйстве их применяют для подкормки животных. Некоторые аминокислоты служат исходными веществами для синтеза полимеров (например, капрона).Аминокислоты основные — Справочник химика 21
Пиридоксальфосфат является коферментной формой витамина В ,, входит в состав ферментов, катализирую-ш,их превраш,ения а-аминокислот, основным из которых можно считать реакцию переаминирования. [c.278] Попытки использования оксиаминокислот более подробно описаны в следующем разделе. Как указывалось выше, расщепление аминокислот основного характера проводилось только при действии трипсина (см. стр. 179—198). Известны работы, посвященные селективному расщеплению пептидных связей в ароматических аминокислотах путем облучения белка светом соответствующей длины волны. В большинстве случаев исследования имели эмпирический характер и предпринимались главным образом с целью изменения свойств белков, часто обладающих ферментативными или иммунологи- [c. 215]
215]
С-Концы пептидных цепей определяются избирательным отщепле нием концевой аминокислоты с помощью специфического фермента — карбоксипептидазы и последующей идентификацией этой аминокислоты. Если макромолекула белка состоит из двух (или более) пептидных цепей, как в случае инсулина (см. рис. 53), то избирательно разрушают дисульфидные мостики окислением (например, надмуравьиной кислотой) и затем полученные полипептиды разделяют путем фракционирования на ионитах. Для определения последовательности расположения аминокислот в каждой полипептидной цепи ее подвергают частичному кислотному гидролизу и избирательному расщеплению с помощью ферментов, каждый из которых разрывает полипептидную цепь только в определенных местах присоединения какой-то одной определенной аминокислоты или одного типа аминокислот (основных, ароматических). Таким образом получают несколько наборов пептидов, которые разделяют, используя методы хроматографии и электрофореза.
 [c.376]
[c.376]Аминокислоты основного характера. Если обе аминогруппы лизина защищены, то не встречается затруднений при конденсации лизина через стадию смешанного ангидрида с другими аминокислотами. Применение а-М-карбобензилокси-ш-бензил- [c.188]
Желатин представляет собой продукт частичного гидролиза коллагена — распространенного в природе вещества белковой природы, образующего главную составную часть соединительной ткани позвоночных (прежде всего в коже, костях, сухожилиях, рогах, копытах). В основе его молекулы лежит полипептидная цепь, образуемая 19-ю аминокислотами, основными из которых являются глицин (до 30 %), а также аланин, пролин, гидроксипролин, глутамин [29]. [c.453]
Кислые и нейтральные аминокислоты Основные аминокислоты [c.153]
В пятой работе рассматриваются электрохимические методы синтеза аминокислот. Основное внимание уделено получению аминокислот из эфиров нитрокарбоновых жислот. Описано также электровосстановление нитропроизводных ароматических карбоновых и сульфокислот с целью получения соответствующих аминопроизводных. [c.4]
Описано также электровосстановление нитропроизводных ароматических карбоновых и сульфокислот с целью получения соответствующих аминопроизводных. [c.4]
Карбонил-6ис-(эфир аминокислоты) Основной тип иссле- [c.99]
Подкисленный уксусной кислотой водный раствор аминокислот пропускают сначала через активированный уголь, который задерживает аминокислоты, содержащие ароматическое ядро. Затем раствор пропускают через катионит с активными группами —СООН, который задерживает аминокислоты основного характера. Из оставшейся в растворе смеси аминокислот нейтрального и кислотного характера последние извлекаются анионитом с активными группами —НН2, тогда как катионит с группами [c.236]
В организме человека белки расщепляются до аминокислот, часть из них (заменимые) являются строительным материалом для создания новых аминокислот, однако имеется 8 аминокислот (незаменимые, эссенциальные), которые не образуются в организме взрослого человека, они должны поступать с пищей.
 Снабжение организма человека необходимым количеством аминокислот — основная функция белка в питании. В белке пищи должен быть сбалансирован не только состав незаменимых аминокислот, но и должно быть определенное соотношение незаменимых и заменимых аминокислот, в противном случае часть незаменимых будет расходоваться не по назначению. [c.18]
Снабжение организма человека необходимым количеством аминокислот — основная функция белка в питании. В белке пищи должен быть сбалансирован не только состав незаменимых аминокислот, но и должно быть определенное соотношение незаменимых и заменимых аминокислот, в противном случае часть незаменимых будет расходоваться не по назначению. [c.18]Углеводы + Аминокислоты Основной путь Нуклеотиды- ДНК [c.576]
Аминокислоты — основные структурные единицы, из которых построены молекулы всех белковых веществ. Что же представляют собой эти структурные единицы белков [c.184]
Транспорт аминокислот через клеточные мембраны осуществляется в основном по механизму вторично-активного транспорта. В этом случае система активного транспорта приводится в действие не путем прямого гидролиза АТФ, а за счет энергии, запасенной в ионных градиентах. Перенос аминокислот внутрь клеток осуществляется чаще всего как симпорт аминокислот и ионов натрия, подобно механизму симпорта сахаров и ионов натрия. Энергия АТФ затрачивается на выкачивание Ка /К -АТФ-азой ионов натрия из клетки, создания электрохимического градиента на мембране, энергия которого опосредованно обеспечивает транспорт аминокислот в клетку. Известен ряд сходных по строению транспортных систем (транслоказ), специфичных к транспорту аминокислот нейтральных аминокислот с небольшой боковой цепью, нейтральных аминокислот с объемным боковым радикалом кислых аминокислот, основных аминокислот, пролина. Эти системы, связывая ионы натрия, индуцируют переход белка-переносчика в состояние с сильно увеличенным сродством к аминокислоте Ка» стремится к транспорту в клетку по градиенту концентрации и одновременно переносит внутрь клетки молекулы аминокислоты. Чем выще градиент Na , тем выше скорость всасывания аминокислот, которые конкурируют друг с другом за соответствующие участки связывания в транслоказе. [c.366]
Энергия АТФ затрачивается на выкачивание Ка /К -АТФ-азой ионов натрия из клетки, создания электрохимического градиента на мембране, энергия которого опосредованно обеспечивает транспорт аминокислот в клетку. Известен ряд сходных по строению транспортных систем (транслоказ), специфичных к транспорту аминокислот нейтральных аминокислот с небольшой боковой цепью, нейтральных аминокислот с объемным боковым радикалом кислых аминокислот, основных аминокислот, пролина. Эти системы, связывая ионы натрия, индуцируют переход белка-переносчика в состояние с сильно увеличенным сродством к аминокислоте Ка» стремится к транспорту в клетку по градиенту концентрации и одновременно переносит внутрь клетки молекулы аминокислоты. Чем выще градиент Na , тем выше скорость всасывания аминокислот, которые конкурируют друг с другом за соответствующие участки связывания в транслоказе. [c.366]
Характеристика буферного раствора Короткая колонка для аминокислот основного анализа характера Длинная колонка для анализа аминокислот нейтрального и кислотного характера [c. 307]
307]
В этой главе мы познакомились с каноническими аминокислотами, основными строительными блоками белка, которые являются частью основной схемы организации всех организмов. Исходя из аминокислот, можно объяснить некоторые аспекты этой универсальной схемы. Однако потребуется еще много времени, чтобы понять, почему была развита именно эта схема. Каждый аминокислотный остаток обладает уникальными свойствами и выполня- т вполне определенную роль в данном месте белковой молекулы. Несмотря на это в ходе белковой эволюции происходили и происходят некоторые замены. Анализ частоты замен позволяет выявить аналогию среди аминокислот и подразделить все аминокислотные остатки на четыре основные группы. [c.25]
ТЫ — аминокислоты, которые не синтезируются в организме. Содержание их в пищевых продуктах необходимо для роста, развития и поддержания нормального физиологического состояния человека, животных и некоторых микроорганизмов. Аминокислоты, которые могут синтезироваться в организме, называются заменимыми аминокислотами. Основным источником аминокислот являются белки, которые расщепляются в н елу-дочно-кишечном тракте до аминокислот. Белки, в состав которых входят все Н. а., называются полноценными белки, которые не содержат хотя бы одну из незаменимых аминокислот, являются неполноценными. Н. а. богаты животные белки — молоко, мясо. Н. а. для человека и всех животных являются восемь аминокислот лизин, треонин, триптофан, метионин, фенилаланин, лейцин, валии, изолейцин. Для роста молодых крыс, кроме того, необходим еще аргинин для роста цыплят необходимо до 15 аминокислот. Г1ри отсутствии в организме (пище) отдельных Н. а. могут развиваться некоторые заболевания, например, при отсутствии триптофана развивается катаракта. [c.171]
Основным источником аминокислот являются белки, которые расщепляются в н елу-дочно-кишечном тракте до аминокислот. Белки, в состав которых входят все Н. а., называются полноценными белки, которые не содержат хотя бы одну из незаменимых аминокислот, являются неполноценными. Н. а. богаты животные белки — молоко, мясо. Н. а. для человека и всех животных являются восемь аминокислот лизин, треонин, триптофан, метионин, фенилаланин, лейцин, валии, изолейцин. Для роста молодых крыс, кроме того, необходим еще аргинин для роста цыплят необходимо до 15 аминокислот. Г1ри отсутствии в организме (пище) отдельных Н. а. могут развиваться некоторые заболевания, например, при отсутствии триптофана развивается катаракта. [c.171]
Жирные кислоты, содержащие аминные группы, или их производные (аминокислоты) — основные единицы, из которых строятся белки и более простые пептиды, например гормоны и антибиотики, нередко несущие важные биологические функции. Простейшая аминокислота — глицин, или аминоуксусная кислота (2-амино-уксусная кислота) КНа—СНа—СООН. Молекула глицина включает кислую (—СООН) и основную (—ЫНа) группы. Такие вещества называются амфотерными электролитами (амфолитами). Интересно определить условия, в которых проявляются кислые или основные функции аминокислоты. В сильнокислой среде глицин существует в виде МНз—СНа—СООН. При pH 2 от этой частицы отщепляется один ион водорода. Образующая- [c.62]
Молекула глицина включает кислую (—СООН) и основную (—ЫНа) группы. Такие вещества называются амфотерными электролитами (амфолитами). Интересно определить условия, в которых проявляются кислые или основные функции аминокислоты. В сильнокислой среде глицин существует в виде МНз—СНа—СООН. При pH 2 от этой частицы отщепляется один ион водорода. Образующая- [c.62]
Наличие свободных аминогрупп в белковых волокнах объясняется присутствием в их составе аминокислот основного характера, имеющих более одной аминогруппы. Точно так же свободные карбоксильные группы в белковых волокнах являются следствием присутствия аминокислот, имеющих две карбоксильные группы. Если молекула белка состоит исключительно из остатков одноосновных аминокислот, таких как глицин или а-аланин, ее цепь должна быть построена следующим образом [c.96]
Волокна из белков, содержащих повышенное количество аминокислот основного или кислотного характера, более гидрофильны, более чувствительны к действию воды (сильнее набухают и в большей степени теряют прочность в мокром состоянии) и обладают меньшей химической стойкостью.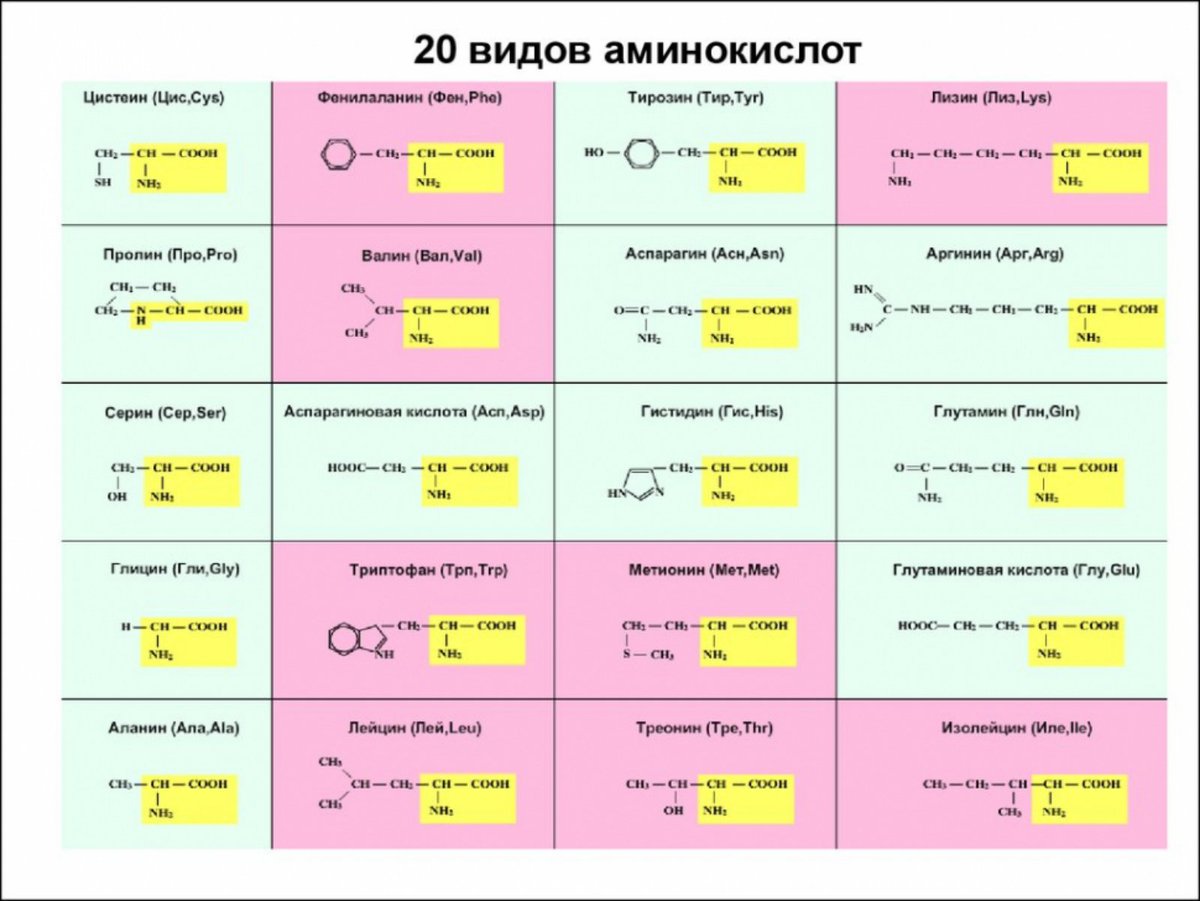 Данные об аминокислотном составе некоторых белков приведены в табл. 11. [c.99]
Данные об аминокислотном составе некоторых белков приведены в табл. 11. [c.99]
В качестве объектов исследований были выбраны аминокислоты и пептиды, образованные из этих аминокислот. Основная задача работы — выявить в проду ктах пиролиза различия, которые появляются при объединении аминокислот в пептиды. Кроме того, были изучены продукты пиролиза белков с целью установления различий, которые возникают при термической деструкции длинных цепей аминокислот. [c.49]
Субтилизин прежде всего расщепляет связи по соседству с сернном, глицином и ароматическими аминокислотами. Эластаза менее специфична и преимущественно гидролизует связи нейтральных аминокислот. Основными точками воздействия малоспецифичного папаина являются остатки аргинина, лизина и глицина, кислые аминокислоты не затрагиваются. Термолизин предпочтительно расщепляет полипептидную цепь по аминокислотным остаткам с гидрофобной боковой цепью. [c.365]
Вазопрессин. Вазопрессин содержит одну аминокислоту основного характера, которая в вазопрессине быка (XII) представляет собой аргинин, а в гормоне свиньи — лизин. Трипсин в обоих случаях вызывает выделение глициламида [83]. Некоторый интерес представляет тот факт, что в вазо- [c.187]
Вазопрессин содержит одну аминокислоту основного характера, которая в вазопрессине быка (XII) представляет собой аргинин, а в гормоне свиньи — лизин. Трипсин в обоих случаях вызывает выделение глициламида [83]. Некоторый интерес представляет тот факт, что в вазо- [c.187]
Белки, внутримолекулярные связи. Белковая молекула представляет собой полимер, состоящий из ковалентно связанных остатков аминокислот. Основная связь — пептидная (амидная). Некоторые участки могут быть связаны ковалентной дисуль-фидной связью (—8—5—). которая образуется при окислении 5Л-групп двух остатков цистенна. [c.12]
В зависимости от строения радикала К аминокислоты подразделяют на следующие группы (табл. 3.3.1) алифатические аминокислоты, алифатические оксиаминокислоты, серусодержащие аминокислоты, дикарбоновые аминокислоты (аминокислоты кислотного характера), диаминокарбоновые кислоты (аминокислоты основного характера), жирио-ароматические аминокислоты, гетероциклические аминокислоты и ими-покислоты.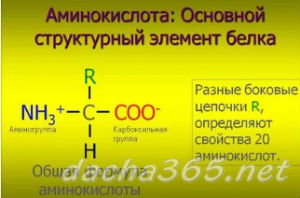 [c.650]
[c.650]
Другие аминокислоты основного типа хорошо десорбируются с активированного угля 10%-ным раствором уксусной кислоты при температуре 40—45 °С. Перед их выделением осветленный гидролизат освобождается от ионов хлора на среднеосновном анионите ЭДЭ-10П в ОН-форме. При этом на смоле анионита сорбируются в большом количестве глютаминовая и аспарагиновая кислоты, которые легко снимаются с ионита при регенерации его щелочью. [c.180]
Белки в пробе можно коагулировать, например нагреванием. Липиды, воски, парафины и другие липофильные соединения удается отделить от гидрофильных компонентов методом экстракционного разделения между фазами петролейного эфира и водных спиртов (например, 60- и 95%-ного метанола в зависимости от природы веществ) в одной делительной воронке или в нескольких, применяя метод противоточного распределения. Различные виды аминокислот (основные, кислые и нейтральные) можно предварительно разделить посредством электрофореза на бумаге или в геле. Для отделения различных органических кислот и ряда соединений типа фенолов от сахароподобных веществ пригодны даже такие старые методы, как осаждение ацетатом свинца, основным ацетатом свинца и т. п. Некоторые группы алкалоидов можно высадить из экстрактов с помощью специфических реагентов, а затем выделить их. В тех случаях, когда представляют интерес органические вещества средней полярности, можно иногда очистить пробу непосредственно на бумаге, на которой должен проводиться хроматографический анализ. Неочищенную пробу хроматографируют сначала чистым петролейным эфиром (иногда несколько раз), липиды при этом перемещаются вместе с фронтом растворителя. Далее хроматограмму сущат, после этого можно хроматографировать пробу еще раз чистой водой, если целевое вещество полностью нерастворимо в ней. Вода вымывает из пробы соли, сахара, аминокислоты и т. д., которые перемещаются вместе с фронтом элюента или вблизи него. В заключение пробу хроматографируют специально подобранным элюентом, следя при этом, чтобы фронт растворителя не продвинулся на такое же расстояние, как при предыдущих операциях по очистке.
Для отделения различных органических кислот и ряда соединений типа фенолов от сахароподобных веществ пригодны даже такие старые методы, как осаждение ацетатом свинца, основным ацетатом свинца и т. п. Некоторые группы алкалоидов можно высадить из экстрактов с помощью специфических реагентов, а затем выделить их. В тех случаях, когда представляют интерес органические вещества средней полярности, можно иногда очистить пробу непосредственно на бумаге, на которой должен проводиться хроматографический анализ. Неочищенную пробу хроматографируют сначала чистым петролейным эфиром (иногда несколько раз), липиды при этом перемещаются вместе с фронтом растворителя. Далее хроматограмму сущат, после этого можно хроматографировать пробу еще раз чистой водой, если целевое вещество полностью нерастворимо в ней. Вода вымывает из пробы соли, сахара, аминокислоты и т. д., которые перемещаются вместе с фронтом элюента или вблизи него. В заключение пробу хроматографируют специально подобранным элюентом, следя при этом, чтобы фронт растворителя не продвинулся на такое же расстояние, как при предыдущих операциях по очистке.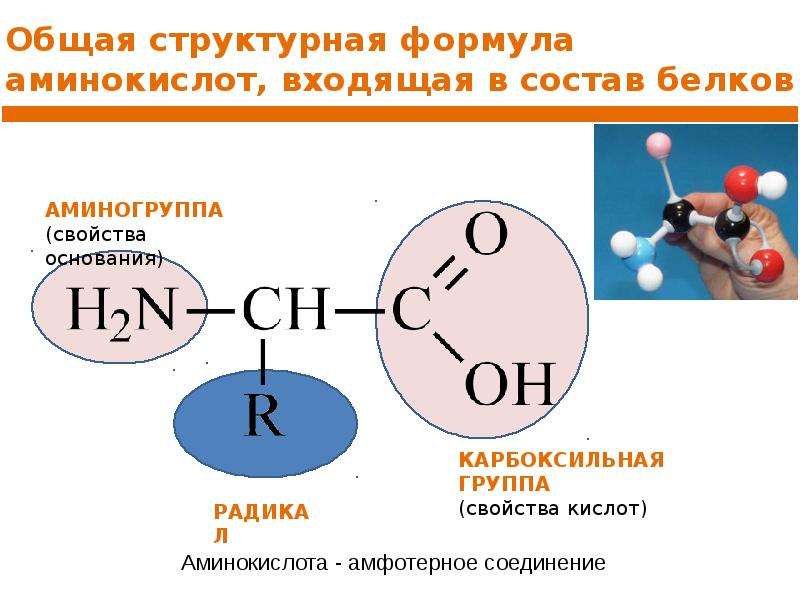 [c.88]
[c.88]
Во всех жидкостях, полученных путем дрожжевого брожения, содержатся сивушные масла пропанол, 2-бутанол, 2-метилпропанол, амиловый (пентанол) и изоамиловый (триметилбутанол) спирты. Они представляют собой продукты нормального бродильного метаболизма дрожжей и обнаруживаются не только при их росте в сложных питательных растворах, содержащих аминокислоты. Основными компонентами сивушного масла являются побочные продукты обмена изолейцина, лрйцина и валина. [c.271]
Продукты реакции, конечно, одни и те же как при одном, так и при другом написании формулы нейтральной аминокислоты, так как нет никакого сомнения, что в кислом растворе аминокислота образует ионы +Nh4 h3 O2H, в то время как в щелочном растворе образуются анионы Nh3 h3 O2. Следует, однако, подчеркнуть, что группы, обусловливающие кислотные и основные свойства, прямо противоположны группам, которым эти свойства приписывались в первоначальных представлениях об аминокислотах. Основные свойства амфолита обусловлены группой — СО2, в то время как кислотные свойства обусловлены группой — Nh4. [c.554]
Основные свойства амфолита обусловлены группой — СО2, в то время как кислотные свойства обусловлены группой — Nh4. [c.554]
В то же время при физиологическом значении pH активность оксидазы Ь-аминокислот довольно низкая. Так, при рН=7,0 она равняется 0,1 активности, наблюдаемой при оптимальном pH. Эти данные, а также и некоторые другие не позволяют приписать оксидазе аминокислот основную роль в физиологических механизмах дезаминирования Ь-аминокислот. Эйлеру удалось показать, что в тканях имеется активная в физиологических условиях дегидрогеназа, специфически дезаминирующая Ь-глютаминовую кислоту, количественно расщепляя ее на кетоглютаровую кислоту и ЫНз. Эта глютамикодегидрогеназа весьма распространена и содержится во многих тканях (печени, почках, мозгу и др.) и легко оттуда извлекается. [c.331]
Полиамиды получаются путем поликонденсации диаминов с дикарбоно-выми кислотами, полимеризацией лактамов, поликонденсацией аминокислот, а также совместной поликонденсацией смеси диаминов и дикарбоновых кислот с лактамами и аминокислотами. Основным сырьем для получения полиамидов является гексаметилендиамин, адипиновая кислота, себациновая кислота, е-капролактам, б-аминокапооновая кислота и ш-аминоундекановая кислота. [c.309]
Основным сырьем для получения полиамидов является гексаметилендиамин, адипиновая кислота, себациновая кислота, е-капролактам, б-аминокапооновая кислота и ш-аминоундекановая кислота. [c.309]
Особенности химических свойств аминокислот обусловлены сочетанием аминной Nh3 и карбоксильной СООН группами. Как видно, у аминокислот основные и кислотные свойства представлены разными группами атомов, поэтому их молекулы могут реагировать между собой [c.309]
Этот процесс был описан в многочисленных статьях и патентах [19, 20, 22 — 27]. При этом процессе применяется метод, названный Тизелиусом [10] и Елессоном [28] вытеснительным про-яв.зением и фронтальным анализом . Протеиновый гидролизат фильтруется сверху вниз через колонну, снаряженную катионитом в И- или МП -форме, до тех пор, пока в фильтрате не обнаруживаются основные аминокислоты. Хотя в начальной стадии на Н-ка- j HOHHTe адсорбируются все аминокислоты, а на Nh5-KaTHonnTe — многие из них, в процессе дальнейшего фильтрования они постепенно вытесняются аминокислотами основного характера, которые адсорбируются ионитом более прочно в конце фильтрования 70—80% всего связанного ионитом азота содержится в виде аргинина, гистидина и лизина. [c.305]
[c.305]
20 основных аминокислот с химическими формулами
Определение 1Аминокислоты (АМК, аминокорбоновые кислоты, пептиды) — органические соединения на основе аминов, под которыми подразумеваются производные аммония 16%.
Из чего состоят заменимые и незаменимые аминокислоты
Аминокислоты играют важную роль — принимают участие в биосинтезе белка. Расщепление белка на аминокислоты происходит в желудочно-кишечном тракте человека. Сколько существует аминокислот? Сегодня известно около двухсот пептидов, но всего 20 аминокислот принимают участие в строительстве биологического организма. Поэтому если перед вами стоит вопрос, как запомнить аминокислоты, не стоит паниковать: нужно запомнить всего 20.
Есть заменимые и незаменимые аминокислоты. Также некоторые выделяют условно заменимые аминокислоты.
Заменимые аминокислоты
Определение 2Заменимые аминокислоты — те аминокислоты, которые попадают в организм человека вместе с продуктами питания.
В самом человеке они тоже могут производиться — из прочих веществ.
Среди таких аминокислот выделяются:
- аланин. Это мономер белков. Он принимает участие в процессе глюкогенеза, становясь глюкозой в человеческой печени. Отвечает за регулирование метаболических процессов;
- аргинин. Синтезируется только в организме взрослых людей — в организме детей образоваться не может. Играет важную роль, к примеру, в системе синтеза гормона роста. Единственная аминокислота, переносящая азот. С ее помощью увеличивается мышечная масса и снижается жировая;
- аспарагин. Является пептидом азотного обмена. Действуя с ферментами, отщепляет аммониак и преобразуется в аспарагиновую кислоту;
- аспарагиновая кислота. Отвечает за образование иммуноглобулинов и деактивацию аммиака. Помогает восстановить баланс в работе сердечного цикла и нервной системы;
- гистидин. Применяют в лечении кишечных заболеваний и в качестве профилактики СПИДа.
 Уменьшает негативное влияние на человеческий организм стрессовых факторов;
Уменьшает негативное влияние на человеческий организм стрессовых факторов; - глицин. Нейромедиатор. Успокаивает;
- глутамин. Составляющая гемоглобина. Отвечает за стимуляцию метаболизма в ЦНС;
- глютаминовая кислота. Отвечает за регуляцию периферической нервной системы;
- пролин. Есть в составе протеинов. Например, в коллагене и эластине;
- серин. Аминокислота, которую можно найти в нейронах головного мозга. Облегчает выработку и высвобождение энергии. Возникает из глицина;
- тирозин. Из этой аминокислоты состоят, в том числе, растительные и животные ткани. В некоторых случаях восстанавливаются из фенилаланина;
- цистеин. Компонент кератина. Принадлежит к антиоксидантам. В отдельных случаях воспроизводится из серина.
Описанные функции кислот не являются полными и могут быть продолжены.
Незаменимые аминокислоты
Определение 3Незаменимые аминокислоты — те, синтез которых человеческим организмом не предусмотрен.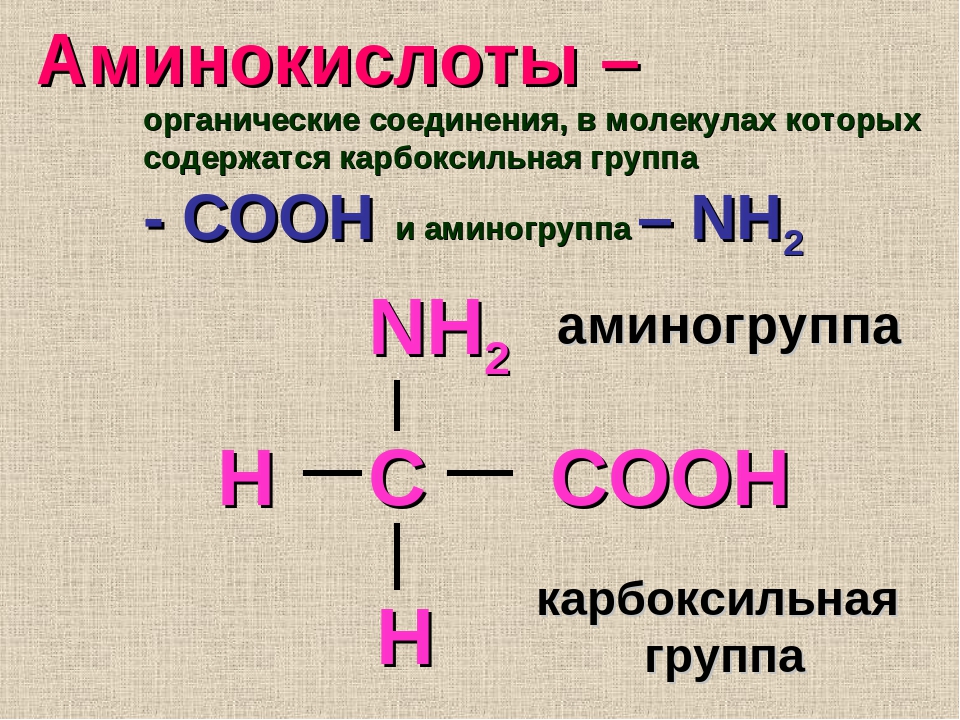
Содержатся в отдельных продуктах и поступают в организм с приемом пищи.
В список аминокислот, которые в организме не вырабатываются, входят:
- валин. Повышает координацию функционирования мышц, обеспечивает устойчивость организма к изменениям температуры;
- изолейцин. Его еще называют естественным анаболиком. Отвечает за насыщение мышц необходимой энергией;
- лейцин. Отвечает за регуляцию всех процессов метаболизма. Важный участник процесса построения белковой структуры. Вместе с двумя описанными выше аминокислотами составляет комплекс BCAA (который отвечает за построение мышечной массы). Эта аминокислота, и комплекс в целом, важна для людей, занимающихся спортом. Она помогает увеличить мышечную массу, понизить уровень развития ПЖК (подкожно-жировая клетчатка), поддерживать гомеостаз при больших физнагрузках;
- лизин. Его наличие в организме влияет на улучшение регенерации тканей, выработку гормонов, антител и ферментов.
 Также немаловажную роль эта аминокислота играет в укреплении сосудов. Находится в составе коллагена;
Также немаловажную роль эта аминокислота играет в укреплении сосудов. Находится в составе коллагена; - метионин. Принимает участи в синтезе холина. Сокращает количество жира в печени;
- треонин. Отвечает за укрепление сухожилий и эмали зубов;
- триптофан. Помогает в регуляции эмоционального состояния, лечении психических расстройств личности;
- фениалалнин. Принимает участие в регуляции деятельности кожных покровов путем снижения их пигментации. Восстанавливает водно-солевой баланс верхних слоев кожи.
Нужна помощь преподавателя?
Опиши задание — и наши эксперты тебе помогут!
Описать заданиеХимические формулы аминокислот
Условная формула аминокислоты в общем виде:
Вот как выглядит структурная формула аминокислот:
Ниже представлено фото с названиями аминокислот и структурными формулами:
Вот еще список аминокислот с молекулярными формулами в виде таблицы:
Чем грозит нехватка или избыток аминокислот в организме
Большинство аминокислот связано с регуляцией метаболизма. Практически любая аминокислота обеспечивает организм нужным количеством энергии для реализации химических реакций. Эти реакции отвечают за важные функции: дыхание, когнитивную деятельность, регуляцию психоэмоционального состояния и др.
Практически любая аминокислота обеспечивает организм нужным количеством энергии для реализации химических реакций. Эти реакции отвечают за важные функции: дыхание, когнитивную деятельность, регуляцию психоэмоционального состояния и др.
Согласно исследованиям ученых в области биохимии, аминокислот, которые содержались бы только в продуктах животного происхождения, не существует. К тому же, растительный белок усваивается организмом намного лучше животного. Однако стоит отметить, что веганы должны контролировать свой рацион тщательнее. И вот почему.
В 100 граммах мяса и 100 граммах бобов процентное соотношение АМК будет разным. По этой причине первое время количество аминокислот, потребляемых с пищей, нужно контролировать.
Примечание 2Негативно на организме сказывается голодание и диеты, связанные с концентрацией на какой-либо одной группе продуктов: баланс полезных веществ будет нарушен.
Если аминокислот в организме не хватает, это выражается:
- Плохим самочувствием.

- Плохим аппетитом.
- Высокой утомляемостью.
- Нарушением гомеостаза.
При этом стоит отметить, что проблемы с самочувствием наблюдаются даже если в организме есть недостаток хотя бы одной аминокислоты.
Но и избыток аминокислот сказывается на организме не лучшим образом: появляются симптомы, напоминающие пищевые отравления.
Если человек ведет здоровый образ жизни, то ему нет необходимости задумываться о том, как выучить все аминокислоты и всех ли аминокислот хватает в его организме: все 20 основных аминокислот поступают вместе с пищей. Исключение — спортсмены, для которых важно высокое содержание белка, необходимого для строительства мышечной массы.
Своевременная корректировка пищевых привычек и соблюдение мер при разработке рациона питания — важная составляющая здоровья. И об этом стоит помнить.
описание, свойства, способ применения, суточная норма и действие лизина
L-Лизин (L-Lysine)
Полезные свойства:
-
Формирование карнитина, отвечающего за состояние волос и кожи;
-
Синтез коллагена, помогающего избежать морщин;
-
Снижение уровня холестерина;
-
Улучшение усвоения кальция.

Лизин – незаменимая аминокислота, которая не может быть синтезирована организмом и поступает в организм только с пищей и добавками. Лизин обладает широким спектром биологических эффектов и прежде всего лизин жизненно необходим как составляющая белков организма. Эта аминокислота в больших количествах содержится в коллагене, который обеспечивает крепость мышц, хрящей, связок и сухожилий. Косвенно лизин укрепляет кости, так как способствует абсорбции кальция из кишечника, при его недостатке может развиваться остеопороз (повышенная ломкость костей). Лизин играет важную роль в иммунной системе, поскольку необходим в больших количествах для продукции антител (иммуноглобулина). Лизин входит в состав гормонов и ферментов, которые регулирую метаболические процессы организма.
Некоторые исследования показали то, что l-lysine может сократить частоту проявления вируса герпеса.
Способ воздействия вещества на вирус герпеса неизвестен, но есть версия о том, что лизин влияет на другую аминокислоту — аргинин.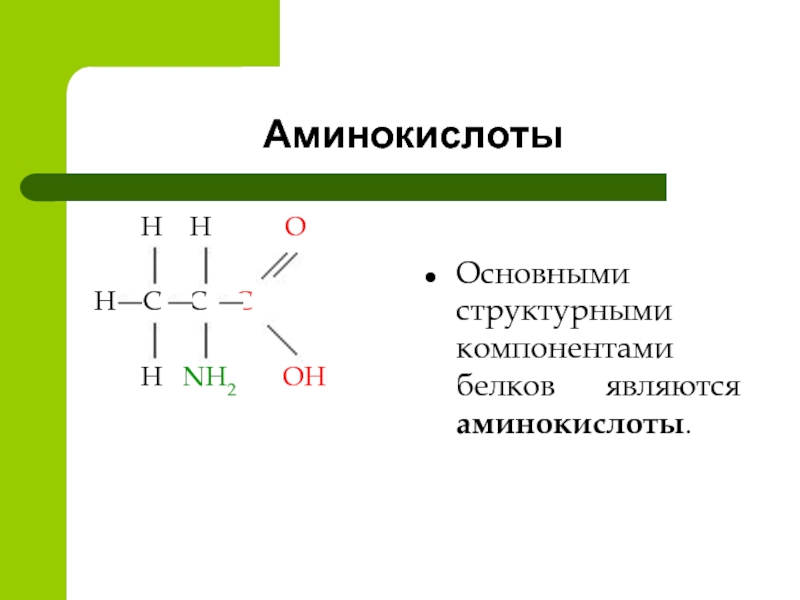 В свою очередь, было установлено влияние аргинина на ускорение деления клеток зараженных вирусом герпеса. Чем меньше аргинина, тем медленнее развивается герпес, а l-лизин снижает активность аргинина.
В свою очередь, было установлено влияние аргинина на ускорение деления клеток зараженных вирусом герпеса. Чем меньше аргинина, тем медленнее развивается герпес, а l-лизин снижает активность аргинина.
В 2007 году, учетые из Университета Флориды (FSU) установили эффект «конъюгатов лизина» (lysine conjugates), позволяющий идентифицировать отдельные повреждения ДНК. Исследованием занимался профессор биохимии FSU Игорь Алабугин. Для лечения рака было предложено использовать конъюгаты лизина под воздействием фототерапии. Такое комплексное воздействие позволяет уничтожить 90%+ больных клеток, при этом не повреждая здоровые. Изобретение профессора Алабугина уже запатентовано и проходит испытания.
Использование лизина для лечения рака было протестировано на колоректальном раке у мышей в 2014 году. В ходе исследования 0 животных погибло, в том числе животных находившихся на поздних стадиях заболевания.
Исследования показали эффективное влияние л-лизина даже на такие виды заболевания как лейкимия, что вселяет дополнительную надежду на скорое избавление человечества от такой страшной болезни.
Вместе с употреблением пищи богатой витаминами группы Б, магнием и омегой-3, можно принимать л-лизин для лечения психологических проблем. Лизин улучшает усвоение кальция и других веществ, тем самым восстанавливая нормальное состояние организма. Данная аминокислота используется для снятия синдрома беспокойства и может безвредно для организма снимать депрессивное состояние.
L-лизин ведет себя как антагонист рецептора серотонина. Он связывается с рецепторами и частично предотвращает ощущение тревоги. Более того, вещество влияет на вызванные стрессом реакции, включая лечение диареи.
Употребление л-лизина связывают с улучшением усвоения кальция, что крайне важно для людей с риском развития остеопороза. На сегодняшний день не существует исследований, которые смогли бы подтвердить связь между лечением остеопороза и употреблением лизина, однако важность влияния кальция на состояние костей дает основание предполагать, что лизин может быть полезен.
Кальций влияет не только на ваши кости, но и воздействует на ваш вес, защищает от серьёзных заболеваний, снижает симптомы ПМС, улучшает состояние зубов, влияет на работу нервной системы и мышц, предотвращает диабет.
Большая часть жителей нашей планеты испытывает проблемы, связанные со здоровьем кишечника. Многие люди даже не знают об этих проблемах, но они оказывают существенное влияние на их здоровье. Речь идет не только о прямых проблемах, таких как кислотный рефлюкс или диарея, а о многих других. Например, нарушение микрофлоры кишечника может влиять на состояние кожи, волос и костей, из-за того, что необходимые вещества не усваиваются организмом.
Одна из форм л-лизина, известная как поли-л-лизин оказывает противовоспалительный эффект и избавляет от многих проблем кишечника.
Американские ученые далеко продвинулись, экспериментируя с лизином, их опыты доказали, что применение лизина способно остановить выпадение волос при андрогенной алопеции и железодефицитной анемии. Существует американский патент на применение Лизина в лечении различных проблем, связанных с выпадением волос, включая облысение. Лизин блокирует 5-альфаредуктазу. Дефицит лизина неблагоприятно сказывается на синтезе белка, что приводит к утомляемости, усталости и слабости, плохому аппетиту.
Существует американский патент на применение Лизина в лечении различных проблем, связанных с выпадением волос, включая облысение. Лизин блокирует 5-альфаредуктазу. Дефицит лизина неблагоприятно сказывается на синтезе белка, что приводит к утомляемости, усталости и слабости, плохому аппетиту.
Лизин широко используется в бодибилдинге, добавляется в спортивное питание и БАДы. Эта аминокислота позволяет ускорить восстановление мышц после силового тренинга. Модулирующее влияние лизина поддерживает положительный азотистый обмен и построение мышечных белков.
Защита и питание мышц — это две основные функции лизина в спорте. Кроме того лизин укрепляет сухожильный корсет и костную систему, что снижает риск травмирования, а также ускоряет восстановление.
В среднем человеку необходимо получать от 800 до 3000 мг l-лизина ежедневно. Дозировка при лечении герпеса может увеличиваться от 1 до 3 гр вещества.
Лизин может быть использован в виде крема, который ускоряет снятие симптомов герпеса.
Лизин в рекомендуемых дозах абсолютно безопасен и не вызывает никаких побочных эффектов. В крайне больших дозах (более 20 г однократно) возможно возникновение спазмов в животе, диарея, метеоризм.
Литература
1. Рональд Клатц, Роберт Голдман «Эра молодости (Anti-aging революция), изд.Москва, Санкт-Петербург, «Ост»,2007 г.
2. Патент США № 5678617.
свойства и польза для организма
Аминокислоты – это группа из 22 органических соединений, которые выполняют функцию «строительных блоков» белков, причем как для растений, так и для животных. Какую роль они играют в организме человека и могут ли аминокислоты помочь в борьбе со старением?
Бесплатные вебинары по антивозрастной медицине
Узнайте об особенностях Международной школы Anti-Age Expert, а также о возможностях для совершенствования врачебной практики изо дня в день.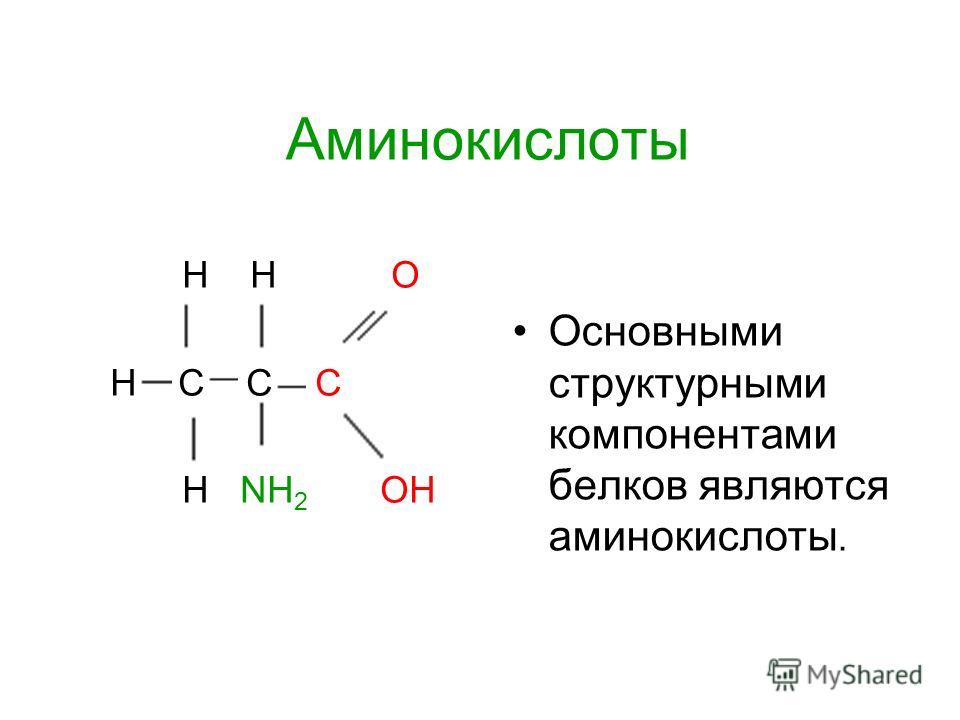 Также в программе вебинаров — увлекательные обзоры инноваций в антивозрастной медицине и разборы сложнейших клинических случаев с рекомендациями, которые действительно работают
Также в программе вебинаров — увлекательные обзоры инноваций в антивозрастной медицине и разборы сложнейших клинических случаев с рекомендациями, которые действительно работают
Что такое аминокислоты
Аминокислоты – это органические соединения, которые сочетают в себе свойства аминов и кислот, образующие белок. В каком-то смысле они как деталь конструктора (белка), являющегося основой жизни.
Точно так же, как можно по-разному собрать предметы из конструктора, есть несколько способов, которыми 22 аминокислоты могут объединиться в последовательность для создания различных белковых структур, таких как гормоны, ферменты, иммунная система, клетки или мышечные волокна.
Есть два типа «заменимых» аминокислот — те, которые синтезируются в организме человека, и «незаменимые», которые люди могут получать только с пищей или принимая добавки.
Так называемые «незаменимые», действуют на организм, подобно витаминам, их отсутствие в организме может привести к серьезным заболеваниям или даже к летальному исходу.
К незаменимым аминокислотам относятся:
-
гистидин;
-
изолейцин;
-
лейцин;
-
лизин;
-
метионин;
-
фенилаланин;
-
треонин;
-
триптофан;
-
валин.
Когда продукты содержат все незаменимые аминокислоты, их называют полноценными белками. Существует распространенное заблуждение, что растительные белки не содержат всех незаменимых аминокислот. Это неправда. В то время как в большинстве растительных источников белков обычно отсутствуют одна или две незаменимые аминокислоты в значительных количествах, другие источники растительных белков могут дополнять эти аминокислоты, обеспечивая полноценные белки.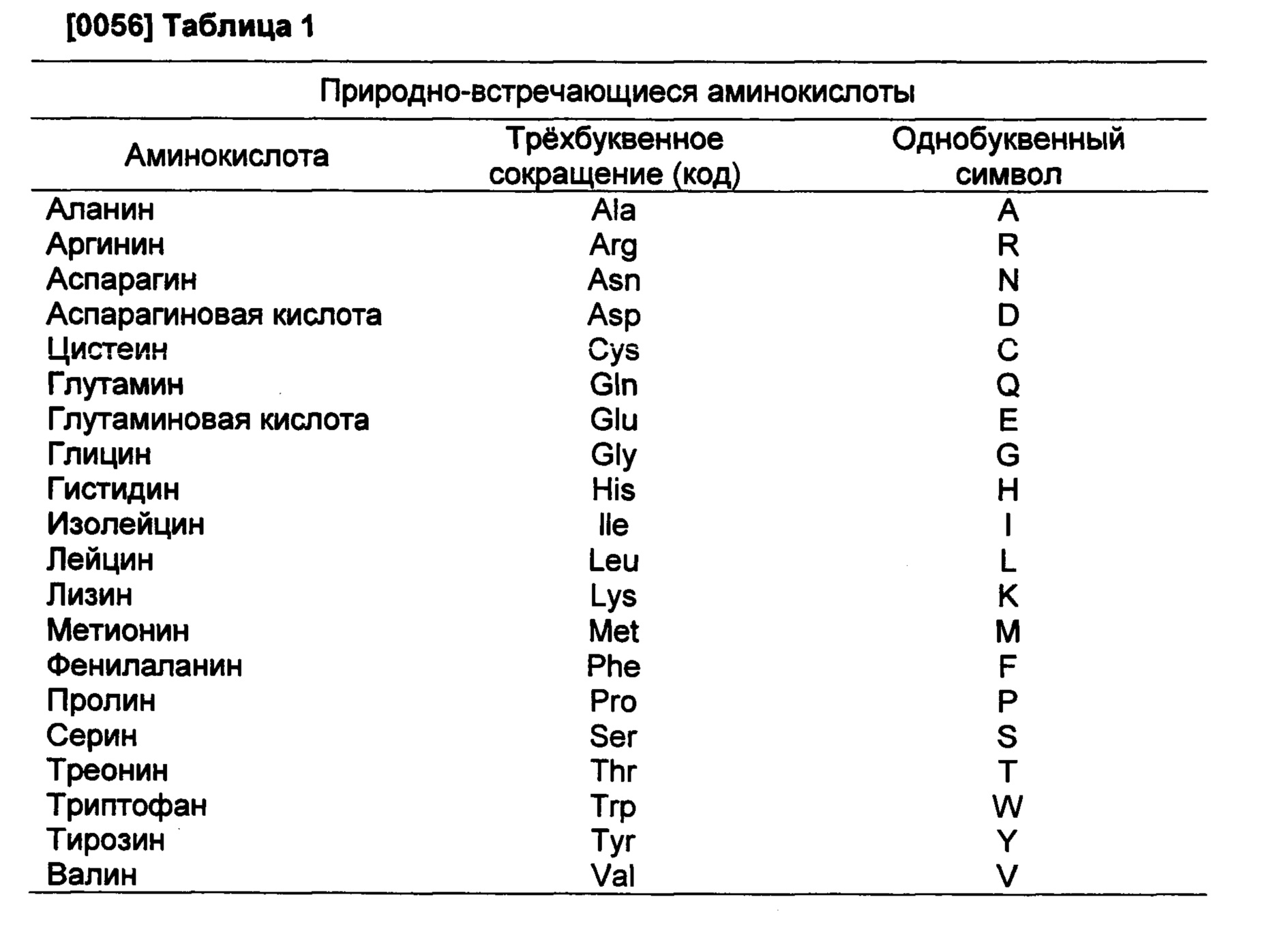
Заменимые аминокислоты организм вырабатывает самостоятельно, независимо от того, есть ли в вашем рационе продукты, содержащие их.
К ним относятся:
Существуют также условно незаменимые аминокислоты, которые вырабатываются, например, во время борьбы с болезнью или со стрессом.
Условное незаменимые аминокислоты:
-
аргинин;
-
цистеин;
-
глутамин;
-
тирозин;
-
глицин;
-
орнитин;
-
пролин;
-
серин.

Сбалансированная диета – важное условие поступления в организм незаменимых и заменимых аминокислот. Если их не будет хватать, телу будет куда сложнее вырабатывать белки, необходимые для нормального функционирования мышц и тканей.
Онлайн обучениеAnti-Age медицине
Изучайте тонкости антивозрастной медицины из любой точки мира. Для удобства врачей мы создали обучающую онлайн-платформу Anti-Age Expert: Здесь последовательно выкладываются лекции наших образовательных программ, к которым открыт доступ 24/7. Врачи могут изучать материалы необходимое количество раз, задавать вопросы и обсуждать интересные клинические случаи с коллегами в специальных чатах
Узнать подробнееПольза для организма
Для того, чтобы оценить масштаб работы, которую аминокислоты проделывают в нашем организме, достаточно перечислить основные их функции и возможности:
-
Помощь в формировании и росте мышц, соединительной ткани и кожи;
-
Поддержка мышечного тонуса и силы тканей;
-
Регенерация;
-
Нормальное пищеварение;
-
Обеспечение тела энергией;
-
Регулирование настроения;
-
Производство нейротрансмиттеров;
-
Поддержание здоровья волос и кожи.

Различные добавки с содержанием аминокислот обычно рекомендуют спортсменам и людям, ведущим активный образ жизни, чтобы повысить продуктивность и сохранить силу мышц.
Кроме того, прием аминокислот может уменьшить естественную потерю мышечной массы у пожилых людей и восстановить объем мышц, особенно если они тренируются с отягощениями.
Аминокислоты и старение
Было доказано, что старение — результат нехватки определенных аминокислот. И если принимать их в виде добавок, это может нанести вред в случае, когда они не усваиваются. Неправильное всасывание определенных аминокислот связано с повреждением кишечника.
Само по себе старение – это накопление повреждений, которые приводят к изменению физических функций и внешнего вида. Первая часть процесса старения — это плохое всасывание определенных аминокислот. Со временем кишечник менее эффективно извлекает питательные вещества из пищи. Это связано с постоянно увеличивающимся повреждением рецепторов кишечника для определенных аминокислот.
Это связано с постоянно увеличивающимся повреждением рецепторов кишечника для определенных аминокислот.
Пять из двадцати аминокислот, формирующих белок в организме человека, имеют проблемы с усвоением. Биологическое старение начинается с недостаточного всасывания в кишечнике хотя бы одной или всех пяти из этих аминокислот.
Поскольку наличие всех 20 аминокислот человеческого белка необходимо для создания любого существенного белка, неспособность абсорбировать определенный белок из кишечника вынуждает лимфатическую систему «красть» недостающее питание из организма.
Например, такой признак возраста как морщины объясняется тем, что теряется коллаген. А он “крадется” организмом из-за содержания в нем аминокислот. Снижение коллагена в коже и субдуральные гематомы, часто наблюдаемые при старении, являются внешними структурными признаками активности лимфатической системы. При старении лимфатическая система становится чрезвычайно агрессивной, перерабатывая редко используемые структуры для обеспечения недостающих аминокислот.
Диабет и гипертония — самые известные болезни, наблюдаемые с возрастом. Оба заболевания вызваны сбоями в процессах, которые используют пептиды для регулирования. Дефицита одной единственной необходимой аминокислоты достаточно, чтобы остановить производство пептида.
Приобретенное повреждение желудочно-кишечного тракта или потеря рецепторов для определенных аминокислот является основной причиной старения.
Семинары по антивозрастной медицинеПолучайте знания, основанные на доказательной медицине из первых уст ведущих мировых специалистов. В рамках Модульной Школы Anti-Age Expert каждый месяц проходят очные двухдневные семинары, где раскрываются тонкости anti-age медицины для врачей более 25 специальностей
Узнать подробнееКраткие выводы
-
Аминокислоты — это группа из 22 органических соединений, которые выполняют функцию «строительных блоков» белков.

-
Есть два типа «заменимых» аминокислот — те, которые синтезируются в организме человека, и «незаменимые», которые люди могут получать только с пищей или принимая добавки.
-
Сбалансированная диета может помочь обеспечить здоровое потребление незаменимых и заменимых аминокислот в течение дня.
-
Аминокислоты помогают строить белковые цепи и играют вспомогательную роль почти во всех частях вашего тела.
-
Их дефицит может ускорить процессы старения.
Список использованной литературы
-
Saini, R. & Zanwar, A. A. (2013) Arginine Derived Nitric Oxide: Key to Healthy Skin, Bioactive Dietary Factors and Plant Extracts in Dermatology (pp. 73-82).
-
Reda, E.
 , D’Iddio, S., Nicolai, R., Benatti, P. & Calvani, M. (2003) The Carnitine System and Body Composition Acta Diabetol, issue 40, (pp. 106-103).
, D’Iddio, S., Nicolai, R., Benatti, P. & Calvani, M. (2003) The Carnitine System and Body Composition Acta Diabetol, issue 40, (pp. 106-103).
-
Bowtell, J.L., Gelly, K., Jackman, M.L., Patel, A., Simeoni, M., Rennie, M.J. (1999) Effect of oral glutamine on whole body carbohydrate storage during recovery from exhaustive exercise Journal Of Applied Physiology, Volume 86, issue 6, (pp. 1770-1777)
аминокислот
Введение:
Каждая аминокислота имеет по крайней мере одну аминную и одну кислотную функциональную группу.
группа, как следует из названия. Различные свойства являются результатом
вариации в строении различных R-групп. Группа R
часто называют боковой цепью аминокислоты. Аминокислоты
имеют специальные общеупотребительные имена, однако сокращенное трехбуквенное
поскольку имя используется большую часть времени. Вторая аббревиатура
, одна буква, используется в длинных белковых структурах.
таблица слева для структуры, названий и сокращений
20 аминокислот.
Вторая аббревиатура
, одна буква, используется в длинных белковых структурах.
таблица слева для структуры, названий и сокращений
20 аминокислот.
Существует четыре основных класса аминокислот.
определяется разными боковыми цепями: (1) неполярными и нейтральными,
(2) полярный и нейтральный, (3) кислый и полярный, (4) основной и полярный.
Принципы полярности:
Чем больше разница в электроотрицательности между атомов в связи, более полярная связь.Частичные отрицательные заряды находятся на наиболее электроотрицательных атомах, остальные частично положительный. Проверьте полярность функциональных группы.
Неполярные боковые цепи:
Боковые цепи, содержащие чистых углеводородов алкильных группы
(алкановые ответвления) или ароматические (бензольные кольца) неполярные . Примеры включают валин, аланин, лейцин, изолейцин, фенилаланин.
Примеры включают валин, аланин, лейцин, изолейцин, фенилаланин.
Число алкильных групп также влияет на полярность. Чем больше присутствует алкильных групп, тем неполярнее аминокислота. будет. Этот эффект делает валин более неполярным, чем аланин; лейцин более неполярен, чем валин.
QUES. Перечислите все аминокислоты с неполярными боковыми цепями.
| Ранжируйте следующие по возрастанию
неполярность i.е. 1 = наименее неполярный, 4 = наиболее неполярный. лей; phe; val; аля | Ответ 1 = аля 2 = val 3 = лей 4 = phe Рейтинг основан на увеличивающиеся числа CHs. |
Полярные боковые цепи:
Боковые цепи, которые имеют различные функциональные группы, такие как кислоты,
амиды, спирты и амины будут давать на более полярный символ к аминокислоте.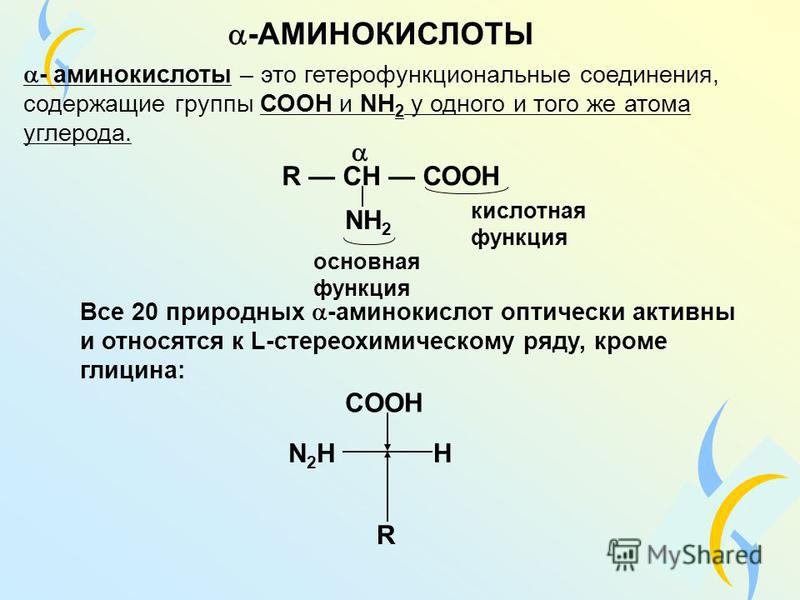 Рейтинг полярности будет зависеть
об относительном ранжировании полярности для различных функциональных групп
как определено в функциональных группах.
Кроме того, количество атомов углерода в алкане или
ароматическая часть боковой цепи должна рассматриваться вместе с
с функциональной группой.
Рейтинг полярности будет зависеть
об относительном ранжировании полярности для различных функциональных групп
как определено в функциональных группах.
Кроме того, количество атомов углерода в алкане или
ароматическая часть боковой цепи должна рассматриваться вместе с
с функциональной группой.
Пример: аспарагиновая кислота более полярна, чем серин, потому что кислотная функциональная группа более полярна, чем спиртовая группа.
Пример: серин более полярен, чем треонин, поскольку треонин имеет на одну метильную группу больше, чем серин. Метильная группа дает немного более неполярный характер треонину.
Пример: серин более полярен, чем тирозин, поскольку тирозин имеет углеводородное бензольное кольцо.
QUES. Перечислите все аминокислоты по аббревиатуре, которые считаются
несколько полярными.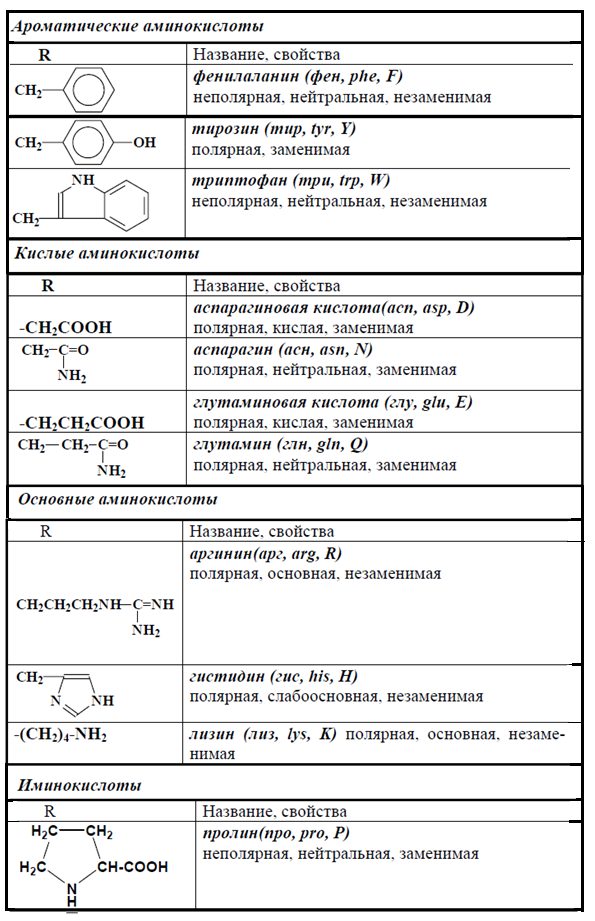
| Оцените следующие аминокислоты по
возрастающая полярность.т.е. 1 = более неполярный. ser; glu; жерех; лиз; ала; gln | Ответ 1 = аля 2 = лиз 3 = сер 4 = глю 5 = жерех 6 = gln |
| Какая аминокислота наиболее нерастворима
в воде: изолейцин или аланин? | Ответ Изолейцин имеет больше CHs, поэтому больше нерастворим, чем ала. |
| Какая аминокислота наиболее растворима в воде: лиз или сер? | Ответ Сер, алкогольная группа более полярен, чем амин в лиз. |
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.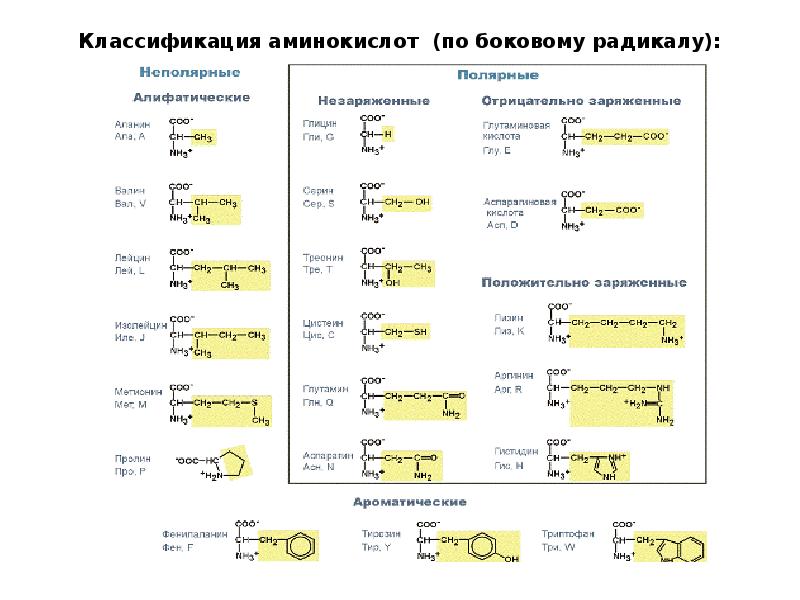 Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
 Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
13.1: Аминокислоты — Chemistry LibreTexts
- Последнее обновление
- Сохранить как PDF
- Аминокислоты
- Правила классификации аминокислот
- Цвиттерион
- pH
- pH> pI
- pH
- Участники и авторство
Результаты обучения
- Определите структурные компоненты аминокислоты.

- Определите цвиттерион и изоэлектрическую точку.
- Определите заряд аминокислоты, когда она не находится в изоэлектрической точке.
- Обозначьте аминокислоты как полярные и неполярные, а также как кислые, основные или нейтральные.
В наши дни легкая атлетика очень конкурентоспособна на всех уровнях, от школьных до профи. Все ищут то преимущество, которое сделает их быстрее, сильнее и физически лучше. Один из подходов, используемых многими спортсменами, — это использование аминокислотных добавок.Теория состоит в том, что увеличение количества аминокислот в рационе приводит к увеличению протеина для мышц. Однако единственная реальная выгода — это люди, которые производят и продают таблетки. Исследования не показали никакого преимущества, полученного самими спортсменами. Вам будет гораздо лучше просто поддерживать здоровую диету.
Аминокислоты
Аминокислота — это соединение, которое содержит как аминогруппу \ (\ left (\ ce {-NH_2} \ right) \), так и карбоксильную группу \ (\ left (\ ce {-COOH} \ right) \ ) в той же молекуле. Хотя можно вообразить любое количество аминокислот, биохимики обычно оставляют термин для группы из 20 аминокислот, которые образуются и используются живыми организмами. На рисунке ниже показана общая структура аминокислоты. Любая структура считается правильной для аминокислоты.
Хотя можно вообразить любое количество аминокислот, биохимики обычно оставляют термин для группы из 20 аминокислот, которые образуются и используются живыми организмами. На рисунке ниже показана общая структура аминокислоты. Любая структура считается правильной для аминокислоты.
Аминная и карбоксильная группы аминокислоты ковалентно связаны с центральным атомом углерода. Этот атом углерода также связан с атомом водорода и группой \ (\ ce {R} \). Именно эта группа \ (\ ce {R} \) меняется от одной аминокислоты к другой и называется боковой цепью аминокислоты.
Рисунок \ (\ PageIndex {2} \): пять из двадцати биологически релевантных аминокислот, каждая из которых имеет отличительную боковую цепь \ (\ left (\ ce {R} \ right) \).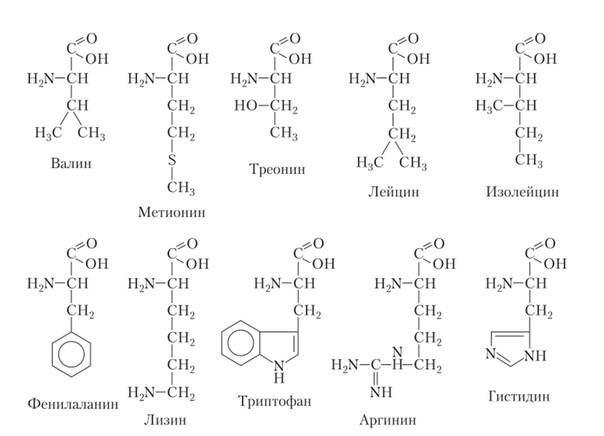 Боковая цепь аланина неполярна, а треонин полярна.Триптофан — одна из нескольких аминокислот, боковая цепь которой ароматическая. Аспарагиновая кислота имеет кислотную боковую цепь, а лизин — основную боковую цепь.
Боковая цепь аланина неполярна, а треонин полярна.Триптофан — одна из нескольких аминокислот, боковая цепь которой ароматическая. Аспарагиновая кислота имеет кислотную боковую цепь, а лизин — основную боковую цепь.Природа боковых цепей объясняет разнообразие физических и химических свойств различных аминокислот. Каждая аминокислота сгруппирована на основе свойств боковой цепи. Группы обозначаются как полярные (гидроксильные, серосодержащие, амидные), неполярные (алифатические и ароматические), кислотные или основные.
Рисунок \ (\ PageIndex {3} \): двадцать аминокислот.В дополнение к полному названию аминокислоты для каждой есть также одно- и трехбуквенные сокращения. Эти сокращения особенно полезны при перечислении аминокислот в белке (цепочке из многих аминокислот, которая будет обсуждена позже).
Правила классификации аминокислот
Следующие правила (вместе с двумя исключениями) могут помочь вам классифицировать аминокислоты как неполярные, полярные кислотные (иногда называемые кислотными), полярно-основные (иногда называемые основными) или полярно-нейтральные.Мы рассмотрим два исключения, но отметим, что переход от неполярного к полярно-нейтральному — это постепенный переход (как цвета радуги), поэтому вы можете увидеть различия в том, как классифицируются аминокислоты, если вы посмотрите на другие источники.
- Неполярные аминокислоты (их 9) содержат алифатические (углеводородные) цепи или ароматические кольца.
- Полярные кислотные аминокислоты (2) содержат группу карбоновой кислоты (или карбоксилат) в боковой цепи (группа R).Это в дополнение к в основной цепи аминокислоты.
- Полярные основные аминокислоты (3) содержат аминогруппу (может быть нейтральной или заряженной) в боковой цепи (группа R). Это в дополнение к в основной цепи аминокислоты.
- Полярно-нейтральные аминокислоты (6) содержат гидроксил (-ОН), серу или амид в группе R).
Есть два важных исключения из приведенных выше правил.
- Тирозин имеет ароматическую группу и группу -ОН и считается полярно нейтральным .
- Метионин содержит серу, но как часть углеродной цепи. Сера имеет ту же электроотрицательность, что и углерод, поэтому она считается неполярной .
Цвиттерион
Аминокислоты обычно извлекаются либо без зарядов, либо с плюсовым и минусовым зарядом (см. Рисунок 13.1.1). Когда аминокислота содержит как положительный, так и отрицательный заряд в «основной цепи», она называется цвиттерионом и имеет общий нейтральный заряд. Цвиттерион аминокислоты существует при pH, равном изоэлектрической точке.+} \) иона с образованием (\ ce {H_2O} \). Аминовая группа имеет нейтральный заряд, оставляя только отрицательный заряд на карбоксилатной группе. В целом, у аминокислоты будет заряд \ (- 1 \).
Рисунок \ (\ PageIndex {4} \): боковые цепи аминокислот и значения pI.Пример \ (\ PageIndex {1} \)
- Укажите аминокислоту, изображенную ниже.
- Найдите значение pI для аминокислоты.
- Определите, как аминокислота будет существовать при pH = 3,52
- Определите, как аминокислота будет существовать при pH = 9.+} \) от него. В результате единственный оставшийся заряд будет на ионе карбоксилата, поэтому аминокислота будет иметь заряд \ (- 1 \).
e. При pH = 5,02 pH = pI, поэтому аминокислота будет существовать в виде цвиттер-иона с положительными и отрицательными зарядами, как показано выше.
Авторы и авторство
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
Эллисон Соулт, Ph.D. (факультет химии, Университет Кентукки)
Состав основных аминокислот.
Потенциал неразрушающего прогнозирования свежести яиц на основе отпечатков пальцев в ближнем инфракрасном (NIR) спектре будет полезен как сотрудникам службы контроля качества, так и потребителям. В этом исследовании ручной NIR-спектрометр в диапазоне от 740 нм до 1070 нм и хемометрия использовались для одновременного определения свежести яиц на основе отмеченной даты кладки яиц, хранящихся в холодных и окружающих условиях.Спектры, полученные от яиц, были предварительно обработаны с использованием коррекции мультипликативного рассеяния и анализа главных компонентов (MSC-PCA). Линейный дискриминантный анализ (LDA) использовался для построения идентификационной модели для прогнозирования категории свежести, в то время как частичная регрессия методом наименьших квадратов (PLS-R) использовалась для определения отмеченной даты яйцекладки. Производительность модели LDA была выше 95% уровня идентификации как в калибровке, так и в наборе прогнозов для яиц, хранящихся в условиях окружающей среды и холодного хранения. Для яиц, хранящихся в обычных хранилищах, у LDA было 95.Уровень идентификации 54% при 5 основных компонентах, в то время как при холодном хранении LDA имеет 100% уровень идентификации при 5 основных компонентах для определения отмеченной даты яйцекладки, а частичная регрессия методом наименьших квадратов (PLS-R) дала R = 0,87 и RMSEI = 2,57 для комнатное хранение и R = 0,88 и RMSEI = 2,66 для холодного хранения в независимом наборе, соответственно. Результаты показывают, что портативный спектрометр и многомерный анализ можно использовать для быстрого и неразрушающего измерения свежести яиц. Это обеспечивает новое решение для прогнозирования целостности яиц в цепочке создания стоимости.1. Введение Куриное яйцо — самый популярный вид яиц среди домашних птиц во всем мире. Он потребляется широким кругом людей во всем мире, поскольку распространяется на людей из разных социально-экономических слоев. Яйцо, как известно, содержит высококачественные белки, богато другими веществами, такими как углеводы, минералы, и имеет легкоусвояемые жиры [1]. Недавнее просвещение о пользе употребления яиц для здоровья привело к интенсивному производству и потреблению яиц во всем мире. Однако одной из основных проблем потребителей и сотрудников службы контроля качества является быстрое и точное определение свежести.Это особенно важно, поскольку рост потребления привел к тому, что многие производители наводнили рынок разными категориями яиц. В частности, это перенасыщение запасов привело к хранению яиц в течение более длительных периодов времени, прежде чем они будут куплены или проданы, и это явление приводит к снижению свежести в результате влияния дней хранения на качество яиц [2]. Некоторые производители хранят яйца во время производства перенасыщения и ошибочно маркируют их как свежие (суточные яйца) для продажи на рынке при высоком спросе.В Западной Африке при покупке яиц чаще всего задают популярный вопрос: «Сколько лет яйцу», поскольку потребители связывают продолжительность хранения со свежестью яйца. Это восприятие потребителей подтверждается другими исследователями, которые обнаружили, что количество единиц Хау уменьшается с хранением [2, 3]. Следовательно, многие розничные торговцы вынуждены продавать свои яйца по разовой цене или неправильно маркировать их. Качество яйца, которое больше всего воспринимается потребителями, — это его свежесть, чистота, вес, качество скорлупы, индекс белка, единица Хау и химический состав [2, 4]; однако наиболее популярным методом, используемым для определения качества яиц, является единица Хау (HU), разработанная Хо [5].Свежесть яйца — это характеристика, связанная с качеством яйца, и этот атрибут снижается после кладки [6, 7]. Более того, при хранении яйца становятся подверженными внутреннему ухудшению качества; таким образом, наблюдается снижение качества, поскольку такие факторы, как температура, время, влажность, движение воздуха и обращение, связаны с ухудшением качества [2]. Также отмечено, что продолжительность хранения в значительной степени влияет на свежесть яйца [8]; однако указанная дата кладки на скорлупе, введенная постановлением Европейской комиссии (2003/2295 / EC), сама по себе не обеспечивает достаточной гарантии качества яйца [3].Следовательно, необходима комбинация факторов. С другой стороны, аналитические методы, используемые для оценки качества яиц, часто являются очень трудоемкими, разрушительными, трудоемкими и часто требуют сложной лабораторной и громоздкой подготовки проб. В связи с этим различные исследователи разработали методы определения качества, такие как система на основе электронного носа [9], и это основано на том факте, что свежие яйца имеют очень низкую концентрацию органических летучих веществ, которая увеличивается при хранении [10].Другая неразрушающая операция состоит в наблюдении за яйцами против света и обнаружении воздушной камеры. Эти методы не могут работать эффективно в первые дни после укладки [3, 11]. Более ранние исследования с использованием спектроскопии в более широком диапазоне длин волн в ближнем инфракрасном диапазоне использовались для определения свежести и оценки качества яиц [12–15]. Также было выполнено применение портативной калибровочной модели NIR, основанной на машинном обучении, для определения времени хранения яиц при комнатной температуре [16]. В этих исследованиях не рассматривалось одновременное измерение свежести яиц в двух условиях, чтобы охватить особые ситуации в развивающихся странах (часто испытывающих трудности с инфраструктурой холодильного хранения).Более того, с использованием портативной БИК-спектроскопии для одновременной классификации и прогнозирования свежести яйца при различных условиях хранения, чтобы представить отмеченную дату яйцекладки, было выполнено мало или совсем не было работы. Это будет способствовать быстрому контролю качества и выявлению случаев мошенничества с неправильной маркировкой с указанием даты укладки на скорлупе, как это предусмотрено европейскими правилами. БИК-спектроскопия является более удобной, неразрушающей, быстрой и простой аналитической техникой, которая практически не требует сложной пробоподготовки [17].Кроме того, достижения в области компьютеров и электроники, которые привели к миниатюризации БИК-спектрометров, дали дополнительные преимущества, сделав эту технологию применимой и удобной для пользователя вне лаборатории. Для спектроскопии ближнего ИК-диапазона относительный вклад отраженного и поглощенного излучения зависит от химического состава, микроструктуры и физических параметров рассматриваемого материала [17, 18]. Настоящее исследование, первое в Гане и Западной Африке, направлено на разработку нового быстрого неразрушающего и одновременного определения свежести яиц и отмеченной даты кладки яиц в двух различных условиях хранения с использованием портативного NIR-спектрометра в сочетании с многомерными алгоритмами.Это означает, что наша технология будет очень важно проверять фальсификацию яиц из-за неправильной маркировки в Африке. Это также приведет к всестороннему контролю качества и мониторингу обеспечения качества в цепочке создания стоимости яиц. Новизна данного исследования заключается в одновременном обнаружении свежести неповрежденных яиц и дней хранения как в условиях окружающей среды, так и в условиях холодного хранения. В связи с этим производство и продажа яиц будет отслеживаться и контролироваться независимо от типа хранения, используемого для уменьшения мошенничества с пищевыми продуктами. 2. Материалы и методы 2.1. Образцы яиц В этом исследовании было отобрано 120 свежих красных неповрежденных яиц от штамма несушек Lohnman Brown в возрасте от 36 до 64 недель непосредственно из учебно-исследовательской фермы Школы сельского хозяйства Университета Кейп-Кост в центральном регионе Ганы и доставлены в исследовательскую лабораторию. для дальнейшего анализа. Образцы были разделены на две части: одна часть заключалась в том, что 60 яиц хранились в холодильнике при 4 ° C с использованием настольного холодильника, а другая (60 яиц) хранилась при температуре окружающей среды (28 ° C) с относительной влажностью 70%.Кроме того, в каждом состоянии хранения по 30 яиц использовалось отдельно для определения единиц Хау и высоты Йорка, которые определялись как мера свежести во время хранения с использованием рекомендованного метода. Каждые пять дней для этих измерений случайным образом выбирали по пять яиц из каждого типа хранилища. 2.2. Сбор образцов спектров Спектр каждого яйца сканировали непрерывно от дня кладки (день сбора свежих образцов) до двадцати дней (0–20 дней) в режиме отражения с использованием портативного спектрометра (SCIO ™) со спектральным диапазоном 740 нм и 1070 нм в разрешение 1 нм для записи спектральных данных.Для каждого яйца экваториальную область яичной скорлупы сканировали трижды после ее поворота на 120 °. Эта часть была выбрана потому, что изменения внутреннего состава наиболее значительны в этой области по сравнению с другими [19]. Сканирование проводилось при температуре окружающей среды 28,6 ± 1 ° C и влажности 68%. 2.3. Эталонные измерения свежести с использованием единиц Хау Единица Хау (Hu) яиц (в качестве эталонного метода определения свежести) была рассчитана с помощью используемого метода (с уравнением (1)), в то время как высота Йорка также была измерена с помощью цифрового штангенциркуля с вернье в соответствии с методом, используемым другими авторы [20].Чтобы контролировать свежесть яиц с использованием HU, десять (10) яиц из каждой группы хранения использовали для определения единицы Хау и высоты Йорка в течение всего периода хранения от нулевого дня до двадцати дней (период хранения 0-20 дней). HU = единица Хау, h = высота белка (мм) с использованием цифрового штангенциркуля и = вес яйца (г) с использованием цифровых весов (0,001 г). 2.4. Программное обеспечение устройства Записи спектральных данных, хранящиеся в облачном наборе данных с соответствующими эталонными значениями для времени сканирования, были загружены с использованием исследовательской лицензии лаборатории SCIO и импортированы в MATLAB версии 9.5.0 (Mathworks Inc., США) с Windows 10 Basic для обработки данных для всех предварительных обработок и многомерных алгоритмов. 2.5. Раздел данных Необработанные данные были разделены на два подмножества: калибровочный набор для разработки модели и набор прогнозов для оценки прогностической способности построенных моделей. Чтобы избежать систематической ошибки, 75% данных из образцов были выбраны в качестве калибровочного набора, а остальные данные были набором прогнозов. Для этого члены в каждом наборе были выбраны так, чтобы получить 3/1 деление набора калибровки / набора прогнозов.2.6. Предварительная обработка данных Что касается спектров, набор необработанных данных был предварительно обработан с помощью коррекции мультипликативного рассеяния (MSC), потому что модели, разработанные с использованием необработанных данных спектров, обычно не дают желаемых результатов. Инструмент MSC — полезный метод для коррекции рассеянного света и отклонения базовой линии [21, 22]. Предварительная обработка данных спектров является неотъемлемой частью моделирования для исключения фоновой информации и шума из полезных свойств отсканированных образцов [16, 23].Анализ главных компонентов (PCA) был проведен для наблюдения за любыми известными кластерными тенденциями. PCA — это неконтролируемое описание данных и методы уменьшения размерности, которые в основном используются для выполнения кластерного анализа спектральных данных [24]. Обычно это делается перед любым многомерным моделированием для обнаружения закономерностей в матрице данных, поскольку оно выявляет визуализированные тенденции данных в размерном пространстве [25]. 2.7. Методы многомерного анализа LDA как метод линейной параметрической классификации был использован в этой работе. Он выполняет свою функцию, максимизируя межклассовую дисперсию по сравнению с внутриклассовой дисперсией, чтобы создать линейную границу принятия решений между ними и найти линейную комбинацию характеристик, которая наилучшим образом различает две или более группы событий [26].Принцип LDA основан на определении линейных функций дискриминации, и количество факторов главных составляющих имеет решающее значение для его работы [27]. В этом исследовании данные PCA использовались в качестве входных данных для LDA для построения идентификационной модели. С другой стороны, для прогнозирования отмеченной даты яйцекладки использовалась регрессия частичных наименьших квадратов (PLS-R). PLS-R — популярный линейный многомерный инструмент, который анализирует данные с сильными коллинеарными, зашумленными и избыточными переменными; за дополнительной информацией обращайтесь к другим авторам [28, 29].Эффективность LDA оценивалась по скорости идентификации (%), в то время как модель PLS оценивалась с использованием трех основных параметров, а именно: среднеквадратичной ошибки перекрестной проверки (RMSECV), среднеквадратичной ошибки прогноза (RMSEP), и коэффициент корреляции (R) [30]. Эти параметры были рассчитаны по уравнениям (2) — (5): где n1 = количество правильно идентифицированных образцов, n = количество образцов, = контрольные результаты измерения для образца i, = оценочный результат для образца i, когда модель построенный с удаленным образцом i, = оценочные результаты модели для образца i, = среднее значение эталонных результатов измерения для всех образцов.3. Результаты и их обсуждение 3.1. Измерения свежести яиц Для контроля и подтверждения свежести яиц в двух условиях хранения использовался деструктивный стандартный метод. Как видно из таблицы 1, было замечено, что свежесть яиц уменьшается или снижается с увеличением продолжительности хранения с использованием оценки единиц Хау (HU). Это наблюдаемое явление согласуется с данными других авторов [8]. В рамках рейтинговых шкал HU, 72 и выше оцениваются как AA, 60–72 как A и ниже 60 как B, в то время как значение ниже 60 также известно как точка сопротивления потребителя, а ниже 50 считается плохим и неприемлемым, соответственно [12] .Однако для яиц, хранящихся в условиях холодного хранения, значения HU не соответствуют непосредственно свежести или продолжительности хранения. Таким образом, эта информация показала, что классификация и прогнозирование продолжительности хранения яиц в рамках четко определенной категории хранения предоставляют полезную информацию для потребителей. Кроме того, эта таблица также поддерживает идею о том, что разработка модели для прогнозирования качества яиц при двух условиях хранения очень важна. Было замечено, что яйца, хранившиеся в условиях холодного хранения, были все еще очень хороши в отношении HU даже при продолжительности хранения 20 дней.Дни Хранение в холодильнике Окружающее хранилище Блок Haugh Высота Йорка Блок Хау Высота Йорка 0 96,78 19,3 95,06 18,7 1 95,56 18,6 87,12 18,2 5 88,97 18,4 77,20 16,9 10 86,48 18,3 71,89 13,8 15 82,53 15,9 60.01 11,8 20 82,42 18,2 41,36 9.9
Молекулярные выражения: коллекция аминокислот
Аланин — вторая простейшая аминокислота, но больше всего используется в белках.
beta -Аланин — единственная встречающаяся в природе аминокислота beta .
Аргинин — Аминокислота, часто используемая в активных центрах ферментов.
Аспарагин — Амидное производное аспарагиновой кислоты.
Аспарагиновая кислота — важный промежуточный продукт в цикле лимонной кислоты.
Карнитин — Необычная аминокислота, переносящая жирные кислоты в митохондрии.
Цитруллин — аминокислота, которая выводит токсины и устраняет нежелательный аммиак.
Цистеин — Тиолсодержащая аминокислота, участвующая в активных центрах и определении третичной структуры белка.
Цистин — продукт окисления цистеина, который удерживает белки вместе.
гамма -аминомасляная кислота — декарбоксилированная аминокислота, которая помогает расслабиться.
Глутаминовая кислота — Отрицательно заряженная аминокислота, обнаруженная на поверхности белков.
Глютамин — единственная аминокислота, способная легко преодолевать барьер между кровью и тканями мозга.
Глутатион — небольшой пептид, который помогает избавляться от свободных радикалов.
Глицин — Простейшая аминокислота, которая также действует как антагонист нейромедиаторов.
Гистидин — Аминокислота, отвечающая за биосинтез гистамина.
Hydroxyproline — важная аминокислота, используемая в структурных белках, таких как коллаген.
Изолейцин — гидрофобная аминокислота, используемая почти исключительно в производстве белков и ферментов.
Лейцин — Еще одна гидрофобная аминокислота, используемая почти исключительно в производстве белков и ферментов.
Лизин — незаменимая аминокислота с положительным зарядом на алифатической боковой цепи.
Метионин — незаменимая аминокислота, которая помогает инициировать синтез белка.
Орнитин — важнейший член аминокислот в цикле мочевины.
Фенилаланин — Наиболее распространенная ароматическая аминокислота, содержащаяся в белках.
Пролин — Циклическая алифатическая аминокислота, используемая в синтезе коллагена.
Серин — Аминокислотный спирт, обнаруженный в активном центре сериновых протеаз.
Таурин — Меркаптан-содержащая аминокислота, участвующая в биохимии желчных кислот.
Треонин — Аминокислотный спирт, участвующий в метаболизме порфиринов.
Триптофан — Ароматическая аминокислота наименее часто используется в белках.
Тирозин — гидроксифениламинокислота, которая используется для создания нейротрансмиттеров и гормонов.
Валин — гидрофобная алифатическая аминокислота, используемая для связывания белков.
Вопросы или комментарии? Отправить нам письмо.
© 1995-2021, автор — Майкл В. Дэвидсон и Государственный университет Флориды. Все права защищены. Никакие изображения, графика, программное обеспечение, сценарии или апплеты не могут быть воспроизведены или использованы каким-либо образом без разрешения правообладателей. Использование этого веб-сайта означает, что вы соглашаетесь со всеми юридическими положениями и условиями, изложенными владельцами.
Этот веб-сайт поддерживается нашим
Команда разработчиков графики и веб-программирования
в сотрудничестве с оптической микроскопией в Национальной лаборатории сильного магнитного поля
.Последнее изменение: пятница, 13 ноября 2015 г., 14:18
Счетчик доступа с 1 апреля 1998 г .: 1053808
Микроскопы предоставлены:
Аминокислоты | Протокол
Аминокислоты — это органические соединения, состоящие преимущественно из углерода, водорода, кислорода и азота. Хотя существуют сотни аминокислот, двадцать работают как строительные блоки белков.Эти двадцать аминокислот часто называют трех- или однобуквенными аббревиатурами.
Все аминокислоты имеют центральный углерод, называемый альфа-углеродом, который функционирует как хиральный центр для большинства аминокислот. Он присоединен к аминогруппе, карбоксильной группе, атому водорода и переменной R-группе.
Хиральная молекула имеет четыре отдельные группы, расположенные вокруг определенного атома, известного как хиральный центр. Поскольку в качестве группы R глицин имеет атом водорода, он не имеет четырех отдельных групп и, следовательно, не имеет хирального центра.
Эти четыре группы могут образовывать две различные конфигурации, которые являются стереоизомерами, называемыми L- и D-изомерами. Эти изомеры представляют собой зеркальные изображения, которые не накладываются друг на друга. Аминокислоты, используемые в синтезе белка, всегда являются L-изомерами.
Аминная группа аминокислоты может действовать как основание и принимать протон, приводя к положительному заряду, тогда как карбоксильная группа может действовать как кислота и отдавать протон, приводя к отрицательному заряду. При физиологическом pH аминокислоты обычно существуют как двухзарядные и называются цвиттерионами, молекулами с равным количеством положительных и отрицательных зарядов.
Каждая аминокислота имеет уникальную группу R, которая отвечает за их различные свойства, включая их размер, растворимость и заряд. Аминокислоты широко классифицируются на две категории в зависимости от их R-групп: неполярные и полярные.
Неполярные аминокислоты можно разделить на алифатические и ароматические. Полярные аминокислоты можно разделить на кислые, основные и незаряженные при нейтральном pH.
Алифатические группы представляют собой углеводороды с одинарными связями, которые существуют в виде прямых, разветвленных или циклических цепей.Аминокислоты с алифатическими группами R представляют собой простейшую аминокислоту глицин; аланин, валин, лейцин и изолейцин, которые чрезвычайно гидрофобны и связываются друг с другом с образованием стабильных ядерных структур в белках; метионин, серосодержащая аминокислота; и пролин, имеющий алифатическое кольцо.

 Уменьшает негативное влияние на человеческий организм стрессовых факторов;
Уменьшает негативное влияние на человеческий организм стрессовых факторов;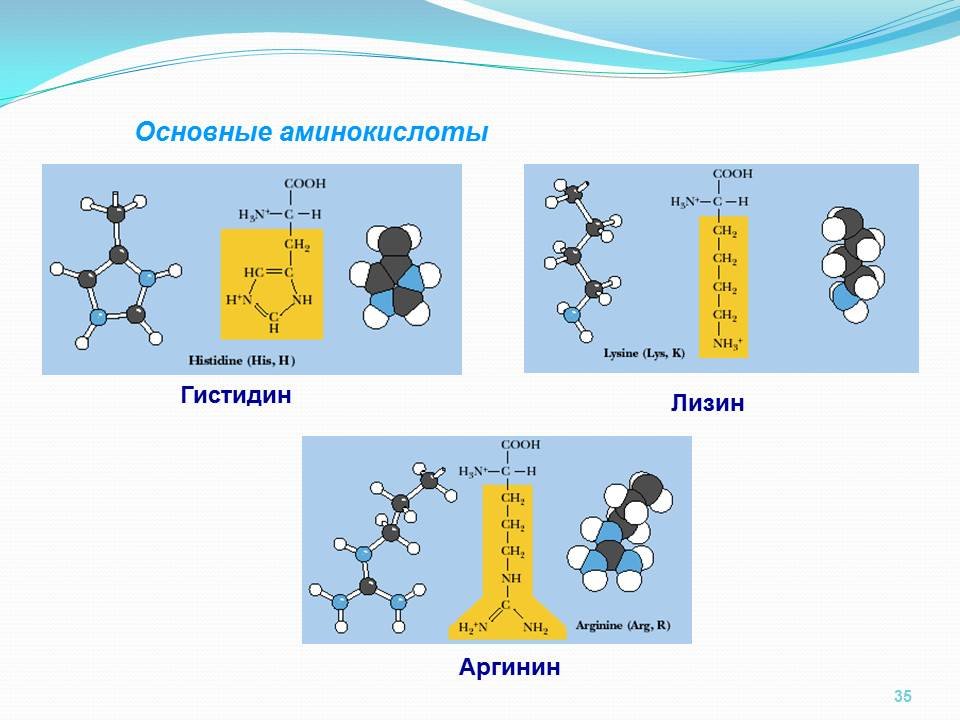 Также немаловажную роль эта аминокислота играет в укреплении сосудов. Находится в составе коллагена;
Также немаловажную роль эта аминокислота играет в укреплении сосудов. Находится в составе коллагена;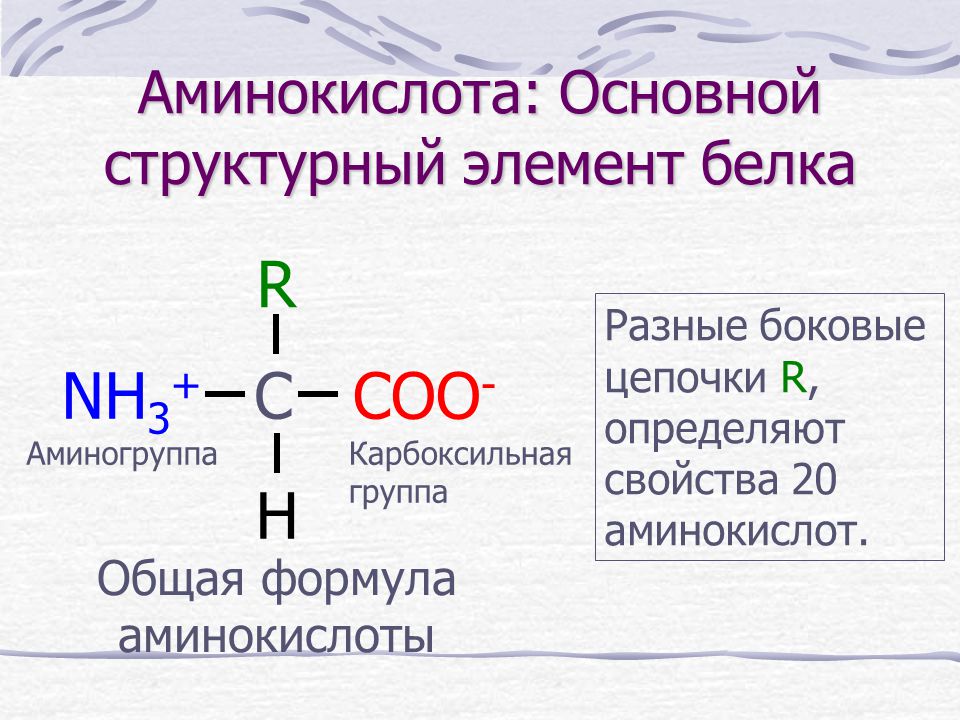


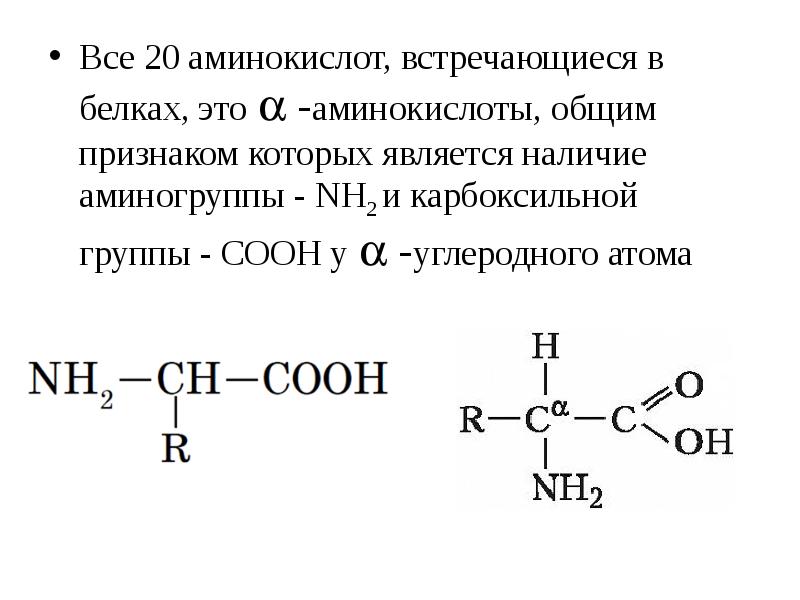

 , D’Iddio, S., Nicolai, R., Benatti, P. & Calvani, M. (2003) The Carnitine System and Body Composition Acta Diabetol, issue 40, (pp. 106-103).
, D’Iddio, S., Nicolai, R., Benatti, P. & Calvani, M. (2003) The Carnitine System and Body Composition Acta Diabetol, issue 40, (pp. 106-103).

 Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.