Аминокислоты это что: что такое, полезные свойства и применение
Польза аминокислот для организма. Как восполнить баланс
Аминокислоты необходимые элементы для нормального функционирования организма. Благодаря наличию аминокислот происходит лучшее усвоение витаминов и минеральных веществ. Также при помощи аминокислот осуществляется деятельность нервной системы, в частности осуществляется передача сигналов к головному мозгу. Существуют определенные аминокислоты, действие которых направлено на восстановление мышечных клеток, что является очень важным для человеческого организма.
Все аминокислоты можно разделить на три типа: заменимые, незаменимые и полузаменимые.
Заменимые аминокислоты организм вырабатывает самостоятельно. Как правило, в здоровом организме их достаточное количество. А вот незаменимые аминокислоты организм может получить только извне.
Незаменимые аминокислоты способствуют похудению. Худеющий человек может включить в свой рацион специальные пищевые добавки, которые содержат аминокислоты.
Наличие незаменимых аминокислот необходимо для нормального функционирования различных процессов в организме. При их нехватке человек становится аморфным, снижается активность, также начинается стремительный рост жировых тканей.
Получить незаменимые аминокислоты можно из различных продуктов: яйца, рыба, мясо. Самым богатым продуктом, содержащим незаменимые аминокислоты являются панты марала. Именно поэтому пантолечение так популярно в современном обществе.
К незаменимым аминокислотам относят следующие вещества:
- Изолейцин и лейцин участвуют в синтезе белка, способствуют укреплению иммунитета.
- Фенилаланин способствует выработке коллагена, а также норэпинерфина, за счет которого осуществляется передача нервных сигналов от органических тканей в головной мозг.
- Валин улучшает регенерацию клеток, а также дает человеку возможность чувствовать себя в хорошем состоянии при резких перепадах температуры.

- Метионин улучшает регенерацию клеток печени
Что такое аминокислоты и как их использовать?
Часто невозможно получить все необходимые питательные вещества с ежедневным рационом, особенно для активных людей. В долгосрочной перспективе недостаточное употребление питательных веществ может иметь множество негативных последствий не только для самочувствия, но и для здоровья.
Чтобы обеспечить организм всеми необходимыми питательными веществами, стоит сделать свое меню более полноценным и приобрести пищевые добавки, в том числе белки и их ингредиенты — аминокислоты.
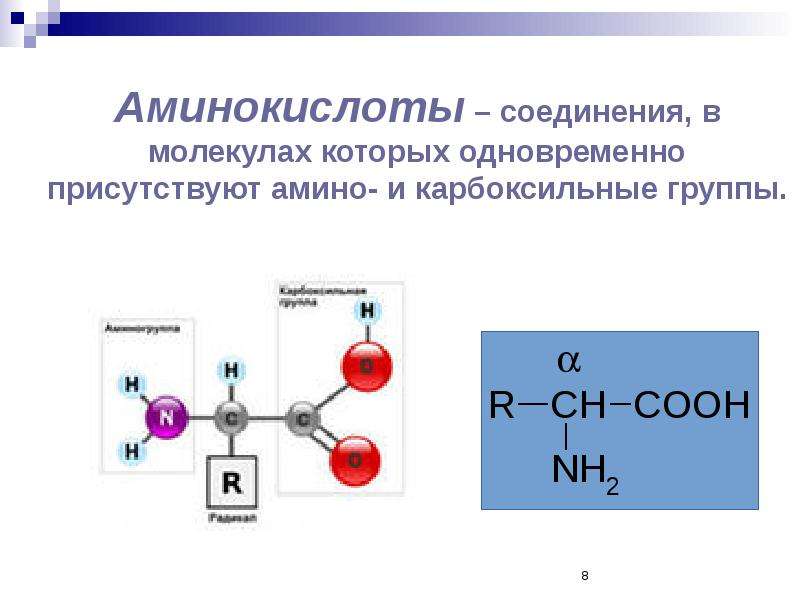
Аминокислоты — что это такое?Аминокислота — это органическое вещество, обладающее свойствами кислот и аминов. В сочетании с другими аминокислотами они образуют белки, из которых состоит любой организм, как животный, так и растительный. Белки, состоящие из аминокислот, составляют примерно пятую часть веса человеческого тела.
После воды вторым по важности компонентом в нашем организме являются аминокислоты и образующиеся из них белки, которые, в свою очередь, образуют ткани, а также обеспечивают процесс роста, различные биосинтетические и неврологические процессы.
Какие типы аминокислот существуют?
В природе существует множество различных аминокислот, но нашему организму необходимо 20 различных аминокислот, которые могут объединяться, образуя около 100 000 различных белков. Есть две основные группы аминокислот — незаменимые и заменимые аминокислоты.
Что такое незаменимые аминокислоты?9 аминокислот, в которых нуждается наш организм, являются незаменимыми аминокислотами. Это означает, что наш организм и его клетки не синтезируют или не могут самостоятельно создавать эти 9 аминокислот, поэтому они должны поступать в организм с пищей.
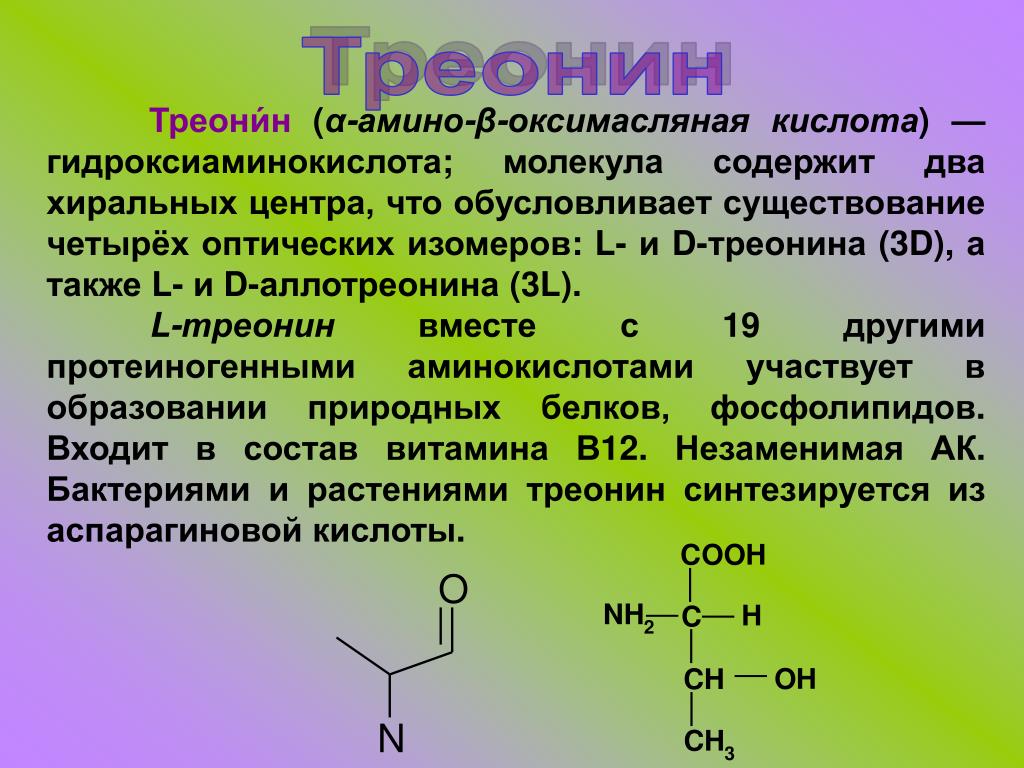
Вегетарианцам и веганам следует быть здесь особенно осторожными, поскольку лишь некоторые растительные продукты содержат все 9 незаменимых аминокислот — гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.
Поскольку организм не может вырабатывать незаменимые аминокислоты, необходимые организму, но они участвуют в различных процессах, важных для функций организма, особенно важно убедиться, что мы потребляем не только достаточное количество общих аминокислот, но и все незаменимые аминокислоты.
Недостаточное количество незаменимых аминокислот в рационе может вызвать серьезные проблемы со здоровьем.
Что такое заменимые аминокислоты?Заменимые аминокислоты — 11 из 20 аминокислот, которые человеческий организм способен создавать или синтезировать из других аминокислот, поэтому количество таких аминокислот в рационе не так важно, если потребляется достаточно белка, из которого организм может синтезировать соответствующие аминокислоты.
Какую роль в нашем организме играют аминокислоты?Как уже упоминалось, одна аминокислота связывается с другой для образования белков. Эти белки являются основой не только веса нашего тела, но и других важных функций организма. Например, гемоглобин в крови — это железосодержащий белок, который содержится в эритроцитах и называется эритроцитами. Гемоглобин используется для снабжения клеток организма кислородом и доставки углекислого газа из тканей в легкие.
Аминокислоты также отвечают за гормональные аспекты здоровья, поскольку они также участвуют в производстве различных пищеварительных ферментов и гормонов. Например, инсулин, один из важнейших метаболических гормонов, состоит из аминокислот.
Например, инсулин, один из важнейших метаболических гормонов, состоит из аминокислот.
Еще одна важная функция аминокислот — обеспечение энергией. В нормальных условиях организм использует углеводы в качестве источника энергии, но в ситуации, когда используются все основные ресурсы, такие как интенсивные физические тренировки, организм также способен вырабатывать энергию из аминокислот.
Если поступает недостаточное количество аминокислот, организму не хватает «сырья» для поддержки наиболее важных жизненных процессов, что приводит к ухудшению структуры волос, кожи и ногтей, ослаблению мышц и запуску мышечной атрофии.
Это означает, что для людей, которые хотят сохранить, но особенно увеличить мышечную массу, особенно важно убедиться, что в вашем рационе достаточно аминокислот.
Основные преимущества использования аминокислот- Функция развития мышц. Поскольку масса нашего тела в значительной степени состоит из белков, которые, в свою очередь, состоят из аминокислот, достаточное количество аминокислот обеспечивает развитие мышц и силу.

- Востановление. Период восстановления также является неотъемлемой частью активного образа жизни. Аминокислоты способствуют восстановлению мышц после тренировки.
- Сбалансированный уровень сахара в крови. Использование аминокислот позволяет контролировать уровень сахара без дополнительного инсулина.
- Улучшается состояние кожи, волос, ногтей. В ситуации, когда организму не хватает питательных веществ, аминокислоты, которые будут использоваться для обеспечения волос, ногтей и кожи, используются для других процессов. Волосы, ногти и кожа в основном состоят из одного белка — кератина, поэтому помимо аминокислот обеспечат человеческий организм всем необходимым сырьем для успешного не только различных обменных процессов, но и здоровой кожи, волос и ногтей.

Благодаря своим свойствам, таким как растворимость в воде, аминокислоты легко пить перорально. В качестве пищевой добавки аминокислоты доступны в виде порошка, таблеток и жидкости.
Рекомендуется употреблять аминокислоты между приемами пищи, а также до, после или во время тренировки, это во многом зависит от индивидуальных целей, для которых используются дополнительные аминокислоты.
Незаменимые есть: ученые заставили клетки давать ценные аминокислоты | Статьи
Специалисты Курчатовского геномного центра создали микроорганизмы, способные производить так называемые незаменимые аминокислоты в большом количестве. Эти вещества не образуются в организме человека и животных, но нормальная жизнедеятельность без них невозможна. Для разработки ученые применили технологию редактирования генома. В 2020 году мировой рынок незаменимых аминокислот достиг $20 млрд. Благодаря достижениям наших исследователей Россия сможет побороться на нем за ведущие позиции.
В Курчатовском геномном центре (НИЦ «Курчатовский институт» — ГосНИИгенетика) ведут работы по созданию микроорганизмов, которые смогут в большом количестве производить незаменимые аминокислоты. Особенность этих веществ в том, что организм не может их синтезировать, они поступают в него только с пищей. В сельском хозяйстве это — важнейшие составляющие кормов.
— Если незаменимые аминокислоты содержатся в недостаточном количестве в пище, то у человека нарушается нормальное развитие, а сельскохозяйственные животные медленно набирают вес, потребляя большое количество корма, — пояснил заместитель директора НИЦ «Курчатовский институт» Александр Яненко.
Специалисты уже подготовили инструментарий для направленной модификации продуцентов клеточных метаболитов в различных бактериях, включая коринебактерии, бациллы и другие простейшие организмы. В руках ученых специальные ферменты — «молекулярные ножницы», с помощью которых редактируют геномы для получения нужных штаммов. Кроме этого, чтобы направленно изменять геном (ДНК) клетки, нужно знать ее полные нуклеотидные последовательности, поэтому специалисты Курчатовского института проводят массовое полногеномное секвенирование микроорганизмов (полная расшифровка их генома). Сегодня прочитано уже больше 1 тыс.
Кроме этого, чтобы направленно изменять геном (ДНК) клетки, нужно знать ее полные нуклеотидные последовательности, поэтому специалисты Курчатовского института проводят массовое полногеномное секвенирование микроорганизмов (полная расшифровка их генома). Сегодня прочитано уже больше 1 тыс.
В обычных условиях в клетках микроорганизма содержится не более 0,2–0,5 г аминокислоты на литр питательной среды. Для промышленного производства нужно, чтобы клетка продуцировала не менее 100 г на 1 л. Такое количество аминокислоты выделяется в среднем за 40–50 ч.
Задача ученых — так изменить метаболизм микроорганизма, чтобы он направил все силы на генерацию нужных веществ. Уже сегодня ученым Курчатовского геномного центра удалось усилить в 100 раз продукцию микроорганизмами лизина, треонина и валина, а в ближайшее время они планируют добиться таких же результатов и для триптофана.
Справка «Известий»Валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин относятся к незаменимым аминокислотам. Эти вещества не синтезируются клетками человека и животных, поэтому должны обязательно содержаться в нужном количестве в их пище. Незаменимые аминокислоты принимают активное участие в синтезе белков и других важных для организма соединений. Они необходимы для нормального роста и синтеза тканей тела, служат источником энергии в мышечных клетках. Нехватка этих веществ может приводить к быстрой утомляемости, усталости, слабости и иным нарушениям. В природе незаменимые аминокислоты синтезируют микроорганизмы, растения и грибы.
Эти вещества не синтезируются клетками человека и животных, поэтому должны обязательно содержаться в нужном количестве в их пище. Незаменимые аминокислоты принимают активное участие в синтезе белков и других важных для организма соединений. Они необходимы для нормального роста и синтеза тканей тела, служат источником энергии в мышечных клетках. Нехватка этих веществ может приводить к быстрой утомляемости, усталости, слабости и иным нарушениям. В природе незаменимые аминокислоты синтезируют микроорганизмы, растения и грибы.
Раньше для получения микроорганизмов с нужными свойствами использовалась генная инженерия: в клетку встраивали чужеродные гены, чтобы получить больше нужной продукции. Но безопасность использования генно-модифицированных организмов вызывает слишком много вопросов, поэтому ученые разработали альтернативный метод геномного редактирования.
При таком подходе для модификации генов микроорганизма ученые используют механизмы, которые в норме существуют в клетке. В природных условиях гены изменяются, теряются или переходят с места на место. Эти процессы не выходят за рамки естественной клеточной изменчивости. То же самое ученые делают и при редактировании генов.
В природных условиях гены изменяются, теряются или переходят с места на место. Эти процессы не выходят за рамки естественной клеточной изменчивости. То же самое ученые делают и при редактировании генов.
Из тысячи клеточных метаболитов они активируют один, который в результате начинает работать в 100 раз активнее. Клетка препятствует этому сверхсинтезу и стремится исправить дисбаланс. Она отключает синтез этого вещества на уровне взаимодействия белков с ДНК. Поэтому, чтобы «обмануть» клетку, ученые корректируют механизмы ее регуляции, меняя последовательности или даже удаляя некоторые гены. Только так можно получить штамм с нужным уровнем продуктивности.
Не так давно ученые Курчатовского геномного центра проанализировали штаммы, которые были разработаны в 1970–1980-х годах для производства незаменимой аминокислоты валина. Тогда не существовало методов направленного изменения генома. Микроорганизмы просто обрабатывали веществами (мутагенами), которые повышали частоту образования мутаций. Сегодня удалось обнаружить конкретные мутации, отвечающие за выработку валина. Их успешно ввели в геном штамма-суперпродуцента.
Сегодня удалось обнаружить конкретные мутации, отвечающие за выработку валина. Их успешно ввели в геном штамма-суперпродуцента.
— В 2020 году мировой рынок незаменимых аминокислот составил около $20 млрд. Благодаря достижениям наших ученых Россия сможет обеспечить незаменимыми аминокислотами собственное животноводство, а также побороться за ведущие позиции на этом рынке, — считает Александр Яненко.
На верном путиПрочесть геномы более 1 тыс. микроорганизмов — уже значительный научный результат, уверен директор научного центра «RASA-Политех» Санкт-Петербургского политехнического университета Петра Великого (вуз — участник проекта повышения конкурентоспособности образования «5-100») Игорь Радченко.
— Обычно генетическая информация многомерна: один и тот же ген может одновременно влиять на несколько, казалось бы, независимых функций организма. Поэтому специалисты из Курчатовского института пошли по верному пути, взяв для модификации одноклеточные микроорганизмы, — отметил эксперт.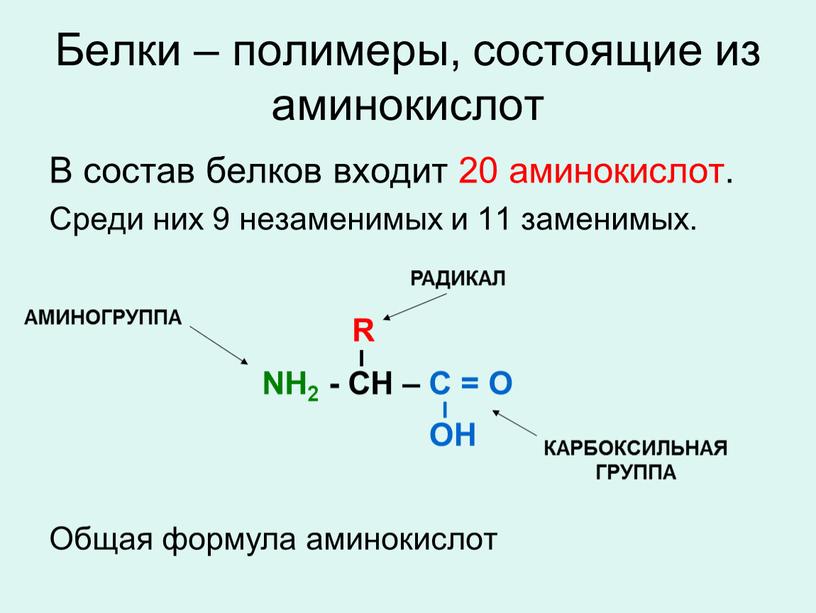
На примере единичных клеток легко увидеть результаты редактирования, полагает ученый. Кроме того, в процессе исследования можно отделить клетки, где процесс происходит удачно. Таким образом создается колония отредактированных клеток, которая продолжает делиться и развиваться. И все клетки-потомки несут именно те генетические изменения, которые были заложены изначально, добавил Игорь Радченко.
— Во всем мире проводят работы, направленные на получение эффективных штаммов-продуцентов. Безусловно, применение этих технологий в России имеет огромное значение как для развития отечественной промышленности, так и сельского хозяйства, — сказала доцент Исследовательской школы химических и биомедицинских технологий Томского политехнического университета Александра Першина.
Разработки в данной области довольно быстро коммерциализируются, добавила она.
Цены на аминокислоты выросли почти в два раза
Аминокислоты – это кормовые добавки, напрямую влияющие на образование тканей в организме животного. При недостатке этих веществ останавливается синтез белка, в результате чего животное может потерять мышечную массу. Аминокислоты (треонин, валин, метионин, триптофан, лизин) применяют в кормлении сельскохозяйственных животных, большая часть этой продукции – импортная.
При недостатке этих веществ останавливается синтез белка, в результате чего животное может потерять мышечную массу. Аминокислоты (треонин, валин, метионин, триптофан, лизин) применяют в кормлении сельскохозяйственных животных, большая часть этой продукции – импортная.
- «Например, цена на лизин из Китая на условиях поставки DAF (поставка до российской границы без последующей таможенной очистки. – Прим. ред.) выросла с 1,1 доллара за килограмм в октябре – ноябре прошлого года до 1,7–1,75 доллара за килограмм в январе 2021», – рассказал Сергей Михнюк.
Цена на треонин возросла с 0,98 до 1,54 доллара, на триптофан – с 7,5 до 9,8 доллара, на валин – с 2,35 до 4,1.
Основное сырье для производства аминокислот – кукуруза. Цены на нее еще в январе 2020 года достигли трехлетнего максимума. Связано это с неурожаем в США, Аргентине, Бразилии и на Украине – это основные поставщики сырья в Китай. К тому же в КНР выросло потребление кукурузы, прежде всего со стороны предприятий свиноводческого комплекса.
Вторая причина роста цен на аминокислоты – новая волна коронавируса в Китае, которая хотя и слабее предыдущей, но заставляет власти даже при единичных случаях выявления инфекции закрывать границы городов и провинций, приостанавливать отгрузки в портах.
- «Новые вспышки коронавирусной инфекции сейчас сильнее всего затронули северо-восточные провинции Китая, где сосредоточено наибольшее количество заводов по глубокой переработке кукурузы и производству аминокислот из этого сырья», – отметил Михнюк, добавив, что приостановка деятельности этих предприятий приводит к возникновению дефицита на рынке и увеличению цен.
Дополнительные сложности – логистические. Из-за рисков распространения коронавируса железная дорога Китая сократила число разрешений на отправку экспортных грузов, в особенности тех, где нужна ручная перегрузка, что привело к срыву ранее оговоренных поставок, в том числе аминокислот. К тому же в конце 2020 года в Китае сложился дефицит контейнеров для отправки грузов на экспорт. Отправленные ранее контейнеры застряли в Европе из-за новых ограничений, связанных с пандемией. Это привело к резкому росту цен на транспортные услуги, что отразилось и на стоимости перевозимого товара.
К тому же в конце 2020 года в Китае сложился дефицит контейнеров для отправки грузов на экспорт. Отправленные ранее контейнеры застряли в Европе из-за новых ограничений, связанных с пандемией. Это привело к резкому росту цен на транспортные услуги, что отразилось и на стоимости перевозимого товара.
В Национальном кормовом союзе прогнозируют, что цены на аминокислоты стабилизируются только к лету.
- «Цена должна стабилизироваться в связи с новым урожаем, а также потому, что заработает большее количество предприятий в Китае, возрастет конкуренция, будет создан рынок покупателя, а не продавца», – добавил Михнюк.
Подпишитесь на нас в Telegram, чтобы читать новости сразу, как только они появляются на сайте.
Аминокислоты, без которых нам не жить
Аминокислоты называют «строительным материалом» при синтезе в организме человека целого ряда белков. И любой белок – это цепочка из аминокислот, которые в определённой последовательности соединены между собой. При отсутствии хотя бы одной аминокислоты происходит сбой.
При отсутствии хотя бы одной аминокислоты происходит сбой.
Из двадцати известных аминокислот, восемь являются незаменимыми. То есть сам организм синтезировать их не может, поэтому должен получать их вместе с пищей. Если же он их не получает, то нарушается работа нервной системы, водно-солевой обмен и многие другие функции в организме.
К незаменимым кислотам относятся:
Валин, который с лейцином и изолейцином участвует в синтезе тканей тела и стимулирует их рост, все трое они служат источником энергии в мышечных клетках.
Валин отвечает за мышечную координацию, понижает чувствительность организма к жаре, холоду и боли, поддерживает уровень гормона «счастья» – серотонина.
Содержится: в мясе, грибах, бобовых, зерновых, арахисе и молочных продуктах.
Лейцин необходим для активизации умственной деятельности и хорошей памяти, он защищает мышечные волокна от повреждений, восстанавливает кожные покровы, мышцы и кости, стимулирует гормон роста и снижает уровень сахара в крови. Содержится в нежирном мясе, печени, рыбе, твороге, молоке, натуральном йогурте, кефире, гречихе, чечевице, овсе, неочищенном рисе, люцерне.
Содержится в нежирном мясе, печени, рыбе, твороге, молоке, натуральном йогурте, кефире, гречихе, чечевице, овсе, неочищенном рисе, люцерне.
Изолейцин так же отвечает за уровень сахара в крови, обеспечивает энергией все к летки и повышает выносливость. Содержится: в мясе птицы, печени, рыбе, яйцах, бобовых, чечевице, во ржи, миндале, кешью, сое, семечках.
Лизин отвечает за работу мозга и ясное мышление до глубокой старости, поддерживает энергию и следит за здоровьем сердца, оказывает сопротивление вирусам, способствует усвоению кальция, восстанавливает ткани, формируя коллаген. Содержится в мясе птицы, рыбе, молочных продуктах, бобовых, кукурузе, орехах, семечках, какао, в горьком шоколаде.
Метионин снижает содержание холестерина и улучшает работу печени, препятствует развитию депрессии.
Содержится в рыбе, желтке яиц, бобовых, зелёном горошке, гречихе, капусте, моркови, в апельсинах, арбузах и дыне.
Треонин – препятствует ожирению печени, участвует жировом и белковом обмене, повышает иммунитет. Содержится: в яйцах, молочных продуктах, бобовых, орехах.
Содержится: в яйцах, молочных продуктах, бобовых, орехах.
Триптофан нормализует психическое состояние, отвечает за нормальное функционирование мозга и замедляет общее старение организма. Кроме того снижает аппетит и способствует повышению выработки гормона роста. Содержится в мясе птицы, рыбе, молоке, твороге, бобовых, орехах, кунжуте, бананах, в винограде и таких сухофруктах, как курага, инжир, финики.
Фенилаланин снижает аппетит и повышает настроение, а так же отвечает за быстроту реакций и уменьшает чувствительность организма к боли. Содержится он в говядине, курином мясе, рыбе, яйцах, твороге, молоке, сметане.
Получается, что для того, чтобы обеспечить организм незаменимыми аминокислотами, нужно потратить не так уж много денег.
Бобовые, злаки, семечки, овощи стоят недорого, мясо птицы, молочные продукты, яйца тоже доступны, есть недорогие сорта рыбы. Дорогими можно назвать только шоколад, орехи и некоторые сухофрукты. Но и их в небольшом количестве можно себе позволить – те же финики и курагу в виде перекуса на работе вместо тоже недешёвых конфет.
Для того чтобы сохранить здоровье, врачи советуют не забывать о крестоцветных – всех видах капусты, о цитрусовых и листовых огородных травах. А так же об оливковом и подсолнечном масле.
Всё это вместе снизит риск развития сердечно-сосудистых заболеваний, инсультов, помешает образованию склеротических бляшек и развитию слабоумия в старости.
АМИНОКИСЛОТЫ | Global Pharma
Аминокислоты – эта частицы, из которых состоит белок. Каждая из них состоит из карбонового скелета, к которому присоединяется аминовая кислотная группа, атом углерода и боковая цепочка. Всего в организме человека встречаются 18 аминокислот – 10 из них – это эндогенные аминокислоты, то есть аминокислоты, которые наш организм может самостоятельно синтезировать путем энзиматических реакций, и 8 экзогенных, которые необходимы для правильной работы, но которые организм не способен сам вырабатывать в достаточном количестве. Поэтому они должны поступать отдельно, с пищей.
К эндогенным аминокислотам относятся: аланин, цистеин, глицин, аспаргиновая кислота, глутаминовая кислота, пролин, тирозин, гистидин, аргинин, серин
К экзогенным аминокислотам относятся: фенилаланин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, валин.
Эти кислоты отличаются друг от друга своим строением, свойствами и ролью в организме.
Мы производим препараты, содержащие аминокислоты BCAA, в том числе:
- L-лейцин,
- L-изолейцин,
- L-валин,
- L-тирозин,
- L-глутамин,
- L-триптофан,
- и многие другие.
Мы можем усилить препараты дополнительной дозой витаминов и минералов. Мы пользуемся услугами польских поставщиков сырья, предлагающих проверенные материалы самого высокого качества.
Весь производственный процесс строится на основе сертифицированной системы управления качеством ISO22000. Каждое изделие перед допуском в продажу проходит проверку по более чем десяти показателям, среди которых содержание тяжелых металлов, микробиологическая чистота, органолептические и физико-химические параметры, а также испытания, подтверждающие ожидаемое содержание вещества.
Продукцию мы можем упаковывать практически в любые упаковки, в том числе:
- дой-пак,
- капсулы,
- пакетики,
- банки,
- пластиковые и стеклянные упаковки.

Мы имеем оборудование для безопасного индукционного закрывания, а также дополнительные средства защиты термоусадочной пленкой для предотвращения открытия.
Приглашаем связаться с нами.
| Аминокислоты | |
Виды: — аминокислоты BCAA — витамины — минералы | Упаковки аминокислот BCAA: — твердые желатиновые и вегетарианские капсулы — дой-паки с замком вместимостью от 200 г до 5 кг — банки вместимостью от 200 г до 5 кг — пакетики от 7 до 30 г |
| Упаковки аминокислот BCAA | |
| |
Аминокислоты: виды, принцип действия, польза для мускулатуры
Аминокислоты являются необходимыми соединениями для организма и выполняют определенные функции. Они повышают эффективность тренировок, способствуют восстановлению и наращиванию мышц. Аминокислоты – это органические соединения, которые образуют белки. Они необходимы для роста и восстановления тканей тела, в том числе мышечной. Поэтому спортсменам и людям с тяжелой физической активностью рекомендовано увеличивать количество диетического белка в рационе. Особенно необходимы аминокислоты с разветвленной цепью, которые помогают структурировать состав волокон и добиться улучшения активности и выносливости.
Они повышают эффективность тренировок, способствуют восстановлению и наращиванию мышц. Аминокислоты – это органические соединения, которые образуют белки. Они необходимы для роста и восстановления тканей тела, в том числе мышечной. Поэтому спортсменам и людям с тяжелой физической активностью рекомендовано увеличивать количество диетического белка в рационе. Особенно необходимы аминокислоты с разветвленной цепью, которые помогают структурировать состав волокон и добиться улучшения активности и выносливости.
Существуют три группы аминокислот:
- незаменимые;
- заменимые;
- условно незаменимые.
Организм способен синтезировать заменимые аминокислоты. Незаменимые аминокислоты должны поступать с пищей или биодобавками, спортпитом. Условно незаменимые аминокислоты могут синтезироваться организмом, но во время стресса и болезней этот процесс может нарушаться. Рассмотрим эффекты аминокислот.
Уменьшение чувства усталости
Тренировка требует энергии и увеличивает потребность организма в калориях и аминокислотах. Незаменимые аминокислоты необходимы для улучшения результатов тренировок. Аминокислоты с разветвленной цепью – это три незаменимые аминокислоты, которые включают лейцин, изолейцин и валин.
Незаменимые аминокислоты необходимы для улучшения результатов тренировок. Аминокислоты с разветвленной цепью – это три незаменимые аминокислоты, которые включают лейцин, изолейцин и валин.
Специалисты доказали, что добавки BCAA могут снизить усталость и способствовать потере жира во время упражнений у людей со сниженным уровнем гликогена. То есть BCAA могут улучшить работоспособность, даже если организм израсходовал запасы.
Наращивание мышечной массы
Аминокислоты с разветвленной цепью присутствуют в больших количествах в мышечной ткани. Это может быть связано с их способностью стимулировать рост мышц. Исследования показали, что прием незаменимых аминокислот после тяжелых упражнений с отягощениями предотвращает разрушение мышц и способствует синтезу белка и росту мышц.
Быстрое восстановление, хорошие результаты
Спортивные добавки с аминокислотами способствуют восстановлению, повышают силу и выносливость. Интенсивные тренировки увеличивают потребность белков, поступающих с пищей. Следовательно, протеиновые и аминокислотные добавки, особенно при принятии в период перед и после тренировок, оказывают благотворное влияние на выносливость. Например, при таких упражнениях, как бег, анаэробные и силовые упражнения, тяжелая атлетика.
Следовательно, протеиновые и аминокислотные добавки, особенно при принятии в период перед и после тренировок, оказывают благотворное влияние на выносливость. Например, при таких упражнениях, как бег, анаэробные и силовые упражнения, тяжелая атлетика.
Аминокислота: полезные свойства и источники питания
Что такое аминокислоты?
Аминокислоты являются строительными блоками белка. Белки представляют собой длинные цепочки аминокислот. В вашем организме есть тысячи различных белков, каждый из которых выполняет важную работу. Каждый белок имеет свою последовательность аминокислот. Последовательность заставляет белок принимать разные формы и выполнять разные функции в организме.
Вы можете думать об аминокислотах как о буквах алфавита. Когда вы комбинируете буквы различными способами, вы получаете разные слова.То же самое и с аминокислотами — когда вы комбинируете их различными способами, вы получаете разные белки.
Какие существуют типы аминокислот?
Ваше тело нуждается в 20 различных видах аминокислот для правильного функционирования. Эти 20 аминокислот комбинируются по-разному, чтобы в организме образовывались белки.
Эти 20 аминокислот комбинируются по-разному, чтобы в организме образовывались белки.
Ваше тело вырабатывает сотни аминокислот, но не может вырабатывать девять необходимых вам аминокислот. Это так называемые незаменимые аминокислоты. Вы должны получать их из пищи, которую едите.Девять незаменимых аминокислот:
- Гистидин : Гистидин помогает вырабатывать химическое вещество мозга (нейротрансмиттер), называемое гистамином. Гистамин играет важную роль в иммунной функции организма, пищеварении, сне и сексуальной функции.
- Изолейцин : Изолейцин участвует в мышечном метаболизме и иммунной функции организма. Это также помогает вашему телу вырабатывать гемоглобин и регулировать энергию.
- Лейцин : Лейцин помогает организму вырабатывать белок и гормоны роста.Он также помогает наращивать и восстанавливать мышечную ткань, заживлять раны и регулировать уровень сахара в крови.
- Лизин : Лизин участвует в производстве гормонов и энергии.
 Это также важно для кальция и иммунной функции.
Это также важно для кальция и иммунной функции. - Метионин : Метионин способствует росту тканей организма, метаболизму и детоксикации. Метионин также помогает усвоению основных минералов, включая цинк и селен.
- Фенилаланин : Фенилаланин необходим для производства химических мессенджеров вашего мозга, включая дофамин, адреналин и норадреналин.Это также важно для производства других аминокислот.
- Треонин : Треонин играет важную роль в коллагене и эластине. Эти белки обеспечивают структуру вашей кожи и соединительной ткани. Они также помогают формировать сгустки крови, которые помогают предотвратить кровотечение. Треонин играет важную роль в жировом обмене и вашей иммунной функции.
- Триптофан : Триптофан помогает поддерживать правильный баланс азота в организме. Он также помогает вырабатывать химическое вещество мозга (нейротрансмиттер), называемое серотонином.Серотонин регулирует ваше настроение, аппетит и сон.

- Валин : Валин участвует в росте мышц, регенерации тканей и выработке энергии.
Ваше тело вырабатывает остальные 11 необходимых вам аминокислот. Это так называемые незаменимые аминокислоты. Заменимыми аминокислотами являются аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глутаминовая кислота, глутамин, глицин, пролин, серин и тирозин.
Некоторые заменимые аминокислоты классифицируются как условные.Это означает, что они считаются необходимыми только тогда, когда вы больны или испытываете стресс. Условные аминокислоты включают аргинин, цистеин, глютамин, тирозин, глицин, орнитин, пролин и серин.
Какова структура аминокислоты?
Аминокислота является органическим химическим веществом. Органические химические вещества содержат углерод-водородные связи. Все аминокислоты имеют одинаковую основную структуру. Каждая молекула имеет центральный атом углерода, связанный вместе с основной аминогруппой, группой карбоновой кислоты, атомом водорода и R-группой или группой боковой цепи. Группа R — это то, что отличает аминокислоты друг от друга. R-группа определяет химическую природу каждой аминокислоты. Химическая природа определяет, как он будет взаимодействовать с другими аминокислотами и окружающей средой.
Группа R — это то, что отличает аминокислоты друг от друга. R-группа определяет химическую природу каждой аминокислоты. Химическая природа определяет, как он будет взаимодействовать с другими аминокислотами и окружающей средой.
Аминокислоты соединяются пептидными связями и становятся белками. Затем силы других аминокислот и эффекты их R-групп сворачивают белок в определенные трехмерные формы.
Что делают аминокислоты?
Ваше тело использует аминокислоты для производства белков.Различные типы аминокислот и способ их соединения определяют функцию каждого белка. Таким образом, аминокислоты участвуют во многих важных ролях в вашем организме. Аминокислоты помогают:
- Разбить еду.
- Рост и восстановление тканей тела.
- Вырабатывать гормоны и химические вещества мозга (нейротрансмиттеры).
- Предоставить источник энергии.
- Поддержание здоровья кожи, волос и ногтей.
- Накачать мышцы.
- Укрепите свою иммунную систему.

- Поддерживайте нормальное пищеварение.
Сколько аминокислот мне нужно?
Вам не нужно есть продукты с аминокислотами при каждом приеме пищи, но важно поддерживать их баланс в течение дня. Рекомендуемая суточная доза каждой из незаменимых аминокислот на каждые 2,2 фунта массы тела составляет:
- Гистидин : 14 миллиграммов
- Изолейцин : 19 миллиграммов
- Лейцин : 42 миллиграмма
- Лизин : 38 миллиграммов
- Метионин : 19 миллиграммов
- Фенилаланин : 33 миллиграмма
- Треонин : 20 миллиграммов
- Триптофан : 5 миллиграммов
- Валин : 24 миллиграмма
Какие продукты содержат аминокислоты?
Незаменимые аминокислоты можно найти во многих различных продуктах.Лучшие источники аминокислот содержатся в животных белках, таких как говядина, птица и яйца. Животные белки наиболее легко усваиваются и используются организмом.
Животные белки наиболее легко усваиваются и используются организмом.
Продукты, содержащие все девять незаменимых аминокислот, называются полноценными белками. Эти продукты включают говядину, птицу, рыбу, яйца, молочные продукты, сою, лебеду и гречку.
Продукты, которые содержат некоторые, но не все незаменимые аминокислоты, называются неполными белками. Эти продукты включают орехи, семена, бобы и некоторые зерна. Если вы придерживаетесь вегетарианской или веганской диеты, вам необходимо включить несколько типов неполных белков, чтобы убедиться, что вы потребляете все девять незаменимых аминокислот.
Должен ли я принимать добавки с аминокислотами?
Обычно вы можете получить все незаменимые аминокислоты, необходимые вашему организму, соблюдая здоровую сбалансированную диету. Некоторые люди принимают добавки с аминокислотами, чтобы улучшить сон, улучшить настроение и улучшить спортивные результаты. Но Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) не одобрило эти добавки. Вы должны поговорить со своим лечащим врачом, прежде чем начинать принимать какие-либо добавки, включая добавки с аминокислотами.
Вы должны поговорить со своим лечащим врачом, прежде чем начинать принимать какие-либо добавки, включая добавки с аминокислотами.
Записка из клиники Кливленда
Аминокислоты являются строительными блоками белков.Это молекулы, которые нужны всем живым существам для производства белка, и вам нужно 20 из них, чтобы ваше тело функционировало должным образом. Ваше тело производит 11 необходимых аминокислот. Хорошая новость заключается в том, что вам не нужно делать ничего особенного, чтобы получить оставшиеся девять аминокислот, в которых нуждается ваш организм. Просто нужно питаться сбалансированно. Сосредоточьтесь на полноценных белках — продуктах, содержащих все девять незаменимых аминокислот, таких как мясо, яйца и молочные продукты. Неполноценные белки, такие как орехи и бобы, тоже хороши. Поговорите со своим лечащим врачом, если вам нужна помощь или предложения по получению достаточного количества аминокислот в вашем рационе.
Что такое аминокислоты? — Определение и структура — Видео и стенограмма урока
Боковые цепи
R-группа (боковая цепь) делает каждую аминокислоту уникальной. Каждая из 20 аминокислот имеет различную структуру боковой цепи. Боковые цепи содержат в основном атомы водорода, углерода и кислорода. Некоторые аминокислоты имеют атомы серы или азота в своих R-группах.
Каждая из 20 аминокислот имеет различную структуру боковой цепи. Боковые цепи содержат в основном атомы водорода, углерода и кислорода. Некоторые аминокислоты имеют атомы серы или азота в своих R-группах.
Каждая аминокислота имеет название, аббревиатуру и уникальный состав боковой цепи.
| Аминокислота | Аббревиатура | Линейная формула группы R |
|---|---|---|
| Аланин | Аля | Ч4 |
| Аргинин | Арг | HN=C(Nh3)-NH-(Ch3)3 |
| Аспарагин | Асн | х3Н-СО-Ч3 |
| Кислота аспарагиновая | Асп | HOOC-Ch3 |
| Цистеин | Цис | HS-Ch3 |
| Глутаминовая кислота | клей | HOOC-(Ch3)2 |
| Глутамин | Глн | h3N-CO-(Ch3)2 |
| Глицин | Гли | Х |
| Гистидин | Его | NH-CH=N-CH=C-Ch3 |
| Изолейцин | Иль | Ч4-Ч3-Ч(Ч4) |
| Лейцин | Лей | (Ч4)2-Ч-Ч3 |
| Лизин | Лис | х3Н-(Ч3)4 |
| Метионин | Встретил | Ч4-С-(Ч3)2 |
| Фенилаланин | Фе | К6Х5-Ч3 |
| Пролайн | Про | (Ч3)3 |
| Серин | Сер.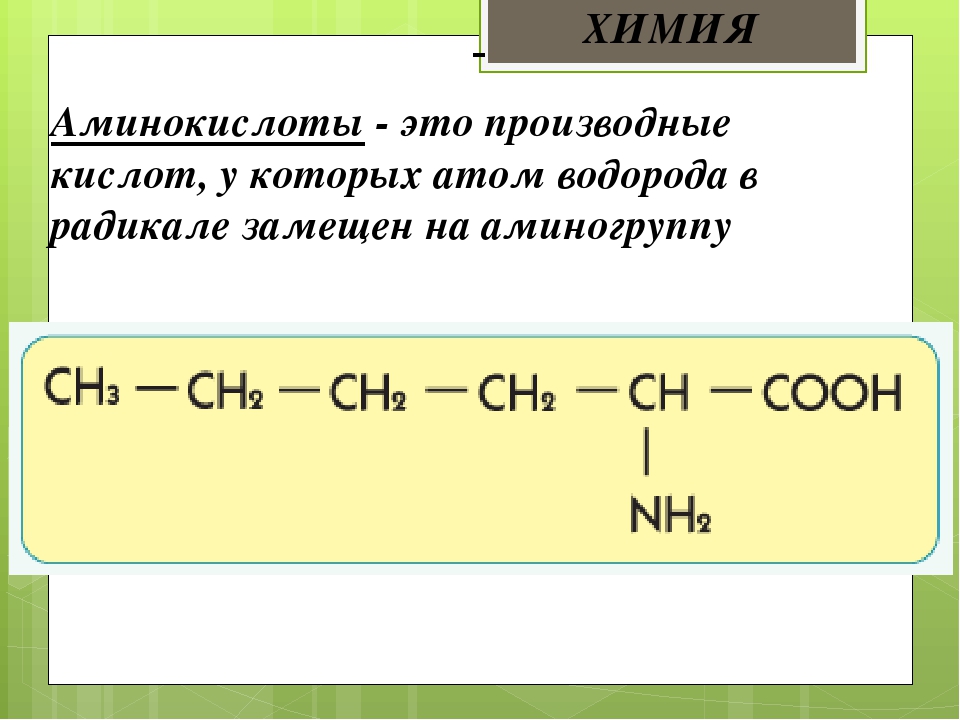 | НО-Ч3 |
| Треонин | Тр | Ч4-СН(ОН) |
| Триптофан | Трп | C6h5-NH-CH=C-Ch3 |
| Тирозин | Тыр | НО-C6h5-Ch3 |
| Валин | Вал | (Ч4)2-Ч |
Типы аминокислот
Некоторые аминокислоты считаются незаменимыми аминокислотами , которые наш организм не может производить самостоятельно.Мы должны получать незаменимые аминокислоты из продуктов, которые мы едим. Заменимые аминокислоты — это аминокислоты, которые наш организм может синтезировать независимо от того, что мы едим. Чтобы помочь вам вспомнить, вы можете подумать: «Важно, чтобы я ел пищу с незаменимыми аминокислотами!»
В организме человека имеется десять незаменимых и десять заменимых аминокислот. Однако аргинин — это особый случай. Взрослые могут синтезировать аргинин, а младенцы – нет. Таким образом, аргинин является незаменимой аминокислотой только для детей.
Таким образом, аргинин является незаменимой аминокислотой только для детей.
| Незаменимые аминокислоты | Заменимые аминокислоты |
|---|---|
| Аргинин | Аланин |
| Гистидин | Аспарагин |
| Изолейцин | Аспарагиновая кислота |
| Лейцин | Цистеин |
| Лизин | Глутаминовая кислота |
| Метионин | Глютамин |
| Фенилаланин | Глицин |
| Треонин | Пролин |
| Триптофан | Серин |
| Валин | Тирозин |
Большинство белков животного происхождения содержат все незаменимые аминокислоты, поэтому их легко получить из пищи, если вы едите продукты животного происхождения.Если вы вегетарианец, получить все аминокислоты, необходимые вашему организму, немного сложнее. Это связано с тем, что в большинстве растительных белков отсутствует несколько незаменимых аминокислот. Вам просто нужно будет есть самые разные растения, чтобы убедиться, что вы получаете все незаменимые аминокислоты.
Это связано с тем, что в большинстве растительных белков отсутствует несколько незаменимых аминокислот. Вам просто нужно будет есть самые разные растения, чтобы убедиться, что вы получаете все незаменимые аминокислоты.
Краткий обзор урока
Аминокислоты — это молекулы, используемые для построения белков. Все аминокислоты имеют центральный атом углерода, окруженный атомом водорода, карбоксильной группой (COOH), аминогруппой (Nh3) и R-группой.Это R-группа или боковая цепь, которая отличается между 20 аминокислотами. Незаменимые аминокислоты — это те, которые ваш организм не может производить. Ваше тело может вырабатывать заменимую аминокислоту .
Аминокислоты – важные термины
- Аминокислоты : молекулы, используемые для создания белков
- Незаменимые аминокислоты : те кислоты, которые организм не может производить, но нуждается в них
- Заменимые аминокислоты : аминокислоты, которые организм может вырабатывать
Результаты обучения
Цель этого урока — помочь вам:
- Определить, что такое аминокислоты, и перечислить их пять основных частей
- Опишите различные структуры многих аминокислот
- Назовите несколько типов аминокислот
- Определение важности незаменимых и заменимых аминокислот для организма
Заменимые и незаменимые аминокислоты для человека | Журнал питания
РЕЗЮМЕ
Здесь мы сравнили традиционное определение незаменимых и незаменимых аминокислот для питания человека с классификациями, основанными на метаболизме и функции аминокислот. Три точки зрения приводят к несколько различным интерпретациям. С точки зрения питания совершенно очевидно, что некоторые аминокислоты абсолютно необходимы для поддержания нормального роста. Тем не менее, в литературе можно найти реакцию роста на недостаток незаменимых аминокислот. С чисто метаболической точки зрения есть только три незаменимые аминокислоты (лизин, треонин и триптофан) и две незаменимые аминокислоты (глутамат и серин). Кроме того, рассмотрение метаболизма аминокислот in vivo приводит к определению третьего класса аминокислот, называемых условно незаменимыми, синтез которых может осуществляться млекопитающими, но может быть ограничен множеством факторов.Эти факторы включают диетическое обеспечение соответствующих предшественников, а также зрелость и здоровье человека. С функциональной точки зрения все аминокислоты являются незаменимыми, и разрабатываются аргументы в пользу идеи критической важности заменимых и условно незаменимых аминокислот для физиологической функции.
Три точки зрения приводят к несколько различным интерпретациям. С точки зрения питания совершенно очевидно, что некоторые аминокислоты абсолютно необходимы для поддержания нормального роста. Тем не менее, в литературе можно найти реакцию роста на недостаток незаменимых аминокислот. С чисто метаболической точки зрения есть только три незаменимые аминокислоты (лизин, треонин и триптофан) и две незаменимые аминокислоты (глутамат и серин). Кроме того, рассмотрение метаболизма аминокислот in vivo приводит к определению третьего класса аминокислот, называемых условно незаменимыми, синтез которых может осуществляться млекопитающими, но может быть ограничен множеством факторов.Эти факторы включают диетическое обеспечение соответствующих предшественников, а также зрелость и здоровье человека. С функциональной точки зрения все аминокислоты являются незаменимыми, и разрабатываются аргументы в пользу идеи критической важности заменимых и условно незаменимых аминокислот для физиологической функции.
В течение как минимум 60 лет было принято делить аминокислоты на две категории: незаменимые (или незаменимые) и незаменимые (или заменимые). Эта категоризация обеспечивает удобный и, как правило, полезный способ рассмотрения аминокислотного питания. Однако, несмотря на долговечность конвенции, по мере поступления дополнительной информации различия между незаменимыми и незаменимыми аминокислотами, по крайней мере, на метаболическом уровне, становятся все более размытыми. В самом деле, В.К. Роуз, ответственный за первоначальное определение этих двух терминов, не был особенно очарован тем, как они применялись другими, и написал следующее (Womack and Rose, 1947):
Эта категоризация обеспечивает удобный и, как правило, полезный способ рассмотрения аминокислотного питания. Однако, несмотря на долговечность конвенции, по мере поступления дополнительной информации различия между незаменимыми и незаменимыми аминокислотами, по крайней мере, на метаболическом уровне, становятся все более размытыми. В самом деле, В.К. Роуз, ответственный за первоначальное определение этих двух терминов, не был особенно очарован тем, как они применялись другими, и написал следующее (Womack and Rose, 1947):
«Мы подчеркнули, что несколько раз… что классификация аминокислот, таких как аргинин или глутаминовая кислота, как необязательных или незаменимых является чисто вопросом определения.
Я хочу рассмотреть этот «вопрос определения», изучив термины с точки зрения питания, обмена веществ и функций.
Пищевые определения незаменимых и незаменимых аминокислот
Важно помнить, что термины «незаменимый» и «незаменимой» первоначально были определены не только в терминах питания, но и в связи с ролью аминокислот в поддержании отложения белка и роста. На самом деле, насколько я могу установить, первоначальное определение незаменимой аминокислоты в питании (Borman et al.1946) было: «Тот, который не может быть синтезирован животным организмом из материалов обычно доступных клеткам со скоростью соизмеримой с потребностями нормального роста. “
На самом деле, насколько я могу установить, первоначальное определение незаменимой аминокислоты в питании (Borman et al.1946) было: «Тот, который не может быть синтезирован животным организмом из материалов обычно доступных клеткам со скоростью соизмеримой с потребностями нормального роста. “
Ключевые фразы в этом определении, а также фразы, которые, по сути, выделены авторами курсивом, это «обычно доступные», «со скоростью» и «нормальный рост». Каждый из них является важным квалификатором.
Фраза «обычно доступный» важна, потому что ряд питательно незаменимых аминокислот, напр.g., аминокислоты с разветвленной цепью, фенилаланин и метионин, могут быть синтезированы переаминированием аналогичных им α-кетокислот. Однако эти кетокислоты обычно не входят в рацион и, следовательно, «обычно недоступны для клеток». Фраза «со скоростью» важна, поскольку существуют обстоятельства, при которых скорость синтеза аминокислоты может быть ограничена, например, наличием соответствующих количеств метаболического азота.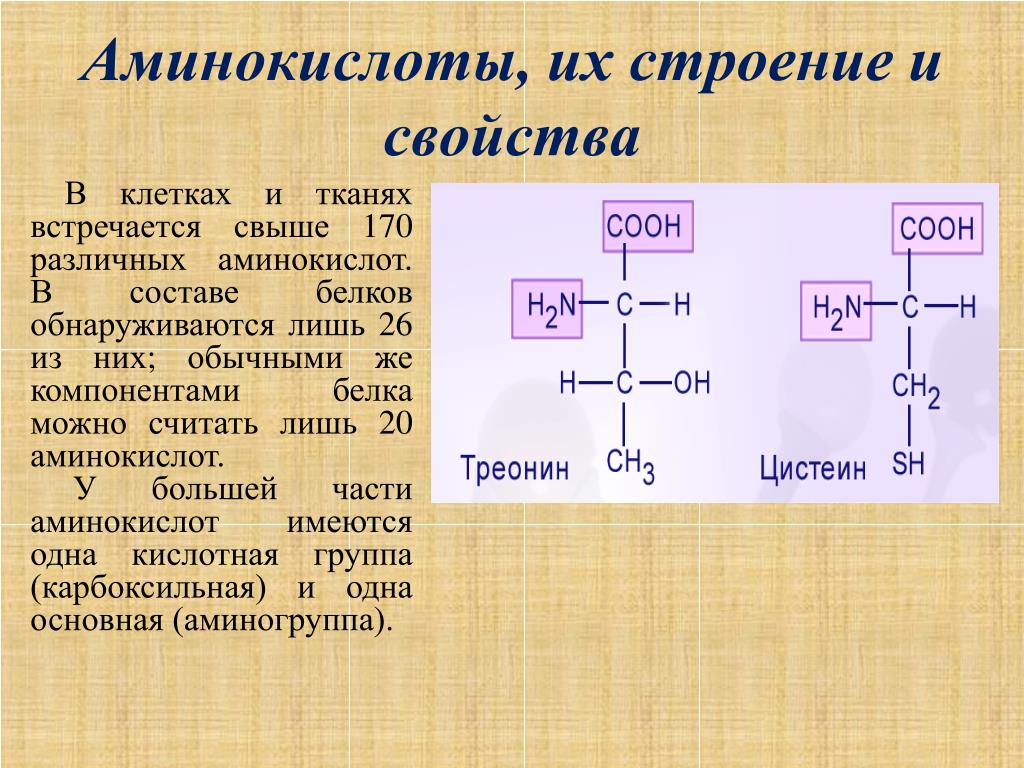 Действительно, скорость синтеза приобретает особую важность, когда мы рассматриваем группу аминокислот, представленную аргинином, цистеином, пролином и, возможно, глицином, которые часто описываются как условно незаменимые.Например, Womack и Rose (1947) сделали важный вывод о том, что степень, в которой аргинин можно считать незаменимым, во многом зависит от количества его естественных предшественников, пролина и глутамата, в рационе. Наконец, фраза «нормальный рост» важна в двух отношениях. Во-первых, это служит для того, чтобы подчеркнуть, что определения были первоначально построены в контексте роста. Например, можно показать (Таблица 1), что прием пищи, полностью лишенной глутамата, который в некотором роде можно рассматривать как старейший незаменимых аминокислот, приводит к небольшому, но статистически значимому замедлению темпов роста.Во-вторых, ограничение определения эссенциальности для роста не включает в себя важность некоторых аминокислот для путей избавления, отличных от отложения белка, предмет, который я обсуждаю позже.
Действительно, скорость синтеза приобретает особую важность, когда мы рассматриваем группу аминокислот, представленную аргинином, цистеином, пролином и, возможно, глицином, которые часто описываются как условно незаменимые.Например, Womack и Rose (1947) сделали важный вывод о том, что степень, в которой аргинин можно считать незаменимым, во многом зависит от количества его естественных предшественников, пролина и глутамата, в рационе. Наконец, фраза «нормальный рост» важна в двух отношениях. Во-первых, это служит для того, чтобы подчеркнуть, что определения были первоначально построены в контексте роста. Например, можно показать (Таблица 1), что прием пищи, полностью лишенной глутамата, который в некотором роде можно рассматривать как старейший незаменимых аминокислот, приводит к небольшому, но статистически значимому замедлению темпов роста.Во-вторых, ограничение определения эссенциальности для роста не включает в себя важность некоторых аминокислот для путей избавления, отличных от отложения белка, предмет, который я обсуждаю позже.
Влияние диеты, не содержащей глутамат + глутамин, на прибавку массы тела у крыс и свиней
Также можно определить заменимость и заменимость аминокислот с помощью химических и метаболических терминов.Изучение аминокислот, которые обычно считаются незаменимыми с точки зрения питания, показывает, что каждая из них имеет специфическую структурную особенность, синтез которой не может катализироваться ферментами млекопитающих (таблица 2). В связи с этим очень важно отметить, что утрата способности к осуществлению этих биосинтезов возникла в начале эволюции и является общей чертой метаболизма эукариотических организмов вообще, а не только млекопитающих. Однако с этой точки зрения важным термином является синтез de novo.Это связано с тем, что некоторые незаменимые аминокислоты могут быть синтезированы из предшественников, очень похожих по структуре. Например, метионин может быть синтезирован как трансаминированием его аналога кетокислоты, так и реметилированием гомоцистеина. В этом смысле млекопитающее способно синтезировать лейцин, изолейцин, валин, фенилаланин и метионин. Однако это не новый синтез, потому что кетокислоты с разветвленной цепью и гомоцистеин первоначально были получены из аминокислот с разветвленной цепью и метионина соответственно.Согласно этому ограниченному метаболическому определению незаменимости, треонин и лизин (и, возможно, триптофан) являются единственными действительно незаменимыми аминокислотами.
В этом смысле млекопитающее способно синтезировать лейцин, изолейцин, валин, фенилаланин и метионин. Однако это не новый синтез, потому что кетокислоты с разветвленной цепью и гомоцистеин первоначально были получены из аминокислот с разветвленной цепью и метионина соответственно.Согласно этому ограниченному метаболическому определению незаменимости, треонин и лизин (и, возможно, триптофан) являются единственными действительно незаменимыми аминокислотами.
Структурные особенности, делающие аминокислоты незаменимыми компонентами рациона млекопитающих
| Аминокислота . | Элемент конструкции . | |
|---|---|---|
| лейцин, изолейцин, валин | разветвленным алифатическим боковой цепи | |
| Лизин | Первичный амин | |
| Треонин | Вторичный спирт | |
| Метионин | Вторичный тиол | |
| Триптофан | индольного кольца | |
| фенилаланин | ароматическое кольцо | |
| Гистидин | Imidazole Ring |
аминокислота
. | Элемент конструкции . | ||
|---|---|---|---|
| лейцин, изолейцин, валин | разветвленным алифатическим боковой цепи | ||
| Лизин | Первичный амин | ||
| Треонин | Вторичный спирт | ||
| Метионин | Вторичный тиол | ||
| Триптофан | INDOLE RING | ||
| Фенилаланин | Ароматное кольцо | ||
| Гистидин | Имидазол | Imidazole Ring |
Структурные особенности, которые представляют аминокислоты Основные компоненты диеты млекопитающих
| аминокислота . | Элемент конструкции . | |
|---|---|---|
| лейцин, изолейцин, валин | разветвленным алифатическим боковой цепи | |
| Лизин | Первичный амин | |
| Треонин | Вторичный спирт | |
| Метионин | Вторичный тиол | |
| Триптофан | индольного кольца | |
| фенилаланин | ароматическое кольцо | |
| Гистидин | Imidazole Ring |
аминокислота
. | Элемент конструкции . |
|---|---|
| лейцин, изолейцин, валин | разветвленным алифатическим боковой цепи |
| Лизин | Первичный амин |
| Треонин | Вторичный спирт |
| Метионин | Вторичный тиол |
| Триптофан | Индольное кольцо |
| Фенилаланин | Ароматическое кольцо |
| Гистидин | Имидазольное кольцо |
 Этот вывод позволяет предположить, что вклад эндогенного синтеза в системные потоки глутамата и серина должен быть выше его вклада в потоки других заменимых аминокислот.По-видимому, это так (таблица 3). Интересно, что существует обратная связь между вкладом эндогенного синтеза в поток данной заменимой аминокислоты в плазме и степенью, в которой кишечник метаболизирует пищевые аминокислоты при первом прохождении (см. Reeds et al. 1996, Stoll et al. 1998). ТАБЛИЦА 3
Этот вывод позволяет предположить, что вклад эндогенного синтеза в системные потоки глутамата и серина должен быть выше его вклада в потоки других заменимых аминокислот.По-видимому, это так (таблица 3). Интересно, что существует обратная связь между вкладом эндогенного синтеза в поток данной заменимой аминокислоты в плазме и степенью, в которой кишечник метаболизирует пищевые аминокислоты при первом прохождении (см. Reeds et al. 1996, Stoll et al. 1998). ТАБЛИЦА 3Вклад эндогенного синтеза в системный поток заменимых аминокислот у человека
+ 1| Аминокислота . | Флюс из синтеза . | . | ||||
|---|---|---|---|---|---|---|
| . | Федеральный штат . | Состояние голодания . + | ||||
| % | ||||||
| Глутамат 1 | 98 | 98 | ||||
| Серин 1 | 94 | 95 | ||||
| аспартат 1 | 76 | 76 | 70 | 78 | ||
| Alanine 1 | 45 | 46 | ||||
| 3 9 | ||||||
| 9 | 14 | 10 | ||||
| Пролин 2 | 0 | 7 | ||||
Аминокислота
. | Флюс из синтеза . | . | ||||
|---|---|---|---|---|---|---|
| . | Федеральный штат . | Состояние голодания . 90 180 | ||||
| Глутамат 1 | 98 | 98 | ||||
| Серин 1 | 94 | 95 | ||||
| аспартат 1 | 76 | 76 | 70 | 78 | ||
| Alanine 1 | 45 | 46 | ||||
| 3 9 | ||||||
| 9 | 14 | 10 | ||||
| Proline 2 | 0 | 7 | ||||
| 7 | ||||||
Таблица 3
Вклад эндогенного синтеза в системный поток несущественных аминокислот в людях
+ 1 аминокислота
. | Флюс из синтеза . | . | ||||
|---|---|---|---|---|---|---|
| . | Федеральный штат . | Состояние голодания . + | ||||
| % | ||||||
| Глутамат 1 | 98 | 98 | ||||
| Серин 1 | 94 | 95 | ||||
| аспартат 1 | 76 | 76 | 70 | 78 | ||
| Alanine 1 | 45 | 46 | ||||
| 3 9 | ||||||
| 9 | 14 | 10 | ||||
| Пролин 2 | 0 | 7 | ||||
| Аминокислота . | Флюс из синтеза . | . | ||||
|---|---|---|---|---|---|---|
| . | Федеральный штат . | Состояние голодания . + | ||||
| Глутамат 1 | 98 | 98 | ||||
| Серин 1 | 94 | 95 | ||||
| аспартат 1 | 76 | 76 | 70 | 78 | ||
| Alanine 1 | 45 | 46 | ||||
| 3 9 | ||||||
| 9 | 14 | 10 | ||||
| Пролин 2 | 0 | 7 | ||||
Условно незаменимые аминокислоты
Хотя азот аминокислот, которые могут синтезировать млекопитающие, в конечном итоге происходит либо из глутамата, либо из серина, некоторые аминокислоты синтезируются более сложными путями, чем простое трансаминирование соответствующей кетокислоты. Эти аминокислоты часто называют «условно» незаменимыми, причем этот термин используется для обозначения того, что существуют измеримые ограничения скорости, с которой они могут быть синтезированы. Когда этот предел достигнут, рассматриваемая аминокислота становится важным компонентом диеты. Ограничения могут быть вызваны рядом факторов.
Эти аминокислоты часто называют «условно» незаменимыми, причем этот термин используется для обозначения того, что существуют измеримые ограничения скорости, с которой они могут быть синтезированы. Когда этот предел достигнут, рассматриваемая аминокислота становится важным компонентом диеты. Ограничения могут быть вызваны рядом факторов.
Во-первых, для синтеза этих аминокислот (Таблица 4) требуется другая аминокислота либо в качестве донора углерода, либо в качестве донора дополнительной группы, такой как группа серы цистеина.Таким образом, способность организма синтезировать данную условно незаменимую аминокислоту определяется доступностью ее аминокислотного предшественника, что было подчеркнуто Роузом в его исследованиях взаимодействий между глутаматом, пролином и аргинином в питании. В некоторых случаях, например, для поддержания запасов глицина у млекопитающих, питающихся молоком, потребность в синтезе условно незаменимых аминокислот (Jackson et al., 1981) требует увеличения синтеза их предшественника, в данном случае серина. .
.
Прекурсоры условно незаменимых аминокислот
| Продукт . | Прекурсор углерода . | Прочие прекурсоры . |
|---|---|---|
| Аргинин | глутамат / глутамин / пролин | Аммиак и аспартат N |
| Пролин | глутамат / глутамин | глутамат / глутамин |
| Цистеин | Серин | Метионин ( S ) |
| Глицин | Серин |
| Продукт . | Прекурсор углерода . | Прочие прекурсоры . |
|---|---|---|
| Аргинин | глутамат / глутамин / пролин | Аммиак и аспартат N |
| Пролин | глутамат / глутамин | глутамат / глутамин |
| Цистеин | Серин | Метионин ( S ) |
| Глицин | Серин |
 Прекурсор углерода
. Прочие прекурсоры
. Аргинин глутамат / глутамин / пролин Аммиак и аспартат N Пролин глутамат / глутамин глутамат / глутамин Цистеин Серин Метионин ( S ) Глицин Серин
Прекурсор углерода
. Прочие прекурсоры
. Аргинин глутамат / глутамин / пролин Аммиак и аспартат N Пролин глутамат / глутамин глутамат / глутамин Цистеин Серин Метионин ( S ) Глицин Серин| Продукт . | Прекурсор углерода . | Прочие прекурсоры . |
|---|---|---|
| Аргинин | глутамат / глутамин / пролин | Аммиак и аспартат N |
| Пролин | глутамат / глутамин | глутамат / глутамин |
| Цистеин | Серин | Метионин ( S ) |
| Глицин | Серин |
Во-вторых, некоторые аминокислоты могут синтезироваться только в ограниченном числе тканей. Например, синтез как пролина, так и аргинина в решающей степени зависит от кишечного метаболизма (Wakabayashi et al., 1994, Wu et al., 1997). Более того, в случае этих двух аминокислот имеющиеся данные свидетельствуют о том, что диетические, в отличие от системных, предшественники аминокислот являются обязательными (Бомье и др., 1995, Бертольд и др., 1995, Брантон и др., 1999, Мерфи и др.). , 1996, Столл и др., 1999). Из этого следует, что изменения как кишечного метаболизма, так и пути питания могут иметь решающее значение для способности организма синтезировать эти аминокислоты.Об этом ярко свидетельствуют проблемы гомеостаза аргинина и аммиака, сопровождающие полное парентеральное питание (Brunton et al., 1999).
Например, синтез как пролина, так и аргинина в решающей степени зависит от кишечного метаболизма (Wakabayashi et al., 1994, Wu et al., 1997). Более того, в случае этих двух аминокислот имеющиеся данные свидетельствуют о том, что диетические, в отличие от системных, предшественники аминокислот являются обязательными (Бомье и др., 1995, Бертольд и др., 1995, Брантон и др., 1999, Мерфи и др.). , 1996, Столл и др., 1999). Из этого следует, что изменения как кишечного метаболизма, так и пути питания могут иметь решающее значение для способности организма синтезировать эти аминокислоты.Об этом ярко свидетельствуют проблемы гомеостаза аргинина и аммиака, сопровождающие полное парентеральное питание (Brunton et al., 1999).
В-третьих, большинство данных свидетельствует о том, что даже в присутствии обильных количеств соответствующих предшественников количества условно незаменимых аминокислот, которые могут быть синтезированы, могут быть весьма ограниченными (Beaumier et al., 1995, Berthold et al. , 1995, Castillo et al., 1995). al., 1993, Fukagawa et al., 1996, Jaksic et al., 1987), поэтому можно утверждать, что существуют обстоятельства, особенно стрессовые, при которых метаболические потребности в аминокислотах возрастают до значений, выходящих за пределы биосинтетической способности организма. организм.Так обстоит дело и с пролиновым питанием обожженных (Jaksic et al., 1991). Более того, у незрелых людей, таких как дети с низким весом при рождении, возможно, что синтез условно незаменимых аминокислот может быть ограничен явным отсутствием ферментативной активности (Gaull et al., 1972).
, 1995, Castillo et al., 1995). al., 1993, Fukagawa et al., 1996, Jaksic et al., 1987), поэтому можно утверждать, что существуют обстоятельства, особенно стрессовые, при которых метаболические потребности в аминокислотах возрастают до значений, выходящих за пределы биосинтетической способности организма. организм.Так обстоит дело и с пролиновым питанием обожженных (Jaksic et al., 1991). Более того, у незрелых людей, таких как дети с низким весом при рождении, возможно, что синтез условно незаменимых аминокислот может быть ограничен явным отсутствием ферментативной активности (Gaull et al., 1972).
Эти комментарии, однако, должны быть умерены с осторожностью, потому что кажется вероятным, что метаболизм некоторых условно незаменимых аминокислот тесно разделен и, следовательно, изотопные измерения в пуле плазмы могут давать количественно вводящее в заблуждение представление о шкале биосинтез.Это, по-видимому, относится к метаболизму пролина, аргинина и цистеина, поскольку оценки скорости их синтеза из параллельных измерений поступления и протеолиза в организме не согласуются с оценками, основанными на включении изотопов меченых предшественников (см. Beaumier et al., 1995 и Berthold et al. 1995 г. для аргинина, Якшич и др., 1987 г. и Бертольд и др., 1995 г. для пролина). Кроме того, есть данные, позволяющие предположить, что вновь синтезированные условно незаменимые аминокислоты могут использоваться в клетках их происхождения и, следовательно, не уравновешиваются с пулом плазмы (Miller et al.1996). Тем не менее, даже с учетом этих неопределенностей представляется, что синтез этих аминокислот может стать ограничением для роста и других физиологических функций и что можно определить абсолютную, а не относительную потребность в пище.
Beaumier et al., 1995 и Berthold et al. 1995 г. для аргинина, Якшич и др., 1987 г. и Бертольд и др., 1995 г. для пролина). Кроме того, есть данные, позволяющие предположить, что вновь синтезированные условно незаменимые аминокислоты могут использоваться в клетках их происхождения и, следовательно, не уравновешиваются с пулом плазмы (Miller et al.1996). Тем не менее, даже с учетом этих неопределенностей представляется, что синтез этих аминокислот может стать ограничением для роста и других физиологических функций и что можно определить абсолютную, а не относительную потребность в пище.
Аминокислоты и физиологическая функция
Как я подчеркивал здесь ранее, первоначальные определения терминов «необходимый» и «необходимый» были сосредоточены на росте или, точнее, на отложении белка.Когда определения применяются таким образом, возникает относительно небольшая путаница, по крайней мере, в отношении незаменимых аминокислот. Количественно определить минимальную потребность в незаменимых аминокислотах для поддержки роста относительно легко, потому что они являются просто продуктом скорости отложения белка и аминокислотного состава откладывающихся белков.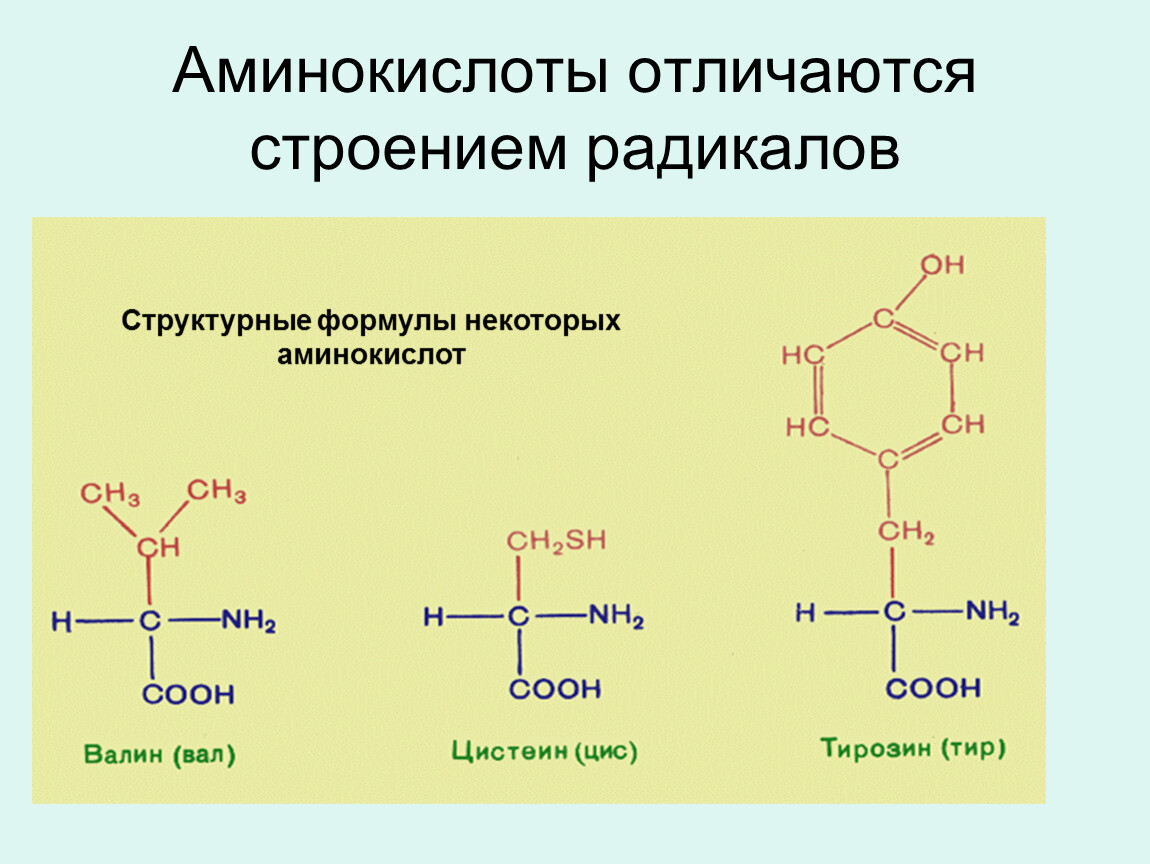 В связи с этим существует хороший консенсус в отношении того, что относительные потребности отдельных аминокислот для поддержания отложения белка очень схожи у разных видов млекопитающих (таблица 5).Другими словами, потребность в аминокислотах для поддержки отложения белка у младенца человека отличается от таковой у других млекопитающих только в той степени, в которой различаются их соответствующие скорости отложения белка.
В связи с этим существует хороший консенсус в отношении того, что относительные потребности отдельных аминокислот для поддержания отложения белка очень схожи у разных видов млекопитающих (таблица 5).Другими словами, потребность в аминокислотах для поддержки отложения белка у младенца человека отличается от таковой у других млекопитающих только в той степени, в которой различаются их соответствующие скорости отложения белка.
Состав незаменимых аминокислот смешанного белка организма неполовозрелых млекопитающих
ТАБЛИЦА 5Состав незаменимых аминокислот смешанного белка организма неполовозрелых млекопитающих
очень незначительная часть общей потребности в аминокислотах (Dewey et al.1996), и >90% общей потребности в аминокислотах, даже у маленького ребенка, связано с поддержанием запасов белка в организме (т. е. с азотным балансом). Сформулировать потребность в аминокислотах для «поддержания» сложно, и это до сих пор является предметом споров (см.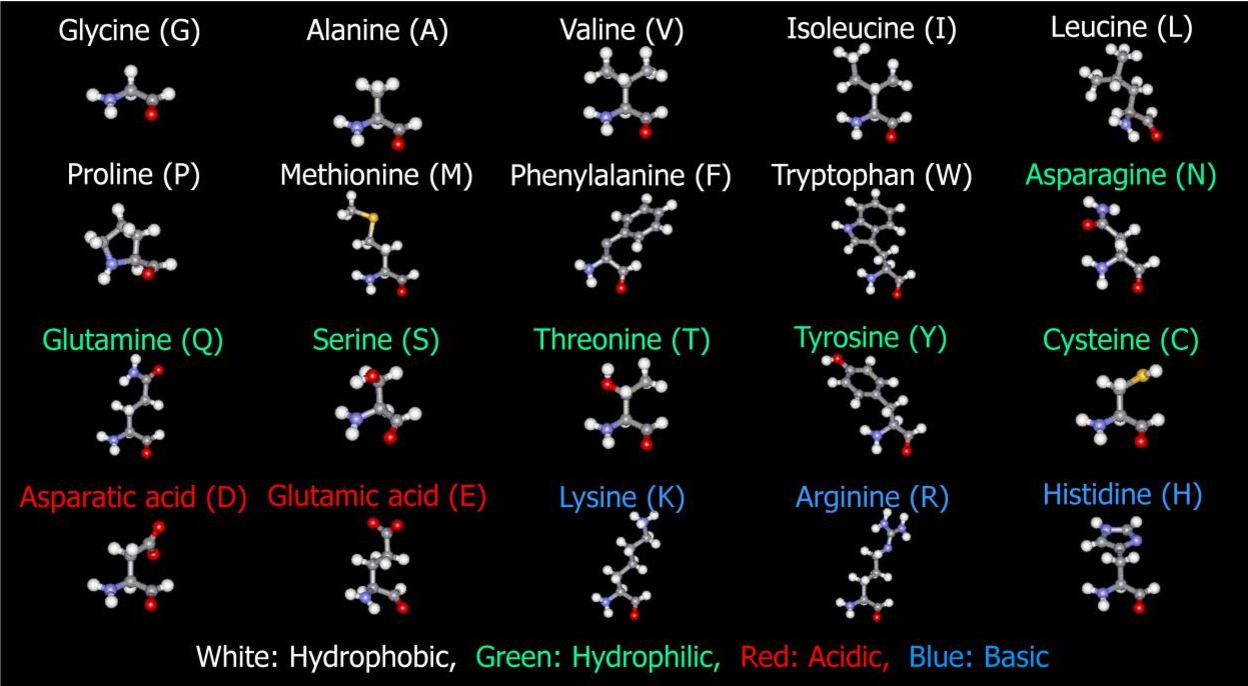 Young and Borgonha 2000).
Young and Borgonha 2000).
Не менее важной, чем технические и экспериментальные трудности, связанные с измерением потребности в аминокислотах для поддержания жизнедеятельности (Fuller and Garlick, 1994), является проблема идентификации процессов, в которых потребляются аминокислоты, близкие к азотному равновесию.Часть этих потребностей, конечно же, напрямую связана с белковым метаболизмом и отражает два взаимосвязанных фактора: маловероятно, что аминокислоты, высвобождаемые в результате деградации тканевого белка, рециркулируются с полной эффективностью, и что присутствие конечных концентраций свободных аминокислот неизбежно приводит к некоторой степени катаболизма. Также появляется все больше доказательств того, что значительная часть потребности в некоторых незаменимых аминокислотах может отражать <100%-ную эффективную рециркуляцию кишечного секрета (Fuller et al.1994, Fuller and Reeds, 1998. Этот аспект базовых или поддерживающих потребностей в аминокислотах поддается прямому измерению, хотя некоторые технические аспекты этих измерений, особенно те, которые связаны с метаболической функцией кишечного белка, вызывают трудности (см. Fuller and Reeds, 1998). . Однако по мере накопления дополнительной информации становится все более очевидным, что аминокислоты участвуют (и, следовательно, потребляются) в ряде физиологических функций, не связанных непосредственно с метаболизмом белков.
Fuller and Reeds, 1998). . Однако по мере накопления дополнительной информации становится все более очевидным, что аминокислоты участвуют (и, следовательно, потребляются) в ряде физиологических функций, не связанных непосредственно с метаболизмом белков.
Прежде чем перейти к обсуждению этих путей, важно подчеркнуть два дополнительных момента. Во-первых, при потреблении белка, которого как раз достаточно для поддержания баланса белков в организме, сам метаболический азот, а не какая-либо отдельная аминокислота, может быть ограничивающим питательным веществом. Другими словами, из-за нехватки азота способность организма синтезировать аминокислоты может быть нарушена до такой степени, что потребление заменимых аминокислот может стать ограничивающим. Это может быть особенно применимо к состояниям, связанным с потреблением небольшого количества так называемых белков высокого качества (т.т. е. белки, которые хорошо сбалансированы для отложения белка и, следовательно, с высоким соотношением незаменимых аминокислот к заменимым аминокислотам). Во-вторых, в настоящее время имеются данные, показывающие, что взрослый человек способен снизить катаболизм любой отдельной аминокислоты почти до нуля, если эта аминокислота является сильно лимитирующей (Raguso et al., 1999). Однако скорость катаболизма аминокислоты, наблюдаемая в этих условиях, намного ниже, чем скорость, наблюдаемая, когда белок в целом является ограничивающим диетическим питательным веществом.Одно из объяснений этого наблюдения заключается в том, что в условиях безбелкового кормления пул свободных аминокислот образуется исключительно в результате протеолиза тканей, так что все аминокислоты являются в равной степени лимитирующими. Следствием этого является то, что использование любой отдельной аминокислоты для поддержки небелкового процесса автоматически ограничивает способность организма перерабатывать все остальные обратно в запасы белка в организме. Возникают следующие вопросы: что это за небелковые пути потребления и каково их количественное влияние на потребность в аминокислотах в целом? Короткий ответ на оба вопроса прост: текущей информации недостаточно, чтобы дать точные ответы.
Во-вторых, в настоящее время имеются данные, показывающие, что взрослый человек способен снизить катаболизм любой отдельной аминокислоты почти до нуля, если эта аминокислота является сильно лимитирующей (Raguso et al., 1999). Однако скорость катаболизма аминокислоты, наблюдаемая в этих условиях, намного ниже, чем скорость, наблюдаемая, когда белок в целом является ограничивающим диетическим питательным веществом.Одно из объяснений этого наблюдения заключается в том, что в условиях безбелкового кормления пул свободных аминокислот образуется исключительно в результате протеолиза тканей, так что все аминокислоты являются в равной степени лимитирующими. Следствием этого является то, что использование любой отдельной аминокислоты для поддержки небелкового процесса автоматически ограничивает способность организма перерабатывать все остальные обратно в запасы белка в организме. Возникают следующие вопросы: что это за небелковые пути потребления и каково их количественное влияние на потребность в аминокислотах в целом? Короткий ответ на оба вопроса прост: текущей информации недостаточно, чтобы дать точные ответы. Тем не менее, можно предположить, какие пути могут быть наиболее важными на уровне общей физиологической функции.
Тем не менее, можно предположить, какие пути могут быть наиболее важными на уровне общей физиологической функции.
Для развития этих гипотез полезно рассмотреть те функции, которые необходимы для поддержания здоровья. Это не новый подход, поскольку его полезность была оценена некоторыми основателями науки о питании. Например, Voit (1902), цитируемый Lusk (1922), писал следующее:
«Поэтому я придерживаюсь своей «старой» точки зрения, точки зрения чистого метаболизма… вещества разрушаются при различных обстоятельствах… и сколько разных материалов нужно кормить, чтобы поддерживало тело в форме.
На мой взгляд, четыре системы критически важны для «поддержания в состоянии» организма: кишечник для поддержания всасывательной и защитной функции; иммунная система и другие аспекты защиты; скелетно-мышечная система; и центральной нервной системы. В каждой системе можно определить критические метаболические роли некоторых конкретных аминокислот (таблица 6).
ТАБЛИЦА 6Участие аминокислот в физиологических и метаболических функциях
Система
. | Функция . | Товар . | Прекурсор . | ||||||
|---|---|---|---|---|---|---|---|---|---|
| кишечник | ATP | ATP | GLU, ASP, Glutamine | ||||||
| Глутрайн, GLY, ASP | |||||||||
| Glutathione | Cys, GLU, GLY | ||||||||
| Arg | |||||||||
| Mucins | Thr, Cys, Ser, Pro | ||||||||
| Скелетные мышцы | Генерация энергии | Create | Gly, Arg, Met | ||||||
| Пероксидативная защита | Taurine (?) | CYS | CYS | Нервная система | Adrenergic | Phe | |||
| серотинергический | Попробуйте 9 0150 | ||||||||
| Glutaminergic | Глу | ||||||||
| глицинергических | Гли | ||||||||
| Окись азота | Арг | ||||||||
| перекисного защита | Таурин (? ) | CYS | |||||||
| Immenty System | Lymphote Priniferater | (?) | Глутамин, ARG, ASP | ||||||
| Пероксидативная защита | Glutathione | CYS, GLU, GLY | |||||||
| Сердечно-сосудистые | Регуляция кровяного давления | Оксид азота | ARG | Arg | |||||
| Пероксидативная защита (?) | Red Cell Glutathione | CYS, GLU, GLY |
Система
. | Функция . | Товар . | Прекурсор . | ||||||
|---|---|---|---|---|---|---|---|---|---|
| кишечник | ATP | ATP | GLU, ASP, Glutamine | ||||||
| Глутрайн, GLY, ASP | |||||||||
| Glutathione | Cys, GLU, GLY | ||||||||
| Arg | |||||||||
| Mucins | Thr, Cys, Ser, Pro | ||||||||
| Скелетные мышцы | Генерация энергии | Create | Gly, Arg, Met | ||||||
| Пероксидативная защита | Taurine (?) | CYS | CYS | Нервная система | Adrenergic | Phe | |||
| серотинергический | Попробуйте 9 0150 | ||||||||
| Glutaminergic | Глу | ||||||||
| глицинергических | Гли | ||||||||
| Окись азота | Арг | ||||||||
| перекисного защита | Таурин (? ) | CYS | |||||||
| Immenty System | Lymphote Priniferater | (?) | Глутамин, ARG, ASP | ||||||
| Пероксидативная защита | Glutathione | CYS, GLU, GLY | |||||||
| Сердечно-сосудистые | Регуляция кровяного давления | Оксид азота | Arg | Arg | |||||
| Пероксидационная защита (?) | Red Cell Glutathione | CYS, GLU, GLY |
Привлечение аминокислот в физиологии и метаболизм функция IC
Система
. | Функция . | Товар . | Прекурсор . | ||||||
|---|---|---|---|---|---|---|---|---|---|
| кишечник | ATP | ATP | GLU, ASP, Glutamine | ||||||
| Глутрайн, GLY, ASP | |||||||||
| Glutathione | Cys, GLU, GLY | ||||||||
| Arg | |||||||||
| Mucins | Thr, Cys, Ser, Pro | ||||||||
| Скелетные мышцы | Генерация энергии | Create | Gly, Arg, Met | ||||||
| Пероксидативная защита | Taurine (?) | CYS | CYS | Нервная система | Adrenergic | Phe | |||
| серотинергический | Попробуйте 9 0150 | ||||||||
| Glutaminergic | Глу | ||||||||
| глицинергических | Гли | ||||||||
| Окись азота | Арг | ||||||||
| перекисного защита | Таурин (? ) | CYS | |||||||
| Immenty System | Lymphote Priniferater | (?) | Глутамин, ARG, ASP | ||||||
| Пероксидативная защита | Glutathione | CYS, GLU, GLY | |||||||
| Сердечно-сосудистые | Регуляция кровяного давления | Оксид азота | ARG | Arg | |||||
| Пероксидативная защита (?) | Red Cell Glutathione | CYS, GLU, GLY |
Система
. | Функция . | Товар . | Прекурсор . | ||||||
|---|---|---|---|---|---|---|---|---|---|
| кишечник | ATP | ATP | GLU, ASP, Glutamine | ||||||
| Глутрайн, GLY, ASP | |||||||||
| Glutathione | Cys, GLU, GLY | ||||||||
| Arg | |||||||||
| Mucins | Thr, Cys, Ser, Pro | ||||||||
| Скелетные мышцы | Генерация энергии | Create | Gly, Arg, Met | ||||||
| Пероксидативная защита | Taurine (?) | CYS | CYS | Нервная система | Adrenergic | Phe | |||
| серотинергический | Попробуйте 9 0150 | ||||||||
| Glutaminergic | Глу | ||||||||
| глицинергических | Гли | ||||||||
| Окись азота | Арг | ||||||||
| перекисного защита | Таурин (? ) | CYS | |||||||
| Immenty System | Lymphote Priniferater | (?) | Глутамин, ARG, ASP | ||||||
| Пероксидативная защита | Glutathione | CYS, GLU, GLY | |||||||
| Сердечно-сосудистые | Регуляция кровяного давления | Оксид азота | ARG | ARG | |||||
| Пероксидативная защита (?) | Глутатион | CYS, GLU, GLY |
Возможно, самый интересный момент, который возникает из рассмотрения Т 6 заключается в том, что за исключением участия фенилаланина и триптофана в поддержании адренергической и серотонинергической нейротрансмиттерных систем и метионина как донора метильных групп для синтеза креатина, необходимыми предшественниками являются заменимые или условно незаменимые аминокислоты. При этом возникает соблазн утверждать, что способность поддерживать синтез этих аминокислот имеет достаточно высокий функциональный приоритет, так что в условиях, в которых белок (азот) является лимитирующим, незаменимые аминокислоты используются для поддержания этих путей. В Таблице 7 я попытался сравнить оценки оборота или потерь некоторых важных конечных продуктов с кинетикой их аминокислот-предшественников. Это сравнение позволяет предположить, что некоторые пути, например производство таурина и оксида азота, имеют незначительное количественное влияние на питание предшественников, в то время как другие имеют гораздо большее значение.Таким образом, синтез креатина (оцененный по экскреции креатинина) и оборот глутатиона (оцененный по измерениям в плазме и эритроцитах) оказывают существенное влияние на использование некоторых предшественников, особенно если скорость синтеза продукта противопоставлена потребление или чистый синтез предшественника. Продолжающийся синтез этих двух конечных продуктов, один из которых участвует в передаче энергии как в мускулатуре, так и в центральной нервной системе, а другой является критическим фактором в механизмах детоксикации, по-видимому, оказывает существенное потенциальное влияние на состояние питания человека.
При этом возникает соблазн утверждать, что способность поддерживать синтез этих аминокислот имеет достаточно высокий функциональный приоритет, так что в условиях, в которых белок (азот) является лимитирующим, незаменимые аминокислоты используются для поддержания этих путей. В Таблице 7 я попытался сравнить оценки оборота или потерь некоторых важных конечных продуктов с кинетикой их аминокислот-предшественников. Это сравнение позволяет предположить, что некоторые пути, например производство таурина и оксида азота, имеют незначительное количественное влияние на питание предшественников, в то время как другие имеют гораздо большее значение.Таким образом, синтез креатина (оцененный по экскреции креатинина) и оборот глутатиона (оцененный по измерениям в плазме и эритроцитах) оказывают существенное влияние на использование некоторых предшественников, особенно если скорость синтеза продукта противопоставлена потребление или чистый синтез предшественника. Продолжающийся синтез этих двух конечных продуктов, один из которых участвует в передаче энергии как в мускулатуре, так и в центральной нервной системе, а другой является критическим фактором в механизмах детоксикации, по-видимому, оказывает существенное потенциальное влияние на состояние питания человека. Действительно, данные, полученные на свиньях с дефицитом белка (Jahoor et al., 1995) и у бессимптомных пациентов с ВИЧ-инфекцией (Jahoor et al., 1999), демонстрируют, что поступление белка и цистеина может заметно изменить способность организма поддерживать синтез глутатиона. .
Действительно, данные, полученные на свиньях с дефицитом белка (Jahoor et al., 1995) и у бессимптомных пациентов с ВИЧ-инфекцией (Jahoor et al., 1999), демонстрируют, что поступление белка и цистеина может заметно изменить способность организма поддерживать синтез глутатиона. .
Потенциальный вклад синтеза функционально важных конечных продуктов в потребности в аминокислотах у взрослых людей
9 9014 9| . | Глутамат . | Глицин . | Цистеин . | аргинин . | Метионин . | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Кинетика [μmol / (кг · д)] | |||||||||||
| 4200 1 | 3960 2 | 1320 3 9 | 1800 4 | 528 | |||||||
| «net» Синтез | 358 5 | 2730 5 | 96 6 | 180 7 | 168 8 9 | ||||||
| Концевая продукция Производство [μMol / (кг · D)] | |||||||||||
| Creatine 9 | 170 | 170 | 170 | ||||||||
| Таурин 10 | 7 | ||||||||||
| Окись азота 11 | 15 | ||||||||||
| Глутатион 12 | 550 | 550 | 550 |
. | Глутамат . | Глицин . | Цистеин . | аргинин . | Метионин . | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Кинетика [μmol / (кг · д)] | |||||||||||
| 4200 1 | 3960 2 | 1320 3 9 | 1800 4 | 528 | |||||||
| «net» Синтез | 358 5 | 2730 5 | 96 6 | 180 7 | 168 8 9 | ||||||
| Концевая продукция Производство [μMol / (кг · D)] | |||||||||||
| Creatine 9 | 170 | 170 | 170 | ||||||||
| Таурин 10 | 7 | ||||||||||
| Окись азота 11 | 15 | ||||||||||
| Глутатион 12 | 550 | 550 | 550 |
Потенциальный вклад синтеза функционально важных конечных продуктов в потребности в аминокислотах у взрослых людей
9 9014 9 .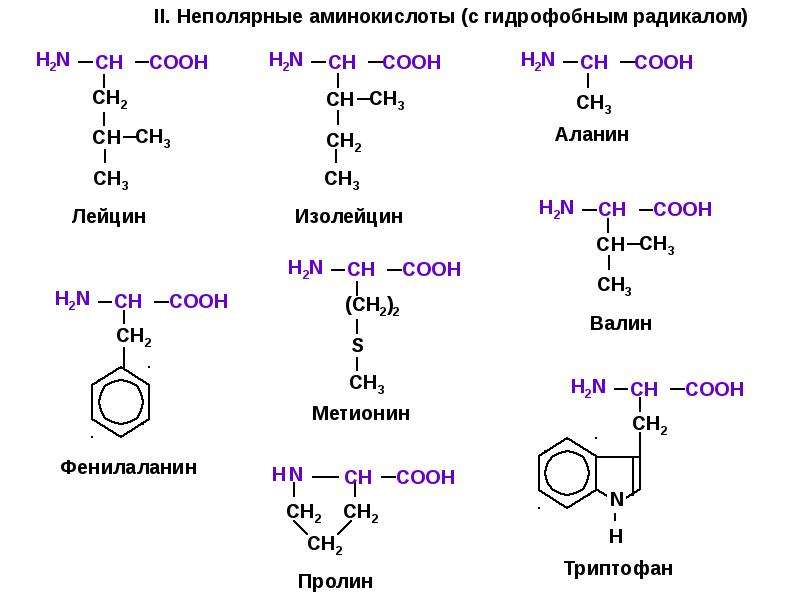 | Глутамат . | Глицин . | Цистеин . | аргинин . | Метионин . | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Кинетика [μmol / (кг · д)] | |||||||||||
| 4200 1 | 3960 2 | 1320 3 9 | 1800 4 | 528 | |||||||
| «net» Синтез | 358 5 | 2730 5 | 96 6 | 180 7 | 168 8 9 | ||||||
| Концевая продукция Производство [μMol / (кг · D)] | |||||||||||
| Creatine 9 | 170 | 170 | 170 | ||||||||
| Таурин 10 | 7 | ||||||||||
| Окись азота 11 | 15 | ||||||||||
| Глутатион 12 | 550 | 550 | 550 |
. | Глутамат . | Глицин . | Цистеин . | аргинин . | Метионин . | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Кинетика [μmol / (кг · д)] | |||||||||||
| 4200 1 | 3960 2 | 1320 3 9 | 1800 4 | 528 | |||||||
| «net» Синтез | 358 5 | 2730 5 | 96 6 | 180 7 | 168 8 9 | ||||||
| Концевая продукция Производство [μMol / (кг · D)] | |||||||||||
| Creatine 9 | 170 | 170 | 170 | ||||||||
| Таурин 10 | 7 | ||||||||||
| Окись азота 11 | 15 | ||||||||||
| Глутатион 12 | 550 | 550 | 550 |
В это неизбежно В кратком изложении я попытался рассмотреть термины «незаменимый» и «необходимый» применительно к аминокислотам с трех точек зрения. Традиционный взгляд на питание, который фокусируется именно на росте, четко отличает аминокислоты, которые должны поступать с пищей, от аминокислот, которые не обязательно должны поступать из этого источника. Метаболическая точка зрения приводит к несколько более сложной интерпретации; это показывает, что могут быть значительные ограничения на синтез некоторых аминокислот, что делает их потенциальными ограничениями роста. Наконец, функциональная точка зрения не только указывает на незаменимость всех аминокислот для определенных физиологических функций, но также приводит к заключению, что в условиях, когда белок является основным диетическим ограничением, способность поддерживать синтез некоторых традиционно заменимых аминокислот может иметь решающее значение для сохранения здоровья и функциональной целостности человека.Ясно, что теперь все готово для дальнейшего, более детального количественного изучения этих важных вопросов. Я с нетерпением жду расширения наших знаний о функциях аминокислот, которые выходят за рамки традиционного внимания к белкам.
Традиционный взгляд на питание, который фокусируется именно на росте, четко отличает аминокислоты, которые должны поступать с пищей, от аминокислот, которые не обязательно должны поступать из этого источника. Метаболическая точка зрения приводит к несколько более сложной интерпретации; это показывает, что могут быть значительные ограничения на синтез некоторых аминокислот, что делает их потенциальными ограничениями роста. Наконец, функциональная точка зрения не только указывает на незаменимость всех аминокислот для определенных физиологических функций, но также приводит к заключению, что в условиях, когда белок является основным диетическим ограничением, способность поддерживать синтез некоторых традиционно заменимых аминокислот может иметь решающее значение для сохранения здоровья и функциональной целостности человека.Ясно, что теперь все готово для дальнейшего, более детального количественного изучения этих важных вопросов. Я с нетерпением жду расширения наших знаний о функциях аминокислот, которые выходят за рамки традиционного внимания к белкам.
ЦИТИРОВАННАЯ ЛИТЕРАТУРА
BERTHOLD
,H. K.
,H. K.
,REEDS
,P. J.
,Кляйн
,P. D.
(1995
)Изотопные доказательства дифференциального регулирования синтеза аргинина и пролина в человеке
.Метаболизм
44
:466
–473
.Beaumier
,L.
,CASTILLO
,L.
,,
Л.
,AJAMI
,AJAMI
,AM
&,
,VR
(VR
(1995
)Промежуточная кинетическая кинетика мочевины и экскреция нитрата при нормальном и «терапевтическое» потребление аргинина у людей
.утра. Дж. Физиол.
269
:E884
–E896
.Bomman
,A.
,,
,
,TR
,Balck
,HC
,Anderson
,, например,
,Остерилинг
,MJ
,Womack
,м.
&Роза
,WC
(1946
)Роль аргинина в росте с некоторыми наблюдениями о влиянии аргининовой кислоты
.
Дж. Биол. хим.
166
:585
–594
.Brunton
,JA
,Bertolo
,RF
,,
RF
,Pencharz
,PB
&Ball
,RO
(RO
(RO
(RO
)Proline Уменьшает дефицит аргинина во время энтерала, но не парентеральный кормление неонатальные поросята
.утра. Дж. Физиол.
277
:E223
–E231
.Castillo
,L.
,Beaumier
,L.
,ajami
,ajami
,00 00005,
vr
()
ВR
(1996
)Синтез оксида цельного тела у здоровых людей определяется из [ 15 N] аргинина-к- [ 15 N] цитруллин маркировка
.Проц. Натл. акад. науч. США
93
:11460
–11465
.Castillo
,L.
,Chapman
,T. E.
,Sanchez
,M.
,YU
,YM
,Burke
,JF
,ajami
,ajami
,м
,vogt
, j.
,
j.
&молодых
,VR
(1993
)Плазма кинетика аргинина и цитруллина у взрослых, получающих адекватную диету и диету без аргинина
.Проц. Натл. акад. науч. США
90
:7749
–7753
.Дэвис
,Т. А.
,Фиоротто
,М.L.
иReeds
,P. J.
(1993
)Аминокислотный состав белков тела и молока изменяется в период подсоса у крыс
.Дж. Нутр.
123
:947
–956
.Dewey
,кг
,Beaton
,G.
,Fjeld
,C.
,Lonnerdal
,B.
&Reeds
,стр.
(1996
)Потребность младенцев и детей в белке
.евро. Дж. Клин. Нутр.
50
(доп. 1
):S119
–S147
.Fukagawa
,N. K.
,N. K.
,AJAMI
,A. M.
&,
A. M.
&RE.
, В. Р.
R.
() R (.
утра. Дж. Физиол.
270
:E209
–E214
.Фуллер
,М.F.
иGarlick
,P. J.
(1994
)Потребность человека в аминокислотах: можно ли разрешить противоречие?
.год. Рев. Нутр
14
:217
–241
.Fuller
,MF
,Milne
,A.
,Harris
,CI
,REID
,TM
&Keenan
,R
(1994
)Amino потери кислоты с илеостомической жидкостью на безбелковой диете
.утра. Дж. Клин. Нутр.
59
:70
–73
.Fuller
,M. F.
иReeds
,P. J.
(1998
)Эндогенный азот в кишечнике
.год. Преподобный Нутр.
18
:385
–411
.Gaull
,G.
,STURMAN
,J. A.
&RAIHA
,N. C.
( N. C.
C.
1972
)Разработка метаболизма серы млекопитающих: отсутствие цистатионизации в тканях плода человека
.Педиатр. Рез.
6
:538
–547
.Hepburn
,F. N.
иBradley
,W. B.
(1964
)Потребность в глутаминовой кислоте и аргинине для быстрого роста крыс, получающих 5,900 аминокислот.
Дж. Нутр.
84
:305
–312
.Хорват
,К.
,Джами
,М.
,Хилл
,И.D .
J. Парентеральный энтеральный нутр.
20
:128
–134
.Джексон
,А. А.
,Шоу
,Дж. К.
,Барбер
,А.
иGolden
,M. H.
(1981
)Метаболизм азота у недоношенных детей, получающих донорское грудное молоко: возможная незаменимость глицина
.Педиатр. Рез.
15
:1454
–1461
.Jahoor
, F.
Jackson
,A.
,Gazzard
,B.
,Philips
,G.
,Sharpstone
,D.
,Frazer
,М.E.
&Heird
,W.
(1999
)Дефицит глутатиона в эритроцитах при бессимптомной ВИЧ-инфекции связан со снижением скорости синтеза
.утра. Дж. Физиол.
276
:E205
–E211
.Jahoor
,F.
,Wykes
,Л. Дж.
,Л. Дж.
,Reeds
,P. J.
,Генри
,J. F.
,del Rosario
,М.P.
иFrazer
,M.E.
(1995
)Свиньи с дефицитом белка не могут поддерживать пониженный гомеостаз глутатиона при стрессе воспаления
.Дж. Нутр.
125
:1462
–1472
.Jaksic
,T.
,WAGNER
,DA
,Burke
,JF
&,
JF
&молодых
,VR
(VR
(1987
)Плазменная кинетика Proline и регулирование синтеза пролина в человек
.
Метаболизм
36
:1040
–1046
.Jaksic
,T.
,VAGNER
,DA
,Burke
,JF
&,
JF
&MULLE
,VR
(VR
(Proline Метаболизм у взрослых мужчин сгоревших пациентов и здоровый контроль предметы
.утра. Дж. Клин. Нутр
54
:408
–413
.Ласк
,Г.
(1922
)Метаболизм пролина у взрослых мужчин с ожогами и у здоровых лиц из контрольной группы
.Наука о питании
Johnson Corporation
Johnson Corporation
New York
, 1976.MAHAN
,MAHAN
,DC
&Щит
,RG
, JR (1998
)Основной и несуществующий аминокислотный состав свиней от рождения до 145 кг массы тела и сравнение с другими исследованиями
.Дж. Аним. науч.
76
:513
–521
.Matthews
, D.E.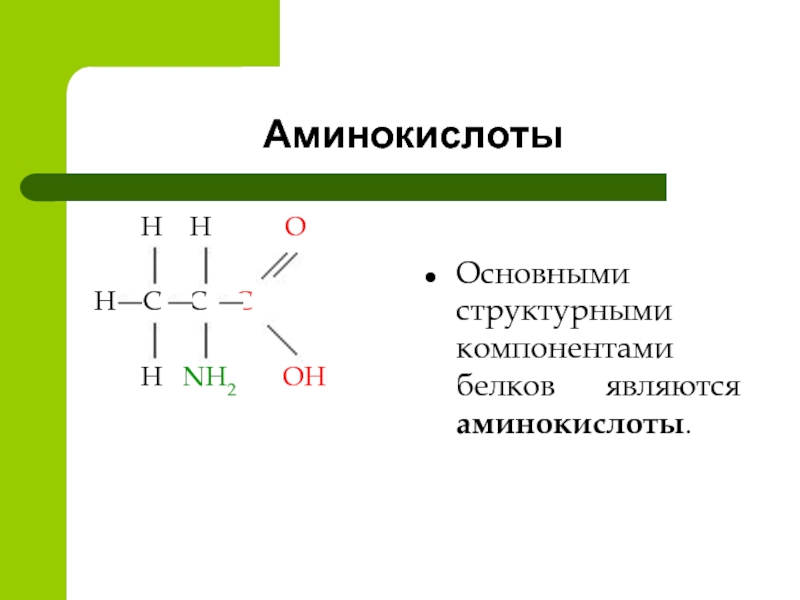
Campbell
,R.G.
(1992
)Влияние потребления белка с пищей на метаболизм глютамина и глутамата азота у людей
.утра. Дж. Клин. Нутр.
55
:963
–970
.Meier
,P.
,Teng
,C.
,Battaglia
,F.C.
иMeschia
,G.
(1981
)Скорость накопления азота аминокислот и общего азота в плоде ягненка
.Проц. соц. Эксп. биол. Мед.
167
:463
–468
.Miller
,RG
,Keshen
,th
,jahoor
,F.
,,
F.
,SHW
,SB
&Jaksic
,T.
(1996
)Бакрицания эндогенно синтезируемых аминокислот у новорожденных
.Дж. Сур. Рез.
63
:199
–203
.Murphy
,J. M.
,M. M.
,MURCH
,S. J.
&Ball
,R. О.
(Proline синтезируется из глутамата во время внутрижелочной инфузии, но не во время внутривенного вливания в неонатальных поросятах
.
Дж. Нутр.
126
:878
–886
.Нейсмит
,Д.J.
,Rana
,S. K.
иEmery
,P. W.
(1987
)Метаболизм таурина во время репродукции у женщин
.Гул. Нутр. клин. Нутр.
41
:37
–45
.Пеллет
,P. L.
иKaba
,H.
(1972
)Аминокислоты туши крысы в условиях определения использования чистого белка
.Дж. Нутр.
102
:61
–68
.Raguso
,C. A.
,C. A.
,Pereira
,P.
&,
P.
&,
,
и(
,VR
(1999
)Операционное исследование обязательных окислительных аминокислотных потерь у здоровых, молодых людей
.утра. Дж. Клин. Нутр.
70
:474
–483
.Ридс
,П. Дж.
,Буррин
,Д.G.
,Jahoor
, F.
Wykes
,Л.
,Генри
,J.
&Frazer
,ME
(1996
)Энтерльский глутамат почти полностью метаболизируется при первом прохождении через желудочно-кишечный тракт поросят
.утра. Дж. Физиол.
270
:E413
–E418
.Ридс
,П. Дж.
,Буррин
,Д. Г.
,Столл
,Б.
,Jahoor
,F.
,Wykes
,L.
,,Л.
,Генри
,J.
&Frazer
,ME
(ME
(1997
)Энтеральный глютамат является преференциальным источником для синтез глутатиона слизистой у откормленных поросят
.утра. Дж. Физиол.
273
:E408
–E415
.Stoll
,B.
,Burrin
,D. G.
,Henry
,J.
,YU
,H.
,Jahoor
,F.
&,
F.
&Reeds
,P. J.
(1999
)Подложка окисления субстрата по порталу осушенные внутренние временных поросятных поросят
.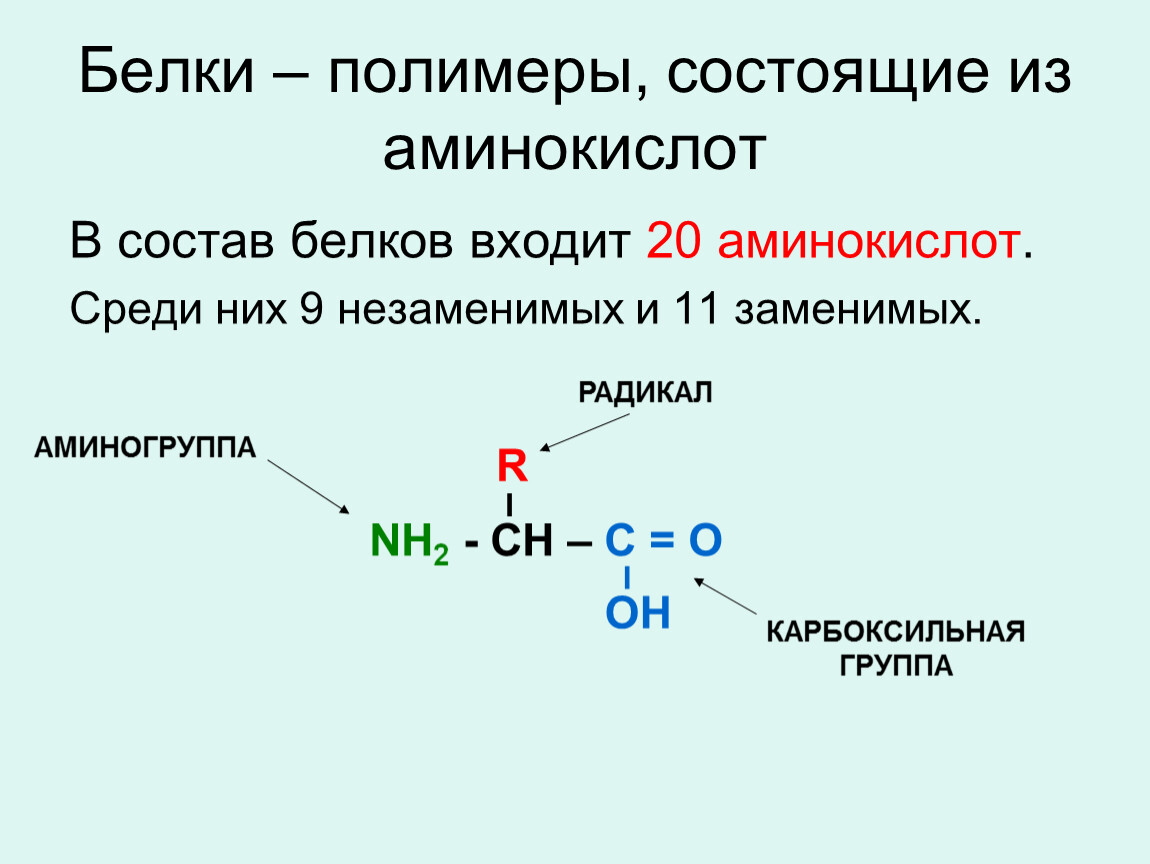
утра. Дж. Физиол.
277
:E168
–E175
.Stoll
,B.
,ГЕНРИ
,J.
,REEDS
,P. J.
,YU
,H.
,Jahoor
,F.
иBurrin
,D.G.
(1998
)Катаболизм доминирует в метаболизме пищевых незаменимых аминокислот первого прохождения через кишечник у поросят, питающихся молочным белком
.Дж. Нутр.
128
:606
–614
.Wakabayashi
,Y.
,Yamada
,E.
,Йошида
,T.
&Takahashi
,H.
(H.
(1995
)Аргинин становится незаменимой аминокислотой после массивная резекция тонкой кишки крысы
.Дж. Биол. хим.
269
:32667
–32671
.Widdowson
,E.M.
,Southgate
,D.A.T.
иHey
,E.N.
(1979
)Состав тела плода и младенца
.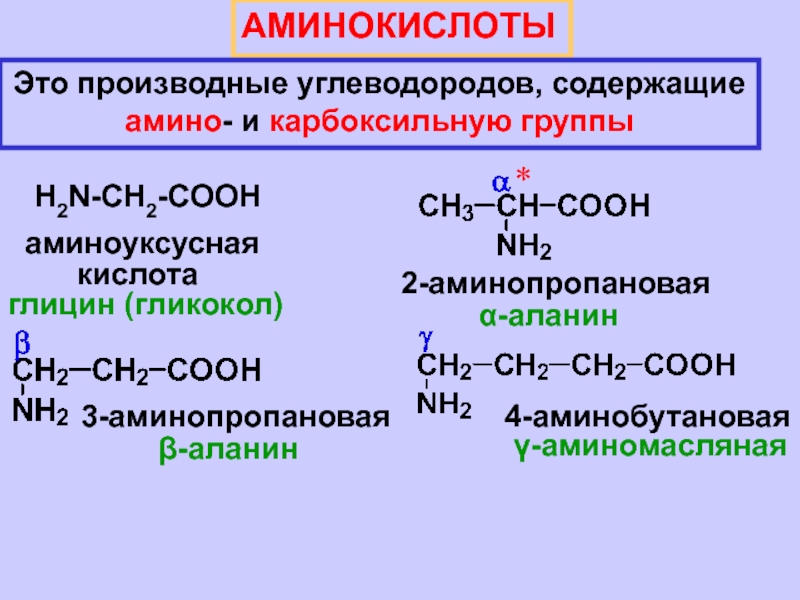
Виссер
,Х.К.А.
изд.Питание плода и младенца
:169
–177
Martinus Njihoff Publishers London
,England
.Williams
,A. P.
(1978
)Аминокислотный, коллагеновый и минеральный состав преджвачных телят
.Дж. Агри. науч. (камб.).
90
:617
–624
.Womack
,M.
иRose
,W. C.
(1947
)Роль пролина, гидроксипролина и глутаминовой кислоты в росте
.Дж. Биол. хим.
171
:37
–50
.WU
,G.
,davis
,pk
,flynn
,ne
,Knabe
,da
&Davidson
,JT
(1997
)эндогенный синтез аргинина играет важную роль в поддержании гомеостаза аргинина у растущих свиней после отъема
.Дж. Нутр.
127
:2342
–2349
.Ву
,Г.
,Отт
, Т. L.
L.
Knabe
,D. A.
иBazer
,F. W.
(1999
)Аминокислотный состав плода свиньи
.Дж. Нутр.
129
:1031
–1038
.Young
,V.
иR & Borgonha
,S.
(2000
)Требования к азоту и аминокислотам: Массачусетский технологический институт 9000 Требования к аминокислотам5 .
Дж. Нутр.
130
:1841S
—1841S
—1849
S.YU
,YM
,Yang
,RD
,Matthews
,DE
,WEN
,ZM
,Burke
,JF
,Bier
,DM
иYoung
,VR
(1985
)Количественные аспекты метаболизма глицина и аланина после азота в организме
.Дж. Нутр.
115
:399
–410
.© 2000 Американское общество наук о питании
D-аминокислоты в нервной и эндокринной системах
Аминокислоты являются важными компонентами пептидов и белков и действуют как передатчики сигналов. Только L-аминокислоты считались необходимыми для млекопитающих, включая человека. Однако у млекопитающих обнаружены различные D-аминокислоты, такие как D-серин, D-аспартат, D-аланин и D-цистеин.Постепенно раскрывается физиологическая роль этих D-аминокислот не только в нервной, но и в эндокринной системе. Рецепторы N-метил-D-аспартата (NMDA) связаны с обучением и памятью. D-серин, D-аспартат и D-аланин могут связываться с рецепторами NMDA. H 2 S, образующийся из D-цистеина, уменьшает дисульфидные связи в рецепторах и усиливает их активность. Аберрантная активность рецепторов связана с заболеваниями центральной нервной системы (ЦНС), такими как болезнь Альцгеймера, боковой амиотрофический склероз и шизофрения.Кроме того, D-аминокислоты обнаруживаются в частях эндокринной системы, таких как шишковидная железа, гипоталамус, гипофиз, поджелудочная железа, надпочечники и яички. D-аспартат исследуется на предмет регуляции высвобождения гормонов из различных эндокринных органов. Здесь мы сосредоточились на недавних открытиях, касающихся синтеза и физиологических функций D-аминокислот в нервной и эндокринной системах.
Только L-аминокислоты считались необходимыми для млекопитающих, включая человека. Однако у млекопитающих обнаружены различные D-аминокислоты, такие как D-серин, D-аспартат, D-аланин и D-цистеин.Постепенно раскрывается физиологическая роль этих D-аминокислот не только в нервной, но и в эндокринной системе. Рецепторы N-метил-D-аспартата (NMDA) связаны с обучением и памятью. D-серин, D-аспартат и D-аланин могут связываться с рецепторами NMDA. H 2 S, образующийся из D-цистеина, уменьшает дисульфидные связи в рецепторах и усиливает их активность. Аберрантная активность рецепторов связана с заболеваниями центральной нервной системы (ЦНС), такими как болезнь Альцгеймера, боковой амиотрофический склероз и шизофрения.Кроме того, D-аминокислоты обнаруживаются в частях эндокринной системы, таких как шишковидная железа, гипоталамус, гипофиз, поджелудочная железа, надпочечники и яички. D-аспартат исследуется на предмет регуляции высвобождения гормонов из различных эндокринных органов. Здесь мы сосредоточились на недавних открытиях, касающихся синтеза и физиологических функций D-аминокислот в нервной и эндокринной системах.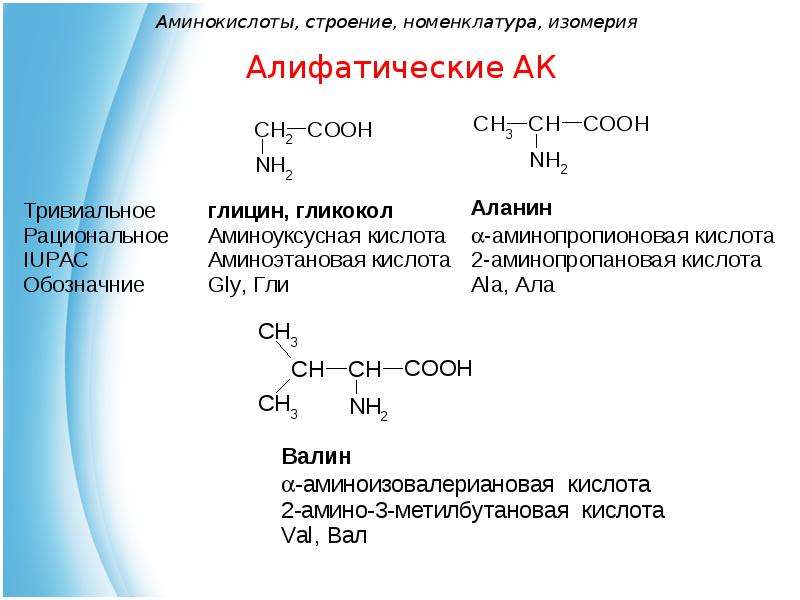
1. Введение
Аминокислоты важны не только как незаменимые компоненты для строительных блоков пептидов и белков, но и как биохимические регуляторы, такие как нейротрансмиттеры [1–4] и регуляторы аутофагии [5–8].D-аминокислоты являются энантиомерами L-аминокислот и долгое время считались отсутствующими и неприродными аминокислотами у млекопитающих. Однако недавнее развитие чувствительных аналитических методов выявило присутствие D-аминокислот, таких как D-серин, D-аспартат и D-аланин, у млекопитающих [9-11]. Более того, исследования ферментов, которые синтезируют или метаболизируют D-аминокислоты, также прояснили локализацию и функции D-аминокислот в нервной и эндокринной системах и обнаружили, что синтез и метаболизм D-аминокислот физиологически регулируются [12-15]. .Здесь мы сосредоточились на последних достижениях в понимании синтеза, метаболизма и физиологической роли D-аминокислот в нервной и эндокринной системах.
2. D-серин
Заметные уровни D-серина были обнаружены в центральной нервной системе (ЦНС) грызунов и человека. Областями ЦНС, богатыми D-серином, были кора головного мозга, гиппокамп и полосатое тело. Кроме того, D-серин также обнаруживается в других областях, таких как средний мозг, мозжечок и спинной мозг, у грызунов и человека [16-19].Внеклеточные уровни D-серина в медиальной префронтальной коре и стриатуме крыс составляют примерно 20% от общего уровня серина [20]. D-серин биосинтезируется серинарацемазой (SR) в ЦНС грызунов и человека [21–23]. Кроме того, уровень D-серина в ЦНС значительно снижен у мышей с нокаутом Sr [24, 25].
Областями ЦНС, богатыми D-серином, были кора головного мозга, гиппокамп и полосатое тело. Кроме того, D-серин также обнаруживается в других областях, таких как средний мозг, мозжечок и спинной мозг, у грызунов и человека [16-19].Внеклеточные уровни D-серина в медиальной префронтальной коре и стриатуме крыс составляют примерно 20% от общего уровня серина [20]. D-серин биосинтезируется серинарацемазой (SR) в ЦНС грызунов и человека [21–23]. Кроме того, уровень D-серина в ЦНС значительно снижен у мышей с нокаутом Sr [24, 25].
Было показано, что SR локализуется в астроцитах, а также в нейронах, и D-серин высвобождается из обоих [22, 23, 26–29]. Кроме того, D-серин в нейронах образуется из L-серина, полученного из астроцитов [27].Модель челнока D-серина описывает оптимальную активность рецептора N-метил-D-аспартата (NMDA), опосредованную D-серином, предполагая, что D-серин транспортируется между нейронами и астроцитами [30, 31]. Эта модель челнока D-серина выглядит следующим образом. Астроциты поглощают глюкозу из кровеносных сосудов через переносчик глюкозы 1, а затем через 3-фосфоглицератдегидрогеназу (Phgdh), которая в основном локализована в астроцитах и превращает глюкозу в L-серин. L-серин экспортируется из астроцитов и импортируется в нейроны через переносчики аланина/серина/цистеина/треонина (ASCT).В нейроне L-серин превращается в D-серин с помощью SR. D-серин высвобождается из нейронов через аланин-серин-цистеиновый транспортер-1 (Asc-1) или другими путями в синапс, где он может регулировать активность рецептора NMDA. Высвобожденный D-серин также может быть импортирован в астроциты через ASCT. Способность SR рацемизировать L-серин в D-серин положительно регулируется пиридоксаль-5′-фосфатом (PLP), двухвалентными катионами и АТФ [22, 32, 33]. С другой стороны, активность SR ингибируется его транслокацией из цитозоля на мембраны, содержащие фосфатидилинозитол-4,5-бисфосфат (PIP 2 ), такие как ядерная, эндоплазматическая сеть (ER) и плазматические мембраны [34].
Астроциты поглощают глюкозу из кровеносных сосудов через переносчик глюкозы 1, а затем через 3-фосфоглицератдегидрогеназу (Phgdh), которая в основном локализована в астроцитах и превращает глюкозу в L-серин. L-серин экспортируется из астроцитов и импортируется в нейроны через переносчики аланина/серина/цистеина/треонина (ASCT).В нейроне L-серин превращается в D-серин с помощью SR. D-серин высвобождается из нейронов через аланин-серин-цистеиновый транспортер-1 (Asc-1) или другими путями в синапс, где он может регулировать активность рецептора NMDA. Высвобожденный D-серин также может быть импортирован в астроциты через ASCT. Способность SR рацемизировать L-серин в D-серин положительно регулируется пиридоксаль-5′-фосфатом (PLP), двухвалентными катионами и АТФ [22, 32, 33]. С другой стороны, активность SR ингибируется его транслокацией из цитозоля на мембраны, содержащие фосфатидилинозитол-4,5-бисфосфат (PIP 2 ), такие как ядерная, эндоплазматическая сеть (ER) и плазматические мембраны [34]. –37].SR также регулируется взаимодействием с другими белками (рис. 1). Обнаружено, что белок 1, взаимодействующий с рецептором глутамата (GRIP1) [38], и белок, взаимодействующий с С-киназой (PICK1) [39, 40], активируют SR, взаимодействуя с ним в астроцитах грызунов. GRIP1 связывается с рецептором α -амино-3-гидрокси-5-метилизоксазол-4-пропионовой кислоты (AMPA) и высвобождается после стимуляции L-глутаматом. Высвобожденный GRIP1 связывает и активирует SR [38]. Обнаружено, что за взаимодействие с SR отвечает домен постсинаптической плотности 95 (PSD95)/Discs large/ZO-1 (PDZ) в С-концевой области GRIP1 [38, 41].PICK1 имеет домен PDZ, который связывается с SR [39], и домен Bin/amphiphysin/Rvs (BAR), взаимодействующий с мембранами [42]. PICK1 связывается с продуцирующим эритропоэтин гепатоцеллюлярным рецептором (Eph) B3 или EphA4 в астроцитах. После того, как эфрин B3, который экспрессируется на постсинаптических нейронах, связывается с рецептором EphB3 или EphA4, PICK1 высвобождается в цитозоль.
–37].SR также регулируется взаимодействием с другими белками (рис. 1). Обнаружено, что белок 1, взаимодействующий с рецептором глутамата (GRIP1) [38], и белок, взаимодействующий с С-киназой (PICK1) [39, 40], активируют SR, взаимодействуя с ним в астроцитах грызунов. GRIP1 связывается с рецептором α -амино-3-гидрокси-5-метилизоксазол-4-пропионовой кислоты (AMPA) и высвобождается после стимуляции L-глутаматом. Высвобожденный GRIP1 связывает и активирует SR [38]. Обнаружено, что за взаимодействие с SR отвечает домен постсинаптической плотности 95 (PSD95)/Discs large/ZO-1 (PDZ) в С-концевой области GRIP1 [38, 41].PICK1 имеет домен PDZ, который связывается с SR [39], и домен Bin/amphiphysin/Rvs (BAR), взаимодействующий с мембранами [42]. PICK1 связывается с продуцирующим эритропоэтин гепатоцеллюлярным рецептором (Eph) B3 или EphA4 в астроцитах. После того, как эфрин B3, который экспрессируется на постсинаптических нейронах, связывается с рецептором EphB3 или EphA4, PICK1 высвобождается в цитозоль. Усиление ассоциации между высвобождаемым PICK1 и SR увеличивает синтез D-серина в астроцитах мышей [40]. Старгазин и белок 22 только F-box (FBXO22) также регулируют активность SR, влияя на субклеточную локализацию SR.Старгазин образует комплекс с покоящимся рецептором AMPA, PSD-95 и SR, ингибируя активность SR, способствуя локализации мембраны в нейронах мышей. Как только AMPA-рецептор активируется, SR высвобождается из старгазина и плазматической мембраны, что приводит к активации SR [43]. FBXO22 связывает и активирует SR, предотвращая его связывание с мембраной ER в нейронах и астроцитах крыс. FBXO22 может блокировать связывающую липиды область SR [35].
Усиление ассоциации между высвобождаемым PICK1 и SR увеличивает синтез D-серина в астроцитах мышей [40]. Старгазин и белок 22 только F-box (FBXO22) также регулируют активность SR, влияя на субклеточную локализацию SR.Старгазин образует комплекс с покоящимся рецептором AMPA, PSD-95 и SR, ингибируя активность SR, способствуя локализации мембраны в нейронах мышей. Как только AMPA-рецептор активируется, SR высвобождается из старгазина и плазматической мембраны, что приводит к активации SR [43]. FBXO22 связывает и активирует SR, предотвращая его связывание с мембраной ER в нейронах и астроцитах крыс. FBXO22 может блокировать связывающую липиды область SR [35].
D-серин катализируется SR и оксидазой D-аминокислот (DAO).SR обладает активностью α , β — элиминации и рацемизации. SR превращает как D-серин, так и L-серин с образованием пирувата и аммиака путем удаления воды из этих аминокислот путем элиминирования α , β [44]. Следовательно, SR может регулировать физиологический уровень D-серина за счет активности рацемизации для синтеза D-серина и активности α , β -элиминации для деградации D-серина. DAO — это флавопротеин, который превращает D-серин в соответствующую альфа-кетокислоту, перекись водорода и аммиак [11].
DAO — это флавопротеин, который превращает D-серин в соответствующую альфа-кетокислоту, перекись водорода и аммиак [11].
Установлено, что распределение D-серина в ЦНС сходно с распределением NMDA-рецепторов, которые являются ионотропными рецепторами глутамата (iGluRs) [18, 45], а для активации NMDA-рецепторов необходимо связывание как глутамата, так и D -серин или глицин. Активированные NMDA-рецепторы индуцируют поток Са 2+ , что приводит к регуляции долговременной потенциации (ДП) и долговременной депрессии (ДД) в различных областях ЦНС. Таким образом, регуляция NMDA-рецепторов тесно связана с синаптической активностью, обучением и памятью [46–49].
Рецептор NMDA в основном состоит из двух субъединиц GluN1 и двух субъединиц GluN2 либо из одинаковых, либо из разных субъединиц GluN2. Глутамат связывается с GluN2, тогда как D-серин или глицин связываются с GluN1 [50–52]. Хотя D-серин или глицин могут действовать как коагонисты NMDA-рецепторов [46], снижение уровня D-серина снижает активность NMDA-рецепторов, а добавление D-серина обращает эту инактивацию, приводя к LTP [46, 53]. Более того, D-серин индуцирует LTP, а деградация D-серина под действием DAO приводит к подавлению этой индукции [49].Следовательно, D-серин играет важную роль в регуляции синаптической активности, обучения и памяти, регулируя активацию рецепторов NMDA. Однако сообщалось о нейротоксических эффектах D-серина. По сравнению с мышами дикого типа сниженные уровни D-серина у взрослых мышей с нокаутом Sr снижали опосредованную рецептором NMDA и β -амилоидную 1–42 -индуцированную нейротоксичность [24]. Более того, повышенный уровень D-серина у взрослых мышей с нокаутом Dao приводил к дегенерации двигательных нейронов [54].Аберрантные уровни D-серина связаны с заболеваниями, вызванными аномальной активностью рецептора NMDA. Сообщалось, что уровни D-серина в спинномозговой жидкости (СМЖ) пациентов с болезнью Альцгеймера выше, чем у здоровых людей [55, 56]. Кроме того, индуцированная бета-амилоидом нейротоксичность подавляется у мышей с нокаутом Sr , у которых показано снижение уровня D-серина в головном мозге на 90% [24].
Более того, D-серин индуцирует LTP, а деградация D-серина под действием DAO приводит к подавлению этой индукции [49].Следовательно, D-серин играет важную роль в регуляции синаптической активности, обучения и памяти, регулируя активацию рецепторов NMDA. Однако сообщалось о нейротоксических эффектах D-серина. По сравнению с мышами дикого типа сниженные уровни D-серина у взрослых мышей с нокаутом Sr снижали опосредованную рецептором NMDA и β -амилоидную 1–42 -индуцированную нейротоксичность [24]. Более того, повышенный уровень D-серина у взрослых мышей с нокаутом Dao приводил к дегенерации двигательных нейронов [54].Аберрантные уровни D-серина связаны с заболеваниями, вызванными аномальной активностью рецептора NMDA. Сообщалось, что уровни D-серина в спинномозговой жидкости (СМЖ) пациентов с болезнью Альцгеймера выше, чем у здоровых людей [55, 56]. Кроме того, индуцированная бета-амилоидом нейротоксичность подавляется у мышей с нокаутом Sr , у которых показано снижение уровня D-серина в головном мозге на 90% [24]. Шизофрения связана с гипофункцией NMDA-рецепторов [57].Снижение уровня D-серина приводит к гипофункции NMDA-рецепторов, что приводит к шизофреноподобным симптомам [25, 58]. Кроме того, введение D-серина улучшает положительные, отрицательные и когнитивные симптомы у пациентов с шизофренией [59]. Боковой амиотрофический склероз (БАС) связан с повышенным уровнем D-серина [60, 61]. Следовательно, контроль уровня D-серина может быть одной из терапевтических целей при этих заболеваниях.
Шизофрения связана с гипофункцией NMDA-рецепторов [57].Снижение уровня D-серина приводит к гипофункции NMDA-рецепторов, что приводит к шизофреноподобным симптомам [25, 58]. Кроме того, введение D-серина улучшает положительные, отрицательные и когнитивные симптомы у пациентов с шизофренией [59]. Боковой амиотрофический склероз (БАС) связан с повышенным уровнем D-серина [60, 61]. Следовательно, контроль уровня D-серина может быть одной из терапевтических целей при этих заболеваниях.
С другой стороны, D-серин связывается с глутаматным рецептором δ 2-го типа (GluD2), который представляет собой iGluR, и вызывает снижение AMPA-рецепторов в клетках Пуркинье в мозжечке путем эндоцитоза.Это приводит к продвижению мозжечкового LTD. Более того, связывание D-серина с GluD2 приводит к приобретению двигательного обучения у мышей [62]. Недавно сообщалось, что возрастзависимое повышение активности пируваткарбоксилазы в глиальных клетках вызывает снижение уровня D-серина, что приводит к возрастным нарушениям памяти у мух [63].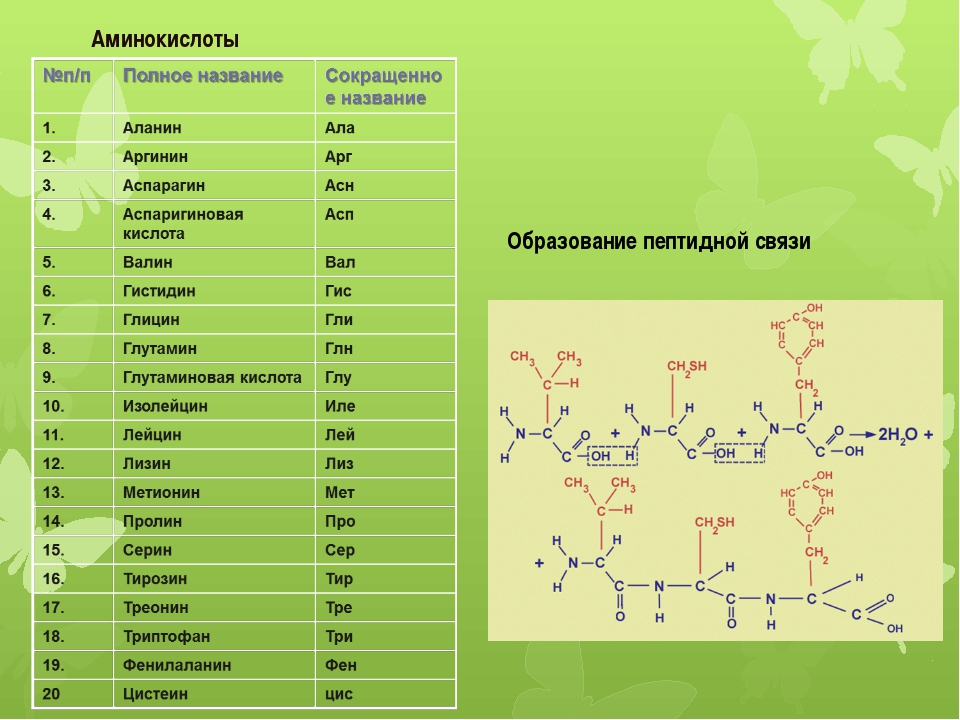 Пируваткарбоксилаза образует щавелевоуксусную кислоту, которая может быть преобразована в аспарагиновую кислоту. И щавелевоуксусная кислота, и аспарагиновая кислота могут ингибировать СР, что приводит к снижению уровня D-серина [64].
Пируваткарбоксилаза образует щавелевоуксусную кислоту, которая может быть преобразована в аспарагиновую кислоту. И щавелевоуксусная кислота, и аспарагиновая кислота могут ингибировать СР, что приводит к снижению уровня D-серина [64].
D-серин был также обнаружен в эндокринных органах, таких как надпочечники и гипофиз, поджелудочная железа и яички крыс [65, 66]. Однако уровни D-серина в эндокринной системе намного ниже, чем в ЦНС, и физиологическая роль D-серина в эндокринной системе остается неясной.
3. D-аспартат
D-аспартат обнаружен в ЦНС грызунов и человека [16, 19, 67–72], а также в эндокринных органах, включая шишковидную железу [69, 72, 73], гипофиз желез [68, 69, 71, 72, 74], поджелудочной железы [66], надпочечников [19, 67, 72, 74, 75] и семенников крыс [74, 76].D-аспартат активирует рецепторы NMDA посредством связывания с сайтом агониста субъединиц GluN2 (2A–D) [77–79], а также может активировать метаботропный глутаматный рецептор 5 (mGlu5) [80]. Хотя фермент, генерирующий D-аспартат, еще не идентифицирован [81–83], образование D-аспартата может зависеть от PLP [67].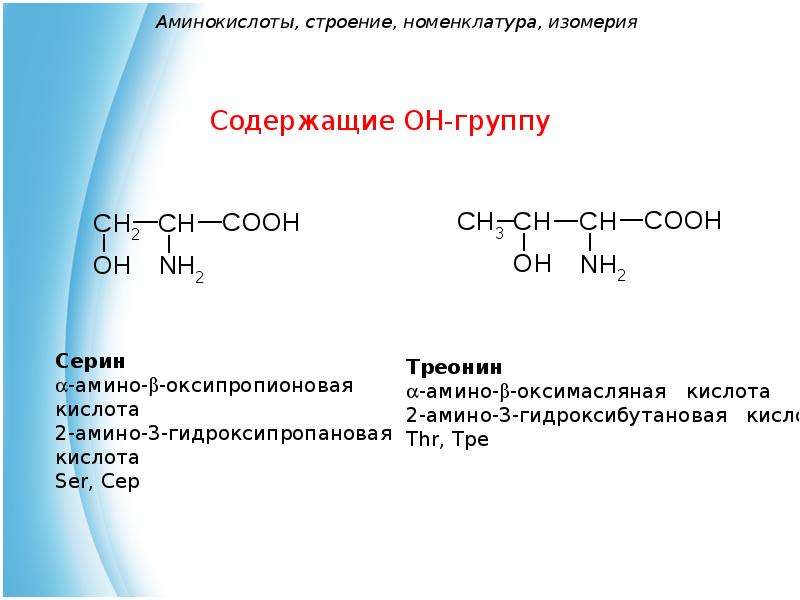
С другой стороны, было продемонстрировано, что D-аспартат расщепляется до оксалоацетата, перекиси водорода и аммония под действием пероксисомальной флавопротеин-D-аспартатоксидазы (DDO) [84–86].Хотя D-аспартат содержится в большом количестве в мозге грызунов и человека во время развития, уровни D-аспартата чрезвычайно снижены на постнатальных стадиях, и это снижение сохраняется на протяжении всей взрослой жизни [16, 67, 68, 71, 87, 88]. Напротив, активность ДДО и его мРНК чрезвычайно низки на постнатальных стадиях и увеличиваются после рождения у грызунов [88, 89]. Более того, было показано, что уровни D-аспартата были значительно повышены в ЦНС мышей с нокаутом Ddo [88, 90-93]. Кроме того, D-аспартат обнаружен исключительно в нейронах крыс [67].Улучшение пространственной памяти продемонстрировано у мышей с нокаутом Ddo [77, 78]. Более того, у мышей, получавших D-аспартат, и мышей с нокаутом Ddo наблюдалось усиление LTP [77–79] и увеличение длины дендритов и плотности шипиков в нейронах префронтальной коры и гиппокампа [94]. Таким образом, значительное увеличение уровней D-аспартата, усиление LTP и увеличение длины дендритов и плотности шипиков нейронов у взрослых мышей с нокаутом Ddo указывает на то, что D-аспартат также может генерироваться и функционировать в ЦНС во взрослом возрасте.Однако стойкое повышение уровня D-аспартата у взрослых мышей с нокаутом Ddo имеет нейротоксические эффекты, такие как активация каспазы-3 и апоптоз в нейронах [88]. Экспрессия мРНК Ddo в посмертном мозге больных шизофренией была значительно выше, чем у контрольных лиц [95]. Более того, сообщалось, что уровни D-аспартата были значительно снижены в посмертном мозге пациентов с шизофренией по сравнению с контрольными людьми [96].Мыши с нокаутом Ddo проявляют ослабленное шизофреноподобное поведение, индуцированное фенциклидином, такое как двигательная гиперактивность и торможение преимпульса [95]. Эти данные указывают на то, что аномальный уровень D-аспартата может быть связан с шизофренией.
Таким образом, значительное увеличение уровней D-аспартата, усиление LTP и увеличение длины дендритов и плотности шипиков нейронов у взрослых мышей с нокаутом Ddo указывает на то, что D-аспартат также может генерироваться и функционировать в ЦНС во взрослом возрасте.Однако стойкое повышение уровня D-аспартата у взрослых мышей с нокаутом Ddo имеет нейротоксические эффекты, такие как активация каспазы-3 и апоптоз в нейронах [88]. Экспрессия мРНК Ddo в посмертном мозге больных шизофренией была значительно выше, чем у контрольных лиц [95]. Более того, сообщалось, что уровни D-аспартата были значительно снижены в посмертном мозге пациентов с шизофренией по сравнению с контрольными людьми [96].Мыши с нокаутом Ddo проявляют ослабленное шизофреноподобное поведение, индуцированное фенциклидином, такое как двигательная гиперактивность и торможение преимпульса [95]. Эти данные указывают на то, что аномальный уровень D-аспартата может быть связан с шизофренией.
В эндокринной системе D-аспартат контролирует синтез и выделение гормонов. D-аспартат ингибирует синтез мелатонина в шишковидной железе крысы [97], а также уменьшает высвобождение мелатонина из культивируемых пинеалоцитов крысы [98].В гипоталамусе крыс D-аспартат индуцирует экспрессию генов окситоцина и вазопрессина [99] и может увеличивать высвобождение гонадотропин-высвобождающего гормона [100]. D-аспартат также индуцирует высвобождение пролактина [101], гормона роста и лютеинизирующего гормона [100, 102] из передней доли гипофиза крысы. Напротив, повышение уровня D-аспартата связано со значительным снижением уровня проопиомеланокортина и α-меланоцитостимулирующего гормона в промежуточной доле мыши [93].В семенниках крыс D-аспартат индуцирует синтез и высвобождение тестостерона [102–104]. Повышенная экспрессия рецепторов андрогенов и пониженная экспрессия рецепторов эстрогена при введении D-аспартата были показаны в семенниках крыс [104]. Кроме того, пероральный прием D-аспартата вызывает высвобождение тестостерона в сыворотке человека [102] и улучшает количество и подвижность сперматозоидов у людей [105].
D-аспартат ингибирует синтез мелатонина в шишковидной железе крысы [97], а также уменьшает высвобождение мелатонина из культивируемых пинеалоцитов крысы [98].В гипоталамусе крыс D-аспартат индуцирует экспрессию генов окситоцина и вазопрессина [99] и может увеличивать высвобождение гонадотропин-высвобождающего гормона [100]. D-аспартат также индуцирует высвобождение пролактина [101], гормона роста и лютеинизирующего гормона [100, 102] из передней доли гипофиза крысы. Напротив, повышение уровня D-аспартата связано со значительным снижением уровня проопиомеланокортина и α-меланоцитостимулирующего гормона в промежуточной доле мыши [93].В семенниках крыс D-аспартат индуцирует синтез и высвобождение тестостерона [102–104]. Повышенная экспрессия рецепторов андрогенов и пониженная экспрессия рецепторов эстрогена при введении D-аспартата были показаны в семенниках крыс [104]. Кроме того, пероральный прием D-аспартата вызывает высвобождение тестостерона в сыворотке человека [102] и улучшает количество и подвижность сперматозоидов у людей [105]. Поэтому ожидается, что D-аспартат может быть кандидатом на лечение бесплодия.
Поэтому ожидается, что D-аспартат может быть кандидатом на лечение бесплодия.
4.Другие D-аминокислоты
Различные D-аминокислоты, кроме D-серина и D-аспартата, также были обнаружены в нервной и эндокринной системах.
D-аланин обнаружен в головном мозге, гипофизе, поджелудочной железе, надпочечниках и семенниках грызунов [106]. Кроме того, он обнаружен и в мозге человека [107]. Большая часть D-аланина у грызунов происходит из кишечных бактерий [108, 109]. D-аланин метаболизируется DAO [11], а уровень D-аланина у грызунов зависит от циркадианного ритма [9, 110].Кроме того, сообщалось, что D-аланин связывается с рецептором NMDA и улучшает симптомы у пациентов с шизофренией [111].
D-цистеин оказался одним из источников H 2 S в головном мозге (рис. 2). D-цистеин, вероятно, хотя бы частично всасывается из пищи, хотя источник D-цистеина в организме до сих пор не выяснен [112]. В ЦНС D-цистеин расщепляется DAO с образованием 3-меркаптопирувата (3MP). Затем 3MP катализируется 3-меркаптопируватсульфотрансферазой (3MST) с образованием H 2 S [113].3MST обнаружен в синаптосомах и нейронах мозга мышей [114]. Более того, полисульфиды водорода (H 2 ; –5) обнаружены в мозге мышей и также генерируются 3MST из 3MP [115]. H 2 S усиливает активность NMDA-рецепторов за счет восстановления дисульфидных связей в NMDA-рецепторах и индуцирует LTP у крыс [116, 117]. Напротив, H 2 активирует каналы переходного рецепторного потенциала (TRP) A1 в астроцитах грызунов и индуцирует поток Ca 2+ [118].Активация каналов TRPA1 приводит к высвобождению D-серина из астроцитов грызунов и усиливает зависимую от рецептора NMDA LTP [119]. Кроме того, паркин является одним из ключевых факторов болезни Паркинсона [7], а H 2 S усиливает активность паркина и приводит к защитным эффектам против болезни Паркинсона [120]. В эндокринной системе H 2 S ингибирует индуцированное глюкозой высвобождение инсулина из клеток поджелудочной железы β [121].
Затем 3MP катализируется 3-меркаптопируватсульфотрансферазой (3MST) с образованием H 2 S [113].3MST обнаружен в синаптосомах и нейронах мозга мышей [114]. Более того, полисульфиды водорода (H 2 ; –5) обнаружены в мозге мышей и также генерируются 3MST из 3MP [115]. H 2 S усиливает активность NMDA-рецепторов за счет восстановления дисульфидных связей в NMDA-рецепторах и индуцирует LTP у крыс [116, 117]. Напротив, H 2 активирует каналы переходного рецепторного потенциала (TRP) A1 в астроцитах грызунов и индуцирует поток Ca 2+ [118].Активация каналов TRPA1 приводит к высвобождению D-серина из астроцитов грызунов и усиливает зависимую от рецептора NMDA LTP [119]. Кроме того, паркин является одним из ключевых факторов болезни Паркинсона [7], а H 2 S усиливает активность паркина и приводит к защитным эффектам против болезни Паркинсона [120]. В эндокринной системе H 2 S ингибирует индуцированное глюкозой высвобождение инсулина из клеток поджелудочной железы β [121].
D-лейцин и D-пролин обнаружены в головном мозге, эпифизе и гипофизе грызунов [122, 123].D-глутамат обнаружен в мозге грызунов [70, 124]. Однако детальная физиологическая роль этих аминокислот остается неясной.
5. Выводы
Считается, что у млекопитающих, включая человека, используются только L-аминокислоты. Однако благодаря недавней разработке чувствительных и селективных аналитических методов для обнаружения хиральных аминокислот [125] в тканях млекопитающих были обнаружены разнообразные D-аминокислоты. Физиологические функции этих D-аминокислот постепенно выясняются.Было продемонстрировано, что D-аминокислоты, такие как D-серин, D-аспартат, D-аланин и D-цистеин, играют важную роль в нервной и эндокринной системах. Поэтому очень важно дальнейшее изучение механизмов синтеза и метаболизма, а также физиологических функций D-аминокислот. Эти исследования обеспечат новые терапевтические и диагностические стратегии для заболеваний, связанных с нервной и эндокринной системами.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Аминокислота — Энциклопедия Нового Света
Общая структура молекулы аминокислоты. Аминогруппа находится слева, а карбоксильная группа справа. Группа R уникальна для каждой аминокислоты.Аминокислота представляет собой органическую молекулу с тремя основными компонентами: аминогруппой (-Nh3), группой карбоновой кислоты (-COOH) и группой R или боковой цепью, уникальной для каждой аминокислоты.
Аминокислоты являются основными структурными строительными блоками белков.Точно так же, как буквы алфавита можно комбинировать по-разному, образуя бесконечное множество слов, ограниченное количество аминокислот можно соединить друг с другом в различной последовательности, чтобы сформировать огромное количество белков. Уникальная трехмерная форма каждого белка, которая является результатом линейной последовательности аминокислот, определяет специфическую функцию белка в организме.
Растения синтезируют необходимые им аминокислоты, используя углерод и кислород из воздуха, водород из воды и азот, который преобразуется в полезную форму посредством азотфиксации.Животные могут синтезировать определенные аминокислоты. Те важные аминокислоты, которые не могут быть синтезированы животным или в количестве, достаточном для удовлетворения его физиологических потребностей, и которые поэтому должны поступать с пищей, называются незаменимыми аминокислотами . Незаменимые аминокислоты различаются в зависимости от типа животного. Хотя всем позвоночным требуются определенные аминокислоты, которые их клетки не могут синтезировать, жвачные животные (например, крупный рогатый скот) переносят в одном из желудков микробы, которые синтезируют аминокислоты, необходимые животным.Аминокислоты отражают взаимосвязь жизни, так как нежвачные животные зависят от растений в отношении незаменимых аминокислот, жвачные животные зависят от микробов внутри как источника, и даже растения зависят от бактерий, фиксирующих азот в форме, которую они могут использовать для производства. аминокислоты.
аминокислоты.
Хотя в природе существует более 100 аминокислот, человеческому организму для нормального функционирования требуется 20 аминокислот, называемых стандартными аминокислотами . Примерно половина этих стандартных аминокислот считаются незаменимыми аминокислотами, которые не могут быть синтезированы и должны поступать с пищей.
Источники аминокислот
Стандартные аминокислоты
У человека 20 аминокислот известны как стандартные аминокислоты или протеиногенные аминокислоты. Как следует из названия «протеиногенные» (буквально, белков, строящих ), эти аминокислоты кодируются стандартным генетическим кодом и участвуют в процессе синтеза белка. Они образуются из матрицы мРНК в процессе, называемом трансляцией, при котором генетическая информация, закодированная в форме нуклеиновых кислот, транслируется в аминокислоты, необходимые для синтеза белка.Комбинации этих аминокислот производят все белки, необходимые для гомеостаза (т. е. поддержания стабильной внутренней среды) человеческого организма.
е. поддержания стабильной внутренней среды) человеческого организма.
Химическая структура 20 стандартных аминокислот.
Из этих 20 19 встречаются в природе как оптически активные левые молекулы из-за асимметричного центрального атома углерода, а один (глицин) является оптически нейтральным. Таким образом, стандартные аминокислоты имеют схему 1 + 19. Эта схема 1 + 19 также встречается в ядерной химии, описывая двадцать элементов, которые встречаются как «чистые изотопы»; один элемент (бериллий) имеет четный атомный номер 4, а остальные девятнадцать элементов (F, Na, Al, P, Sc, Mn, Co, As, Y, Nb, Rh, I, Cs, Pr, Tb, Ho, Tm, Au, Bi) имеют нечетные атомные номера.Тот же образец 1 + 19 встречается среди двадцати элементов, которые встречаются в виде двух стабильных изотопов. Соответствие закономерностей на разных уровнях природы — одна из неразгаданных тайн науки. [1]
Незаменимые аминокислоты
Приблизительно половина из 20 стандартных аминокислот называются незаменимыми аминокислотами, поскольку они не могут быть синтезированы человеческим организмом из других соединений посредством химических реакций; вместо этого их нужно принимать с пищей. У людей существенные аминокислоты представляют собой лизин , Isolecine , Feenylalanine , Leucine , Metoionine , TrEonine , Tronine и Валина . Аргинин и гистидин также могут быть классифицированы как незаменимые аминокислоты, хотя обычно они считаются незаменимыми только у детей, чей неразвитый метаболизм неспособен их синтезировать. Таким образом, количество незаменимых аминокислот у человека варьируется от 8 до 10.
У людей существенные аминокислоты представляют собой лизин , Isolecine , Feenylalanine , Leucine , Metoionine , TrEonine , Tronine и Валина . Аргинин и гистидин также могут быть классифицированы как незаменимые аминокислоты, хотя обычно они считаются незаменимыми только у детей, чей неразвитый метаболизм неспособен их синтезировать. Таким образом, количество незаменимых аминокислот у человека варьируется от 8 до 10.
Остальные стандартные аминокислоты не являются незаменимыми; хотя они могут быть получены из пищи, организм также может синтезировать их по мере необходимости.
Нестандартные аминокислоты
Помимо 20 стандартных аминокислот и двух особых аминокислот, селеноцистеина и пирролизина, которые кодируются ДНК нетипичным образом, существует большое количество нестандартных или непротеиногенных аминокислот.Эти последние либо не встречаются в белках (таких как аминокислоты карнитин, ГАМК или L-ДОФА), либо они не закодированы в стандартном генетическом коде (например, гидроксипролин и селенометионин), но они могут быть результатом модификации стандартного аминокислот после образования белка на стадии трансляции белкового синтеза.
Некоторые из этих нестандартных аминокислот были обнаружены в метеоритах, особенно в метеоритах, известных как углеродсодержащие хондриты, состав которых считается характерным для солнечной туманности или газообразного облака, из которого сконденсировалась Солнечная система.Например, в примитивном метеорите Мерчисон, типе углеродистого хондрита, было обнаружено более 79 аминокислот. Микроорганизмы и растения также могут производить необычные аминокислоты, которые можно найти в пептидных антибиотиках, таких как низин, который используется в качестве пищевого консерванта.
Строение аминокислот
В биохимии термин «аминокислота» часто используется для обозначения альфа-аминокислот : тех аминокислот, в которых амино- и карбоксилатные группы присоединены к одному и тому же углероду, так называемому α-углероду (альфа-углероду). ).Общая структура этих протеиногенных альфа-аминокислот:
Р
|
H 2 N-C-COOH
|
ЧАС
, где R представляет собой боковую цепь , специфичную для каждой аминокислоты. Исключением из этой базовой структуры является пролин, боковая цепь которого зацикливается на основной цепи, образуя кольцевую структуру, в которой вторичная аминогруппа заменяет первичную аминогруппу.
Исключением из этой базовой структуры является пролин, боковая цепь которого зацикливается на основной цепи, образуя кольцевую структуру, в которой вторичная аминогруппа заменяет первичную аминогруппу.
Когда аминокислоты соединяются вместе, образуя белки, основная аминогруппа и кислая карбоксильная группа нейтрализуются.Вместо этого боковые цепи аминокислот определяют кислотно-основные свойства белков. Таким образом, аминокислоты обычно классифицируют по двум основным химическим свойствам боковой цепи: заряду R-группы (от которого зависит, действует ли белок как слабая кислота или слабое основание) и его полярности (или склонности к взаимодействию с водой). при нейтральном рН).
Эти свойства влияют на взаимодействие аминокислот с другими структурами белка, а также на их взаимодействие с другими белками.Например, поверхность растворимых белков богата полярными аминокислотами, такими как серин и треонин. Напротив, интегральные мембранные белки, как правило, имеют внешнее кольцо из гидрофобных аминокислот (которые, как правило, не взаимодействуют с водой), которое прикрепляет их к липидному бислою.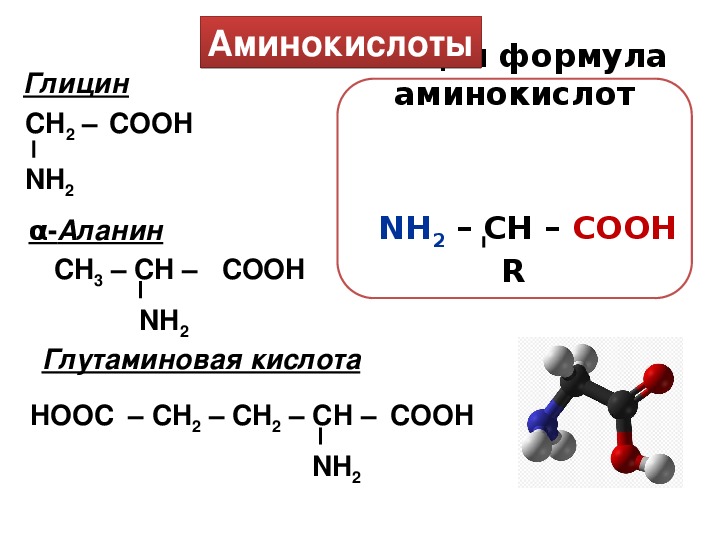 Точно так же белки, которые должны связываться с положительно заряженными молекулами, имеют поверхность, богатую отрицательно заряженными аминокислотами, такими как глутамат и аспартат, в то время как белки, связывающиеся с отрицательно заряженными молекулами, имеют поверхность, богатую положительно заряженными цепями, такими как лизин и аргинин.
Точно так же белки, которые должны связываться с положительно заряженными молекулами, имеют поверхность, богатую отрицательно заряженными аминокислотами, такими как глутамат и аспартат, в то время как белки, связывающиеся с отрицательно заряженными молекулами, имеют поверхность, богатую положительно заряженными цепями, такими как лизин и аргинин.
Изомеры
Большинство аминокислот встречаются в виде двух возможных оптических изомеров, называемых D и L. Аминокислоты L представляют подавляющее большинство аминокислот, содержащихся в белках. D-аминокислоты содержатся в некоторых белках, продуцируемых экзотическими морскими организмами, такими как улитки-конусы. Они также являются обильными компонентами протеогликановых клеточных стенок бактерий.
Роль аминокислот в синтезе белка
Краткое изложение образования пептидной связи. Нажмите на изображение, чтобы увидеть реакцию.Две аминокислоты связаны друг с другом пептидной связью, которая образуется, когда основная аминогруппа одной аминокислоты реагирует с кислой карбоксильной группой второй аминокислоты. Эта реакция конденсации (потеря воды) дает пептидную связь и молекулу воды. Аминокислотный остаток — это то, что осталось от аминокислоты после того, как молекула воды (H + со стороны аминогруппы и OH — со стороны карбоксильной группы) была потеряна при образовании пептида. связь.
Белки затем создаются путем полимеризации аминокислот, процесса, в котором аминокислоты соединяются вместе в цепи, называемые, в зависимости от их длины, пептидами или полипептидами.
Другие биологические роли аминокислот
Помимо своей функции в формировании белков, аминокислоты играют и другие биологически важные роли. Стандартные аминокислоты глицин и глутамат, содержащиеся в белках, также функционируют как нейротрансмиттеры, соответственно подавляющие и усиливающие сигналы в нервной системе.Нестандартная аминокислота карнитин используется для транспорта липидов внутри клетки.
Многие аминокислоты используются для синтеза молекул, отличных от белков:
- Триптофан является предшественником серотонина, нейротрансмиттера, играющего важную роль в регуляции настроения.
- Глицин является одним из реагентов в синтезе порфиринов, таких как гем, который является компонентом молекул гемоглобина, обнаруженных в красных кровяных тельцах.
- Аргинин используется для синтеза гормона оксида азота.
Вещества, полученные из аминокислот, находят важное применение в медицине и пищевой промышленности; Например:
- Аспартам (аспартил-фенилаланин-1-метиловый эфир) — искусственный подсластитель, а глутамат натрия — пищевая добавка, улучшающая вкус.
- 5-HTP (5-гидрокситриптофан) использовался для лечения неврологических проблем, связанных с ФКУ (фенилкетонурией), а также депрессии (в качестве альтернативы L-триптофану).
- L-ДОФА (L-дигидроксифенилаланин) — препарат, используемый для лечения симптомов болезни Паркинсона.
Таблица химических свойств
Ниже приведена таблица, в которой перечислены символы и химические свойства стандартных аминокислот. Указанная масса представляет собой средневзвешенное значение всех распространенных изотопов и включает массу H 2 O. Однобуквенный символ неопределенной аминокислоты — X . Трехбуквенный символ Asx или однобуквенный символ B означает, что аминокислота представляет собой либо аспарагин, либо аспарагиновую кислоту, тогда как Glx или Z означает либо глутаминовую кислоту, либо глутамин.Трехбуквенный символ Sec или однобуквенный символ U относится к селеноцистеину. Буквы J и O не используются.
Незаменимые аминокислоты отмечены звездочкой.
| Сокр. | Полное имя | Тип боковой цепи | Масса | пИ | pK 1 (α-COOH) | pK 2 (α- + NH 3 ) | пКр (R) | Замечания | |
|---|---|---|---|---|---|---|---|---|---|
| А | Ала | Аланин | гидрофобный | 89.09 | 6.01 | 2,35 | 9,87 | Очень богатый и универсальный. Он ведет себя достаточно нейтрально и может располагаться как в гидрофильных областях снаружи белка, так и в гидрофобных внутренних областях. | |
| С | Цис | Цистеин | гидрофобный (Нагано, 1999 г.) | 121,16 | 5,05 | 1,92 | 10,70 | 8.18 | Атом серы легко связывается с ионами тяжелых металлов.В окислительных условиях два цистеина могут быть соединены дисульфидной связью с образованием аминокислоты цистина. Когда цистины являются компонентами белка, они усиливают третичную структуру и делают белок более устойчивым к разворачиванию и денатурации; поэтому дисульфидные мостики распространены в белках, которым приходится функционировать в суровых условиях, пищеварительных ферментах (например, пепсин и химотрипсин), структурных белках (например, кератине) и белках, которые слишком малы, чтобы сохранять свою форму самостоятельно (например,инсулин). |
| Д | Асп | Аспарагиновая кислота | кислый | 133,10 | 2,85 | 1,99 | 9,90 | 3,90 | Действует подобно глутаминовой кислоте. Несет гидрофильную кислотную группу с сильным отрицательным зарядом. Обычно располагается на внешней поверхности белка, что делает его водорастворимым. Связывается с положительно заряженными молекулами и ионами, часто используется в ферментах для фиксации иона металла. |
| Э | клей | Глутаминовая кислота | кислый | 147.13 | 3,15 | 2.10 | 9,47 | 4,07 | Действует подобно аспарагиновой кислоте. Имеет более длинную и немного более гибкую боковую цепь. |
| *Ф | Фе | Фенилаланин | гидрофобный | 165,19 | 5,49 | 2,20 | 9.31 | Фенилаланин, тирозин и триптофан содержат большую жесткую ароматическую группу в боковой цепи. Это самые большие аминокислоты.Подобно изолейцину, лейцину и валину, они гидрофобны и имеют тенденцию ориентироваться внутрь свернутой белковой молекулы. | |
| Г | Гли | Глицин | гидрофобный | 75,07 | 6,06 | 2,35 | 9,78 | Из-за двух атомов водорода у α-углерода глицин не является оптически активным. Это самая маленькая аминокислота, она легко вращается и придает гибкость белковой цепи.Он способен проникать в самые узкие места (например, в тройную спираль коллагена). | |
| *Н | Его | Гистидин | базовый | 155,16 | 7,60 | 1,80 | 9,33 | 6.04 | Даже в слабокислых условиях происходит протонирование азота, изменяющее свойства гистидина и полипептида в целом. Он используется многими белками в качестве регуляторного механизма, изменяя конформацию и поведение полипептида в кислых областях, таких как поздняя эндосома или лизосома, вызывая изменение конформации ферментов. |
| *I | Иль | Изолейцин | гидрофобный | 131,17 | 6,05 | 2,32 | 9,76 | Изолейцин, лейцин и валин имеют большие алифатические гидрофобные боковые цепи. Их молекулы жесткие, а их взаимные гидрофобные взаимодействия важны для правильного фолдинга белков, так как эти цепи стремятся располагаться внутри белковой молекулы. | |
| *К | Лис | Лизин | базовый | 146.19 | 9,60 | 2,16 | 9,06 | 10,54 | Действует аналогично аргинину. Содержит длинную гибкую боковую цепь с положительно заряженным концом. Гибкость цепи делает лизин и аргинин подходящими для связывания с молекулами, на поверхности которых имеется множество отрицательных зарядов. (например, ДНК-связывающие белки имеют свои активные области, богатые аргинином и лизином.) Сильный заряд делает эти две аминокислоты склонными располагаться на внешних гидрофильных поверхностях белков. |
| *л | Лей | Лейцин | гидрофобный | 131,17 | 6.01 | 2,33 | 9,74 | Действует аналогично изолейцину и валину. См. изолейцин. | |
| *М | Встретил | Метионин | гидрофобный | 149,21 | 5,74 | 2.13 | 9,28 | Всегда первая аминокислота, включаемая в белок; иногда удаляются после перевода.Как и цистеин, он содержит серу, но с метильной группой вместо водорода. Эта метильная группа может быть активирована и используется во многих реакциях, когда к другой молекуле добавляется новый атом углерода. | |
| Н | Асн | Аспарагин | гидрофильный | 132,12 | 5,41 | 2,14 | 8,72 | Нейтрализованная версия аспарагиновой кислоты. | |
| П | Про | Пролин | гидрофобный | 115.13 | 6.30 | 1,95 | 10,64 | Содержит необычное кольцо на N-конце аминогруппы, которое переводит амидную последовательность CO-NH в фиксированную конформацию. Может разрушать структуры сворачивания белка, такие как α-спираль или β-лист, вызывая желаемый изгиб в цепи белка. Часто встречается в коллагене, где он подвергается посттрансляционной модификации до гидроксипролина. Необычно в других местах. | |
| В | Глн | Глютамин | гидрофильный | 146.15 | 5,65 | 2,17 | 9.13 | Нейтрализованная версия глутаминовой кислоты. Используется в белках и в качестве хранилища аммиака. | |
| *Р | Арг | Аргинин | базовый | 174,20 | 10,76 | 1,82 | 8,99 | 12.48 | Функционально подобен лизину. |
| С | Сер | серин | гидрофильный | 105.09 | 5,68 | 2.19 | 9.21 | Серин и треонин имеют короткую группу, оканчивающуюся гидроксильной группой. Его водород легко удалить, поэтому серин и треонин часто выступают в качестве доноров водорода в ферментах. Оба очень гидрофильны, поэтому внешние области растворимых белков, как правило, богаты ими. | |
| *Т | Тр | Треонин | гидрофильный | 119,12 | 5.60 | 2,09 | 9.10 | Действует аналогично серину. | |
| *В | Вал | Валин | гидрофобный | 117,15 | 6,00 | 2,39 | 9,74 | Ведет себя подобно изолейцину и лейцину. См. изолейцин. | |
| *Ш | Трп | Триптофан | гидрофобный | 204,23 | 5.89 | 2,46 | 9,41 | Ведет себя аналогично фенилаланину и тирозину (см. фенилаланин). Предшественник серотонина. | |
| Д | Тыр | Тирозин | гидрофобный | 181,19 | 5,64 | 2,20 | 9.21 | 10,46 | Ведет себя аналогично фенилаланину и триптофану (см. фенилаланин). Предшественник меланина, адреналина и гормонов щитовидной железы. |
Примечания
- ↑ Питер Плихта Плихта. Тайная формула Бога: разгадка загадки Вселенной и код простого числа . Шефтсбери: Element Books, 1997. ISBN 1862040141.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Doolittle, RF 1989. Избыточность белковых последовательностей. В Прогнозы структуры белка и принципы конформации белка , изд.Г. Д. Фасман, 599-623. Нью-Йорк, штат Нью-Йорк: Пленум Пресс.
- Нельсон Д. Л. и М. М. Кокс. 2000. Принципы биохимии Ленингера , 3-е издание. Нью-Йорк, штат Нью-Йорк: Worth Publishers.
- Наганоа Н., О. Мотонори и К. Нисикава. 1999. Сильная гидрофобная природа остатков цистеина в белках. Письма FEBS 458(1):69-71. О гидрофобной природе цистеина.
Кредиты
Энциклопедия Нового Света авторов и редакторов переписали и дополнили статью Википедии в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Упоминание должно осуществляться в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в New World Encyclopedia :
Примечание. На использование отдельных изображений, которые лицензируются отдельно, могут распространяться некоторые ограничения.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Amino acid — CMBIwiki
Белок состоит из небольших строительных блоков, называемых аминокислотами.
Аминокислоты лежат в основе биоинформатики. Эволюция в основном управляется случайными изменениями в ДНК, приводящими к изменениям отдельных аминокислот, которые медленно накапливаются в течение эпох (конечно, это не вся история, но, безусловно, большая ее часть). Если мы хотим выровнять две последовательности, мы выровняем их аминокислоты. Белки состоят в основном из аминокислот, и если мы хотим модифицировать белок с помощью методов белковой инженерии, мы заменяем аминокислоты.
Обзор всех аминокислот, разделенных на группы.Обзор
20 аминокислот
Мы знаем 20 незаменимых аминокислот, это означает, что ваш организм не может сам производить эти молекулы. Нормальная и здоровая диета содержит достаточное количество этих незаменимых аминокислот, чтобы выжить.
Каждая аминокислота имеет свои свойства. Они могут быть представлены полным именем, трехбуквенным кодом или однобуквенным кодом:
Общая структура
Общая структура всех аминокислотКаждая аминокислота состоит из нескольких атомов, одинаковых во всех аминокислотах, эти атомы образуют основу аминокислоты.Каждая аминокислота имеет центральный атом углерода, известный как С-альфа. К этому атому углерода всегда присоединены атом водорода, аминогруппа и группа карбоновой кислоты. Четвертая группа, присоединенная к центральной С-альфа, представляет собой вариабельную боковую цепь. Эта боковая цепь различна для каждой аминокислоты, поэтому специфические свойства аминокислоты являются результатом различия боковых цепей. Все аминокислоты, за исключением глицина, хиральны.
Образование пептидной связиПептидная связь
Две аминокислоты соединены пептидной связью.



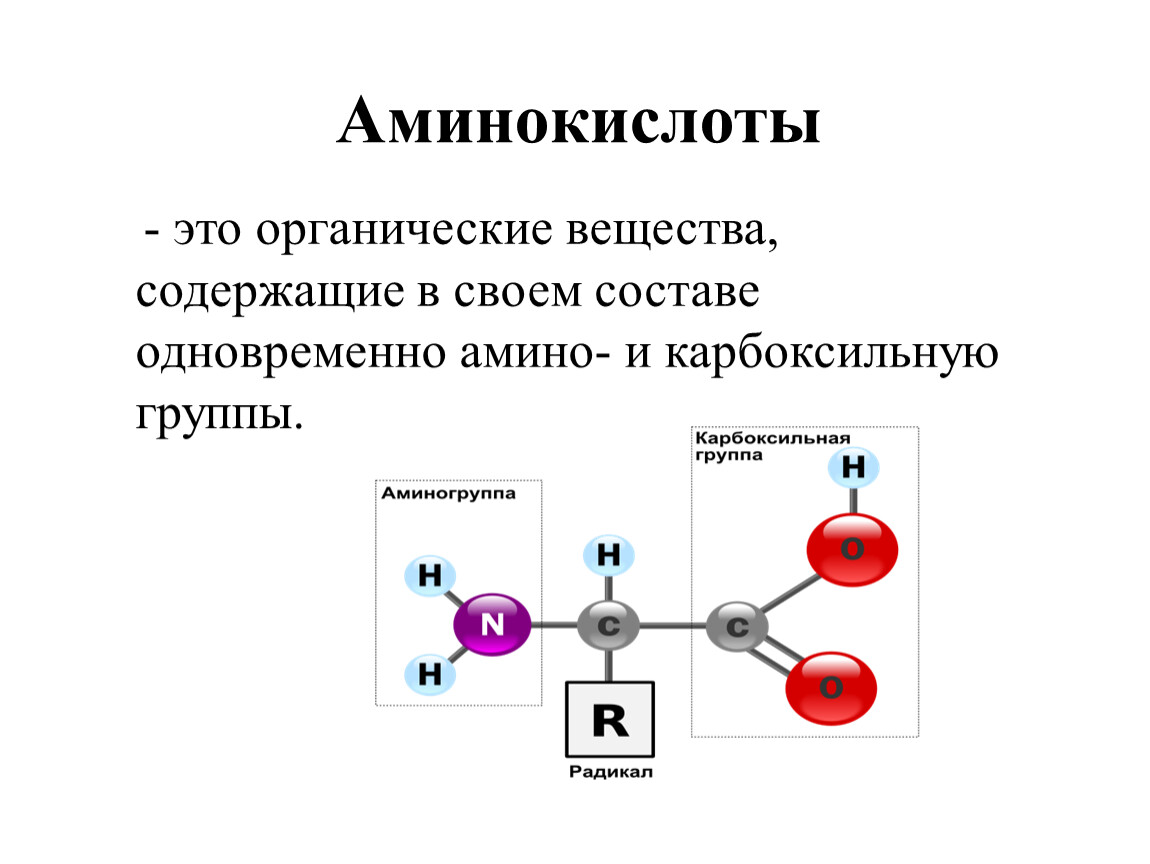

 Это также важно для кальция и иммунной функции.
Это также важно для кальция и иммунной функции.
